据估计,全世界范围约有4.22亿人患有糖尿病,其中2型糖尿病(type 2 diabetes mellitus, T2DM)占90%以上[1]。在过去几十年中,2型糖尿病的发病率急剧上升,特别是在中低收入国家,患病人数自1980年来大约增加了1倍。研究显示,尽管2型糖尿病患者的骨密度较非糖尿病患者不低甚或升高[2],但其骨折风险较非糖尿病患者升高[3],且随着糖尿病病程的延长骨折风险更高,因此近些年提出了“糖尿病性骨病”的概念,将骨折列为糖尿病的并发症之一[4]。重要的是,伴有2型糖尿病的髋部骨折患者的死亡率较不伴有糖尿病的患者更高[5]。因此,积极探索2型糖尿病患者骨折风险升高的发生机制可能为“糖尿病性骨病”的防治提供线索。本文将对此进行综述,并对目前的研究热点进行展望。
1 2型糖尿病患者骨转换异常的发生机制
骨转换包括成骨细胞介导的骨形成和破骨细胞介导的骨吸收2个过程。成骨细胞来源于间充质干细胞(mesenchymal stem cells, MSC),负责合成胶原、矿化有机质、形成骨组织。破骨细胞起源于单核-巨噬细胞系统,是一种特殊的终末分化细胞,负责骨吸收。
1.1 血糖升高
对成骨细胞的研究发现,T2DM患者的血清可抑制间充质干细胞向成骨细胞的分化[6],同时高浓度葡萄糖可降低2型糖尿病大鼠成骨细胞中Wnt信号通路的活性、降低骨形态发生蛋白-2(bone morphogenetic protein, BMP-2)和骨桥蛋白的表达、减少成骨细胞的分化[7]。高血糖还可减少骨钙素的表达[8],近期研究发现,胰岛素抵抗的患者体内羧化骨钙素和总骨钙素水平均降低[9]。对破骨细胞的研究表明,高血糖状态可减少破骨细胞数量、降低其分化和活性、抑制骨吸收陷窝的重吸收[10]。高血糖对骨代谢的影响可能造成2型糖尿病患者的低骨转换状态、改变骨微结构,从而掩盖其实际的骨折风险[11]。
1.2 晚期糖基化终产物(advanced glycation end products, AGEs)生成增加
AGEs是通过还原糖和胺残基之间的非酶促反应而产生的多种化合物,它能通过生物和物理途径影响糖尿病患者的骨强度。前者指AGEs对骨形成和骨吸收的作用,后者指其在骨胶原纤维中沉积、影响骨骼的材料特性。
用高浓度AGEs处理成骨细胞,可抑制成骨细胞的增殖、分化及矿化,诱导成骨细胞的凋亡,并能引起成骨细胞中AGEs受体(receptor for advanced glycation end products, RAGE)的表达增加[12]。体内研究也显示,较正常培养液处理的骨组织相比,高浓度AGEs处理的骨组织原位移植入大鼠体内后,其骨骼矿化沉积率(the mineral apposition rate, MAR)、骨表面的矿化面积(mineralized surface per bone surface, MS/BS)和骨形成率(bone formation rate, BFR)均显著降低,表明AGEs在骨骼中的浓度与骨形成呈负相关[13]。研究还发现,破骨细胞对含AGEs骨骼切片的骨吸收面积和每层骨吸收陷窝的数量均较对照骨骼切片显著减少[13]。且AGEs所修饰的牛血清白蛋白(bovine serum albumin, BSA)在体外可抑制破骨细胞的生成,其机制可能是通过抑制破骨细胞祖细胞转化为前破骨细胞[14]。此外研究还显示,AGEs可增加硬骨素(sclerostin)的表达,降低核因子κB受体活化因子配体(receptor activator of nuclear factor-κb ligand, RNAKL)蛋白的表达[15],从而影响骨代谢。
胶原蛋白的非酶促交联可能是一个普遍存在的糖基化过程。通过酶促交联可增加Ⅰ型胶原的强度从而提高骨强度,但Ⅰ型胶原蛋白的长半衰期又使其在侧链更容易糖基化,糖基化的胶原蛋白失去其应有的材料属性,致骨强度降低[16]。对自发性糖尿病大鼠WBN/Kob的研究发现,随着血糖的升高,骨组织中非酶促交联增加,骨骼的强度降低[17]。在人体内进行的微压痕试验也显示,T2DM患者骨骼的材料强度较非糖尿病患者降低,并且其骨强度与皮肤中AGEs的自发荧光水平(代表体内AGEs的浓度)呈负相关[18]。
1.3 胰岛素水平降低及作用缺陷
胰岛素及其信号转导通路在骨形成中发挥重要作用。研究显示,成骨细胞中特异性胰岛素受体基因敲除的小鼠,成骨细胞数量减少、骨形成及骨体积均降低[19]。同时,胰岛素还可抑制破骨细胞的活性而减少骨吸收,降低糖尿病大鼠的血糖而减少骨中AGEs的积累[20]。体外研究显示,较未使用胰岛素治疗的糖尿病小鼠相比,每日使用胰岛素治疗可维持糖尿病小鼠的糖化血红蛋白水平、增加骨皮质骨量,且促进骨内植入物周围的骨骼修复和整合[21]。人体研究也显示,在2型糖尿病患者中通过双能X线测得的骨密度与循环胰岛素水平呈正相关,表明胰岛素对骨合成代谢具有正性作用。然而,长病程的T2DM患者常存在胰岛素水平降低及作用缺陷,导致骨形成减少、骨量减少,骨折风险增加[22]。
1.4 胰岛素样生长因子1(insulin-like growth factor 1, IGF-1)水平降低
血液循环中的IGF-1主要由肝脏分泌,其次来源于骨组织。成骨细胞中表达的IGF-1是骨形成的重要调节剂之一。研究显示,成骨细胞中特异性敲除IGF-1受体基因的小鼠出现骨小梁减少和矿化不足[23]。IGF-1也介导了诸多促骨形成因子的成骨作用,如长效类胰高血糖素样肽-1受体激动剂[24]、重组人甲状旁腺激素[25]和小干扰RNA等[26]。研究发现,2型糖尿病患者体内IGF-1水平降低与其非椎体骨折风险的升高明显相关[27],且IGF-1信号参与了糖尿病所致骨微结构异常和骨强度降低[28]。
1.5 氧化应激和促炎细胞因子水平增加
在2型糖尿病患者中,活性氧类(reactive oxygen species, ROS)和促炎细胞因子(proinflammatory cytokines)随着血糖水平的升高而增加[29]。与非糖尿病人群相比,2型糖尿病患者的骨钙素水平降低、骨形成减少,且骨钙素水平与糖尿病患者血清中的白细胞介素-6(interleukin 6, IL-6)和C反应蛋白(C-reactive protein, CRP)呈负相关[30]。长期的慢性炎症状态可刺激成骨细胞中NF-κB(nuclear factor kappa-B)表达增加,Fos相关抗原1(Fos related antigen 1, FRA-1)和Runt相关转录因子(Runt-related transcription factor 2, RUNX2)表达下降[29],影响成骨细胞分化,减少骨形成。
在破骨细胞中,FOXOs转录因子诱导的过氧化氢(hydrogen peroxide, H2O2)降解减少,可抑制破骨细胞的增殖并促进破骨细胞的凋亡、减少骨吸收[31]。长期高水平的促炎细胞因子如肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、IL-1、IL-6、IL-18通过增加脂质过氧化,进一步导致破骨细胞生成增加[32]。此外,高水平的TNF-α可增加RANKL/OPG比值,促进骨吸收[33]。
2 增加骨折风险的降糖药物的应用
2型糖尿病患者常需长期应用口服降糖药物和/或胰岛素控制血糖,以减少糖尿病相关并发症的发生,但研究显示,胰岛素、噻唑烷二酮类和钠-葡萄糖协同转运蛋白2抑制剂(sodium-dependent glucose transporters 2 inhibitors, SGLT-2i)可增加2型糖尿病患者的骨折发生风险[34]。
2.1 胰岛素
如前所述,循环中胰岛素对骨代谢具有正性作用,胰岛素水平降低的患者骨形成减少、骨量减少。但临床研究显示,较未使用胰岛素的2型糖尿病患者相比,使用胰岛素的2型糖尿病患者骨折风险增加,这可能与使用胰岛素的2型糖尿病患者病程较长、糖尿病慢性并发症发生率高及低血糖发生增加相关[35]。
研究显示,与使用二甲双胍单药治疗的T2DM患者相比,胰岛素单药治疗可能增加T2DM患者骨折发生风险[36]。研究还发现,较未使用胰岛素治疗的绝经后2型糖尿病女性患者相比,使用胰岛素治疗可增加2型糖尿病患者足部及髋部骨折风险,且髋部骨折风险更高[37]。但值得注意的是,开始接受胰岛素治疗的T2DM患者年龄较大且病程较长,常合并糖尿病并发症如微血管疾病或周围神经病变,其跌倒风险增加[34]。另外,低血糖是糖尿病患者使用胰岛素常见的不良反应,随着低血糖发作频率的增加,跌倒的发生率增加,骨折发生风险也相应增加[38]。但也有研究显示,不同胰岛素剂型对骨折风险影响不一,与短、中效胰岛素相比,长效胰岛素不易引起低血糖,且可降低骨折发生风险[34]。
2.2 噻唑烷二酮类(thiazolidinediones, TZDs)
TZDs是过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors, PPAR-γ)激动剂,PPAR-γ活化可促进间充质干细胞向脂肪细胞分化、抑制成骨细胞生成、增加骨髓脂肪含量。多个大型临床研究均证实,TZDs(曲格列酮、吡格列酮和罗格列酮)的使用与老年2型糖尿病妇女的骨丢失显著相关,能增加骨折的发生风险[39]。与二甲双胍或格列本脲相比,罗格列酮治疗的T2DM患者骨折累积风险明显增加(罗格列酮骨折累积发生率为15.1%,二甲双胍为7.3%,格列本脲为7.7%)[40]。
2.3 钠-葡萄糖共转运蛋白2抑制剂(sodium-dependent glucose transporters 2 inhibitors, SGLT-2i)
SGLT-2i通过抑制肾脏对葡萄糖的重吸收、促进葡萄糖从尿液中排出,降低血糖。然而,长期暴露于SGLT-2i可导致高钙尿及钙代谢负平衡,从而导致骨体积减少[3]。研究显示,较未应用卡格列净的2型糖尿病患者相比,使用卡格列净可降低老年2型糖尿病患者的全髋骨密度[41]。CANVAS研究还发现,使用卡格列净可增加2型糖尿病患者的骨折风险,尤其是老年、有心血管疾病史或心血管高危风险的、肾小球滤过率较低的或使用噻嗪类利尿剂的2型糖尿病患者[42]。但不同SGLT-2i对骨折的影响并不一致,在临床选用中需要予以考虑[34]。
3 跌倒风险增加
2型糖尿病患者跌倒风险增加也可致其骨折风险升高,与其跌倒风险增加相关的因素包括低血糖发作、糖尿病慢性并发症、肌肉功能减退等。
3.1 低血糖
低血糖是糖尿病患者实现高质量降糖的主要障碍。研究显示,在经历过低血糖发作的老年糖尿病患者中,1年内跌倒相关事件发生风险增加了2倍,且随着低血糖发作频率的增加,跌倒的发生风险也明显增加[38]。此外,一些降糖药物,尤其是胰岛素,容易引起低血糖发作。Wu等[43]研究发现,与未使用胰岛素治疗的糖尿病患者相比,使用胰岛素的糖尿病女性患者跌倒风险增加、骨折发生风险升高。
3.2 糖尿病慢性并发症
长病程的2型糖尿病患者常伴多种慢性并发症,如视网膜病变导致的视力损害、心血管疾病引起的心律失常、自主神经病变引起的直立性低血压及白内障等均可导致跌倒发生风险升高。
研究显示,约15%的2型糖尿病患者会发生自主神经病变,可引起体位性低血压和步态失衡,且糖尿病周围神经病变也影响身体平衡、步行稳定性和踝关节力量,导致跌倒增加[44]。此外,微血管并发症也可能通过损害骨髓微环境,改变骨骼局部重塑,具体机制仍待探索[45]。
3.3 肌肉功能降低
肌肉减少症是一种以骨骼肌减少、骨骼肌强度下降及功能减退为特征的疾病。研究显示,与健康人群相比,2型糖尿病患者的肌肉力量、肌肉功能和步速均降低[46],且骨骼肌质量下降、功能丧失与糖尿病持续时间及血糖控制不佳相关,增加了糖尿病患者的跌倒风险[47]。研究也发现,患有肌少症的受试者2年内发生跌倒的风险是正常受试者的1.6~3.2倍,同时因肌肉减震能力降低,导致跌倒时对骨骼的冲击更大,骨折风险增加[48]。但目前对于肌少症在2型糖尿病人群中的患病率尚不清楚,且导致2型糖尿病患者肌肉质量和功能减退的机制也需进一步探索。
4 展 望
本文综述了引起2型糖尿病患者骨折风险增加的病理生理机制、可引起骨折风险增加的降糖药物及导致跌倒风险增加的相关因素,但仍有很多未知。比如,骨骼这一血管和神经密布的器官是否也是糖尿病微血管病变的靶器官之一?严格和良好的血糖控制能否降低2型糖尿病患者的骨折风险?有高骨折风险的2型糖尿病患者,血糖控制在什么水平能最大限度降低骨折风险?有高骨折风险的2型糖尿病患者,体重指数在哪个范围的患者骨折风险最低?SGLT-2i引起骨折风险增加的机制是什么?
由于2型糖尿病患者骨折后的致死率、致残率和经济负担均较非糖尿病患者升高,且随着社会的老龄化,2型糖尿病的患病人数越来越多,因此需要关注2型糖尿病患者的骨折风险以提高2型糖尿病患者的整体生活质量、减少对社会和家庭的负担。
[1] POIANA C, CAPATINA C.Fracture risk assessment in patients with diabetes mellitus[J].J Clin Densitom, 2017,20(3): 432-443.
[2] SCHWARTZ A V, VITTINGHOFF E, BAUER D C, et al.Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes[J].JAMA, 2011,305(21): 2184-2192.
[3] KASPERK C, GEORGESCU C, NAWROTH P.Diabetes mellitus and bone metabolism[J].Exp Clin Endocrinol Diabetes, 2017,125(4): 213-217.
[4] STARUP-LINDE J, HYGUM K, LANGDAHL B L.Skeletal fragility in type 2 diabetes mellitus[J].Endocrinol Metab(Seoul), 2018,33(3): 339-351.
[5] SCHWARTZ A V.Diabetes, bone and glucose-lowering agents: clinical outcomes[J].Diabetologia, 2017,60(7): 1170-1179.
[6] DENG X Q, XU M, SHEN M Y, et al.Effects of type 2 diabetic serum on proliferation and osteogenic differentiation of mesenchymal stem cells[J].J Diabetes Res, 2018,2018: 5765478.
[7] HAMANN C, GOETTSCH C, METTELSIEFEN J, et al.Delayed bone regeneration and low bone mass in a rat model of insulin-resistant type 2 diabetes mellitus is due to impaired osteoblast function[J].Am J Physiol Endocrinol Metab, 2011,301(6): E1220-E1228.
[8] BARTOLOMÉ A, L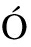 PEZ-HERRAD
PEZ-HERRAD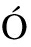 N A, PORTAL-N
N A, PORTAL-N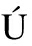
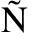 EZ S, et al.Autophagy impairment aggravates the inhibitory effects of high glucose on osteoblast viability and function[J].Biochem J, 2013,455(3): 329-337.
EZ S, et al.Autophagy impairment aggravates the inhibitory effects of high glucose on osteoblast viability and function[J].Biochem J, 2013,455(3): 329-337.
[9] RAZNY U, POLUS A, GORALSKA J, et al.Effect of insulin resistance on whole blood mRNA and microRNA expression affecting bone turnover[J].Eur J Endocrinol, 2019,181(5): 525-537.
[10] XU J, YUE F, WANG J B, et al.High glucose inhibits receptor activator of nuclear factor-κB ligand-induced osteoclast differentiation via downregulation of v-ATPase V0 subunit d2 and dendritic cell-specific transmembrane protein[J].Mol Med Rep, 2015,11(2): 865-870.
[11] STARUP-LINDE J, VESTERGAARD P.Biochemical bone turnover markers in diabetes mellitus——A systematic review[J].Bone, 2016,82: 69-78.
[12] FRANKE S, RÜSTER C, PESTER J, et al.Advanced glycation end products affect growth and function of osteoblasts[J].Clin Exp Rheumatol, 2011,29(4): 650-660.
[13] YANG X, MOSTAFA A J, APPLEFORD M, et al.Bone formation is affected by matrix advanced glycation end products(AGEs)in vivo[J].Calcif Tissue Int, 2016,99(4): 373-383.
[14] VALCOURT U, MERLE B, GINEYTS E, et al.Non-enzymatic glycation of bone collagen modifies osteoclastic activity and differentiation[J].J Biol Chem, 2007,282(8): 5691-5703.
[15] TANAKA K, YAMAGUCHI T, KANAZAWA I, et al.Effects of high glucose and advanced glycation end products on the expressions of sclerostin and RANKL as well as apoptosis in osteocyte-like MLO-Y4-A2 cells[J].Biochem Biophys Res Commun, 2015,461(2): 193-199.
[16] DEPALLE B, QIN Z, SHEFELBINE S J, et al.Influence of cross-link structure, density and mechanical properties in the mesoscale deformation mechanisms of collagen fibrils[J].J Mech Behav Biomed Mater, 2015,52: 1-13.
[17] SAITO M, FUJII K, MORI Y, et al.Role of collagen enzymatic and glycation induced cross-links as a determinant of bone quality in spontaneously diabetic WBN/Kob rats[J].Osteoporos Int, 2006,17(10): 1514-1523.
[18] FURST J R, BANDEIRA L C, FAN W W, et al.Advanced glycation endproducts and bone material strength in type 2 diabetes[J].J Clin Endocrinol Metab, 2016,101(6): 2502-2510.
[19] FERRON M, WEI J W, YOSHIZAWA T, et al.Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism[J].Cell, 2010,142(2): 296-308.
[20] CREECY A, UPPUGANTI S, MERKEL A R, et al.Changes in the fracture resistance of bone with the progression of type 2 diabetes in the ZDSD rat[J].Calcif Tissue Int, 2016,99(3): 289-301.
[21] PICKE A K, GORDALIZA ALAGUERO I, CAMPBELL G M, et al.Bone defect regeneration and cortical bone parameters of type 2 diabetic rats are improved by insulin therapy[J].Bone, 2016,82: 108-115.
[22] THRAILKILL K M, LUMPKIN C K Jr, BUNN R C, et al.Is insulin an anabolic agent in bone? Dissecting the diabetic bone for clues[J].Am J Physiol Endocrinol Metab, 2005,289(5): E735-E745.
[23] ZHANG M, XUAN S H, BOUXSEIN M L, et al.Osteoblast-specific knockout of the insulin-like growth factor(IGF)receptor gene reveals an essential role of IGF signaling in bone matrix mineralization[J].J Biol Chem, 2002,277(46): 44005-44012.
[24] ZHANG M J, XIE Y Z, ZHOU Y, et al.Exendin-4 enhances proliferation of senescent osteoblasts through activation of the IGF-1/IGF-1R signaling pathway[J].Biochem Biophys Res Commun, 2019,516(1): 300-306.
[25] COHEN A, KOUSTENI S, BISIKIRSKA B, et al.IGF-1 receptor expression on circulating osteoblast progenitor cells predicts tissue-based bone formation rate and response to teriparatide in premenopausal women with idiopathic osteoporosis[J].J Bone Miner Res, 2017,32(6): 1267-1273.
[26] ZENG Q C, WANG Y, GAO J, et al.MiR-29b-3p regulated osteoblast differentiation via regulating IGF-1 secretion of mechanically stimulated osteocytes[J].Cell Mol Biol Lett, 2019,24: 11.
[27] MIYAKE H, KANAZAWA I, SUGIMOTO T.Decreased serum insulin-like growth factor-I is a risk factor for non-vertebral fractures in diabetic postmenopausal women[J].Intern Med, 2017,56(3): 269-273.
[28] MA R F, WANG L L, ZHAO B S, et al.Diabetes perturbs bone microarchitecture and bone strength through regulation of Sema3A/IGF-1/β-catenin in rats[J].Cell Physiol Biochem, 2017,41(1): 55-66.
[29] JIAO H L, XIAO E, GRAVES D T.Diabetes and its effect on bone and fracture healing[J].Curr Osteoporos Rep, 2015,13(5): 327-335.
[30] SARKAR P D, CHOUDHURY A B.Relationships between serum osteocalcin levels versus blood glucose, insulin resistance and markers of systemic inflammation in central Indian type 2 diabetic patients[J].Eur Rev Med Pharmacol Sci, 2013,17(12): 1631-1635.
[31] BARTELL S M, KIM H N, AMBROGINI E, et al.FoxO proteins restrain osteoclastogenesis and bone resorption by attenuating H2O2 accumulation[J].Nat Commun, 2014,5: 3773.
[32] MOSELEY K F.Type 2 diabetes and bone fractures[J].Curr Opin Endocrinol Diabetes Obes, 2012,19(2): 128-135.
[33] PACIOS S, KANG J, GALICIA J, et al.Diabetes aggravates periodontitis by limiting repair through enhanced inflammation[J].FASEB J, 2012,26(4): 1423-1430.
[34] JACKULIAK P, KUŽMA M, PAYER J.Effect of antidiabetic treatment on bone[J].Physiol Res, 2019,68(Suppl 2): S107-S120.
[35] LOSADA-GRANDE E, HAWLEY S, SOLDEVILA B, et al.Insulin use and excess fracture risk in patients with type 2 diabetes: a propensity-matched cohort analysis[J].Sci Rep, 2017,7(1): 3781.
[36] LOSADA E, SOLDEVILA B, ALI M S, et al.Real-world antidiabetic drug use and fracture risk in 12, 277 patients with type 2 diabetes mellitus: a nested case-control study[J].Osteoporos Int, 2018,29(9): 2079-2086.
[37] SCHWARTZ A V, SELLMEYER D E, ENSRUD K E, et al.Older women with diabetes have an increased risk of fracture: a prospective study[J].J Clin Endocrinol Metab, 2001,86(1): 32-38.
[38] CHIBA Y, KIMBARA Y, KODERA R, et al.Risk factors associated with falls in elderly patients with type 2 diabetes[J].J Diabetes Complicat, 2015,29(7): 898-902.
[39] PASCHOU S A, DEDE A D, ANAGNOSTIS P G, et al.Type 2 diabetes and osteoporosis: a guide to optimal management[J].J Clin Endocrinol Metab, 2017,102(10): 3621-3634.
[40] KAHN S E, ZINMAN B, LACHIN J M, et al.Rosiglitazone-associated fractures in type 2 diabetes: an analysis from a diabetes outcome progression trial(ADOPT)[J].Diabetes Care, 2008,31(5): 845-851.
[41] BILEZIKIAN J P, WATTS N B, USISKIN K, et al.Evaluation of bone mineral density and bone biomarkers in patients with type 2 diabetes treated with canagliflozin[J].J Clin Endocrinol Metab, 2016,101(1): 44-51.
[42] WATTS N B, BILEZIKIAN J P, USISKIN K, et al.Effects of canagliflozin on fracture risk in patients with type 2 diabetes mellitus[J].J Clin Endocrinol Metab, 2016,101(1): 157-166.
[43] WU J S, YANG Y C, LU F H, et al.Population-based study on the prevalence and risk factors of orthostatic hypotension in subjects with pre-diabetes and diabetes[J].Diabetes Care, 2009,32(1): 69-74.
[44] MENZ H B, LORD S R, ST GEORGE R, et al.Walking stability and sensorimotor function in older people with diabetic peripheral neuropathy[J].Arch Phys Med Rehabil, 2004,85(2): 245-252.
[45] MANGIALARDI G, FERLAND-MCCOLLOUGH D, MASELLI D, et al.Bone marrow pericyte dysfunction in individuals with type 2 diabetes[J].Diabetologia, 2019,62(7): 1275-1290.
[46] GUERRERO N, BUNOUT D, HIRSCH S, et al.Premature loss of muscle mass and function in type 2 diabetes[J].Diabetes Res Clin Pract, 2016,117: 32-38.
[47] KALYANI R R, SAUDEK C D, BRANCATI F L, et al.Association of diabetes, comorbidities, and A1C with functional disability in older adults: results from the National Health and Nutrition Examination Survey(NHANES), 1999-2006[J].Diabetes Care, 2010,33(5): 1055-1060.
[48] SCOTT D, SEIBEL M, CUMMING R, et al.Sarcopenic obesity and its temporal associations with changes in bone mineral density, incident falls, and fractures in older men: the concord health and ageing in men project[J].J Bone Miner Res, 2017,32(3): 575-583.