急性肠系膜血管缺血(acute mesenteric ischemia, AMI)是因肠系膜动脉突发供血不足引起、可危及生命的急腹症,其主要病理改变为动脉栓塞、动脉血栓形成和动脉夹层形成。临床表现多样,早期症状重、不典型且多表现为剧烈腹痛,腹部体征相对较轻。由于发病急、进展快,容易误诊或漏诊,病死率较高,部分患者可因短肠综合征致生活质量低下[1]。本文分析总结65例AMI诊治经验,以便提供参考。
1 资料与方法
1.1 一般资料
共收集上海交通大学医学院附属新华医院收治的65例AMI患者临床资料,均经手术探查或肠系膜动脉造影确诊。其中,男36例,女29例,平均年龄(67.38±9.89)岁;属动脉栓塞26例,动脉夹层20例,动脉血栓形成19例,其平均就诊时间分别为(13.9±10.5)、(18.3±10.8)和(19.1±10.7) h。多合并冠心病、房颤、高血压病、高脂血症、周围动脉疾病、糖尿病、脑血管病及慢性肾功能不全。多数患者以腹痛为首发症状,不同程度伴有恶心呕吐、消化道出血、腹泻、肠梗阻、脓毒症、急性肾功能不全等,见表1。
表1 65例AMI患者基本资料及临床表现
Tab.1 Basic data and clinical manifestations of 65 patients with AMI![]()
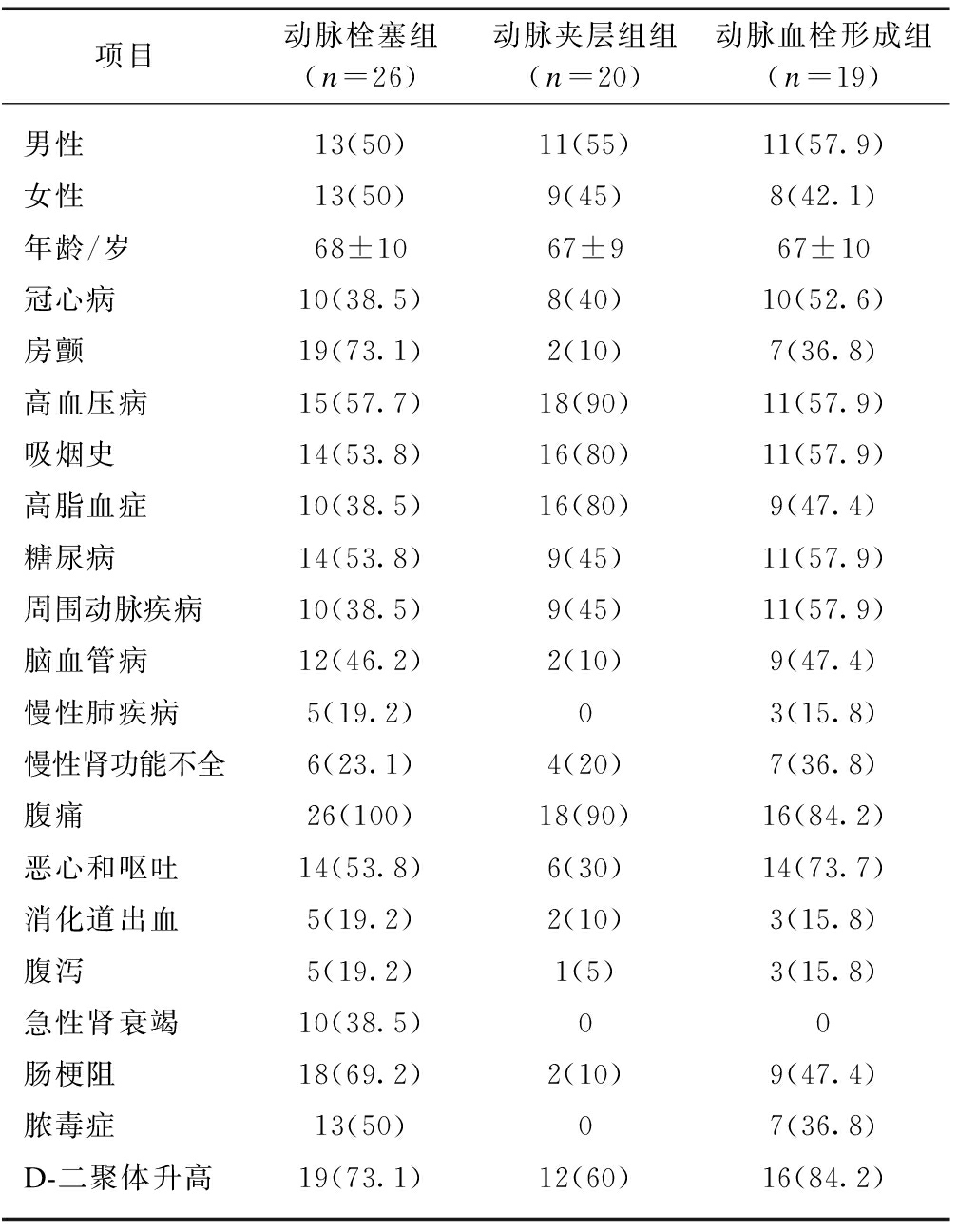
项目动脉栓塞组(n=26)动脉夹层组组(n=20)动脉血栓形成组(n=19)男性13(50)11(55)11(57.9)女性13(50)9(45)8(42.1)年龄/岁68±1067±967±10冠心病10(38.5)8(40)10(52.6)房颤19(73.1)2(10)7(36.8)高血压病15(57.7)18(90)11(57.9)吸烟史14(53.8)16(80)11(57.9)高脂血症10(38.5)16(80)9(47.4)糖尿病14(53.8)9(45)11(57.9)周围动脉疾病10(38.5)9(45)11(57.9)脑血管病12(46.2)2(10)9(47.4)慢性肺疾病5(19.2)03(15.8)慢性肾功能不全6(23.1)4(20)7(36.8)腹痛26(100)18(90)16(84.2)恶心和呕吐14(53.8)6(30)14(73.7)消化道出血5(19.2)2(10)3(15.8)腹泻5(19.2)1(5)3(15.8)急性肾衰竭10(38.5)00肠梗阻18(69.2)2(10)9(47.4)脓毒症13(50)07(36.8)D-二聚体升高19(73.1)12(60)16(84.2)
1.2 方法
1.2.1 开放手术 对于剧烈腹痛、血白细胞明显升高伴腹膜炎体征及急性肾功能不全病例,多选择急诊剖腹探查术。一般取上腹正中切口进腹,首先探查小肠颜色及血运并排除其他急腹症后,再探查肠系膜上动脉。在胰腺下缘显露肠系膜上动脉根部,解剖出主干、中结肠动脉及其分支,分别临时阻断、横形切开肠系膜上动脉前壁,采用Forgarty导管取栓,取栓成功后向远端缓慢推注尿激酶并缝合肠系膜动脉。然后观察小肠血运,并根据小肠缺血范围和程度行小肠切除吻合或造瘘术。
1.2.2 介入治疗 对于发病时间<24h、无腹膜炎体征和活动性出血、脑出血、心房内栓子等溶栓禁忌证的患者,一般选择介入治疗。首选行股动脉穿刺置管,在腹主动脉高压造影明确肠系膜动脉病变后,超选肠系膜动脉行置管溶栓或支架植入术,部分病例可转开放手术。若为血栓形成则在肠系膜上动脉内置入多侧孔溶栓导管(Uni Fuse溶栓导管),术后经该导管用尿激酶持续溶栓,第1个12h时维持泵入尿激酶50万U,动脉鞘内维持泵入肝素钠12500U 预防导管周围血栓形成,12h后检测血常规及凝血常规,根据结果每24h泵入尿激酶50~100万U,24~48h后复查肠系膜动脉造影,评估是否拔管及动脉支架植入。若溶栓过程中患者病情加重应及时复查造影,必要时急诊剖腹探查;若造影提示动脉夹层形成,则一期行肠系膜动脉支架植入术,一般选择裸支架植入。
1.3 评价指标
患者症状缓解、可进食半流质,顺利出院为疗效满意;如治疗过程中病情恶化、患者死亡,或自动出院,视为治疗无效。比较开放手术及介入手术的手术时间、术中出血量、术后住院时间、并发症发生情况及住院费用。
1.4 统计学处理
采用SPSS 17.0软件进行数据分析。计量资料以![]() 表示;三组合并症及临床表现分析采用列联表卡方检验,疗效分析采用χ2检验。P<0.05表示差异有统计学意义。
表示;三组合并症及临床表现分析采用列联表卡方检验,疗效分析采用χ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 AMI病理分型
根据术前增强CT、术中探查及造影检查,65例中属动脉栓塞26例,动脉夹层20例,动脉血栓形成19例,分别占40%、30.8%、29.2%。其主要病理基础为动脉栓塞。
2.2 AMI与年龄关系
随年龄增长,AMI的发病率逐渐升高。各组中均以>60岁患者为主,见表2。
表2 AMI患者年龄分布
Tab.2 Age distribution of AMI patients [n(%)]
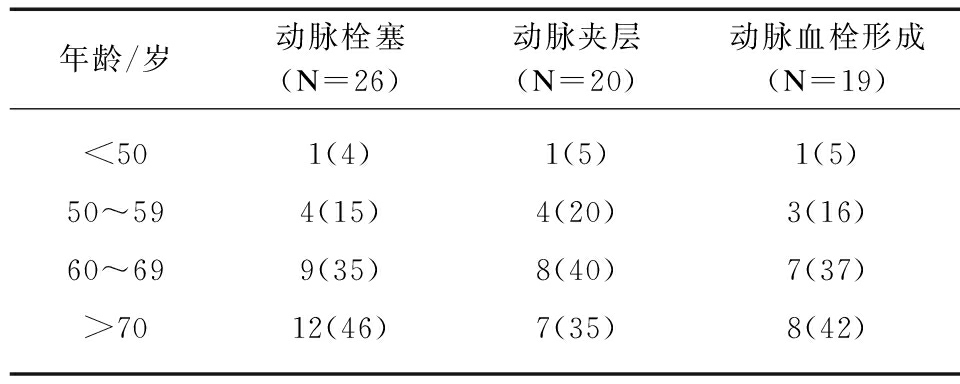
年龄/岁动脉栓塞(N=26)动脉夹层(N=20)动脉血栓形成(N=19)<501(4)1(5)1(5)50~594(15)4(20)3(16)60~699(35)8(40)7(37)>7012(46)7(35)8(42)
2.3 AMI合并症与临床表现
AMI患者多伴各种内科疾病,其中尤以房颤、高血压病、高脂血症、脑血管病多见,提示这些疾病可能参与不同AMI的发病;且临床表现多样,主要有恶心和呕吐、急性肾功能衰竭、肠梗阻和脓毒血症,见表3。提示可用于不同病理类型AMI的鉴别诊断。
表3 AMI合并症与临床表现比较
Tab.3 Comparison of AMI complications and clinical manifestations (n)
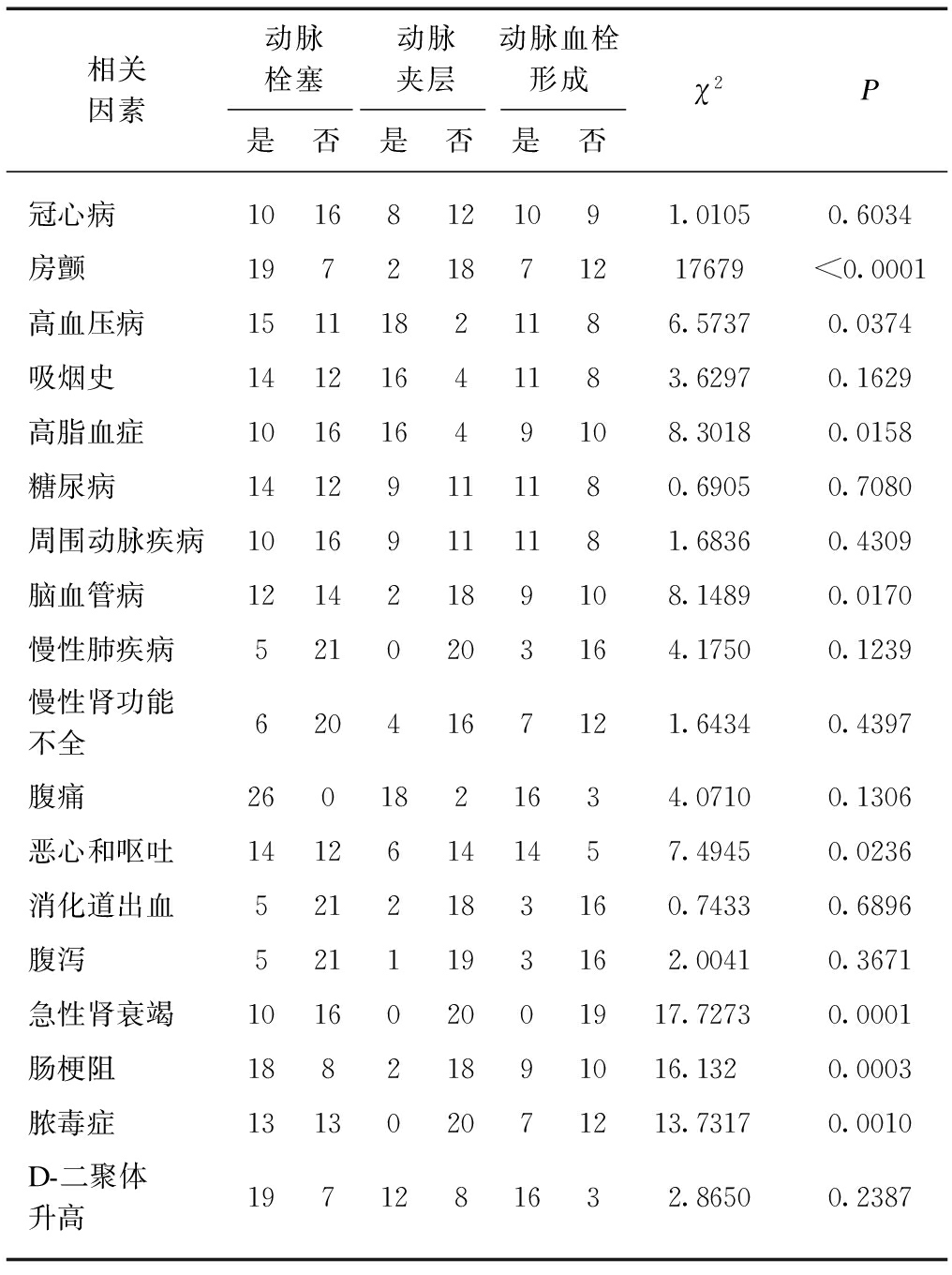
相关因素动脉栓塞动脉夹层动脉血栓形成是否是否是否χ2P冠心病10168121091.01050.6034房颤19721871217679<0.0001高血压病15111821186.57370.0374吸烟史14121641183.62970.1629高脂血症10161649108.30180.0158糖尿病14129111180.69050.7080周围动脉疾病10169111181.68360.4309脑血管病12142189108.14890.0170慢性肺疾病5210203164.17500.1239慢性肾功能不全6204167121.64340.4397腹痛2601821634.07100.1306恶心和呕吐14126141457.49450.0236消化道出血5212183160.74330.6896腹泻5211193162.00410.3671急性肾衰竭101602001917.72730.0001肠梗阻18821891016.1320.0003脓毒症131302071213.73170.0010D-二聚体升高1971281632.86500.2387
2.4 不同治疗方式及效果比较
在65例患者中,25例接受开放手术,40例接受了腔内介入治疗;54例症状缓解,可进食半流质,顺利出院,3例出现短肠综合症不能进食(动脉栓塞组2例,动脉血栓形成组1例),另3例家属签字自动出院(动脉栓塞组、动脉夹层组、动脉血栓形成组各1例),5例院期间死亡(动脉栓塞组2例、动脉夹层组1例、动脉血栓形成组2例)。在动脉栓塞、动脉夹层组,开放手术和腔内手术治疗疗效差异无统计学意义;在动脉血栓形成组,腔内手术疗效明显优于开放手术组(92.9% vs 40.0%,P=0.0128),见表4。
表4 不同手术方式和疗效比较
Tab.4 Comparison of different operative methods and effects
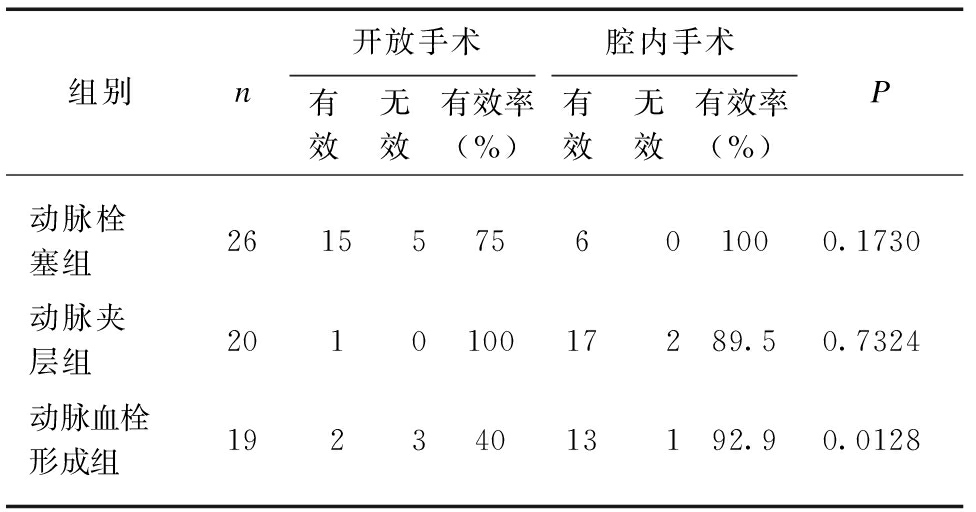
组别n开放手术腔内手术有效无效有效率(%)有效无效有效率(%)P动脉栓塞组2615575601000.1730动脉夹层组201010017289.50.7324动脉血栓形成组19234013192.90.0128
为进一步比较不同手术方式对AMI治疗的效果与质量。本研究统计分析了不同手术方式的手术时间、术中出血量、术后住院时间、住院费用及并发症发生情况。与介入手术相比,开放手术的手术时间更长,术中出血更多,住院时间延长,差异有统计学意义(P<0.01);住院总费用差异无统计学意义,见表5。术后并发症开放手术中,有3例出现切口感染、2例腹腔感染、5例术后肺部感染,介入手术中有2例伤口出血,1例血尿,无切口感染及腹腔感染发生。
表5 不同手术方式手术相关因素比较
Tab.5 The comparison of the related factors of different operation methods
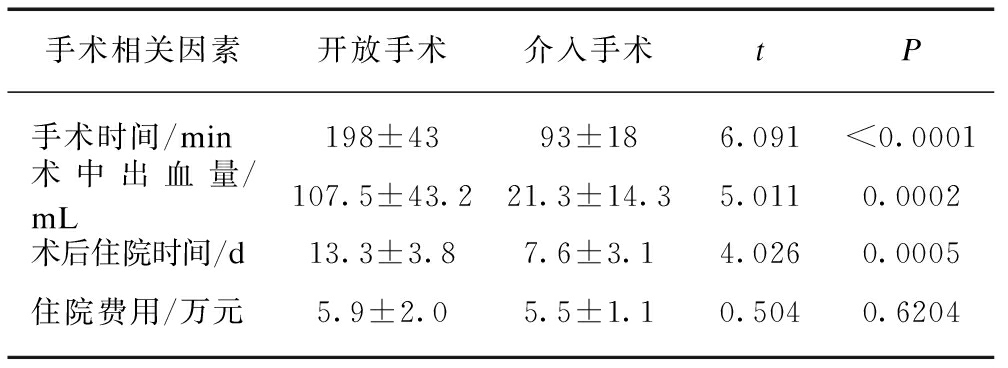
手术相关因素开放手术介入手术tP手术时间/min198±4393±186.091<0.0001术中出血量/mL107.5±43.221.3±14.35.0110.0002术后住院时间/d13.3±3.87.6±3.14.0260.0005住院费用/万元5.9±2.05.5±1.10.5040.6204
3 讨 论
随着影像诊断、外科技术、血管腔内技术及外科监护治疗的发展,AMI的治疗取得了显著进步,但近远期预后仍不理想[2]。AMI引起缺血的病因,主要包括动脉栓塞、动脉夹层及动脉血栓形成,本研究中分别占40%、30.8%、29.2%,而动脉栓塞仍是AMI的主要病因[3]。AMI主要发病于老年人[4],本资料亦类似如高发年龄为(67±10)岁。冠心病、房颤、高血压病、吸烟史、高脂血症、糖尿病、周围动脉疾病、脑血管病和慢性肾功能不全是AMI的高危因素。本研究动脉栓塞组多伴房颤(73.1%);动脉夹层组多伴高血压病(90%)、吸烟(80%)、高脂血症(80%);动脉血栓形成组相对无特殊,超半数合并冠心病、高血压病、糖尿病及有吸烟史。这也是AMI病情重,诊治困难的原因之一。
腹部剧痛而无明显腹膜炎体征是急性小肠缺血的重要表现;随着病情进展,患者出现小肠缺血坏死,可出现腹膜炎体征及急性肾功能衰竭[5]。虽然血白细胞、C反应蛋白、乳酸脱氢酶、肌酸激酶、淀粉酶、D-二聚体水平等对诊断AMI有一定辅助诊断价值,但这些指标无特异性,诊断困难;多数患者在排除其他急腹症后才通过增强CT诊断,部分患者确诊时已存在大面积小肠坏死。近年随着CT血管造影及血管介入技术的快速发展,AMI术前确诊率增高,并能直观反映肠系膜动脉形态,有利于指导手术方案[6]。肠系膜动脉缺血患者常并发不同程度的动脉粥样硬化,突发动脉缺血,缺少形成侧支循环的时间,短时间内严重缺血可造成肠道黏膜缺血坏死、脱落及不可逆透壁性坏死;同时,腹腔及肠腔内渗出导致循环血容量锐减以及肠腔内细菌大量繁殖和移位最终引起中毒性休克、急性肾功能不全等危及生命的情况。此外,多数患者虽存在明显腹痛,但腹部体征不典型,临床医师习惯性采用观察、试验性治疗为主要手段,直到患者出现腹膜炎或肠梗阻明确征象时才想到进一步检查(如增强CT等),此时已出现不可逆小肠坏死[7]。小肠耐受缺血缺氧的时间为6h[8],超过6h小肠受代谢产物堆积、肠黏膜屏障破坏、肠道内细菌移位、缺血再灌注损伤等因素影响,肠黏膜就会水肿、坏死、脱落,肠腔出血、穿孔,进而引起弥漫性腹膜炎、全身炎症反应综合征、多器官功能衰竭、感染性休克及死亡,因此,早期诊断及治疗是挽救患者生命的重要因素[9-10]。
本研究中动脉栓塞及动脉血栓形成组多伴恶心呕吐(分别为53.8%、73.7%),动脉夹层组相对较低(30%),这可能与大部分动脉夹层不至于引起肠系膜动脉远端血供完善闭塞有关。故动脉夹层组临床症状相对较轻,疗效相对理想。消化道出血发生率从高到低依次为动脉栓塞组(19.2%)、动脉血栓形成(15.8%)和动脉夹层(10%)。AMI引起消化道出血多提示小肠黏膜缺血坏死,是小肠严重缺血的标志之一,同时多伴腹泻;若不及时救治,极易引起小肠穿孔导致病情恶化[11]。AMI患者多伴肠梗阻(发生率达69.2%),但动脉夹层组发生率较低(仅10%),这可能与肠道血运障碍、肠蠕动消失有关[12]。急性肾衰及脓毒症多发生于大面积小肠坏死病例,以动脉栓塞患者多见。值得一提的是,超过一半AMI患者出现D-二聚体升高,发生率分别为73.1%、60%、84.2%。D-二聚体是纤维蛋白单体交联后降解产物,可作为血栓栓塞性疾病诊断、疗效和预后的判断指标[13-14],有学者研究发现D-二聚体可用于辅助诊断AMI[15-16]。
毫无疑问,早期诊断及治疗是提高AMI疗效的关键因素[17]。目前治疗主要包括保守治疗、开放手术及腔内介入治疗。手术方式主要包括肠系膜动脉切开取栓、肠系膜动脉补片成形、肠系膜动脉旁路、肠系膜动脉置管溶栓、肠系膜动脉吸栓、肠系膜动脉扩张成形及支架植入术等,以及小肠切除、小肠吻合及造瘘术等[6]。本研究动脉栓塞组多采取开放手术,26例中有20例采取开放手术,6例采取介入治疗。这主要是由于动脉栓塞组患者大多病情危重,伴小肠缺血坏死,需尽早开通肠系膜动脉学运并行手术切除坏死小肠。其中,20例开放手术中有5例发病时间<24h、无溶栓禁忌证患者首先进行了介入溶栓治疗,病情进展时及时采取了开放手术。动脉夹层组多采取腔内手术方式,20例均先采取介入治疗如肠系膜动脉裸支架植入,其中1例因导丝不能回到真腔而进行了开放手术(肠系膜动脉远端内膜剥脱+近端支架植入术),疗效满意。术前增强CT、血生化检查及细致病史询问、体格检查对手术方式的选择很有意义。本组动脉栓塞及动脉夹层组采取开放及腔内手术的疗效无差异,动脉血栓形成组选择腔内手术有更高疗效。由于动脉血栓形成患者多伴基础疾病且肠系膜动脉多合并动脉粥样硬化,腔内手术往往更有优势[18-19]。对于溶栓效果不满意应果断转开放手术进行血运重建,必要时行小肠切除吻合术。
介入手术相比较开放手术而言,手术时间短、术中出血少,术后恢复快、住院时间短,虽然介入需要花费一定的手术耗材,但因其恢复快、住院时间短、手术并发症少,并没有明显增加患者住院费用。开放手术不可避免地会带来肺部感染、伤口感染、腹腔感染等术后并发症,而介入手术可大大避免这类并发症的发生。
总之,AMI病情危重,应酌情尽早采取合理手术方式。开放手术及腔内介入手术均为有效的治疗方式。对于发病时间<24h、无腹膜炎体征和活动性出血、脑出血、心房内栓子等溶栓禁忌证患者,可首选介入治疗;对于肠系膜动脉血栓形成病例,采取介入手术或许更有益于患者。
[1] ZETTERVALL S L, LO R C, SODEN P A, et al. Trends in treatment and mortality for mesenteric ischemia in the United States from 2000 to 2012[J]. Ann Vasc Surg, 2017,42:111-119.
[2] RYER E J, ODERICH G S, BOWER T C, et al. Differences in anatomy and outcomes in patients treated with open mesenteric revascularization before and after the endovascular era[J]. J Vasc Surg, 2011,53(6):1611-1618.e2.
[3] BURNS B J, BRANDT L J. Intestinal ischemia[J]. Gastroenterol Clin N Am, 2003,32(4):1127-1143.
[4] MENDES B C, ODERICH G S, TALLARITA T, et al. Superior mesenteric artery stenting using embolic protection device for treatment of acute or chronic mesenteric ischemia[J]. J Vasc Surg, 2018,68(4):1071-1078.
[5] KASSAHUN W T, SCHULZ T, RICHTER O, et al. Unchanged high mortality rates from acute occlusive intestinal ischemia:six year review[J]. Langenbecks Arch Surg, 2008,393(2):163-171.
[6] ARTHURS Z M, TITUS J, BANNAZADEH M, et al. A comparison of endovascular revascularization with traditional therapy for the treatment of acute mesenteric ischemia[J]. J Vasc Surg, 2011,53(3):698-704; discussion 704-705.
[7] GUPTA P K, NATARAJAN B, GUPTA H, et al. Morbidity and mortality after bowel resection for acute mesenteric ischemia[J]. Surgery, 2011,150(4):779-787.
[8] WEN S H, LING Y H, YANG W J, et al. Necroptosis is a key mediator of enterocytes loss in intestinal ischaemia/reperfusion injury[J]. J Cell Mol Med, 2017,21(3):432-443.
[9] CORCOS O, CASTIER Y, SIBERT A, et al. Effects of a multimodal management strategy for acute mesenteric ischemia on survival and intestinal failure[J]. Clin Gastroenterol Hepatol, 2013,11(2):158-165.e2.
[10] KLAR E, RAHMANIAN P B, BÜCKER A, et al. Acute mesenteric ischemia:a vascular emergency[J]. Dtsch Arztebl Int, 2012,109(14):249-256.
[11] BLAUW J T, BULUT T, ODERICH G S, et al. Mesenteric vascular treatment 2016:from open surgical repair to endovascular revascularization[J]. Best Pract Res Clin Gastroenterol, 2017,31(1):75-84.
[12] CHEN Y, ZHU J C, MA Z C, et al. Hybrid technique to treat superior mesenteric artery occlusion in patients with acute mesenteric ischemia[J]. Exp Ther Med, 2015,9(6):2359-2363.
[13] ADAM S S, KEY N S, GREENBERG C S. D-dimer antigen:current concepts and future prospects[J]. Blood, 2009,113(13):2878-2887.
[14] RIGHINI M, VAN ES J, DEN EXTER P L, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism:the ADJUST-PE study[J]. JAMA, 2014,311(11):1117-1124.
[15] CHIU Y H, HUANG M K, HOW C K, et al. D-dimer in patients with suspected acute mesenteric ischemia[J]. Am J Emerg Med, 2009,27(8):975-979.
[16] BLOCK T, NILSSON T K, BJÖRCK M, et al. Diagnostic accuracy of plasma biomarkers for intestinal ischaemia[J]. Scand J Clin Lab Invest, 2008,68(3):242-248.
[17] CARVER T W, VORA R S, TANEJA A. Mesenteric ischemia[J]. Crit Care Clin, 2016,32(2):155-171.
[18] FREITAS B, BAUSBACK Y, SCHUSTER J, et al. Thrombectomy devices in the treatment of acute mesenteric ischemia:initial single-center experience[J]. Ann Vasc Surg, 2018,51:124-131.
[19] KUHELJ D, KAVCIC P, POPOVIC P. Percutaneous mechanical thrombectomy of superior mesenteric artery embolism[J]. Radiol Oncol, 2013,47(3):239-243.