阿尔茨海默病(Alzheimer’s diseases, AD)主要表现为进行性记忆认知损害。海马作为边缘系统的重要组成部分,在学习、记忆和情感等方面起着重要作用。海马神经元丢失被认为是AD发病的早期迹象[1-2]。较长时间以来,研究者均把海马作为一个功能整体,认为海马整体负责记忆相关功能。然而,近年来有证据表明海马存在功能分区,其前部后部负责不同功能[3-4]。前海马主要与情绪和情感有关;后海马与记忆和认知功能密切相关[5-6]。AD患者以记忆障碍为主要症状,因此推测其主要损害海马后部结构。本研究利用MRI体素形态学分析(voxel-based morphometry, VBM)方法,对左右侧海马前后部分割,探索AD患者是否为选择性海马后部损害。
1 资料与方法
1.1 一般资料
本研究共纳入复旦大学华山医院门诊27例AD患者,其中男性13例,女性14例,平均年龄(66.04±9.01)岁,均为汉族、右利手。AD患者均符合美国国立神经病、语言障碍和卒中研究所阿尔茨海默病及相关疾病协会2011年诊断标准[7],采用统一简明智能状态检查量表(mini-mental state examination, MMSE)进行认知能力评估。MRI排除血管性痴呆和其他可导致痴呆的神经系统疾病,无严重躯体疾病和烟、酒等物质滥用情况,无胆碱酯酶抑制剂使用史,排除抑郁症。22例正常老年受试者为对照组,其中男性12例,女性10例,平均年龄(63.50±6.05)岁,均为汉族,右利手。入组标准:(1) 受教育时间>5年;(2) MMSE 评分正常;(3) 视 力、听力、言语正常;(4) 无重要脏器疾病;(5) 无颅脑疾病;(6) 无精神病史;所有受试者已签署知情同意书,一般资料见表1。
表1 一般资料
Tab.1 General data
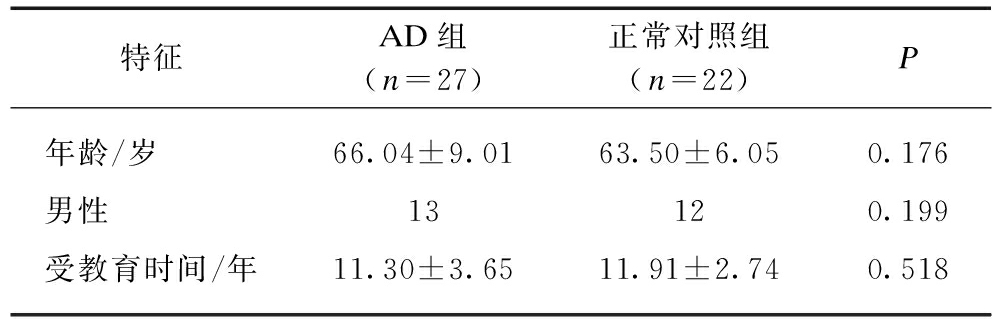
特征AD组(n=27)正常对照组(n=22)P年龄/岁66.04±9.0163.50±6.050.176男性13120.199受教育时间/年11.30±3.6511.91±2.740.518
1.2 MRI数据采集
所有受试者均接受西门子Verio 3.0 T MRI扫描,使用标准头部线圈,以3DMPRAGE序列采集全脑高分辨率结构像;扫描参数:TR=2300ms,TE=2.98ms,TI=900ms,翻转角=9°,层厚=1mm,无层间距,矩阵为256×256,体素大小为1mm×1mm×1mm。检查注意事项:(1) 橡皮耳塞降低噪声;(2) 泡沫固定头部(减少运动伪影)。
1.3 数据预处理
使用Matlab 2013b作为操作平台,利用SPM8(Statistical Parametric Mapping 8)和VBM8对数据进行预处理和组织分割。VBM方法是基于体素的形态学分析方法,以Dartel组织概率模板对脑组织分割[8]。
数据处理主要处理步骤:所有数据的高分辨率全脑结构像标准化到一个标准的立体模板空间(MNI空间);将标准化后的脑结构数据进行分割、平滑,得到灰质、白质和脑脊液;对平滑后灰质图像进行重新采样,重采样后体素大小为1.5mm×1.5mm×1.5mm;根据Fan等[4]提出的Brainnetome atlas海马分区模板(模板下载地址http:∥atlas.brainnetome.org),将左右侧海马分割前部和后部,见图1。用Restplus软件估算AD患者左右侧海马前后部的体积值。
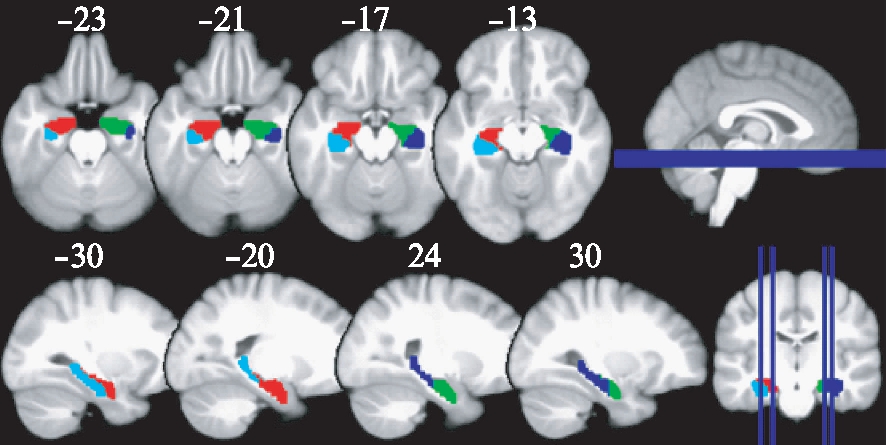
图1 左右海马前后部划分[4]
Fig.1 The division of bilateral anterior and posterior hippocampus
左侧海马前部(红色);左侧海马后部(浅蓝色);右侧海马前部(绿色);右侧海马后部(藏蓝色)
1.4 统计学处理
对AD组和正常对照组左右侧海马前后部进行基于体素水平的两独立样本t检验,考虑年龄可能是影响海马体积的因素,将年龄协变量已消除其可能影响,体素水平P<0.001,并作团块水平FEW校正。采用SPSS 20.0软件进行统计分析,对分类资料行χ2检验。计量资料以![]() 表示,临床资料组间比较采用独立样本t检验;两侧海马前后部体积值与MMSE评分进行相关性分析。P<0.05为差异具有统计学意义。
表示,临床资料组间比较采用独立样本t检验;两侧海马前后部体积值与MMSE评分进行相关性分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 AD患者左右侧海马前后部体积
Restplus软件估算AD患者左右侧海马前后部体积。左侧海马前部体积为(0.59±0.13) cm3;左侧海马后部体积为(0.42±0.81) cm3;右侧海马前部体积为(0.48±0.98) cm3;右侧海马后部体积为(0.45±0.85) cm3。
2.2 AD患者左右侧海马前后部体积改变
采用两独立样本t检验,比较AD患者与正常对照组两侧海马前后部差异。结果显示:与正常对照组相比,AD患者左侧海马后部及右侧海马后部体积明显减小(FWE校正,P<0.001,t=3.277),体积减小区域如图2 所示,红色越明显提示体积减小更为明显;左侧海马前部与右侧海马前部体积未见明显变化。
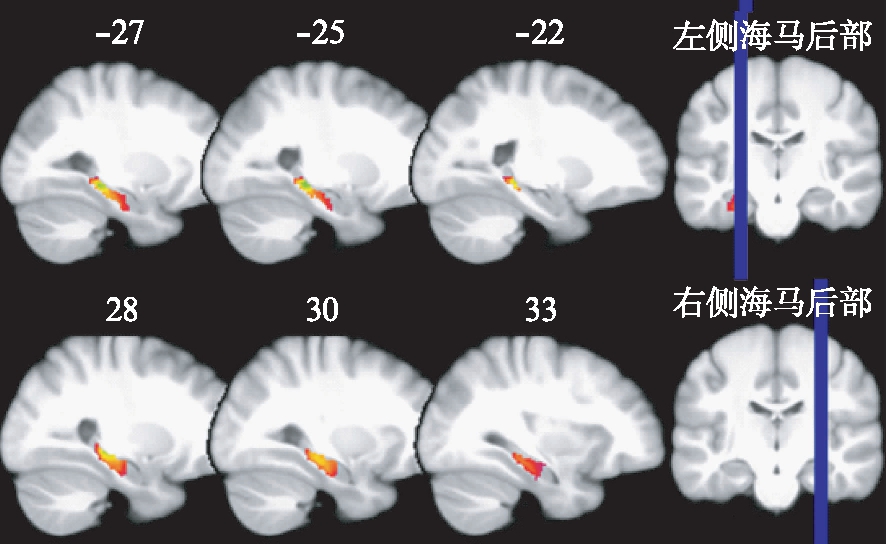
图2 AD患者左右侧海马后部体积改变
Fig.2 The volume changes of the posterior left and right hippocampus in AD patient
与正常对照组相比,AD患者左侧海马后部及右侧海马后部体积明显减小(FWE校正,P<0.001,t=3.277),红色越明显提示海马体积萎缩越显著
2.3 AD患者海马前后部体积与MMSE评分相关性分析
AD患者左侧及右侧前后部体积值与MMSE评分的皮尔逊相关,差异有统计学意义(P<0.05)。结果显示,与正常人相比,AD患者左右侧海马前后部体积均值与MMSE评分存在相关性(P<0.05)。其中左侧海马后部与MMSE评分相关性最为显著(r=0.412,P<0.001),见图3。
3 讨 论
AD以情景记忆损害为主要特征[9]。海马在记忆存储中起到重要作用。新的研究发现,海马前部和后部功能存在分化,后部主要与空间记忆和情景记忆密切相关[5-6,10],而前部与情绪等因素相关。因此,推测AD患者海马损害可能以后部为主,而不是整体平行受损。
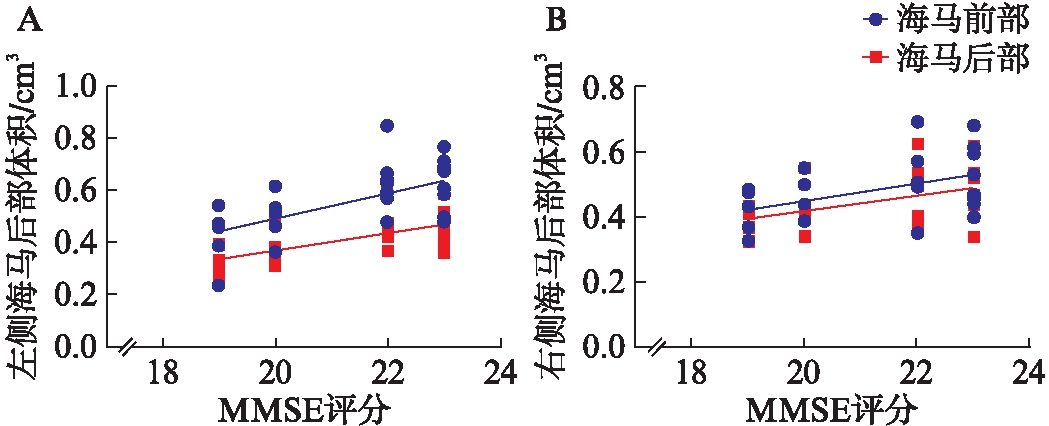
图3 AD患者左右侧海马前后部体积与MMSE评分的相关性
Fig.3 Correlation between MMSE score and volume of bilateral anterior and posterior hippocampus in patients with AD
A:左侧海马;蓝色表示AD患者左侧海马前部与MMSE评分相关性(r=0.368,P=0.001),红色表示AD患者左侧海马后部与MMSE评分相关性(r=0.412,P<0.001);B:右侧海马;蓝色表示AD患者右侧海马前部与MMSE评分相关性(r=0.182,P=0.026),红色表示AD患者右侧海马前部与MMSE评分相关性(r=0.215,P=0.015)
本研究基于VBM方法,对比分析正常老年人与AD患者左右侧海马前后部体积差异,发现AD患者主要左右侧海马后部发生了明显萎缩,而左右侧海马前部体积较正常人无明显差异;相较海马其他区域,左侧海马后部体积与认知评分的相关性最为显著。
3.1 海马解剖及其功能细分
海马位于丘脑与内侧颞叶之间,在情景记忆、空间导航、巩固长时记忆等认知功能方面起关键作用。许多疾病与海马结构改变以及功能失调有关,例如精神分裂症患者其海马的杏仁核-复合体明显萎缩[11];抑郁症患者也出现与情绪相关的海马与皮层间功能连接异常[12]。
既往大多数学者认为海马是与学习记忆相关的功能整体。随着研究深入,越来越多的证据表明,海马存在着解剖和功能分区[13-14]。通过探索动物海马体与皮层连接通路,发现前后部海马与大脑其他区域的解剖联系有明显差异[15-17]。Kahn等[18]利用静息态功能磁共振(resting functional MRI, r-fMRI)技术,在正常人脑内也得到了相同结论。有研究根据海马各部分功能连接区域不同,将其分为头、体、尾3部分[19]。也有学者将海马分为前后2个部分,海马前部主要负责情绪、情感调控,而海马后部则与空间、情景记忆和回忆等功能有关。不同疾病表现出的海马前后部功能变化是不同的。一项针对创伤性应激障碍患者海马前后部功能连接模式研究结果显示,海马后部与楔前叶功能连接下降,可能与其脑功能受损有关[5]。Voets等[20]发现慢性癫痫患者在海马前后部之间表现出异常的静息态功能连接。AD患者主要表现为回忆功能损害,因此推测,AD患者可能出现与回忆相关的海马区域受损。
3.2 AD患者海马后部选择性萎缩
研究[21-22]表明,AD患者海马体积出现萎缩,并且与认知能力存在显著相关,即萎缩程度越大,认知能力下降越明显。r-fMRI功能连接结果也证实AD患者海马是主要受损部位[23]。正如前文所述,海马存在解剖和功能分区,其中海马后部与用于评价回忆能力的情景记忆和空间定位能力密切相关。AD患者最主要的临床表现为进行性近事遗忘。考虑这可能与AD患者回忆能力相关的海马区域受损有关。本研究利用VBM技术,探究AD患者左右侧海马前后部体积受损情况,结果发现AD患者两侧海马后部明显萎缩,而两侧海马前部并未出现明显改变,其中左侧海马后部体积与MMSE评分相关性最为显著。这些结果提示,AD患者可能选择性损害与回忆功能相关的海马后部,而不是海马整体平行受损。Blum等[23]探索青年人和老年人海马前后部功能连接模式,发现海马后部是老年人认知调控的主要位点。本研究AD患者海马后部萎缩,可能是AD患者认知调控功能受损的原因之一。Carmichael等[22]运用局部成分分析计算技术(localized components analysis, LoCA),识别出390例被试者(包括AD患者、轻度认知功能障碍患者、正常人)海马萎缩的7种独立模式,发现AD患者较MCI患者和正常人为海马尾部萎缩更为显著,并且与tau蛋白沉积、神经心理学评分相关。结合本研究AD患者出现两侧海马后部萎缩,本课题组认为AD患者可能为选择性海马后部损伤。但Zarei等[19]一项有关AD患者海马不同区域功能连接模式的研究发现,AD患者较正常人海马头部功能连接活动增强,海马体部功能连接活动下降。这可能与海马前部并未出现明显受损,其功能活动发生代偿性升高有关。
已有研究证实,成年人海马体积会随着年龄增长出现一定程度萎缩[24-25],本研究充分考虑年龄可能对海马体积变化的影响,将年龄作为协变量,消除了与年龄有关的海马体积萎缩的影响。
3.3 本研究的不足与局限性
本研究初步探索AD患者海马回忆功能区域的选择性损害,对传统针对海马整体变化的研究作了一定补充。但本研究样本量相对较小,并未开展AD患者海马前后部体积纵向变化研究。考虑到本研究的局限性,未来工作中会扩大样本量,展开纵向随访研究。
本研究利用VBM方法分析AD患者左右侧海马前后部脑灰质体积改变,发现海马体积萎缩主要发生在海马后部。该结果表明,AD患者可能是与回忆功能有关的海马后部区域选择性损害,这为了解AD可能的发生机制提供了新的思路。
[1] GERISCHER L M, FEHLNER A, KÖBE T, et al. Combining viscoelasticity, diffusivity and volume of the Hippocampus for the diagnosis of Alzheimer’s disease based on magnetic resonance imaging[J]. Neuroimage Clin, 2018,18:485-493.
[2] ZHENG W M, CUI B, HAN Y, et al. Disrupted regional cerebral blood flow, functional activity and connectivity in Alzheimer’s disease:a combined ASL perfusion and resting state fMRI study[J]. Front Neurosci, 2019,13:738.
[3] HADAR P N, KINI L G, COTO C, et al. Clinical validation of automated hippocampal segmentation in temporal lobe epilepsy[J]. Neuroimage Clin, 2018,20:1139-1147.
[4] FAN L Z, LI H, ZHUO J J, et al. The human brainnetome atlas:a new brain atlas based on connectional architecture[J]. Cereb Cortex, 2016,26(8):3508-3526.
[5] LAZAROV A, ZHU X, SUAREZ-JIMENEZ B, et al. Resting-state functional connectivity of anterior and posterior Hippocampus in posttraumatic stress disorder[J]. J Psychiatr Res, 2017,94:15-22.
[6] LEE J K, FANDAKOVA Y, JOHNSON E G, et al. Changes in anterior and posterior Hippocampus differentially predict item-space, item-time, and item-item memory improvement[J]. Dev Cogn Neurosci, 2020,41:100741.
[7] MCKHANN G M, KNOPMAN D S, CHERTKOW H, et al. The diagnosis of dementia due to Alzheimer’s disease:recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J]. Alzheimers Dement, 2011,7(3):263-269.
[8] SUN J H, MALLER J J, GUO L T, et al. Superior temporal gyrus volume change in schizophrenia:a review on region of interest volumetric studies[J]. Brain Res Rev, 2009,61(1):14-32.
[9] 马文洁,赵小虎,王湘彬,等.阿尔茨海默病患者脑网络间交互作用异常的静息态fMRI研究[J].同济大学学报(医学版),2019,40(1):68-72.
[10] FJELL A M, SNEVE M H, SEDEREVICIUS D, et al. Volumetric and microstructural regional changes of the Hippocampus underlying development of recall performance after extended retention intervals[J]. Dev Cogn Neurosci, 2019,40:100723.
[11] LIU Y C, CHANG X, HAHN C G, et al. Non-coding RNA dysregulation in the amygdala region of schizophrenia patients contributes to the pathogenesis of the disease[J]. Transl Psychiatry, 2018,8(1):44.
[12] GAO C H, WENHUA L, LIU Y L, et al. Decreased subcortical and increased cortical degree centrality in a nonclinical college student sample with subclinical depressive symptoms:a resting-state fMRI study[J]. Front Hum Neurosci, 2016,10:617.
[13] MACMASTER F P, MIRZA Y, SZESZKO P R, et al. Amygdala and hippocampal volumes in familial early onset major depressive disorder[J]. Biol Psychiatry, 2008,63(4):385-390.
[14] DAUGHERTY A M, FLINN R, OFEN N. Hippocampal CA3-dentate gyrus volume uniquely linked to improvement in associative memory from childhood to adulthood[J]. Neuroimage, 2017,153:75-85.
[15] AGSTER K L, BURWELL R D. Cortical efferents of the perirhinal, postrhinal, and entorhinal cortices of the rat[J]. Hippocampus, 2009,19(12):1159-1186.
[16] JELLINGER K A. Fiber pathways of the brain[J]. Eur J Neurol, 2007,14(1):e51.
[17] SUZUKI W A, AMARAL D G. Perirhinal and parahippocampal cortices of the macaque monkey:cortical afferents[J]. J Comp Neurol, 1994,350(4):497-533.
[18] KAHN I, ANDREWS-HANNA J R, VINCENT J L, et al. Distinct cortical anatomy linked to subregions of the medial temporal lobe revealed by intrinsic functional connectivity[J]. J Neurophysiol, 2008,100(1):129-139.
[19] ZAREI M, BECKMANN C F, BINNEWIJZEND M A, et al. Functional segmentation of the Hippocampus in the healthy human brain and in Alzheimer’s disease[J]. Neuroimage, 2013,66:28-35.
[20] VOETS N L, ZAMBONI G, STOKES M G, et al. Aberrant functional connectivity in dissociable hippocampal networks is associated with deficits in memory[J]. J Neurosci, 2014,34(14):4920-4928.
[21] HAYES J P, MOODY J N, ROCA J G, et al. Body mass index is associated with smaller medial temporal lobe volume in those at risk for Alzheimer’s disease[J]. Neuroimage Clin, 2020,25:102156.
[22] CARMICHAEL O, XIE J, FLETCHER E, et al. Localized Hippocampus measures are associated with Alzheimer pathology and cognition independent of total hippocampal volume[J]. Neurobiol Aging, 2012,33(6):1124.e31-1124.e41.
[23] BLUM S, HABECK C, STEFFENER J, et al. Functional connectivity of the posterior Hippocampus is more dominant as we age[J]. Cogn Neurosci, 2014,5(3-4):150-159.
[24] PRUESSNER J C, COLLINS D L, PRUESSNER M, et al. Consistent age-related volume decline of left and right Hippocampus in healthy normal males but not females in early adulthood[J]. Neuroimage, 2000,11(5):S642.
[25] MARKS S M, LOCKHART S N, BAKER S L, et al. Tau and β-amyloid are associated with medial temporal lobe structure, function, and memory encoding in normal aging[J]. J Neurosci, 2017,37(12):3192-3201.