支气管哮喘是由嗜酸粒细胞、肥大细胞和T淋巴细胞等多种细胞和细胞组分参与的气道慢性炎症性疾病,主要病理特点为上皮层大量的嗜酸粒细胞浸润及以上皮下纤维化、平滑肌增生及胶原蛋白沉积为主的气道重塑[1]。支气管热成形术(bronchial thermoplasty, BT)是一种新型支气管镜技术,用于治疗对标准药物治疗,包括高剂量吸入皮质类固醇(inhaled corticosteroid, ICS)和长效β2激动剂(inhaled long-acting β2 receptor agonist, LABA)无反应的难治性哮喘(refractory asthma, RA)。
BT是射频导管通过支气管镜在指定部位张开,电极密切接触于管壁,继而控制能量的释放、作用的时间及所需的温度,将高频交流电磁波(350~500kHz)输入组织,通过电磁转换后,组织中带电离子发生震荡并且产生热能。在局部温度达到预设后,细胞溶解,细胞内蛋白变性,细胞内外的水分丧失,组织发生凝固性坏死,从而减少支气管平滑肌(airway smooth muscle, ASM)的数量,减弱了气道收缩力[2]。
尽管一些研究表明BT改善了哮喘患者的生活质量并减少了严重的哮喘急性发作[3],但目前BT与支气管管腔面积及疗效研究很少,因此,本研究主要评估BT对RA患者的肺功能、血嗜酸性粒细胞(eosinophil,E)改变率和高分辨率CT(high resolution CT, HRCT)下管腔面积(lumen area, LA)的影响。
1 资料与方法
1.1 一般资料
选择2016年1月至2020年1月同济大学附属第十人民医院呼吸科收治的8例完成BT手术的RA患者为BT组,选择同期收治的18例未行BT手术的RA患者为对照组。RA患者纳入标准: (1) 符 合我国哮喘防治指南中哮喘的诊断标准;(2) 排除患者治疗依从性不良,并排除诱发加重或使哮喘难以控制的因素;(3) 按照我国哮喘防治指南,采用2种或2种以上控制性药物规范治疗和管理6个月以上,尚不能达到理想控制[4]。本研究获得同济大学附属第十人民医院医院伦理委员会批准(编号: SHSY-IEC-4.1/20-21/01)。
1.2 BT组患者纳入和排除标准
纳入标准: (1) 年龄18~65周岁;(2) 严重的持续性哮喘: 症状白天持续、夜晚多发,每日多次使用速效β2受体激动剂,日常活动受限;(3) 目前规律使用大剂量ICS(丙酸氟替卡松>500μg/d或布地奈德>800μg/d)和LABA ;(4) 使用支气管扩张药前FEV1>60%预计值。
排除标准: (1) 植入心脏起搏器、除颤器等其他电子设备的患者;(2) 急性心肌梗死6周以内者;(3) 严重心肺疾患无法进行支气管镜操作者;(4) 麻 醉药物过敏,无法实施支气管镜检查者;(5) 无 法纠正的出凝血功能障碍者。
1.3 方法
BT组患者使用ALAIR®装置,每例患者分别行3个阶段BT治疗,每次间隔为3周或以上,从右下叶开始,然后是左下叶,最后是两个上叶,右中叶未经治疗,以避免发生右中叶综合征。射频探头可通过气管镜达直径为3mm的支气管,治疗时处理部位的温度为55~65℃,每次部位持续10s,沿着支气管树由远及近每隔5mm治疗1次,直到肺叶支气管。该过程在患者镇静下进行,在手术后立即接受密切的临床监测,泼尼松(50mg/d)是在每个阶段治疗前2d和治疗3d后系统地口服给药,术后予患者吸入性短效支气管扩张剂。对照组患者继续给予吸入性激素(丙酸氟替卡松>500μg/d或布地奈德>800μg/d),以及长效支气管扩张剂。
1.3.1 肺功能检测 两组患者分别于入组前和入组后1年行肺功能检查,评估1年后各项肺功能改善率。
1.3.2 HRCT采集和图像分析 患者以仰卧姿势进行非增强型HRCT,所有患者都接受了指导并仔细监测稳定的全吸气和正常扫描前的呼气末呼吸位置,患者吸气后屏气,由肺尖扫描至膈肌。扫描数据均以层厚2.5mm,肺窗、纵隔窗的窗宽和窗位分别为1600、-550HU和400、50HU。应用Image Pro plus 6.0分别识别左、右上叶尖段、左上叶固有段、左右下叶基底段和左右下叶后基底段支气管开口处,分别测量两组患者HRCT下同一部位治疗前后支气管管腔面积(lumen area, LA),计算每例患者治疗前后7个部位管腔面积的改善率,计算公式为 (1年后管腔面积-入组前管腔面积)/入组前管腔面积。包括段支气管(第3~4级): 右肺下叶基底段、左肺固有段、左肺下叶基底段开口处,小支气管(第5~6级): 右肺上叶尖段、右肺下叶后基底段、左肺上叶尖段、左肺下叶后基底段开口处。
1.3.3 嗜酸性粒细胞检测 选择两组患者入组前和入组后1年外周血嗜酸性粒细胞值和百分比,计算每个患者这两项指标的改善率。
1.4 统计学处理
采用SPSS 25.0和Graphpad Prism 7统计软件进行数据处理和分析。正态分布的数据以![]() 表示,并进行方差分析;呈非正态分布的数据则以中位数四分位数表示,并进行秩和检验。Logistic回归分析探讨气道LA与E相关的危险因素。P<0.05为差异有统计学意义。
表示,并进行方差分析;呈非正态分布的数据则以中位数四分位数表示,并进行秩和检验。Logistic回归分析探讨气道LA与E相关的危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 两组基线资料
两组患者年龄、性别、吸烟史、病程等差异无统计学意义(P>0.05),见表1。
2.2 患者BT治疗前后临床症状、AQLQ、嗜酸性粒细胞的变化
与BT治疗前比较,入选的8例患者AQLQ评分好转(3.20±0.59 vs 4.16±0.61,P<0.0001),提示BT治疗改善难治性哮喘患者的生活质量。患者术后吸入糖皮质激素用量降低,为丙酸氟替卡松200μg/d 或布地奈德160μg/d。血嗜酸性粒细胞[(0.21±0.25)×109/L vs (0.26±0.33)×109/L]及血嗜酸性细胞百分比(3.34%±4.14% vs 2.5%±2.73%)差异均无统计学意义(P>0.05),但有5例患者血嗜酸性粒细胞百分比出现下降。
表1 BT组和对照组患者临床指标、肺功能和管腔面积基线资料
Tab.1 Baseline data of clinical indicators, lung function and lumen area of patients in BT group and control group
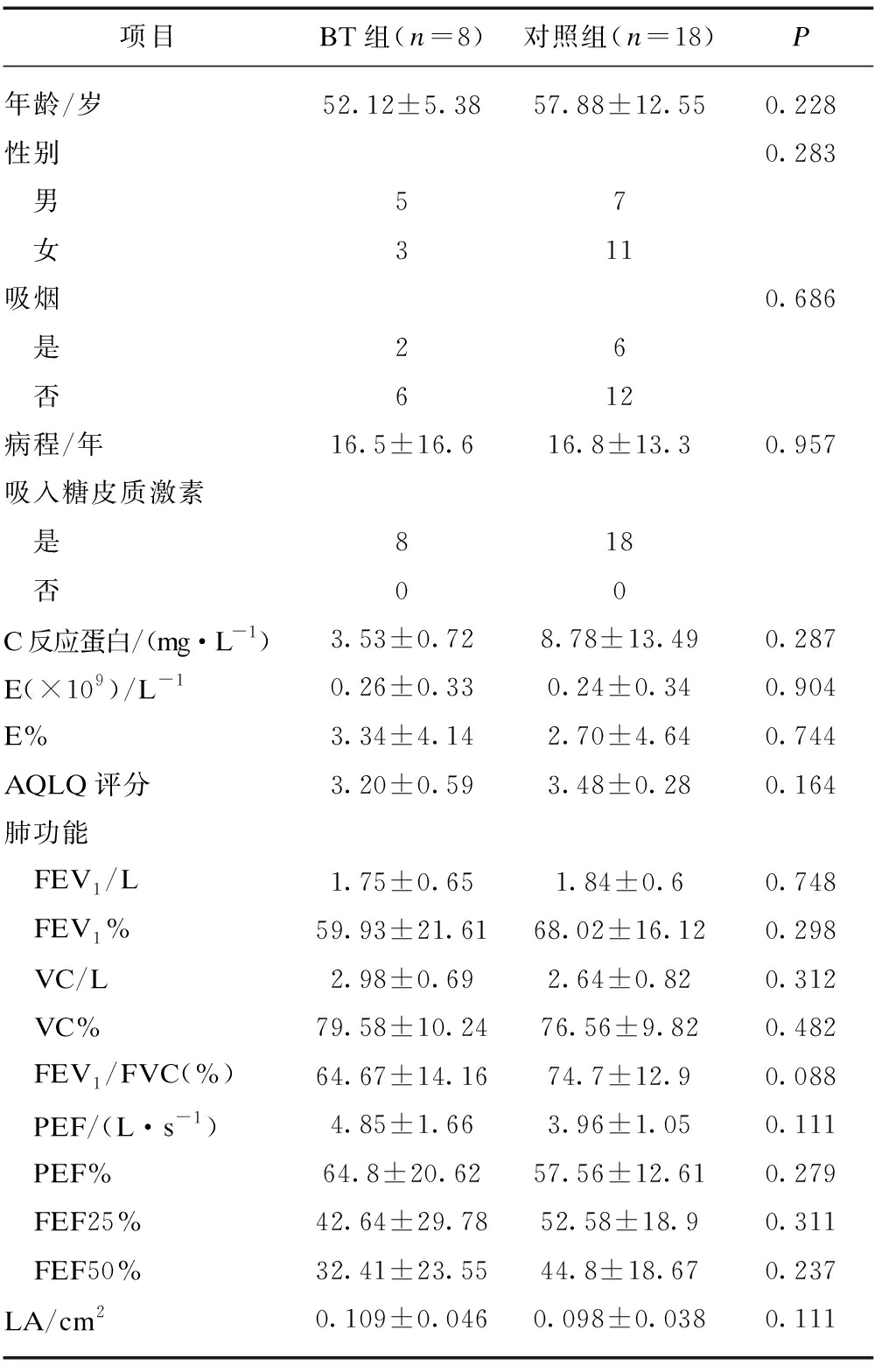
项目BT组(n=8)对照组(n=18)P年龄/岁52.12±5.3857.88±12.550.228性别0.283 男57 女311吸烟0.686 是26 否612病程/年16.5±16.616.8±13.30.957吸入糖皮质激素 是818 否00C反应蛋白/(mg·L-1)3.53±0.728.78±13.490.287E(×109)/L-10.26±0.330.24±0.340.904E%3.34±4.142.70±4.640.744AQLQ评分3.20±0.593.48±0.280.164肺功能 FEV1/L1.75±0.651.84±0.60.748 FEV1%59.93±21.6168.02±16.120.298 VC/L2.98±0.692.64±0.820.312 VC%79.58±10.2476.56±9.820.482 FEV1/FVC(%)64.67±14.1674.7±12.90.088 PEF/(L·s-1)4.85±1.663.96±1.050.111 PEF%64.8±20.6257.56±12.610.279 FEF25%42.64±29.7852.58±18.90.311 FEF50%32.41±23.5544.8±18.670.237LA/cm20.109±0.0460.098±0.0380.111
VC: 肺活量;FEV1/FVC: 第1秒用力呼气量占用力肺活量比值;FEV1: 1秒钟用力呼气容积;PEF: 呼气峰值流速;FEF25%: 呼出25%肺容量位时的呼气流速实际值/预计值;FEF50%: 呼出50%肺容量位时的呼气流速实际值/预计值;E: 血嗜酸性粒细胞;LA: 管腔面积
2.3 两组治疗前后肺功能改善率评价
BT组中1例患者和对照组中9例患者因哮喘急性发作,未完成1年后的肺功能随访。与对照组比较,BT组肺功能指标改善率,即FEV1/FVC、FEV1、FEV1%、FEF25、FEF25%、FEF50、FEF50%、MMEF、MMEF%负值明显减少,差异有统计学意义(P均<0.05),提示BT组肺功能下降程度优于对照组,见表2。
2.4 两组治疗前后支气管LA改善率评价
结果显示与对照组比较,BT组患者段支气管(0.008±0.157 vs 0.121±0.149)、小支气管(0.022±0.265 vs 0.176±0.311)、总支气管(0.015±0.224 vs 0.153±0.254)LA改善率明显增大,差异有统计学意义(P值均<0.05),见表3。
表2 BT组和对照组肺功能改善率的对比
Tab.2 Comparison of improvement rate of lung function between BT group and control group

肺功能指标BT组(n=7)对照组(n=9)PVC-0.042±0.117-0.096±0.1120.358VC%-0.025±0.100-0.0888±0.1380.330FEV1/FVC-0.038±0.096-0.188±0.1230.019FEV1-0.061±0.185-0.263±0.1460.029FEV1%-0.050±0.169-0.254±0.1630.029PEF-0.026±0.220-0.125±0.2180.383PEF%-0.019±0.212-0.121±0.2280.374FEF25-0.069±0.298-0.375±0.2180.033FEF25%-0.066±0.294-0.373±0.2260.033FEF50-0.084±0.323-0.450±0.1970.014FEF50%-0.076±0.317-0.447±0.2030.013FEF75-0.133±0.497-0.506±0.2140.062FEF75%-0.125±0.500-0.505±0.2160.059MMEF25~75-0.072±0.300-0.464±0.1840.006MMEF25%~75%-0.071±0.292-0.461±0.1890.006MVV0.059±0.334-0.227±0.2130.055MVV%0.067±0.323-0.221±0.2210.053舒张FEV1改善值1.969±2.9449.205±34.2360.589舒张FEV1改善率2.695±3.8279.040±34.3930.637RV/TLC0.068±0.1370.072±0.0990.954DLCO0.005±0.157-0.116±0.1510.139
VC: 肺活量;FEV1/FVC: 第1秒用力呼气量占用力肺活量比值;FEV1: 1秒钟用力呼气容积;PEF: 呼气峰值流速;FEF25: 呼出25%肺容量时的呼气流速;FEF25%: 呼出25%肺容量时的呼气流速实际值/预计值;FEF50: 呼出50%肺容量时的呼气流速;FEF50%: 呼出50%肺容量时的呼气流速实际值/预计值;FEF75: 呼出75%肺容量时的呼气流速;FEF75%: 呼出75%肺容量时的呼气流速实际值/预计值;MMEF25~75: 用力呼气中期流速;MMEF25%~75%: 用力呼气中期流速实际值/预计值;MVV: 最大通气量;RV/TLC: 残总比;DLCO: 弥散功能实际值/预计值
表3 BT组和对照组支气管管腔面积改善率的对比
Tab.3 Comparison of improvement rate of bronchial lumen area between BT group and control group
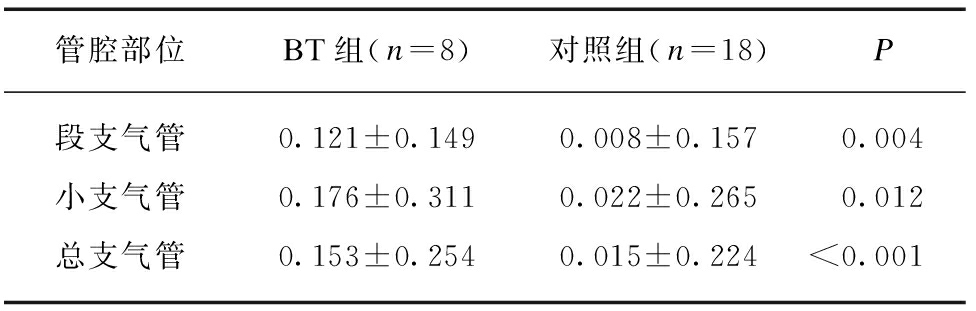
管腔部位BT组(n=8)对照组(n=18)P段支气管0.121±0.1490.008±0.1570.004小支气管0.176±0.3110.022±0.2650.012总支气管0.153±0.2540.015±0.224<0.001
段支气管: 右肺下叶基底段、左肺固有段、左肺下叶基底段;小支气管: 右肺上叶尖段、右肺下叶后基底段、左肺上叶尖段、左肺下叶后基底段;总支气管: 段支气管+小支气管;改善率: (1年后管腔面积-入组前管腔面积)/入组前管腔面积
2.5 BT组支气管LA改善率相关性分析
将BT组患者小支气管治疗前后LA改善率与肺功能改善率、BT手术前后血嗜酸性粒细胞计数和百分比进行相关性分析,结果显示小支气管LA改善率与术后血嗜酸性粒细胞值和百分比有负相关趋势,但无统计学意义(r=-0.108,P=0.798;r=-0.065,P=0.878)。小支气管LA改善率与其他指标无相关性,见表4和图1。
表4 小支气管管腔面积改善率相关性分析
Tab.4 Correlation analysis of the improvement rate of small bronchial lumen area
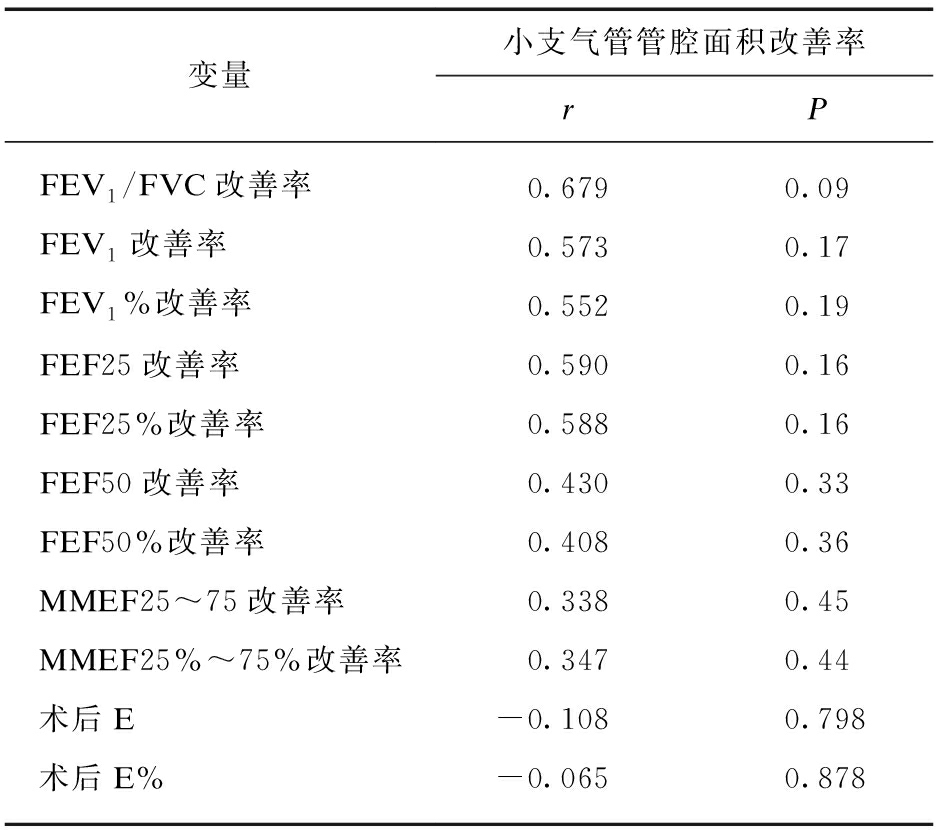
变量小支气管管腔面积改善率rPFEV1/FVC改善率0.6790.09FEV1改善率0.5730.17FEV1%改善率0.5520.19FEF25改善率0.5900.16FEF25%改善率0.5880.16FEF50改善率0.4300.33FEF50%改善率0.4080.36MMEF25~75改善率0.3380.45MMEF25%~75%改善率0.3470.44术后E-0.1080.798术后E%-0.0650.878
FEV1/FVC: 第1秒用力呼气量占用力肺活量比值;FEV1: 1秒钟用力呼气容积; FEF25: 呼出25%肺容量时的呼气流量;FEF25%: FEF25实际值/预计值;FEF50: 呼出50%肺容量时的呼气流量;FEF50%: FEF50实际值/预计值;MMEF25~75: 25%~75%肺容量时的呼气平均流量;MMEF25%~75%: MMEF25~75实际值/预计值;E: 血嗜酸性粒细胞;E%: 血嗜酸性粒细胞百分比;小支气管: 右肺上叶尖段、右肺下叶后基底段、左肺上叶尖段、左肺下叶后基底段
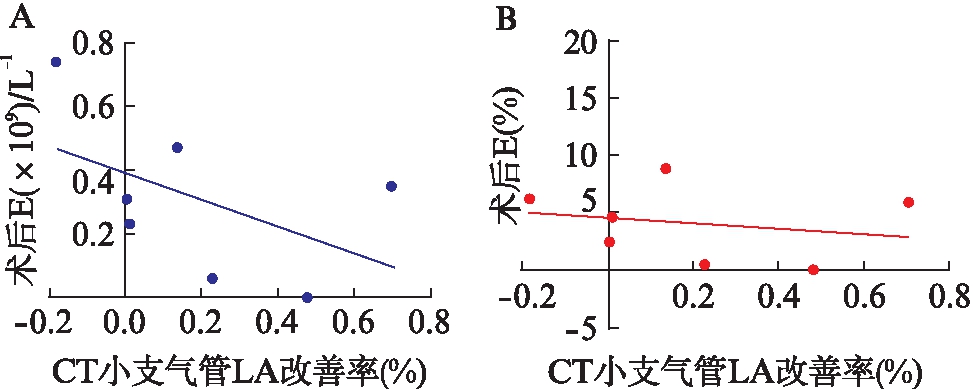
图1 小支气管管腔面积改善率与BT术后血嗜酸性粒细胞相关性分析
Fig.1 Correlation between the improvement rate of small bronchial lumen area and blood eosinophils after BT
A: 小支气管管腔面积改善率与BT术后血E值的散点图;B: 小支气管管腔面积改善率与BT术后血E%的散点图;r=-0.108,P=0.798;r=-0.065,P=0.878
3 讨 论
本研究首次将BT后肺功能改善率和支气管管腔面积改善率进行对比,发现BT治疗延缓了肺功能下降的速度,降低了气道阻力,明显扩张了支气管管腔面积,但小支气管腔面积的改善率与肺功能变化和术后嗜酸性粒细胞没有相关性,但与BT术后血嗜酸性粒细胞值和百分比呈现负相关趋势,这提示BT能够改善难治性哮喘患者的气道重塑。本研究的一个潜在局限性是入选BT组患者只有8例,虽然各观察指标提示两组之间有差异,但未发现与管腔面积改善率的相关性指标,本课题组将在未来的研究里开展更大样本的研究。
支气管哮喘气道重塑体现在气道平滑肌细胞数量增多和体积肥大、腺上皮化生、气道管壁的增厚、气道黏膜上皮下纤维化及黏膜基膜下胶原纤维细胞外基质的沉积[5]。气道平滑肌(airway smooth muscle, ASM)体积的增大在中央大气道上体现为平滑肌数量的增多,以增生为主,在小气道上体现为平滑肌体积的增大,以肥大为主[6]。与正常人气道平滑肌细胞比较,哮喘患者气道平滑肌细胞处于细胞周期增殖时相的比例明显较多[7]。增殖的ASM导致支气管管壁增厚,这直接引起了支气管的狭窄。正常人体气道平滑肌细胞多为收缩型,而在多种因素刺激下哮喘患者气道平滑肌细胞发生了表型转化[8-9],胞内具有收缩作用的结构和蛋白减少,其生长能力、迁移能力均明显增强,具有合成功能的细胞器(如高尔基体等)含量增加,ASM可以分泌各种细胞因子、化学趋化因子、生长因子及细胞外基质,诱导平滑肌细胞的生长和增殖,并且还能够诱导ASM持久性收缩[10]。关于BT术开展的AIR、RISA及AIR2等试验及随访研究均表明BT治疗在临床实践应用中能有效降低难治性哮喘患者的急性发作频率,提高患者的生活质量,减少急救药物的使用次数,并持续有效[11-13]。Chakir等[14]通过研究9例BT患者手术前后支气管病理发现,随着时间的延长气道平滑肌的面积在减少,患者吸入皮质类固醇的剂量、严重恶化的次数和哮喘的控制状态均得到改善。本研究发现,BT术后患者的支气管LA扩大,肺功能下降速度减慢,说明BT术的有效性,并且这种有效性是通过消融支气管平滑肌扩张气道实现的,这与之前其他的实验一致。
目前多项研究证明BT术能改善患者的肺功能,主要以改善FEV1为主[15-16],在本研究中发现BT治疗患者肺功能指标FEV1/FVC、FEV1、FEV1%、FEF75、FEF75%、FEF50、FEF50%、MMEF、MMEF%改善率显著优于对照组,在肺功能指标中FEV1/FVC、FEV1、FEV1%反映大气道阻力,BT治疗靶点是直径>3mm的支气管,这说明BT治疗可以通过消融支气管平滑肌,改善气道重塑,进而起到扩张支气管的治疗作用,改善了大气道的通气阻力。MEF75、MEF75%、MEF50、MEF50%、MMEF、MMEF%反映小气道功能,小气道是指支气管内径<2mm且无软骨支持的小细支气管,其具有气流阻力小、易阻塞等特点[17]。MMEF是指用力呼气25%~ 75%肺活量时的平均流速,是判断气道阻塞的主要指标,其数值降低表明小气道阻塞增加,反映小气道病变具有较高的敏感性和准确性[18]。FEF25%、FEF50%、FEF75%分别反映呼气早期、中期和末期的流速指标。在早期哮喘症状中,呼气中期流速指标在肺功能检测中认为比FEV1更敏感[19],并且哮喘患者FEF50%pred、FEF75%pred和FEF25%~75%pred与炎症因子呈负相关[20]。在本研究中BT改善了小气道的通气功能,考虑BT的治疗机制除了对支气管平滑肌的消融作用以外,可能还有神经机制参与其中。
HRCT已广泛应用于肺部疾病的诊断,能反映与大体标本相似的形态学改变,在HRCT中可识别细支气管、终末细支气管、肺小叶及支气管伴行的血管[21]。HRCT由于具有无创、高分辨率的优势,可以对哮喘患者的气道重塑进行定量,Hoshino等[22]通过自动测量软件得出哮喘患者的气道腔内径与气流受限具有很高的相关性;本研究发现BT术后患者肺功能下降速度和支气管管腔面积的改善均优于对照组,将支气管管腔面积的改善率与其肺功能的改善率作相关分析,结果显示支气管管腔面积的改善率与肺功能变化不相关。
哮喘是由多种炎症细胞(包括嗜酸性粒细胞、中性粒细胞、T淋巴细胞、肥大细胞)和炎症组分共同参与的气道慢性炎症性疾病,嗜酸性粒细胞是哮喘发病机制中的主要效应细胞[23],在哮喘患者的支气管肺泡灌洗液和诱导痰中发现有大量活化聚集的嗜酸性粒细胞,而且发现嗜酸性粒细胞数量的多少与哮喘的严重程度相关[24]。ASM可以释放细胞因子,参与了嗜酸性粒细胞介导的炎症反应[25]。Ryan等[26]观察了13例患者BT手术前后血嗜酸性粒细胞,发现术后嗜酸性粒细胞明显下降。本研究发现小支气管管腔面积的改善率与术后血嗜酸性粒细胞值和百分比无相关性,但呈现出负相关趋势,小气道因其自身特点是气道高反应发生的关键部位,小气道结构的变化在支气管哮喘患者气道炎症中扮演着重要角色,BT治疗通过对ASM的消融,减少了细胞数量,进而减少了嗜酸性粒细胞相关的细胞因子的释放,减轻了哮喘的炎症反应。
综上所述,在RA的疗效观察中验证了BT治疗的有效性,并且发现通过扩大了支气管管腔面积提高了肺功能FEV1改善率,改善了阻塞性通气功能障碍。
[1] AGHASAFARI P, GEORGE U, PIDAPARTI R. A review of inflammatory mechanism in airway diseases[J]. Inflamm Res, 2019,68(1): 59-74.
[2] MANDOVRA N P, LEUPPI J D, HERTH F J F, et al. Interventions in asthma and COPD[J]. Ther Umschau, 2019,76(6): 328-336.
[3] MADSEN H, HENRIKSEN D P, BACKER V, et al. Efficacy of bronchial thermoplasty in patients with severe asthma[J]. J Asthma, 2019. https:∥doi.org/10.1080/02770903.2019.1678636.
[4] 中华医学会呼吸病分会哮喘学组.难治性哮喘诊断与处理专家共识[J].中华结核和呼吸杂志,2010,33(8): 572-577.
[5] FANG L, SUN Q Z, ROTH M. Immunologic andnon-immunologic mechanisms leading to airway remodeling in asthma[J]. Int J Mol Sci, 2020,21(3): 757.
[6] SAGLANI S, LLOYD C M. Novel concepts in airway inflammation and remodelling in asthma[J]. Eur Respir J, 2015,46(6): 1796-1804.
[7] JOUBERT P, HAMID Q. Role of airway smooth muscle in airway remodeling[J]. J Allergy Clin Immunol, 2005,116(3): 713-716.
[8] HIROTA J A, NGUYEN T T, SCHAAFSMA D, et al. Airway smooth muscle in asthma: phenotype plasticity and function[J]. Pulm Pharmacol Ther, 2009,22(5): 370-378.
[9] DEKKERS B G, SCHAAFSMA D, NELEMANS S A, et al. Extracellular matrix proteins differentially regulate airway smooth muscle phenotype and function[J]. Am J Physiol Lung Cell Mol Physiol, 2007,292(6): L1405-L1413.
[10] FANG L, SUN Q Z, ROTH M. Immunologic and non-immunologic mechanisms leading to airway remodeling in asthma[J]. Int J Mol Sci, 2020,21(3): E757.
[11] COX G, THOMSON N C, RUBIN A S, et al. Asthma control during the year after bronchial thermoplasty[J]. N Engl J Med, 2007,356(13): 1327-1337.
[12] PAVORD I D, COX G, THOMSON N C, et al. Safety and efficacy of bronchial thermoplasty in symptomatic, severe asthma[J]. Am J Respir Crit Care Med, 2007,176(12): 1185-1191.
[13] CASTRO M, RUBIN A S, LAVIOLETTE M, et al. Effectiveness and safety of bronchial thermoplasty in the treatment of severe asthma: a multicenter, randomized, double-blind, sham-controlled clinical trial[J]. Am J Respir Crit Care Med, 2010,181(2): 116-124.
[14] CHAKIR J, HAJ-SALEM I, GRAS D, et al. Effects of bronchial thermoplasty on airway smooth muscle and collagen deposition in asthma[J]. Ann Am Thorac Soc, 2015,12(11): 1612-1618.
[15] EISENMANN S, SCHÜTTE W, FUNKE F, et al. Bronchial thermoplastyincluding the middle lobe Bronchussignificantly improves lung function and quality of life in patients suffering from severe asthma[J]. Lung, 2019,197(4): 493-499.
[16] YAMAMOTO S, IIKURA M, KAKUWA T, et al. Can the number of radiofrequency activations predict serious adverse events after bronchial thermoplasty? A retrospective case-control study[J]. Pulm Ther, 2019,5(2): 221-233.
[17] 陈俊松,汤昱,李敏,等.哮喘患儿病情不同阶段气道功能变化的研究[J].中国医师进修杂志(综合版),2018(3): 208-211.
[18] 中华医学会呼吸病学分会肺功能专业组.肺功能检查指南—呼气峰值流量及其变异率检查[J].中华结核和呼吸杂志,2017,40(6): 426-430.
[19] USMANI O S. Small airways dysfunction in asthma: evaluation and management to improve asthma control[J]. Allergy Asthma Immunol Res, 2014,6(5): 376-388.
[20] 史兆雯,蔡朱莺,王昌惠.哮喘急性发作患者血清中IL-18、IL-33表达意义及其与肺功能的关系[J].同济大学学报(医学版),2017,38(6): 58-62.
[21] 李林霞,周炜.CT高分辨薄层扫描技术在胸部病变的应用价值[J].四川医学,2008,29(5): 599-600.
[22] HOSHINO M, MATSUOKA S, HANDA H, et al. Correlation between airflow limitation and airway dimensions assessed by multidetector CT in asthma[J]. Respir Med, 2010,104(6): 794-800.
[23] KAY A B, PHIPPS S, ROBINSON D S. A role for eosinophils in airway remodelling in asthma[J]. Trends Immunol, 2004,25(9): 477-482.
[24] PRICE D B, RIGAZIO A, CAMPBELL J D, et al. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study[J]. Lancet Respir Med, 2015,3(11): 849-858.
[25] CALVÉN J, AKBARSHAHI H, MENZEL M, et al. Rhinoviral stimuli, epithelial factors and ATP signalling contribute to bronchial smooth muscle production of IL-33[J]. J Transl Med, 2015,13: 281.
[26] RYAN D M, FOWLER S J, NIVEN R M. Reduction in peripheral blood eosinophil counts after bronchial thermoplasty[J]. J Allergy Clin Immunol, 2016,138(1): 308-310.