卒中相关性肺炎(stroke-associated pneumonia, SAP)是由21世纪初德国科隆大学附属医院的Hilker等[1]于2003年提出,此后美国及英国均对定义有所修订[2],目前通行的概念为急性脑卒中(acute ischemia stroke, AIS)患者发病7d以内伴有发热、咳痰等呼吸系统症状[3],并与美国疾病防控中心(Center for Disease Control and Prevention, CDC)肺炎诊断标准相符的急性期肺部感染。卒中的恶化会增加SAP的难治性,而SAP的出现又可能会加重卒中病情,影响预后。寻找SAP的危险因素对于AIS及SAP的治疗有重要意义。由于重症SAP影响因素较多,本研究分析比较了剔除与不剔除重症SAP患者后危险因素的差异,以期深入了解SAP的发病,从而更好地指导临床治疗。
1 资料与方法
1.1 一般资料
连续入组2018年10月至2019年10月上海市徐汇区中心医院神经内科住院治疗的急性期脑梗死患者共153例,年龄31~96岁,平均年龄(74.67±13.1)岁,男70例,女83例。AIS合并SAP患者共70例,年龄31~95岁,平均年龄(80.5±9.2)岁,其中男28例,女42例,年龄≥65岁62例;美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale, NIHSS)评分≥10分57例,意识障碍48例,吞咽障碍63例。其中45例为重症SAP患者,急性生理学及慢性健康状况评分系统Ⅱ(Acute Physiology and Chronic Health Evaluation Scoring System Ⅱ, APACHE Ⅱ)评分12~21分,平均为(15±3.2)分。
1.2 入选标准
均符合缺血性脑卒中诊断标准,并经头颅CT或MRI证实;首次发生卒中的患者,既往无明确脑卒中病史;脑卒中症状出现至入院时间不超过48h;入院时NIHSS评分≥2分。
1.3 排除标准
脑卒中症状出现前及近期已有肺部感染;既往有其他肺部疾病如肺结核、肺肿瘤、肺间质病变、肺栓塞、肺不张、肺水肿等;入院时NIHSS评分<2分;脑卒中症状出现至入院时间>48h;脑卒中症状出现24h内行血管内介入治疗;恶性肿瘤、瘤卒中;严重的心肺疾病、严重的肝肾功能障碍;血液病、中毒、梅毒、风湿免疫疾病、严重的内分泌和代谢疾病;有机械通气的患者。
1.4 分组标准
据患者是否符合改良版美国CDC肺炎诊断标准,将患者分为SAP组和非SAP组,据患者APACHE Ⅱ评分是否>12分将患者分为普通SAP组和重症SAP组。
1.5 检测指标
记录各组患者性别、年龄、有无意识障碍、有无吞咽困难、有无房颤、入院时NIHSS评分,检测患者空腹血糖、肌酐、B型钠尿肽、肌钙蛋白I、肌红蛋白、胆固醇、三酰甘油、低密度脂蛋白、高密度脂蛋白、同型半胱氨酸、血浆白蛋白、C反应蛋白、降钙素原、淋巴细胞计数、淋巴细胞百分比、中性粒细胞数/淋巴细胞数,纤维蛋白原、D-二聚体,对影响因素进行筛选,再进行多因素Logistic回归分析其危险因素。
1.6 统计学处理
运用SPSS 22.0软件比较两组间各危险因素指标间的差异,先用K-S检验方法进行正态性检验,根据数据的分布,符合正态分布的计量资料或连续变量用![]() 表示,采用t检验;非正态分布的计量资料或连续变量用中位数(四分位数)表示,采用Mann-Whitney U检验;计数资料或分类变量用频数及百分数表示,采用卡方检验;P<0.05认为差异有统计学意义;将P<0.05的单因素分析结果纳入多因素Logistic回归模型,P<0.05为差异有统计学意义。
表示,采用t检验;非正态分布的计量资料或连续变量用中位数(四分位数)表示,采用Mann-Whitney U检验;计数资料或分类变量用频数及百分数表示,采用卡方检验;P<0.05认为差异有统计学意义;将P<0.05的单因素分析结果纳入多因素Logistic回归模型,P<0.05为差异有统计学意义。
2 结 果
2.1 单因素分析结果
为防止重症SAP患者对结果产生偏倚,分别将全部SAP患者及去除重症SAP患者后所余普通SAP患者与非肺炎组患者进行单因素方差分析,2次分析后,以下因素与卒中后肺炎的发生呈正相关:存在吞咽障碍、存在意识障碍、房颤、NIHSS评分、肌红蛋白、肌钙蛋白I、B型钠尿肽、C反应蛋白、降钙素原、中性粒细胞数/淋巴细胞数、D-二聚体、纤维蛋白原,即这些指标数值越大,越容易发生卒中后肺炎;以下因素与卒中后肺炎的发生呈负相关:白蛋白、淋巴细胞百分比、淋巴细胞计数、三酰甘油,即这些指标数值越低,越容易发生卒中后肺炎。以上因素在肺炎组及非肺炎组间差异均有统计学意义(P<0.05),见表1~3。
2.2 发生SAP危险的多因素Logistic分析
将单因素分析所得危险因素进一步行Logistic分析,结果显示吞咽障碍、房颤、淋巴细胞百分比减低、中性粒细胞数/淋巴细胞数增高、血脂减低是急性缺血性脑卒中后肺炎发生的独立危险预测因素,值得注意的是,NIHSS评分在去除重症SAP患者后不再是发生SAP的危险因素,但心房颤动却始终显示是发生SAP的危险因素,见表4。
表1 全部SAP患者与非肺炎组患者数据比较
Tab.1 Difference between all SAP patients and non-SAP patients
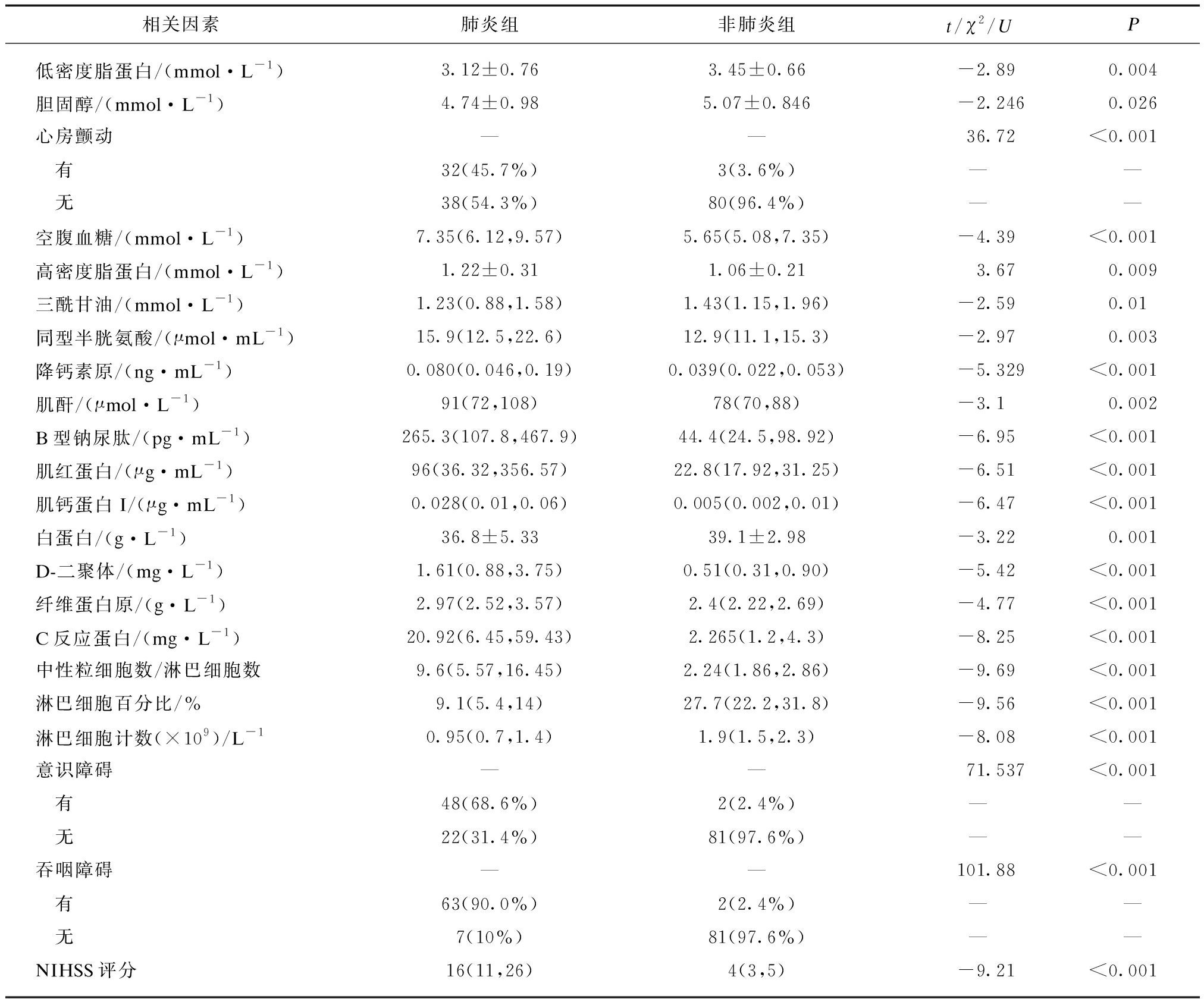
相关因素肺炎组非肺炎组t/χ2/UP低密度脂蛋白/(mmol·L-1)3.12±0.763.45±0.66-2.890.004胆固醇/(mmol·L-1)4.74±0.985.07±0.846-2.2460.026心房颤动——36.72<0.001 有32(45.7%)3(3.6%)—— 无38(54.3%)80(96.4%)——空腹血糖/(mmol·L-1)7.35(6.12,9.57)5.65(5.08,7.35)-4.39<0.001高密度脂蛋白/(mmol·L-1)1.22±0.311.06±0.213.670.009三酰甘油/(mmol·L-1)1.23(0.88,1.58)1.43(1.15,1.96)-2.590.01同型半胱氨酸/(μmol·mL-1)15.9(12.5,22.6)12.9(11.1,15.3)-2.970.003降钙素原/(ng·mL-1)0.080(0.046,0.19)0.039(0.022,0.053)-5.329<0.001肌酐/(μmol·L-1)91(72,108)78(70,88)-3.10.002B型钠尿肽/(pg·mL-1)265.3(107.8,467.9)44.4(24.5,98.92)-6.95<0.001肌红蛋白/(μg·mL-1)96(36.32,356.57)22.8(17.92,31.25)-6.51<0.001肌钙蛋白I/(μg·mL-1)0.028(0.01,0.06)0.005(0.002,0.01)-6.47<0.001白蛋白/(g·L-1)36.8±5.3339.1±2.98-3.220.001D-二聚体/(mg·L-1)1.61(0.88,3.75)0.51(0.31,0.90)-5.42<0.001纤维蛋白原/(g·L-1)2.97(2.52,3.57)2.4(2.22,2.69)-4.77<0.001C反应蛋白/(mg·L-1)20.92(6.45,59.43)2.265(1.2,4.3)-8.25<0.001中性粒细胞数/淋巴细胞数9.6(5.57,16.45)2.24(1.86,2.86)-9.69<0.001淋巴细胞百分比/%9.1(5.4,14)27.7(22.2,31.8)-9.56<0.001淋巴细胞计数(×109)/L-10.95(0.7,1.4)1.9(1.5,2.3)-8.08<0.001意识障碍——71.537<0.001 有48(68.6%)2(2.4%)—— 无22(31.4%)81(97.6%)——吞咽障碍——101.88<0.001 有63(90.0%)2(2.4%)—— 无7(10%)81(97.6%)——NIHSS评分16(11,26)4(3,5)-9.21<0.001
表2 普通组SAP患者与非肺炎组患者数据比较
Tab.2 Difference between general SAP patients and non-SAP patients
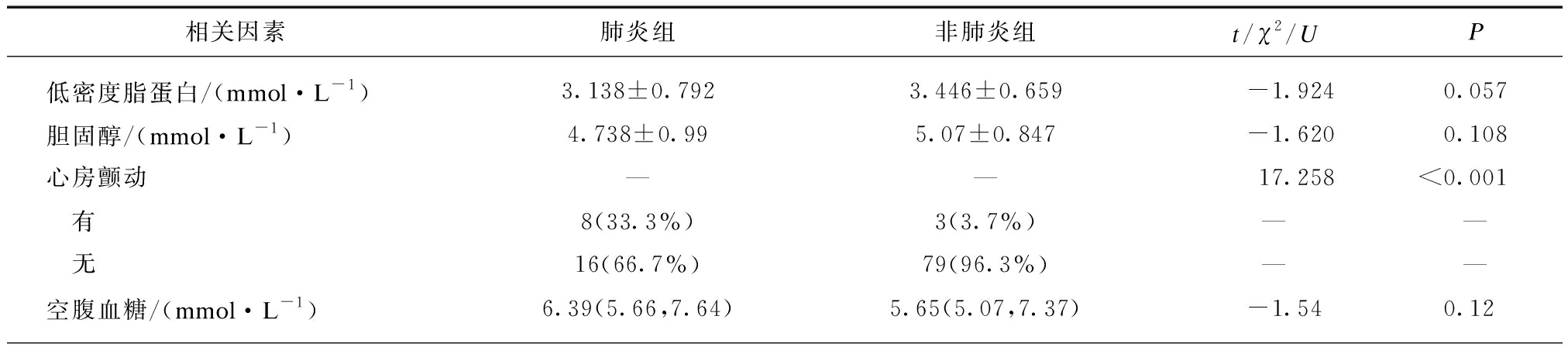
相关因素肺炎组非肺炎组t/χ2/UP低密度脂蛋白/(mmol·L-1)3.138±0.7923.446±0.659-1.9240.057胆固醇/(mmol·L-1)4.738±0.995.07±0.847-1.6200.108心房颤动——17.258<0.001 有8(33.3%)3(3.7%)—— 无16(66.7%)79(96.3%)——空腹血糖/(mmol·L-1)6.39(5.66,7.64)5.65(5.07,7.37)-1.540.12
(续表2)
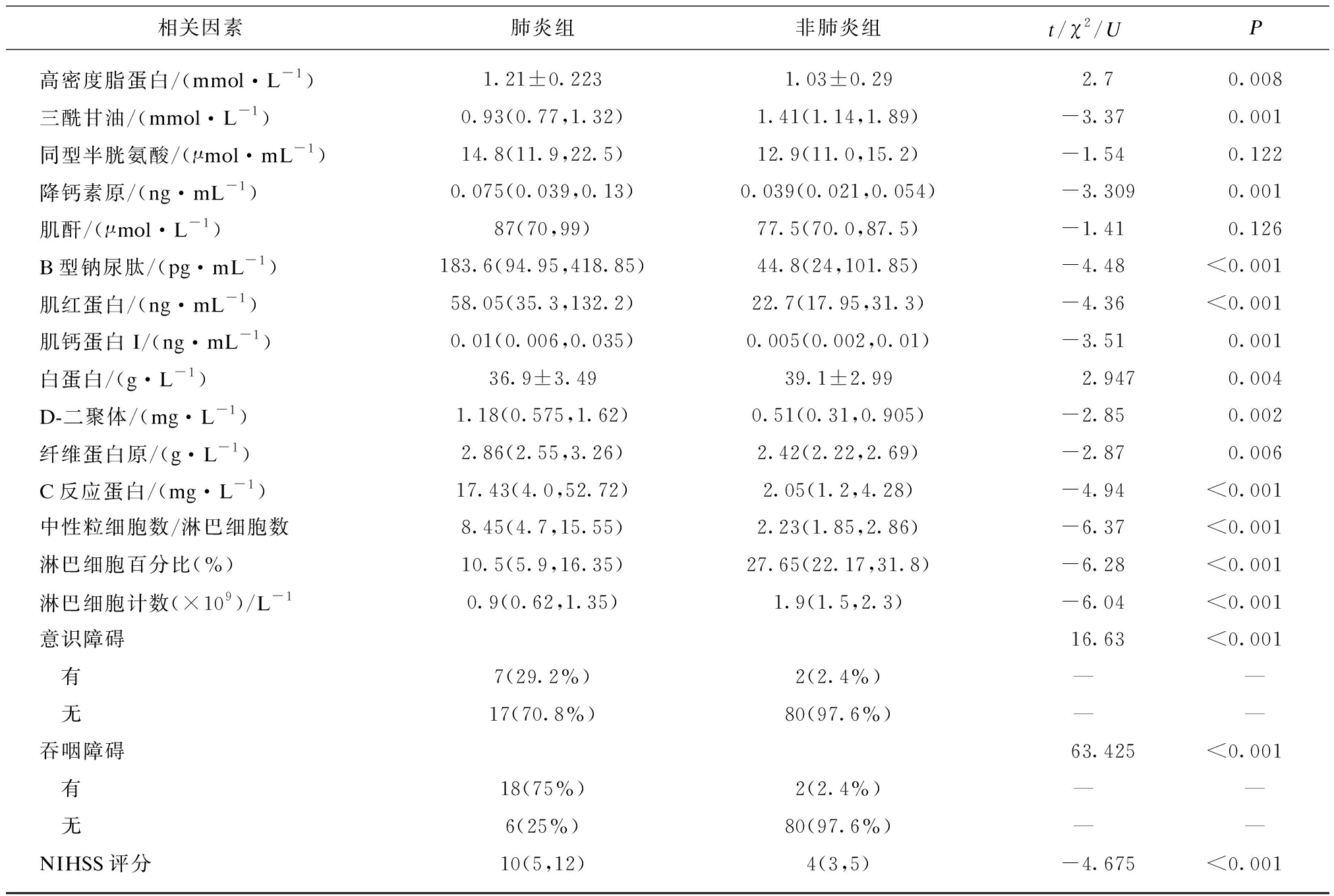
相关因素肺炎组非肺炎组t/χ2/UP高密度脂蛋白/(mmol·L-1)1.21±0.2231.03±0.292.70.008三酰甘油/(mmol·L-1)0.93(0.77,1.32)1.41(1.14,1.89)-3.370.001同型半胱氨酸/(μmol·mL-1)14.8(11.9,22.5)12.9(11.0,15.2)-1.540.122降钙素原/(ng·mL-1)0.075(0.039,0.13)0.039(0.021,0.054)-3.3090.001肌酐/(μmol·L-1)87(70,99)77.5(70.0,87.5)-1.410.126B型钠尿肽/(pg·mL-1)183.6(94.95,418.85)44.8(24,101.85)-4.48<0.001肌红蛋白/(ng·mL-1)58.05(35.3,132.2)22.7(17.95,31.3)-4.36<0.001肌钙蛋白I/(ng·mL-1)0.01(0.006,0.035)0.005(0.002,0.01)-3.510.001白蛋白/(g·L-1)36.9±3.4939.1±2.992.9470.004D-二聚体/(mg·L-1)1.18(0.575,1.62)0.51(0.31,0.905)-2.850.002纤维蛋白原/(g·L-1)2.86(2.55,3.26)2.42(2.22,2.69)-2.870.006C反应蛋白/(mg·L-1)17.43(4.0,52.72)2.05(1.2,4.28)-4.94<0.001中性粒细胞数/淋巴细胞数8.45(4.7,15.55)2.23(1.85,2.86)-6.37<0.001淋巴细胞百分比(%)10.5(5.9,16.35)27.65(22.17,31.8)-6.28<0.001淋巴细胞计数(×109)/L-10.9(0.62,1.35)1.9(1.5,2.3)-6.04<0.001意识障碍16.63<0.001 有7(29.2%)2(2.4%)—— 无17(70.8%)80(97.6%)——吞咽障碍63.425<0.001 有18(75%)2(2.4%)—— 无6(25%)80(97.6%)——NIHSS评分10(5,12)4(3,5)-4.675<0.001
表3 全部患者发生SAP危险因素的多因素Logistic回归分析
Tab.3 Logistic regression of risk factors in SAP patients
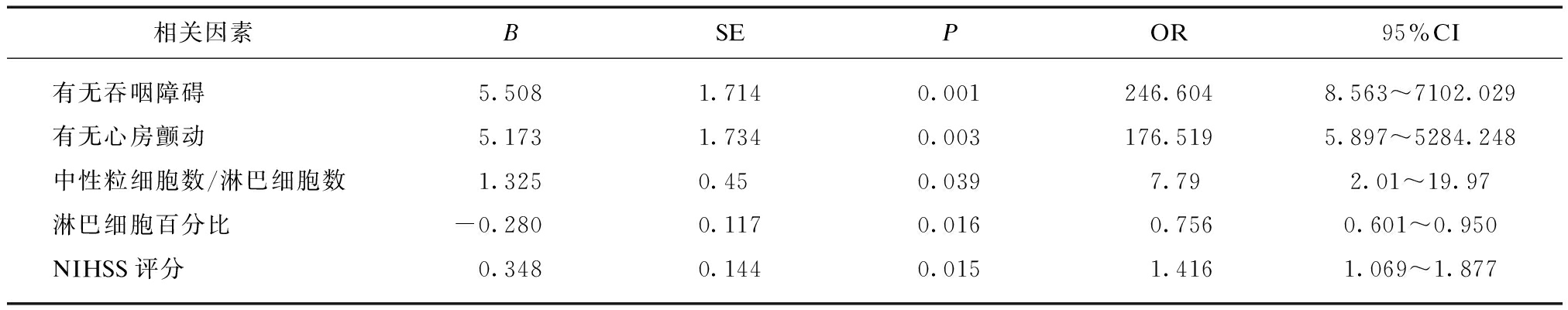
相关因素BSEPOR95%CI有无吞咽障碍5.5081.7140.001246.6048.563~7102.029有无心房颤动5.1731.7340.003176.5195.897~5284.248中性粒细胞数/淋巴细胞数1.3250.450.0397.792.01~19.97淋巴细胞百分比-0.2800.1170.0160.7560.601~0.950NIHSS评分0.3480.1440.0151.4161.069~1.877
表4 普通组患者发生SAP危险因素的多因素Logistic回归分析
Tab.4 Logistic regression of risk factors in general SAP patients
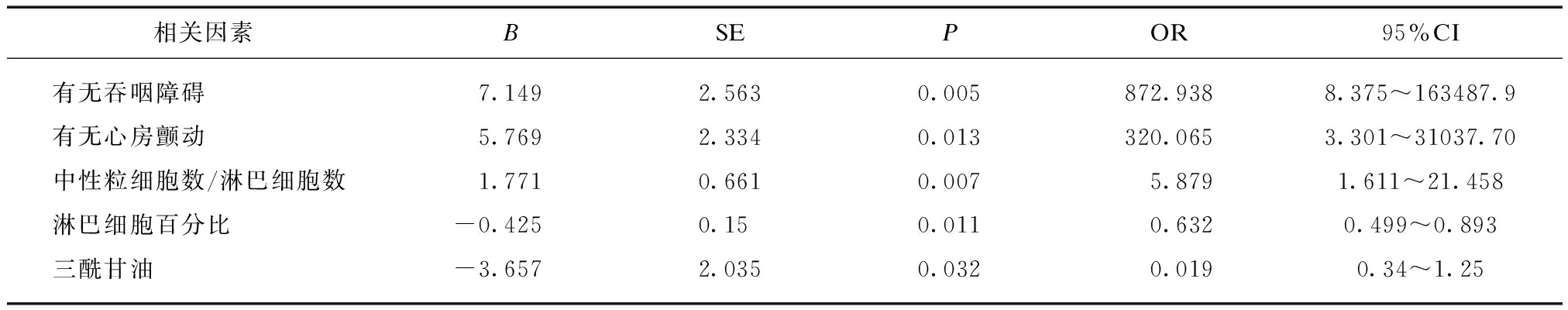
相关因素BSEPOR95%CI有无吞咽障碍7.1492.5630.005872.9388.375~163487.9有无心房颤动5.7692.3340.013320.0653.301~31037.70中性粒细胞数/淋巴细胞数1.7710.6610.0075.8791.611~21.458淋巴细胞百分比-0.4250.150.0110.6320.499~0.893三酰甘油-3.6572.0350.0320.0190.34~1.25
B:偏回归系数;SE:标准误;OR:优势比;CI:置信区间
3 讨 论
SAP虽然是一种肺炎,但它的特别之处在于其发生发展与卒中后病理生理变化密切相关。所以SAP无法通过使用抗生素有效预防[4],而且有些SAP患者即使通过调整升级抗生素,肺炎也无明显好转;但有时患者即使未更换抗生素,随着卒中本身的好转,肺炎也会随之好转。所以对于SAP危险因素的探索不仅利于肺炎的治疗,也利于卒中的好转。
本研究除了关注常见SAP危险因素,诸如吞咽困难[5]等,也重点观察了AIS后免疫功能的改变是否是SAP的危险因素。脑组织炎性免疫反应会加重脑损伤。为保护脑组织免受进一步的损伤,机体会通过抑制免疫反应而保护脑组织[6],但这种保护却是以削弱对病原体的抵抗力,容易诱发感染为代价的[7-8]。对这种免疫抑制机制的推测主要有两种:一种认为脑卒中发生后,由于缺血再灌注,炎性免疫细胞从外周转移至中枢神经系统中,导致外周免疫细胞暂时耗尽,从而引起免疫抑制;另一种解释是,中风引起的脑损伤会触发下丘脑-垂体-肾上腺轴和交感神经系统,刺激糖皮质激素和儿茶酚胺的分泌,从而产生外周的免疫抑制。但无论是哪种原因,所产生的免疫抑制可能正是卒中后肺炎的主要诱发因素[9-11]。淋巴细胞在宿主防御细菌中起重要作用,淋巴细胞减少容易诱发感染,是指示性很强的预测因素[12]。淋巴细胞计数、淋巴细胞百分比降低及中性粒细胞数/淋巴细胞数增高可以反映免疫抑制。本研究发现,不论是否剔除重症SAP患者,免疫抑制的指标均为SAP预测的独立因素。这也和既往的研究结果一致[13]。
此外,在对全部SAP患者进行分析时发现NIHSS评分及房颤均为危险因素,但将重症SAP剔除后再统计,发现仅房颤为SAP的危险因素。房颤患者出现大面积栓塞会导致其NIHSS评分增高,从而促进SAP的发生,但房颤促进SAP的发生并不仅仅因为导致NIHSS评分增高,还会因心房的不规律活动导致心脏泵血功能异常,心排血量下降和肺充血,肺泡充盈、微生物清除率降低等情况,从而促进肺部感染的发生[14]。
既往的研究对于高血脂在卒中后肺炎的发病方面是危险因素还是保护因素并没有统一的观点。有研究认为,血脂增高是卒中后肺部感染发生的危险因素,也有研究认为降脂治疗会促进卒中后肺炎的发生。本研究通过单因素分析得出,三酰甘油与卒中后肺炎的发生呈负相关,既往研究认为血脂过低及营养不良可能会导致卒中后肺炎及死亡风险增高[15-16],故而不排除这种负相关可能与营养状态差,从而促进SAP的发生有关。高龄患者可能因咀嚼困难、吞咽障碍等原因致摄食减少,或合并心力衰竭、胃肠道淤血消化吸收不良而导致白蛋白、血脂低下等情况,从而增加营养不良相关的肺炎高风险。
除了上述因素外,本研究还对一些可能的因素进行了分析,例如纤维蛋白原。纤维蛋白原在炎症中起重要作用[17]。先前的一项动物研究表明,炎症刺激会增加肺泡上皮细胞合成和分泌纤维蛋白原,纤维蛋白原作为血浆蛋白,通过与人白细胞黏附糖蛋白相互作用从而活化中性粒细胞。因此,假设纤维蛋白原可以通过反映中风患者的炎症状态从而作为危险因素的提示性指标[18]。事实上,在单因素分析时,纤维蛋白原确实有显著性意义,但进行Logistic分析时,纤维蛋白原的显著性意义却消失了。
本研究发现,吞咽困难、免疫抑制、房颤、血脂降低等因素均为SAP发病的危险因素。临床工作中若发现AIS患者有上述情况,应及时小心预防SAP的发生。
[1] HILKER R, POETTER C, FINDEISEN N, et al. Nosocomial pneumonia after acute stroke: implications for neurological intensive care medicaine[J]. Stroke, 2003,34(4): 975-981.
[2] JOUNDI R A, MARTINO R, SAPOSNIK G, et al. Predictors and outcomes of dysphagia screening after acute ischemic stroke[J]. Stroke, 2017,48(4):900-906.
[3] WESTENDORP W F, VERMEIJ J D, HILKENS N A, et al. Development and internal validation of a prediction rule for post-stroke infection and post-stroke pneumonia in acute stroke patients[J]. Eur Stroke J, 2018,3(2):136-144.
[4] KALRA L, IRSHAD S, HODSOLL J, et al. Prophylactic antibiotics after acute stroke for reducing pneumonia in patients with dysphagia(STROKE-INF):a prospective, cluster-randomised, open-label, masked endpoint, controlled clinical trial[J]. Lancet, 2015,386(10006):1835-1844.
[5] ELTRINGHAM S A, KILNER K, GEE M, et al. Factors associated with risk of stroke-associated pneumonia in patients with dysphagia:a systematic review[J]. Dysphagia, 2019. doi: 10.1007/s00455-019-10061-6.
[6] FARRIS B Y, MONAGHAN K L, ZHENG W, et al. Ischemic stroke alters immune cell niche and chemokine profile in mice independent of spontaneous bacterial infection[J]. Immun Inflamm Dis, 2019,7(4):326-341.
[7] LIU D D, CHU S F, CHEN C, et al. Research progress in stroke-induced immunodepression syndrome(SIDS) and stroke-associated pneumonia(SAP)[J]. Neurochem Int, 2018,114:42-54.
[8] SANTOS SAMARY C, PELOSI P, LEME SILVA P, et al. Immunomodulation after ischemic stroke:potential mechanisms and implications for therapy[J]. Crit Care, 2016,20(1):391.
[9] VOGELGESANG A, BECKER K J, DRESSEL A. Immunological consequences of ischemic stroke[J]. Acta Neurol Scand, 2014,129(1):1-12.
[10] RÖMER C, ENGEL O, WINEK K, et al. Blocking stroke-induced immunodeficiency increases CNS antigen-specific autoreactivity but does not worsen functional outcome after experimental stroke[J]. J Neurosci, 2015,35(20):7777-7794.
[11] MRACSKO E, LIESZ A, KARCHER S, et al. Differential effects of sympathetic nervous system and hypothalamic-pituitary-adrenal Axis on systemic immune cells after severe experimental stroke[J]. Brain Behav Immun, 2014,41:200-209.
[12] HAEUSLER K G, SCHMIDT W U, FÖHRING F, et al. Cellular immunodepression preceding infectious complications after acute ischemic stroke in humans[J]. Cerebrovasc Dis, 2008,25(1/2):50-58.
[13] NAM K W, KIM T J, LEE J S, et al. High neutrophil-to-lymphocyte ratio predicts stroke-associated pneumonia[J]. Stroke, 2018,49(8):1886-1892.
[14] ZHU J X, ZHANG X, SHI G G, et al. Atrial fibrillation is an independent risk factor for hospital-acquired pneumonia[J]. PLoS One, 2015,10(7):e0131782.
[15] BELL C L, RANTANEN T, CHEN R D, et al. Prestroke weight loss is associated with poststroke mortality among men in the Honolulu-Asia aging study[J]. Arch Phys Med Rehabilitation, 2014,95(3):472-479.
[16] BELL C L, LACROIX A, MASAKI K, et al. Prestroke factors associated with poststroke mortality and recovery in older women in the women’s health initiative[J]. J Am Geriatr Soc, 2013,61(8):1324-1330.
[17] WILLIAMS S R, HSU F C, KEENE K L, et al. Shared genetic susceptibility of vascular-related biomarkers with ischemic and recurrent stroke[J]. Neurology, 2016,86(4):351-359.
[18] LUYENDYK J P, SCHOENECKER J G, FLICK M J. The multifaceted role of fibrinogen in tissue injury and inflammation[J]. Blood, 2019,133(6):511-520.