低温治疗是目前研究最深入、最有效的脑保护方法之一,已有多项研究证明了轻中度低温(30~34℃)在缺血条件下的脑保护作用[1-3]。目前通过体表及血管内方法进行全身降温已经在急性缺血性卒中的治疗中得到广泛应用[4-5],但因为其潜在的严重不良反应(凝血功能障碍,电解质紊乱,诱发肺炎等)而使得临床应用受到较大限制。
针对全身降温的缺点,选择性动脉内灌注低温生理盐水引起了人们的关注,可以最大限度地发挥低温治疗的益处,同时避免全身降温的不良反应。通过这一方法在对急性颅内大血管闭塞进行开通时,低温生理盐水可直接灌注到缺血脑组织,能够更快地达到目标温度,同时低温生理盐水仅灌注到缺血脑组织,达到目标温度所需的液体量与全身血容量相比很小,因此对体温的影响很小,进而消除了全身降温的不良反应。
本实验通过构建大鼠大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)的缺血再灌注模型,模拟临床对急性颅内大血管闭塞进行开通时行选择性动脉内低温治疗,研究这一方式对大鼠脑缺血再灌注后血脑屏障通透性的影响,并探究不同温度低温治疗对脑保护能力的差异。
1 材料与方法
1.1 研究对象及分组
选择健康SD清洁级雄性大鼠24只,体重 240~300g,由同济大学附属第十人民医院动物实验室提供,置于笼内适应性饲养1周,实验前禁食12h但不禁水。随机将实验动物分为正常组、模型组、4℃实验组、10℃实验组、20℃实验组、37℃实验组,每组4只。实验所使用动物相关实验方法均依据国际实验动物使用及照顾相关方法,通过同济大学附属第十人民医院动物福利伦理委员会审查。
1.2 方法
1.2.1 缺血模型构建 按照传统的线栓模型建模[6]。将雄性SD大鼠采用3%水合氯醛(1mL/100g)腹腔注射麻醉,采取颈部正中竖直切口,沿胸锁乳突肌内侧缘分离出左侧颈总动脉、颈外动脉并分离翼腭动脉。在颈内动脉近端备线,远端放置动脉夹,颈总动脉分叉处切口,插入专用栓线,避开翼腭动脉,栓线进入颈内动脉,进入颅至颈内动脉的分叉,阻断大脑中动脉血流来源,从颈内、颈外动脉分叉处算起深度约17~20mm,伤口以碘伏消毒,缝合皮肤。此时大鼠如出现呼吸、心跳突然加快,部分大鼠出现尿失禁,是判断栓塞成功的一个标志。
1.2.2 再灌注处理 实验组将成功建模的大鼠在血流阻断2h后再次麻醉,并将栓线抽出恢复血流,灌注生理盐水则通过原先插入栓线的血管,经留置针以0.6mL/min的速度滴生理盐水,设置4种不同的水温(4、10、20、37℃),累计滴入6mL,完毕拔出针头,测量实验鼠直肠温度和脑内温度。模型组阻断血流2h后将栓线抽出,实行血流再灌注,测量实验鼠直肠温度和脑内温度。正常组不作任何处理,测量实验鼠直肠温度和脑内温度。
1.2.3 温度测量 脑温测量点选取人字缝后1mm,旁开1mm处,深度约3mm,插入温度探头,连接测温仪;肛温测量采用体温表测量大鼠直肠内温度。
实验组在灌注完生理盐水后先测量1次温度,然后每15min测量1次,共监测5次,分别为0、15、30、45、60min的体温。
1.2.4 神经功能评分 观察大鼠缺血再灌注建模48h后的神经功能,根据参考文献[6]建立的评分系统对大鼠缺血模型进行神经损伤评价,将大鼠缺血再灌注后出现的神经症状分为0~4分。0分: 无神经功能缺损;1分: 提尾时右前肢内收,不能完全伸展;2分: 自发行走时向右侧转圈;3分: 行走时身体向右侧倾倒;4分: 不能自发行走,有意识丧失。
1.2.5 脑梗死体积测定 大鼠脑缺血48h后迅速处死并取出脑组织,置于0~4℃PBS溶液中转移,于-20℃冰箱冷冻30min。除去小脑、嗅球和低位脑干。切取冠状位脑片,厚度为2mm,将脑片放入2%红四氮唑溶液中,37℃水浴30min,每5min轻微晃动容器,使充分染色。取出脑片用PBS溶液洗涤3~5min,再用10%中性甲醛固定脑片6h。正常脑组织表现为深红色,缺血脑组织表现为苍白色,使用数码相机拍摄,使用Image-pro Plus 6.0(Media Cyber-netics, Inc., Rockville, MD, USA)软件进行图像处理,对每张照片进行分析并计算得出梗死面积百分比。
1.2.6 血脑屏障通透性改变检测 在恢复灌注48h后,处死前1h,经大鼠尾静脉注入2%的伊文思蓝(Evans blue, EB)(4mL/kg),1h后经心脏灌注预冷的生理盐水直至右心房流出清亮液体时,快速取缺血脑组织,称湿重后放入5mL甲酰胺溶液中,45℃ 水浴24h后离心取上清液,使用酶标仪测定其630nm 处的吸光度值(A630),以甲酰胺溶液做空白比色,根据标准曲线求出待测样品EB含量。
1.2.7 透射电镜观察血脑屏障超微结构的变化 再灌注48h后的大鼠麻醉,采用4℃生理盐水200mL,经心脏快速灌注,待右心耳流出清亮液体时,再用2%戊二醛和4%多聚甲醛混合液灌注固定,剖取缺血侧半球额顶区皮质,大小约1mm×1mm×1mm,2.5%戊二醛固定24h,1%锇酸固定1h,脱水等常规透射电镜样品制备,超薄切片(片厚60nm)铀铅双染,加速电压80kV,透射电镜(×20000)下观察血脑屏障结构并摄片。
1.2.8 ELISA法检测 大鼠S100β蛋白含量实验组、模型组及正常组大鼠于建模48h后采集右心室静脉血,将血标本于室温下离心半径8cm,2000r/min,离心15min后,取上清液进行测量,按照ELISA试剂盒说明书进行操作,检测S100β蛋白含量。
1.3 统计学处理
应用SPSS 21.0统计软件,计量资料以均数±标准差表示,多组间均数比较采用单因素方差分析,两组数据间比较使用t检验;P<0.05为差异有统计学意义。
2 结 果
2.1 动物模型的建立
整个实验过程中共采用24只SD雄性大鼠,建模过程中无实验动物死亡。建模完成后,各组大鼠脑温变化可见灌注刚结束及灌注结束15min时,4℃ 实验组的大鼠脑温显著低于其他组(0min: F=6.53,P=0.01;15min: F=3.55,P=0.02),见表1。其余时间点各组大鼠间的脑温差异无统计学意义。各组间大鼠肛温差异没有统计学意义,见表2。
2.2 选择性动脉内低温对大鼠脑缺血再灌注损伤神经功能评分的影响
大鼠缺血再灌注建模48h后进行神经功能评分,发现除正常组外,各组实验动物都有明显的神经功能缺损,但各组间差异无统计学意义(F=0.78,P=0.55),见图1。
表1 各组大鼠在不同时间点的脑温变化
Tab.1 Comparison of cerebral temperature in different groups (℃)
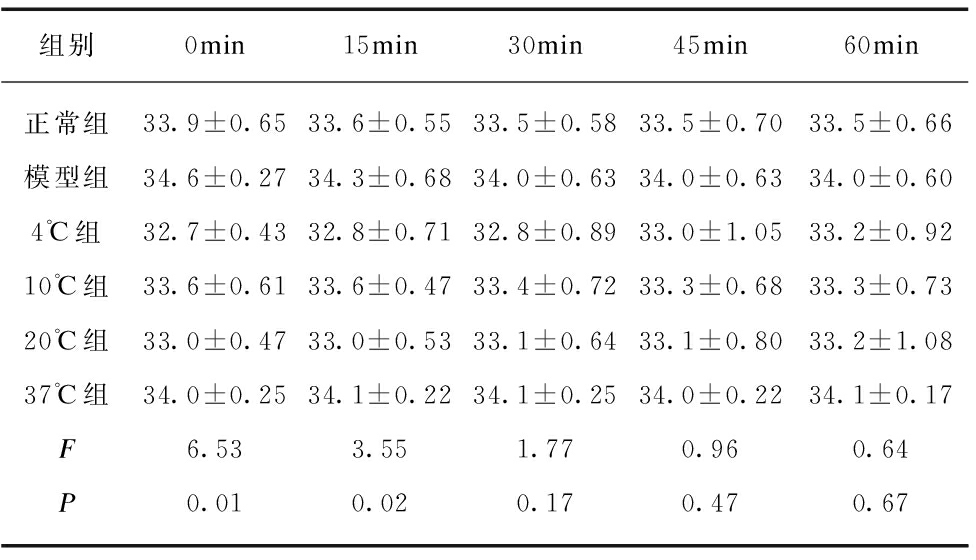
组别0min15min30min45min60min正常组33.9±0.6533.6±0.5533.5±0.5833.5±0.7033.5±0.66模型组34.6±0.2734.3±0.6834.0±0.6334.0±0.6334.0±0.604℃组32.7±0.4332.8±0.7132.8±0.8933.0±1.0533.2±0.9210℃组33.6±0.6133.6±0.4733.4±0.7233.3±0.6833.3±0.7320℃组33.0±0.4733.0±0.5333.1±0.6433.1±0.8033.2±1.0837℃组34.0±0.2534.1±0.2234.1±0.2534.0±0.2234.1±0.17F6.533.551.770.960.64P0.010.020.170.470.67
表2 各组大鼠在不同时间点的肛温变化
Tab.2 Comparison of rectal temperaturein different groups (℃)

组别0min15min30min45min60min正常组34.4±0.2734.4±0.3934.6±0.4634.6±0.4534.7±0.49模型组34.6±0.2734.7±0.3634.5±0.2234.5±0.2134.6±0.304℃组34.8±0.3734.6±0.5134.7±0.4734.7±0.4434.8±0.4610℃组34.6±0.2734.6±0.2934.6±0.3034.6±0.3334.7±0.3120℃组34.6±0.3534.7±0.4434.8±0.5534.7±0.5134.7±0.3837℃组34.6±0.4434.6±0.3234.6±0.4034.6±0.5034.6±0.36F0.4290.1400.1640.1090.145P0.8230.9810.9720.9890.979
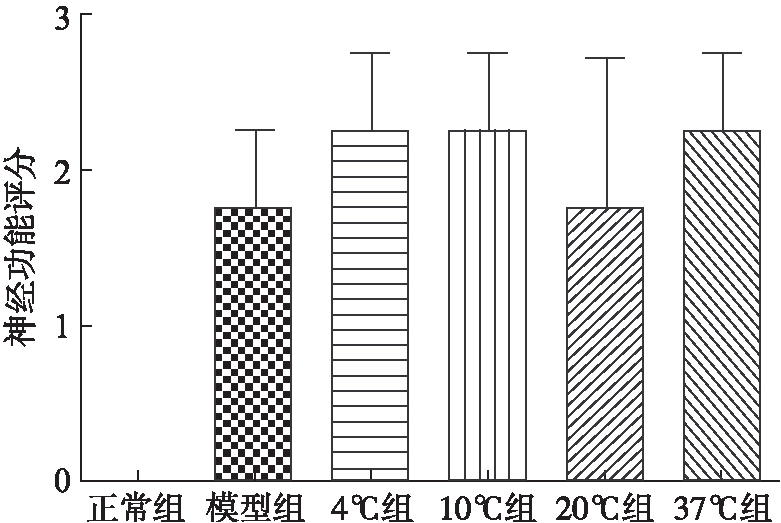
图1 各组大鼠神经功能评分
Fig.1 Comparison of neurological function scores in different groups
2.3 选择性动脉内低温对大鼠脑梗死体积的影响
大鼠缺血再灌注建模48h后,4℃及10℃实验组的梗死体积相对模型组的梗死体积显著缩小(4℃ vs 模型组: P=0.012;10℃ vs 模型组: P=0.0086),差异均有统计学意义,见图2。
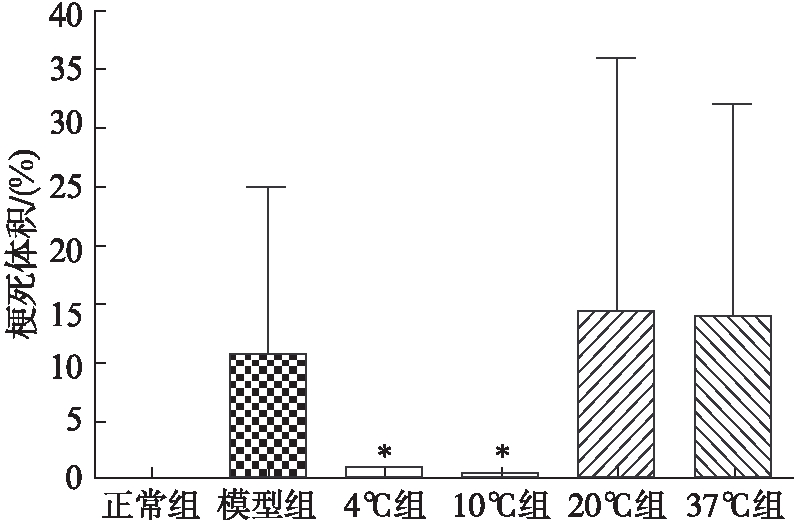
图2 各组大鼠脑梗死体积比较
Fig.2 Comparison of infarction volume in different groups
大鼠缺血再灌注建模48h后,与模型组相比,*P<0.05
2.4 选择性动脉内低温对大鼠血脑屏障通透性的影响
各组大鼠EB含量测定后显示,模型组及不同温度实验组对于EB的通透性明显高于正常组(F=2.838,P=0.025),与模型组相比,4℃实验组的EB通透性显著性降低,差异有统计学意义(P=0.002)。其余各温度实验组对EB的通透性与模型组相比,差异没有统计学意义(10℃ vs 模型组P=0.136;20℃ vs 模型组P=0.730;37℃ vs 模型组P=0.931),见图3。

图3 各组大鼠EB含量比较
Fig.3 Comparison of EB level in different groups
与正常组相比,*P<0.05
2.5 透射电镜观察低温生理盐水灌注对各组大鼠血脑屏障破坏的影响
正常组毛细血管内皮细胞核膜、核仁形态规则,染色质密度均一,内皮细胞基膜清晰,厚薄均匀,紧密连接结构完好。模型组毛细血管明显变形,管腔狭窄,血管周围见大片电子空白区,内皮细胞大量溶解,残存的线粒体空泡变性,多出基膜片状溶解、断裂,紧密连接融合、扩张。4℃组血管周围无电子空白区,毛细血管基膜有断裂现象,血管厚薄不均;10℃、20℃和37℃组仍可见电子空白区,毛细血管基膜有溶解、断裂现象,内皮细胞内线粒体空泡变性,紧密连接融合、扩张;从电子空白区、血管基膜完整性、紧密连接和线粒体的变化程度对比,这3组的病理变化加重,见图4。

图4 各组大鼠透射电镜观察血脑屏障
超微结构的变化(×20000)
Fig.4 Comparison of the ultrastructure of blood-brain barrier shown by transmission electron microscopy in different groups
2.6 选择性动脉内低温对大鼠局灶性脑缺血-再灌注后血清S100β蛋白的影响
缺血再灌注建模后,模型组中的大鼠血清中S100β蛋白浓度显著高于正常对照组,差异有统计学意义(P<0.001);经过不同温度的生理盐水治疗后血清中S100β蛋白浓度均低于模型组,差异具有统计学意义(F=293.3,P<0.001);其中4℃生理盐水灌注组的S100β蛋白浓度最低,见图5。

图5 各组大鼠血清S100β蛋白浓度变化
Fig.5 Comparison of S100β in different groups
与正常对照组相比,*P<0.001;与模型组相比,*P<0.01
3 讨 论
选择性动脉内滴注低温生理盐水是一种高效的低温的方式,相比其他低温方式,它的降温速度更快,效率更高[7-9]。同时,这种方式又能够延长急性缺血性卒中的治疗时间窗,并能与其他治疗措施相结合。本实验结果表明,通过选择性动脉内低温对缺血脑组织灌注低温生理盐水能快速降低脑温,减少脑梗死的体积,稳定血脑屏障,并能减少血清S100β蛋白的表达,减轻脑组织损伤,具有一定的神经保护作用。
Konstas等[10]研究显示,选择性动脉内滴注低温生理盐水,能够在10min内实现局部的低温。本研究结果发现,在选择性滴注生理盐水后,在0和15min时,4℃实验组的大鼠脑温显著低于其他组,表明选择性动脉滴注低温生理盐水能够迅速地降低脑温,4℃的生理盐水具有更强的降温效应。同时,在灌注低温生理盐水时,各组大鼠的肛温没有发生明显变化,表明选择性动脉内滴注低温生理盐水能够快速降低局部的脑温,而对全身体温的影响很小,一定程度上可以避免全身低温的不良反应。既往动物实验证实,在脑缺血后即刻,微血栓形成和血脑屏障破坏就已经发生了[11]。本实验发现,虽然选择性动脉内持续降低脑温的时间相对较短,但足以起到脑保护的作用,这可能与即刻血管内低温对于微血栓的冲刷以及稳定血脑屏障有关。
既往研究表明低温能够抑制基质金属蛋白酶的激活并抑制其蛋白水解活性[12],减少血脑屏障的破坏,同时也能抑制水通道开放,减轻脑水肿[13]。也有研究发现,低温能够调控透过血脑屏障的相关分子运输。而我们的研究发现,大鼠缺血再灌注建模48h后,4℃及10℃实验组的梗死体积相对模型组的梗死体积显著缩小(P=0.012,P=0.0086),表明选择性血管内低温治疗可以减少梗死脑组织体积。同时通过对各组大鼠脑组织EB含量的测定显示缺血发生后血脑屏障对于EB的通透性显著升高,在恢复血流灌注同时采用4℃生理盐水进行灌注,其血脑屏障的保护作用明显优于缺血对照组及其它温度实验组。而透射电镜的观察结果也显示4℃组的神经组织结构最完整,损伤程度最低。既往研究表明,低温可以通过降低钙离子内流,抑制兴奋性毒性反应,减少氧自由基生成,影响细胞凋亡,减轻脑内炎症反应,稳定血脑屏障等方式,起到脑保护的作用[14-16]。本实验也证实了低温对于保护血脑屏障、减轻缺血及再灌注损伤,减少梗死体积具有显著作用。
本研究还发现,选择性动脉滴注低温生理盐水能够降低外周血清中S100β的含量。S100β是一种钙结合蛋白,在脑组织中含量丰富,在中枢神经系统具有神经营养活性,主要由星形胶质细胞表达[17-18]。在血液和脑脊液中都可测得S100β的表达。在各种原因所致急性脑损伤(如急性颅脑外伤、颅内出血、急性缺血性卒中等),外周血清中S100β含量显著升高,可作为脑损伤的生物标志物[19-20]。一项系统评价表明,急性脑梗死后患者血清S100β水平越高,脑梗死体积越大,功能预后越差[21]。在急性缺血/再灌注大鼠模型中发现,降低血清中S100β的浓度,能够改善大鼠的神经行为学评分,降低梗死体积,具有一定的神经保护作用[22]。另一项动物实验表明,抑制S100β表达可减轻大鼠永久性大脑中动脉闭塞后梗死体积的扩大以及改善神经功能缺损[23-24]。在本实验中,经过不同温度的生理盐水治疗后血清中S100β蛋白浓度均低于模型组(F=293.3,P<0.001),差异具有统计学意义,其中4℃组的S100β蛋白浓度最低,表明选择性动脉内低温可以有效减少S100β的表达,从而起到降低脑损伤,保护脑组织的作用。
综上所述,通过选择性动脉内低温技术对缺血脑组织灌注低温生理盐水能快速降低脑温,减少脑梗死的体积,稳定血脑屏障结构,并能减少血清S100β蛋白的表达,具有一定的神经保护作用。且4℃的生理盐水相比其他温度的生理盐水,具有更强的脑保护效应。当然,本研究各组样本量较小,观察时间有限,可能是研究中各组神经功能评分无显著性差异的主要原因之一,尚有待进一步深入研究。
[1] HYPOTHERMIA AFTER CARDIAC ARREST STUDY GROUP. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest[J]. N Engl J Med, 2002,346(8): 549-556.
[2] BERNARD S A, GRAY T W, BUIST M D, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia[J]. N Engl J Med, 2002,346(8): 557-563.
[3] 陈胜,闵红叶,周书琴,等.亚低温对脑缺血再灌注损伤大鼠神经细胞凋亡和caspase-3释放的影响[J].同济大学学报(医学版),2016,37(6): 18-22, 34.
[4] DE GEORGIAM A, KRIEGERD W, ABOU-CHEBL A, et al. Cooling for Acute Ischemic Brain Damage (COOL AID): a feasibility trial of endovascular cooling[J]. Neurology, 2004,63(2): 312-317.
[5] LYDENP D, ALLGRENR L, NG K, et al. Intravascular cooling in the treatment of stroke (ICTuS): early clinical experience[J]. J Stroke Cerebrovasc Dis, 2005,14(3): 107-114.
[6] LONGAE Z, WEINSTEINP R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1): 84-91.
[7] KAMMERSGAARDL P, RASMUSSENB H, JØRGE-NSENH S, et al. Feasibility and safety of inducing modest hypothermia in awake patients with acute stroke through surface cooling: a case-control study: the Copenhagen Stroke Study[J]. Stroke, 2000,31(9): 2251-2256.
[8] SCHWAB S, GEORGIADIS D, BERROUSCHOT J, et al. Feasibility and safety of moderate hypothermia after massive hemispheric infarction[J]. Stroke, 2001,32(9): 2033-2035.
[9] GEORGIADIS D, SCHWARZ S, KOLLMAR R, et al. Endovascular cooling for moderate hypothermia in patients with acute stroke: first results of a novel approach[J]. Stroke, 2001,32(11): 2550-2553.
[10] KONSTASA A, NEIMARKM A, LAINEA F, et al. A theoretical model of selective cooling using intracarotid cold saline infusion in the human brain[J]. J Appl Physiol, 2007,102(4): 1329-1340.
[11] DESILLESJ P, SYVANNARATH V, DI MEGLIO L, et al. Downstream microvascular thrombosis in cortical venules is an early response to proximal cerebral arterial occlusion[J]. J Am Heart Assoc, 2018,7(5): e007804.
[12] YENARIM A, HANH S. Neuroprotective mechanisms of hypothermia in brain ischaemia[J]. Nat Rev Neurosci, 2012,13(4): 267-278.
[13] LI J B, LI C S, YUAN W, et al. Mild hypothermia alleviates brain oedema and blood-brain barrier disruption by attenuating tight junction and adherens junction breakdown in a swine model of cardiopulmonary resuscitation[J]. PLoS One, 2017,12(3): e0174596.
[14] CAMPOS F, PÉREZ-MATO M, AGULLA J, et al. Glutamate excitoxicity is the key molecular mechanism which is influenced by body temperature during the acute phase of brain stroke[J]. PLoS One, 2012,7(8): e44191.
[15] CHOIH A, BADJATIA N, MAYERS A. Hypothermia for acute brain injury: mechanisms and practical aspects[J]. Nat Rev Neurol, 2012,8(4): 214-222.
[16] STRECKERJ K, MINNERUP J, SCHÜTTE-NÜTGEN K, et al. Monocyte chemoattractant protein-1-deficiency results in altered blood-brain barrier breakdown after experimental stroke[J]. Stroke, 2013,44(9): 2536-2544.
[17] 王子溪,钱凯,王勋,等.S100B蛋白与脑梗死研究进展[J].医学综述,2019,25(23): 4626-4630.
[18] 何金婷,李晓炎,邱培森,等.S100B与神经系统疾病相关性研究进展[J].中国实验诊断学,2019,23(9): 1650-1654.
[19] HE Y L, CAI Z Y, CHEN Y M. Role of S-100β in stroke[J]. Int J Neurosci, 2018,128(12): 1180-1187.
[20] ASTRAND R, UNDÉN J, ROMNER B. Clinical use of the calcium-binding S100B protein[J]. Methods Mol Biol, 2013,963: 373-384.
[21] NASHD L, BELLOLIOM F, STEADL G. S100 as a marker of acute brain ischemia: a systematic review[J]. Neurocrit Care, 2008,8(2): 301-307.
[22] JIANG D L, WANG Y T, ZANG Y N, et al. Neuroprotective effects of rhGLP-1 in diabetic rats with cerebral ischemia/reperfusion injury[J]. Drug Dev Res, 2016,77(3): 124-133.
[23] MATSUI T, MORI T, TATEISHI N, et al. Astrocytic activation and delayed infarct expansion after permanent focal ischemia in rats. Part Ⅰ: enhanced astrocytic synthesis of S-100beta in the periinfarct area precedes delayed infarct expansion[J]. J Cereb Blood Flow Metab, 2002,22(6): 711-722.
[24] TATEISHI N, MORI T, KAGAMIISHI Y, et al. Astrocytic activation and delayed infarct expansion after permanent focal ischemia in rats. Part Ⅱ: suppression of astrocytic activation by a novel agent (R)-(-)-2-propyloctanoic acid (ONO-2506) leads to mitigation of delayed infarct expansion and early improvement of neurologic deficits[J]. J Cereb Blood Flow Metab, 2002,22(6): 723-734.