肿瘤微环境响应释放的金纳米颗粒载药体系是由金纳米颗粒与肿瘤微环境响应单元通过组装形成的纳米载药体系。它使载带药物被高效释放在肿瘤组织中,有效地提高了抗肿瘤药物的利用率,降低了抗肿瘤药物对正常组织的损伤。但是纳米颗粒在体内的留存时间、肿瘤组织的留存效率以及肿瘤细胞的摄取效率对其颗粒尺寸的要求各异[1-3],因此形貌可变的纳米载体成为发展的潮流[4]。本研究利用pH响应型可变形三链体脱氧核糖核酸(triplex DNA)、不同粒径(直径)金纳米颗粒以及抗肿瘤药物多柔比星(doxorubicin hydrochloride, DOX)组装出一种可响应酸性肿瘤微环境,从而产生结构形态改变,释放出DOX的载药聚集体(cluster-DOX)。
1 材料与方法
1.1 仪器与试剂
triplex DNA的序列为5′-GGAGGGGAGG-GGAGGTTTACCTCCCCTCCCCTCCCTTTGCCTC-CCCTCCCCTCCTCGACTTTTTTTTTTT-3′,DNA互补链(complement DNA)的序列为5′-AGTCGAG-GAGGGGAGGTTTTTTTTTT-3′,保护链(S-10T DNA)的序列为5′-TTTTTTTTTT-3′,上述DNA均定制于生工生物工程(上海)股份有限公司,人非小细胞肺癌细胞(NCI-H1299),购于中国科学院细胞库,氯金酸(HAuCl4·4H2O)购自上海思域化工科技有限公司,无水碳酸钾以及二水合柠檬酸三钠购自国药集团化学试剂有限公司,鞣酸以及DOX购自美国Sigma-Aldrich公司,胎牛血清购于美国Gibco公司,MEM培养基购自美国康宁公司,细胞活性(活死细胞染色)检测试剂盒购于江苏凯基生物技术股份有限公司。超微量分光光度计使用的是美国赛默飞世尔科技公司的NanoDrop2000。荧光酶标仪使用的是瑞士帝肯公司的Infinite 200 PRO多功能酶标仪。倒置荧光显微镜使用的是日本Nikon公司的ECLIPSETi。
1.2 聚丙烯酰胺凝胶电泳(PAGE)检测triplex DNA结构形成
triplex DNA与complement DNA按1∶2的浓度比进行混合,37℃静置1h,自然恢复至室温,两条单链DNA杂交成为双链结构。将杂交完成的双链DNA分为两组,一组为不改变pH的中性条件组,一组为加入盐酸[5]至pH=4.5[6]的酸性条件组,使用12%的聚丙烯酰胺凝胶电泳进行验证。中性条件组使用pH=7的1X TBE缓冲液,酸性条件组则使用pH=4.5的1X TBE缓冲液。
1.3 双链DNA对DOX的最大载带量
将浓度为20、50、100、200、500、1000nmol/L的杂交完成的DNA双链溶液分别与浓度为 500nmol/L的DOX溶液混合并过夜,用荧光酶标仪进行检测。
1.4 双链DNA在不同pH下的释药
令载带有DOX的高浓度杂交双链(triplex-DOX)稀释在不同pH的0.1mol/L磷酸盐缓冲液(phosphate buffer saline, PBS)中,使其终浓度为0.8μmol/L,37℃下静置过夜。
1.5 酸性肿瘤微环境响应的可变形聚集体结构的制备
1.5.1 直径5nm金颗粒制备 采用鞣酸法[7]制备5nm金颗粒,并通过前期实验对条件进行了优化。配制50mL的二水合柠檬酸三钠溶液,使其终浓度达到2.2μmol/L,向其中加入33μL且浓度为 2.5mmol/L的鞣酸溶液,随后加入335μL浓度为150mmol/L 的碳酸钾溶液,最后向上述混合溶液中加入1%的氯金酸溶液335μL。室温下(25℃)搅拌过夜反应,溶液颜色由灰黑色逐渐变为橙红色。5nm 金颗粒溶液制备好后,使用超滤管将溶液浓缩,并利用超微量分光光度计定量溶液浓度,4℃保存备用。
1.5.2 直径13nm金颗粒的制备 采用柠檬酸三钠还原法[8]制备13nm金颗粒,将1mL浓度为1%的氯金酸溶液以及99mL的Milli-Q水混合,搅拌加热至溶液沸腾。随后加入3.5mL浓度为65mmol/L的二水合柠檬酸三钠溶液,继续加热搅拌30min,溶液变为酒红色。将产物离心浓缩(离心半径25cm,10000r/min,3min),通过超微量分光光度计定量溶液浓度,4℃保存备用。
1.5.3 酸性肿瘤微环境响应的可变形聚集体的组装 制作100μL体系的载药聚集体结构,使13、5nm 金颗粒、triplex DNA、complement DNA、DNA互补链的最终浓度分别为3、30、800、1600、400nmol/L。将triplex DNA与complement DNA混合,37℃ 静置1h,自然恢复至室温,两条单链DNA杂交成为双链结构。随后将双链DNA、S-10T DNA、5nm 金颗粒、13nm金颗粒、适量MIlli-Q水同时混合并于-80℃冷冻1h,水溶液冷冻成冰,样品颜色变为蓝紫色。样品于室温(25℃)下自然融化后溶液恢复为紫红色。离心产物(离心半径25cm,10000r/min,20min)通过10mmol/L的磷酸缓冲液(phosphate buffer solution, PBS)对产物进行两次重悬,洗去未聚集成功的小颗粒,最后使产物分散在0.1mol/L PBS中。
1.5.4 酸性肿瘤微环境响应的可变形聚集体的载药与释药 按上述浓度在杂交完成的双链DNA溶液中加入DOX,使其终浓度为4μmol/L,避光室温(25℃)过夜,再按上述方式组装出cluster-DOX。重悬完成后,将聚集体浓缩液分散于不同pH的0.1mol/L 的PBS中,37℃过夜。
1.6 酸性肿瘤微环境响应的可变形聚集体结构在肿瘤细胞内的表现
1.6.1 酸性肿瘤微环境响应的可变形聚集体在肿瘤细胞中的释药 将制备好的cluster-DOX与DOX溶液分别稀释在培养基中,pH=4.5时,培养基中游离DOX的浓度均为0.35μmol/L。将配好的培养基加入铺有NCI-H1299细胞的96孔板中,培养12、24h后在荧光显微镜下拍照。
1.6.1 活死染色检测不同颗粒对肿瘤细胞的毒性通过冷冻法在5、13nm颗粒表面修饰S-10T DNA后加入培养基中,二者终浓度分别为30、3nmol/L。同时将制备好的cluster-DOX、DOX溶液以及同浓度的cluster颗粒分别稀释在培养基中,当pH=4.5时,培养基中游离DOX的浓度均为0.35μmol/L。将配好的培养基加入铺有NCI-H1299细胞的96孔板中,培养3d后使用活死细胞试剂盒进行染色,共孵育30min 后在荧光显微镜下拍照。
1.7 统计学处理
数据采用Graph Pad Prism 7进行统计分析并作图,中性条件组和酸性条件组的比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结 果
2.1 triplex结构对pH改变的响应
聚丙烯酰胺凝胶电泳(PAGE)实验发现,在中性条件下,杂交产物条带(图1AⅣ蓝色箭头所示位置)运动速率明显变慢,见图1A,说明此时大部分triplex DNA与其对应complement DNA形成质量更大的杂交双链产物,小部分保持了三链形态(图1A黄色箭头所示位置)。但在酸性条件下,杂交链溶液的条带位置(图1B Ⅳ)分别与单独的triplex DNA(图1B Ⅱ)、complement DNA(图1B Ⅲ)位置相同,说明此时杂交双链解链为两条链。杂交双链熔解曲线的测试结果(图1C)与PAGE结果一致,图中酸性条件下的熔解曲线(图1C黑色虚线)仅在75℃出现拐点(黄色箭头),即此温度令溶液中三链体结构中的Hoogsteen键发生断裂,C—G·C+三链体解链成C—G双链体构型[9]。而中性条件下,(图1C红色虚线)55℃ 处的新增拐点(蓝色剪头)接近双链所计算的解链温度,同样证明了双链杂交成功,但有部分保持三链形态。上述两项实验证明了在酸性条件下,因三链体结构的形成使杂交双链发生解链。

图1 triplex结构对pH改变的响应
Fig.1 triplex structure response to pH changes
A: pH=7时triplex DNA与其互补链的PAGE结果;B: pH=4.5时triplex DNA与其互补链的PAGE结果;C: 不同pH下triplex DNA与其互补链的溶解曲线,同种颜色的两条曲线为温度先升至95℃再降至25℃的温度循环
2.2 载药聚集体结构的形成
使用不同的方法验证聚集体结构的形成。图2A为加入金溶液的核酸总量与聚集体形成并离心后上清液中游离的核酸量,由此可知,约有2.5μmol/L 的DNA被成功修饰在金颗粒表面。同时,琼脂糖凝胶电泳(图2B)显示,Ⅲ泳道的条带明显滞后于Ⅰ泳道的 5nm金条带与Ⅱ泳道的13nm金条带,同样表明DNA被成功修饰金颗粒表面,且形成聚集体。紫外可见光谱结果(图2C)显示,聚集体吸收峰位于 528nm,对比单颗粒发生明显红移,与透射电子显微镜(transmission electron microscope, TEM)图(图3C)与动态光散射(dynamic light scattering, DLS)粒径(图3G)结果一致,均显示在中性杂交条件下聚集体形成。
随后,本实验验证了聚集体结构的酸性响应能力。TEM结果表明,本研究自制的5、13nm金颗粒(图3A、3B)形貌尺寸均一,分散性良好,且聚集体组装成功(图3C)并可以在酸性条件下发生解体(图3D)。详细分析TEM图后发现,聚集体尺寸多分布在50~80nm(图3E黑色)。而在酸性条件下(图3E花灰色),尺寸集中在0~40nm。随后,随机统计了不同条件下,多张TEM图片中1000 颗纳米颗粒。结果发现,在中性条件下,超过98%的纳米颗粒呈现聚集状态(聚集颗粒数≥2)(图3F左,pH= 7),而在酸性条件下,仅有58.37%的颗粒保持聚集状态,有41.63%的金纳米颗粒变为分散的单颗粒状态(图3F右,pH=4.5)。同时,测量了不同pH下聚集体的DLS粒径,如图3G、图3H所示,pH=7时,粒径在50~80nm大小的聚集体颗粒数占总颗粒数的75%,而pH=4.5时,89.6%的颗粒尺寸分布于18~32nm,与TEM结果相吻合。由此表明,本研究构建的纳米聚集体,具有良好的pH诱导形变的能力,且形变效率高。

图2 triplex结构可令聚集体形成
Fig.2 triplex structure allows aggregates to nanoparticles
A: 聚集体组装前后溶液中游离的核酸量;B: 直径5、13nm金纳米颗粒与载药聚集体的琼脂糖凝胶电泳;C: 直径5、13nm金纳米颗粒与 载药聚集体的紫外可见光谱

图3 聚集体颗粒对pH变化的响应
Fig.3 Response of nanoclusters to pH changes
A: 直径5nm裸金的TEM图像;B: 直径13nm裸金的TEM图像;C: pH=7时载药聚集体的TEM图像;D: pH=4.5时载药聚集体的 TEM图像;E: 不同pH下聚集体颗粒的尺寸分布;F: 不同pH下聚集体颗粒与单颗粒数量对比;G: pH=7时聚集体的DLS粒径; H: pH=4.5时聚集体的DLS粒径
2.3 酸性肿瘤微环境响应的可变形聚集体结构的载药与释药
2.3.1 DOX的标准曲线与杂交双链DNA对DOX的载带量 DOX的标准荧光曲线如图4A中所示,其拟合方程已列在表1中,由此可知不同浓度的游离DOX具有不同强度的红色自发荧光,且几乎不受pH改变的影响。之前的研究表明,当DOX插入DNA双链后,固有荧光淬灭,当其恢复游离状态后,荧光恢复[10]。
当双链DNA的浓度为100nmol/L时,荧光强度的下降速度明显降低,且接近最低值。说明此时绝大部分DOX被插入到双链DNA中,仅有极少量处于游离状态,且此时双链DNA处于满载状态。为尽可能减少用药量且略有过量来保证双链DNA可以充分载带,故本研究中,都将DOX与双链DNA的浓度比例保持在5∶1,见图4。
表1 DOX在不同pH下荧光标准曲线的拟合方程
Tab.1 Fitting equations for the fluorescence standard curve of doxorubicin at different pH

样本方程R2pH=3Y=2117X + 578.10.9953pH=4Y=2198X+333.50.9905pH=5Y=2198X+333.50.9905pH=6Y=1882X+3320.9945pH=7Y=1853X+78.390.9870

图4 DOX的荧光强度变化
Fig.4 Changes in the fluorescence intensity of doxorubicin
A: DOX在不同pH下的荧光标准曲线;B: triplex DNA与其complement DNA杂交形成的双链结构对DOX的载代量
2.3.2 不同pH下杂交双链DNA对DOX的释放能力 酸性条件双链DNA对DOX的释放情况结果如图5所示,当pH=4时,溶液的荧光值约为pH=7溶液荧光值的3.9倍,当pH=5时,荧光值约为pH= 7时的2.6倍。由DOX的标准曲线估算出溶液中游离的DOX浓度分别为0.78μmol/L和0.6μmol/L,对比pH=7条件下溶液中仅有0.2μmol/L 游离状态的DOX,表明插入双链中的DOX被成功释放出来。

图5 triplex-DOX在不同pH下对DOX的释放
Fig.5 triplex-DOX release DOX at different pH
与pH=7相比,***P<0.01
2.3.3 不同pH下酸性肿瘤微环境响应的可变形聚集体结构对DOX的释放能力 随后,验证本文所设计的pH响应载药体系(cluster-DOX)是否能够达到可控释药的目的。结果如图6所示,当pH=4和4.5时的荧光值分别是pH=7时荧光值的10.1倍、4.9倍,此时溶液中对应的游离状态的DOX浓度约为0.6μmol/L及0.35μmol/L。cluster-DOX荧光值增加倍数相较于triplex-DOX更明显是由于离心去除了过量的DOX。上述实验证明了本研究的载药聚集体结构可以成功响应酸性环境,产生形变,释放载代药物。

图6 cluster-DOX在不同pH下对DOX的释放
Fig.6 cluster-DOX release DOX at different pH
与pH=7相比,***P<0.01
2.4 酸性肿瘤微环境响应的可变形聚集体结构的在肿瘤细胞中的表现
2.4.1 酸性肿瘤微环境响应的可变形载药聚集体在肿瘤细胞中的释药 选用具有DOX耐药性的NCI-H1299细胞[11]来验证载药聚集体对药物的载带能力,该细胞对DOX敏感性较差。由图7可知,反应12h后,cluster-DOX组NCI-H1299细胞的形态发生变化,红色荧光表示有大量DOX进入细胞中。反应24h后,cluster-DOX组的细胞形态产生更明显的损伤,DOX完全进入细胞当中。相比之下,相同时间下仅加入DOX的对照组细胞形态并未发生明显变化,且细胞内未观察到红色荧光,此结果可能与DOX浓度过低,刺激时间较短有关[12-13]。对图片进行统计分析后可发现,12h时有95%的细胞有了红色荧光,24h所有细胞均有了红色荧光。则说明了本次所设计的载药聚集体可成功响应酸性肿瘤微环境,释放出所载带的抗肿瘤药物,且极大提高了抗肿瘤药物进入细胞的效率。

图7 载药聚集体在细胞内的表现
Fig.7 Performance of cluster-DOX in cells
A: 12h时cluster-DOX在NCI-H1299细胞中的入胞与释药;B: 12h时DOX在NCI-H1299细胞中的入胞与释药;24h时cluster-DOX在NCI-H1299细胞中的入胞与释药;D: 24h时DOX在NCI-H1299细胞中的入胞与释药
2.4.2 酸性肿瘤微环境响应的可变形载药聚集体对肿瘤细胞的毒性 如图8所示,单独的5、13nm金颗粒以及所组装的聚集体对NCI-H1299细胞的毒性较小,证明了载体的安全性。且cluster-DOX组对细胞的毒性相较于仅加入DOX来说,有极为明显的差距,cluster-DOX组仅有极少数细胞存活,而DOX组则正好相反。统计后可得,仅含DOX的试验组细胞存活率为94.8%,聚集体组细胞存活率为85.8%,cluster-DOX组细胞存活率仅为11.9%。以上结果均表明本研究构建出一种高效、安全、效果良好的肿瘤微环境响应的载药聚集体。
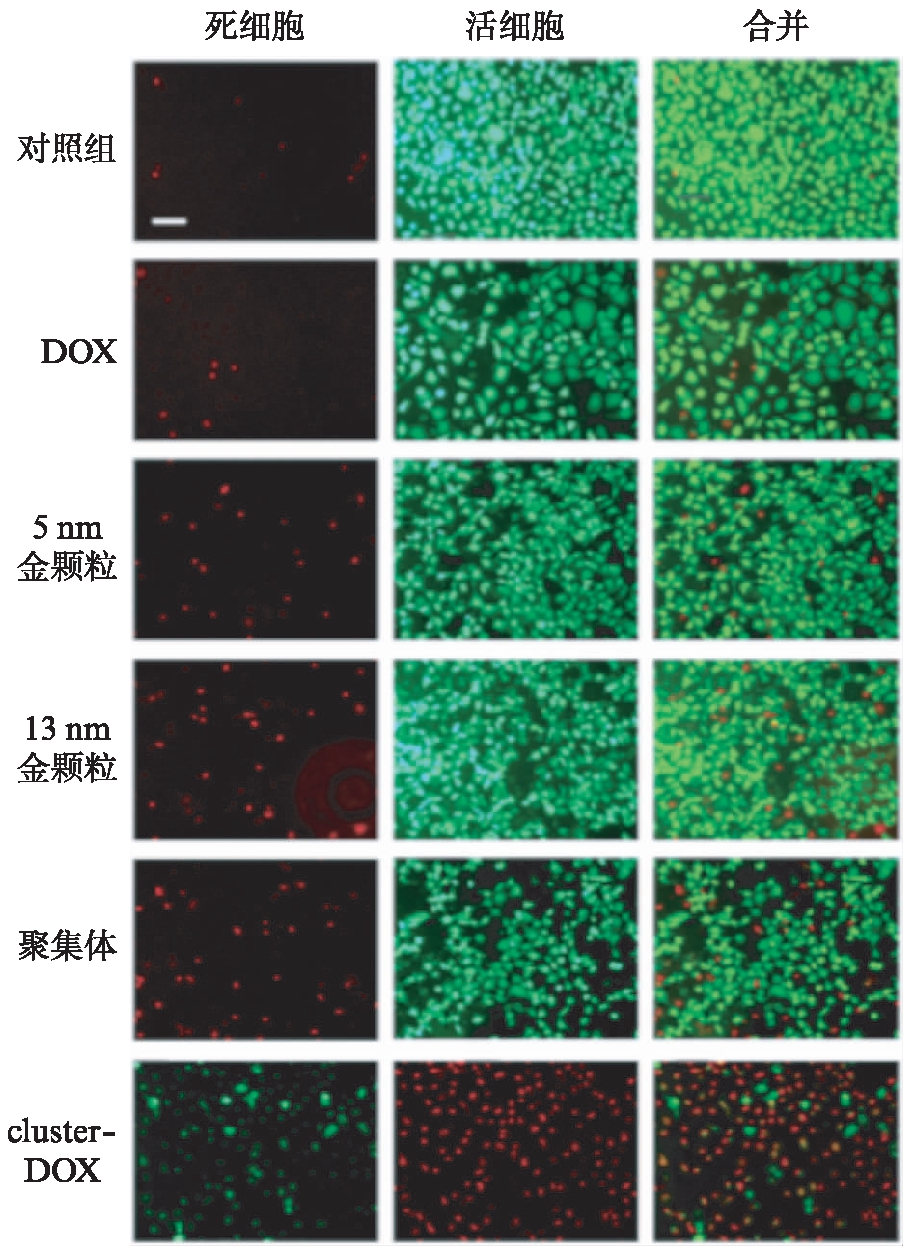
图8 载药聚集体对细胞活性的影响
Fig.8 Effect of cluster-DOX on cell viability
3 讨 论
肿瘤微环境响应释放的金纳米颗粒载药体系在化学疗法、光热疗法、射频疗法等多种治疗中应用广泛[13-20]。目前对肿瘤微环境响应释放的金纳米颗粒载体的研究,多是利用响应单元改变纳米颗粒表面性质来达到载药目的。但是,纳米载体的尺寸大小与其在体内的表现息息相关。为了进一步提高纳米载药体系穿过血流进入患病部位的效率,克服各种生物屏障,激活其诊断或治疗目标部位的功能,本研究引入了DNA-金纳米颗粒复合物,设计出一种形貌可变的纳米载体。
本研究利用肿瘤细胞微环境所具有的酸性特点,引入了一种优异的pH响应型的可变形三链体脱氧核糖核酸。而C—G·C+三链体DNA结构作为triplex DNA的其中一种,在pH=4.5的酸性条件下稳定,在中性pH下重新解链成C—G双链体构型[21-22],其响应率高,pH响应区间窄[23-27]。这与肿瘤微环境所具有的偏酸性特点相对应,因此,选择了C—G·C+三链体DNA结构作为本载药聚集体的响应框架。PAGE以及DNA溶解曲线的实验证明了在中性条件下,triplex DNA可以和其互补序列complement DNA形成杂交双链,使溶液环境变为酸性后,因三链体结构的形成,使杂交双链发生解链,即选择的C—G·C+型可以实现预期的pH诱导结构变化。
本研究利用杂交双链两端以及互补链S-10T上的巯基,通过冷冻法将其修饰在不同的金纳米颗粒上,由DNA链的牵引固定作用,令5、13nm金颗粒形成聚集体结构,组装出聚集体结构。冷冻法[28]是最新出现的修饰方法,冷冻法无需添加其他化学试剂,方法简单,最短耗时仅需2min,且表面修饰的DNA数量更多[6]。琼脂糖凝胶电泳以及紫外可见光谱结果说明了本研究成功构建出了粒径较大的聚集体结构。而TEM以及DLS均表明,绝大多数聚集体尺寸在50~80nm之间,为更易进入细胞的大小,且不易被肾脏快速清除[27-30]。5nm金颗粒具有水溶性好、合成方法简单、稳定性好、不易聚集等优点,故本文选取5nm金颗粒作为主要响应基元,同时为了所组装的聚集体达到利于细胞内吞的尺寸大小,向其中加入少量13nm金颗粒作为聚集体的核心。且当聚集体处于酸性条件下时,三链体结构形成,杂交双链解链,聚集体重新恢复分散的单颗粒或小聚集体状态,更易被细胞外排。
DOX是临床及科研中非常经典的抗肿瘤药物,其抗癌谱相对大部分药物来说更为广泛,同时由于其自发荧光的特性,极大地方便了其表征过程。游离状态下,DOX的自发荧光强度会随着其浓度的增强而发生线性增长,且pH改变对其荧光强度的影响极低,故可借此来估算溶液中游离DOX的浓度。而DNA双链中,连续的CG碱基提供了DOX的运载位点,DOX可以利用其平面芳香环结构选择性的插入DNA双螺旋的CG或GC碱基对中[31-32]。当DOX插入DNA双链后,其固有荧光淬灭,在验证不同pH下双链DNA对DOX释放能力的试验中,溶液中游离的DOX明显增多,证明了在酸性环境下时,Hoogsteen键形成,促使双链打开并将DOX释放,且其自发荧光恢复,是刺激响应变形载体成功构建的有力保证。
通过载带有DOX的杂交双链与纳米颗粒组装出响应肿瘤酸性微环境的载药聚集体(cluster-DOX)。在酸性环境下,溶液中游离的DOX较中性环境下明显增多,且pH为4~4.5时,DOX的释放量有较明显的变化,说明cluster-DOX成功释放出药物DOX,可以达到杀死肿瘤细胞的目的。而细胞实验中,载药聚集体可以被细胞快速内吞,释放出DOX,并对肿瘤细胞有显著的杀伤效果。
综上,本研究构建的纳米载药体系完成了结构的聚集、解聚过程,在该过程中,载带的药物可以被成功释放出来,达到更加精准、快速、高效、更低药物剂量杀死肿瘤细胞的目的。本研究成果可以为新一代刺激响应型纳米载带体系提供新的思路,也为纳米材料辅助癌症治疗提供借鉴意义。
[1] CHITHRANI B D, GHAZANI A A, CHAN W C. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells[J]. Nano Lett, 2006,6(4): 662-668.
[2] SYKES E A, CHEN J, ZHENG G, et al. Investigating the impact of nanoparticle size on active and passive tumor targeting efficiency[J]. ACS Nano, 2014,8(6): 5696-5706.
[3] DREADEN E C, AUSTIN L A, MACKEY M A, et al. Size matters: gold nanoparticles in targeted cancer drug delivery[J]. Ther Deliv, 2012,3(4): 457-478.
[4] RAEESI V, CHOU L Y, CHAN W C. Tuning the drug loading and release of DNA-assembled gold-nanorod superstructures[J]. Adv Mater, 2016,28(38): 8511-8518.
[5] IDILI A, VALLÉE-BÉLISLE A, RICCI F. Programmable pH-triggered DNAnanoswitches[J]. J Am Chem Soc, 2014,136(16): 5836-5839.
[6] AMODIO A, ZHAO B, PORCHETTA A, et al. Rational design of pH-controlled DNA strand displacement[J]. J Am Chem Soc, 2014,136(47): 16469-16472.
[7] SLOT J W, GEUZE H J. A new method of preparing gold probes for multiple-labeling cytochemistry[J]. Eur J Cell Biol, 1985,38(1): 87-93.
[8] PEI H, LI F, WAN Y, et al. Designed diblock oligonucleotide for the synthesis of spatially isolated and highly hybridizable functionalization of DNA-gold nanoparticle nanoconjugates[J]. J Am Chem Soc, 2012,134(29): 11876-11879.
[9] MORGAN A R, WELLS R D. Specificity of the three-stranded complex formation between double-stranded DNA and single-stranded RNA containing repeating nucleotide sequences[J]. J Mol Biol, 1968,37(1): 63-80.
[10] ZHAO T T, CHEN Q Y, YANG H. Spectroscopic study on the formation of DNA-Ag clusters and its application in temperature sensitive vehicles of DOX[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2015,137: 66-69.
[11] LV Y, HUO Y N, YU X C, et al. TopBP1 contributes to the chemoresistance in non-small cell lung cancer through upregulation of p53[J]. Drug Des Devel Ther, 2016,10: 3053-3064.
[12] ZHAO M X, ZHU B J, YAO W J, et al. The delivery of doxorubicin of multifunctional β-cyclodextrin-modified CdSe/ZnS quantum dots for bioactivity and nano-probing[J]. Chem Biol Drug Des, 2018,91(1): 285-293.
[13] KHANDELIA R, JAISWAL A, GHOSH SS, et al. Gold nanoparticle-protein agglomerates as versatile nanocarriers for drug delivery[J]. Small, 2013,9(20): 3494-3505.
[14] ZOU L L, WANG H, HE B, et al. Current approaches of photothermal therapy in treating cancer metastasis with nanotherapeutics[J]. Theranostics, 2016,6(6): 762-772.
[15] LIU Y, CAO C S, YU Y, et al. Thermal ablation in cancer[J]. Oncol Lett, 2016,12(4): 2293-2295.
[16] DE JONG W H, BORM P J. Drug delivery and nanoparticles: applications and hazards[J]. Int J Nanomedicine, 2008,3(2): 133-149.
[17] LIU F, HUANG P L, HUANG D, et al. Smart “on-off” responsive drug delivery nanosystems for potential imaging diagnosis and targeted tumor therapy[J]. Chem Eng J, 2019,365: 358-368.
[18] ZHANG Z, NIU N, GAO X, et al. A new drug carrier with oxygen generation function for modulating tumor hypoxia microenvironment in cancer chemotherapy[J]. Colloids Surf B Biointerfaces, 2019,173: 335-345.
[19] LIASKONI A, ANGELOPOULOU A, VOULGARI E, et al. Paclitaxel controlled delivery using a pH-responsive functional-AuNP/block-copolymer vesicular nanocarrier composite system[J].Eur J Pharm Sci, 2018,117: 177-186.
[20] 张旭南,王培军.靶向整合素αvβ3受体磁共振/荧光双模态成像纳米探针的体外成像性能及光动力治疗效应评价[J].同济大学学报(医学版),2018,39(2): 32-37.
[21] LIAO W C, RIUTIN M, PARAK W J, et al. Programmed pH-responsive microcapsules for the controlled release of CdSe/ZnS quantum dots[J]. ACS Nano, 2016,10(9): 8683-8689.
[22] LU S S, WANG S, ZHAO J H, et al. A pH-controlled bidirectionally pure DNA hydrogel: reversible self-assembly and fluorescence monitoring[J]. Chem Commun(Camb), 2018,54(36): 4621-4624.
[23] FRANK-KAMENETSKII M D, MIRKIN S M. triplex DNA structures[J]. Annu Rev Biochem, 1995,64(1): 65-95.
[24] LV H S, LIU J, ZHAO J, et al. Highly selective and sensitive pH-responsive fluorescent probe in living Hela and HUVEC cells[J]. Sensor Actuat B Chem, 2013,177: 956-963.
[25] PORCHETTA A, IDILI A, VALLÉE-BÉLISLE A, et al. General strategy to introduce pH-inducedallostery in DNA-based receptors to achieve controlled release of ligands[J]. Nano Lett, 2015,15(7): 4467-4471.
[26] LEE J S, JOHNSON D A, MORGAN A R. Complexes formed by(pyrimidine)n.(purine)n DNAs on lowering the pH are three-stranded[J]. Nucleic Acids Res, 1979,6(9): 3073-3091.
[27] SABUNCU A C, GRUBBS J, QIAN S Z, et al. Probing nanoparticle interactions in cell culture media[J]. Colloids Surf B Biointerfaces, 2012,95: 96-102.
[28] SHANG L, NIENHAUS K, NIENHAUS G U. Engineered nanoparticles interacting with cells: size matters[J]. J Nanobiotechnology, 2014,12: 5.
[29] DUAN X P, LI Y P. Physicochemical characteristics of nanoparticles affect circulation, biodistribution, cellular internalization, and trafficking[J]. Small, 2013,9(9/10): 1521-1532.
[30] OHTA S, GLANCY D, CHAN W C. DNA-controlled dynamic colloidal nanoparticle systems for mediating cellular interaction[J]. Science, 2016,351(6275): 841-845.
[31] ZHANG Z J, WANG J, CHEN C Y. Near-infrared light-mediated nanoplatforms for cancer thermo-chemotherapy and optical imaging[J]. Adv Mater, 2013,25(28): 3869-3880.
[32] LI H, ZHOU X, YAO D B, et al. PH-Responsive spherical nucleic acid for intracellular lysosome imaging and an effective drug delivery system[J]. Chem Commun(Camb), 2018,54(28): 3520-3523.