结直肠癌是世界范围内最常见的消化道恶性肿瘤之一,每年新发140万例,死亡70万例[1]。目前对于结直肠癌的治疗仍以手术为主,但是手术后不同患者的生存时间和生存质量有明显差异。恶性肿瘤患者的预后不仅与肿瘤原发灶有关,也与肿瘤转移及复发有关,其中肝转移是结直肠癌常见的导致治疗失败的主要因素之一。15%~ 20%结直肠癌第1次手术时已发生肝转移,手术2年后复发肝转移约50%[2]。DNA异常突变是许多肿瘤(包括结直肠癌)发生、发展、转移的重要分子机制之一,如何早期对DNA异常突变进行检测是治疗结直肠癌的重点[3],也是结直肠癌早期干预和治疗的关键。本研究通过收集47例结直肠癌组织样本(发生/未发生远处转移=18/29),进行微阵列比较基因组杂交(comparative genome hybridizatio, CGH)分析,鉴定与远处转移相关的基因组改变。研究结果有助于进一步了解结直肠癌远处转移的生物学过程,并为其治疗和预防其转移提供新的方向。
1 材料与方法
1.1 肿瘤标本收集
收集2014年8月—2017年6月同济大学附属杨浦医院胃肠外科的47例结直肠癌患者的手术切除标本,收集其临床病理资料,包括年龄、性别、肿瘤位置、肿瘤分化程度、肿瘤TNM分期等。其中男性30例,女性17例,年龄中位数69(44~88)岁;高分化31例,低分化16例;结直肠癌术后TNM分期(AJCC第八版): Ⅰ期6例,Ⅱ期6例,Ⅲ期17例,Ⅳ期18例。本研究经患者书面同意,并获得同济大学附属杨浦医院伦理委员会批准(LL-2019-SCI-001)。
纳入标准: (1) 患者行结直肠癌根治术,包括根治性和姑息性手术;(2) 术后病理确诊为结直肠癌;(3) 有完整的临床病理资料。排除标准: (1) 术 前存在感染或合并自身免疫性疾病;(2) 合并其他恶性肿瘤;(3) 术后1个月内出现急性严重并发症或死亡。
1.2 对肿瘤样本进行CGH基因芯片分析
使用QIAmp组织试剂盒从冰冻肿瘤中提取DNA;使用安捷伦SurePrint G3 Cancer CGH+SNP 4× 180K芯片进行细胞基因组微阵列分析;使用安捷伦基因芯片微阵列扫描仪对芯片进行扫描;使用Agilent Cyto Genomics 2.5软件分析全基因组微阵列数据以鉴定DNA拷贝数改变(DNA copy number alteratians, DCNA)。本研究的CGH数据仅包含常染色体,不包含性染色体。
1.3 生物信息分析
选取组织中常染色体的CGH数据,利用χ2检验,筛选出两组之间差异最大的DCNA(P<0.05)。在DAVID数据库中对DCNA中的基因进行比对,用基因本体论(gene ontology, GO)分析方法从生物过程(biological process, BP)、细胞组成(cellular components, CC)和分子功能(molecular function, MF)3个方面分析基因的功能,并使用京都基因与基因组百科全书基因通路(Kyoto encyclopedia of genes and genomes pathway, KEGG pathway)分析识别这些基因相关的信号通路。使用相互作用基因检索工具(STRING)研究获得基因之间的相互作用关系(95%CI),并使用Cytoscape软件绘制PPI网络图,并在CytoNCA插件中将度中心性(degree)、接近中心性(closeness)和中介中心性(betweenness)设置为方法,识别网络图中的关键基因。
1.4 统计学处理
使用SPSS 22.0和R语言Ver.3.2.0进行统计学分析。分类变量使用χ2检验、Fisher精确检验,连续变量使用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 结直肠癌远处转移与DCNA的关系
对47个结直肠癌样本进行CGH芯片分析,发现这批样本在20q(70.2%),13q(59.6%),8q(55.3%),7p(51.1%)和7q(51.1%)处常检测到扩增,而在5q(51.1%),15q(42.6%),14q(40.4%),18q(40.4%)和17p(36.2%)处常检测到缺失。图1显示了发生远处转移和未发生远处转移的结直肠癌DCNA的比较(发生转移/未发生转移=18/29),218个DCNA(其中24个发生扩增,194个发生缺失)在两组中差异有统计学意义(P<0.05),且大多数位于17q(27.98%)、22q(26.14%)、12p(8.71%)。
2.2 功能富集分析与PPI网络分析
从218个DCNA中鉴定出1649个与结直肠癌远处转移相关的基因,并对其进行功能富集分析。分析显示,这些基因在BP中显著富集的有免疫反应调节、补体激活、Wnt信号通路等;在MF中显著富集的有趋化因子活性、趋化因子受体活性、糖类结合等;在CC中显著富集的有中间丝、角蛋白丝等,见图2。KEGG通路分析显示,这些基因大多数集中在趋化因子信号通路、MAPK信号通路、自然杀伤细胞介导的细胞毒性等,见图3。
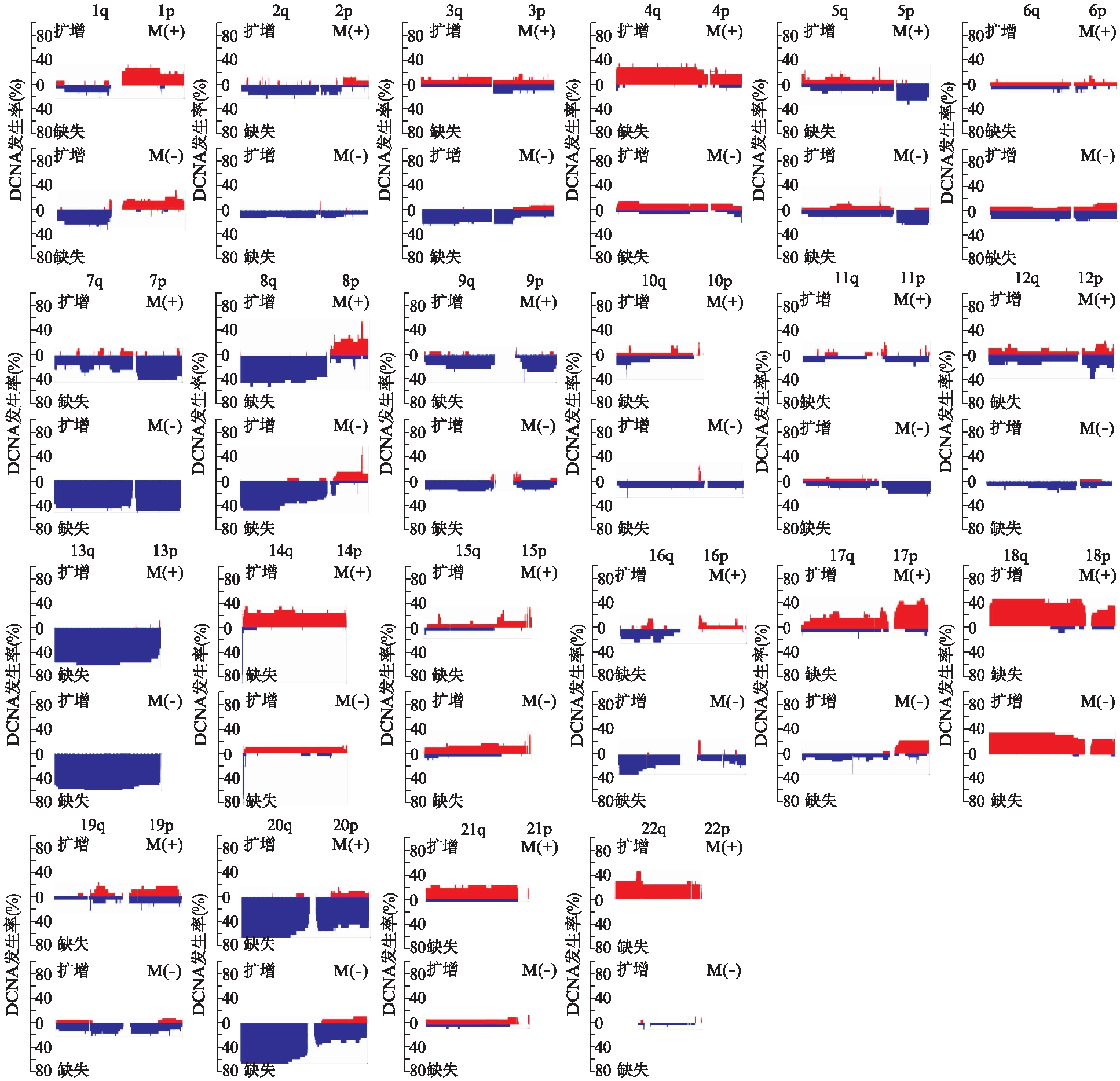
图1 发生转移和未发生转移结直肠癌的DCNA发生率的比较(发生转移/未发生转移=18/29)
Fig.1 Comparison of DCNA incidence between metastatic and non-metastatic colorectal cancer (18 cases in metastasis group and 29 cases in non-metastasis group)
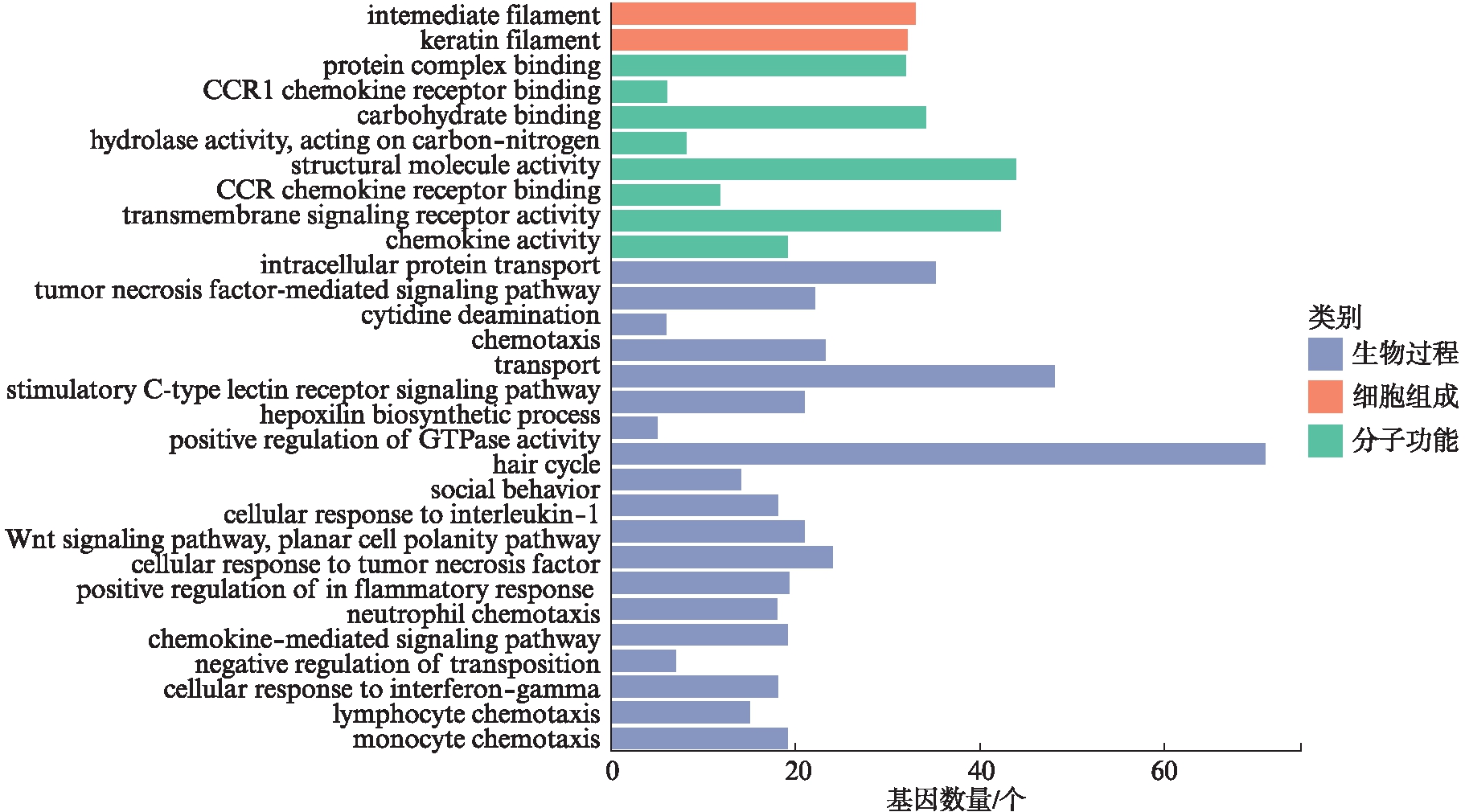
图2 218个DCNA中包含的1649个基因中富集最多的GO分类
Fig.2 The most enrichment GO terms of 1649 genes in 218 DCNAs
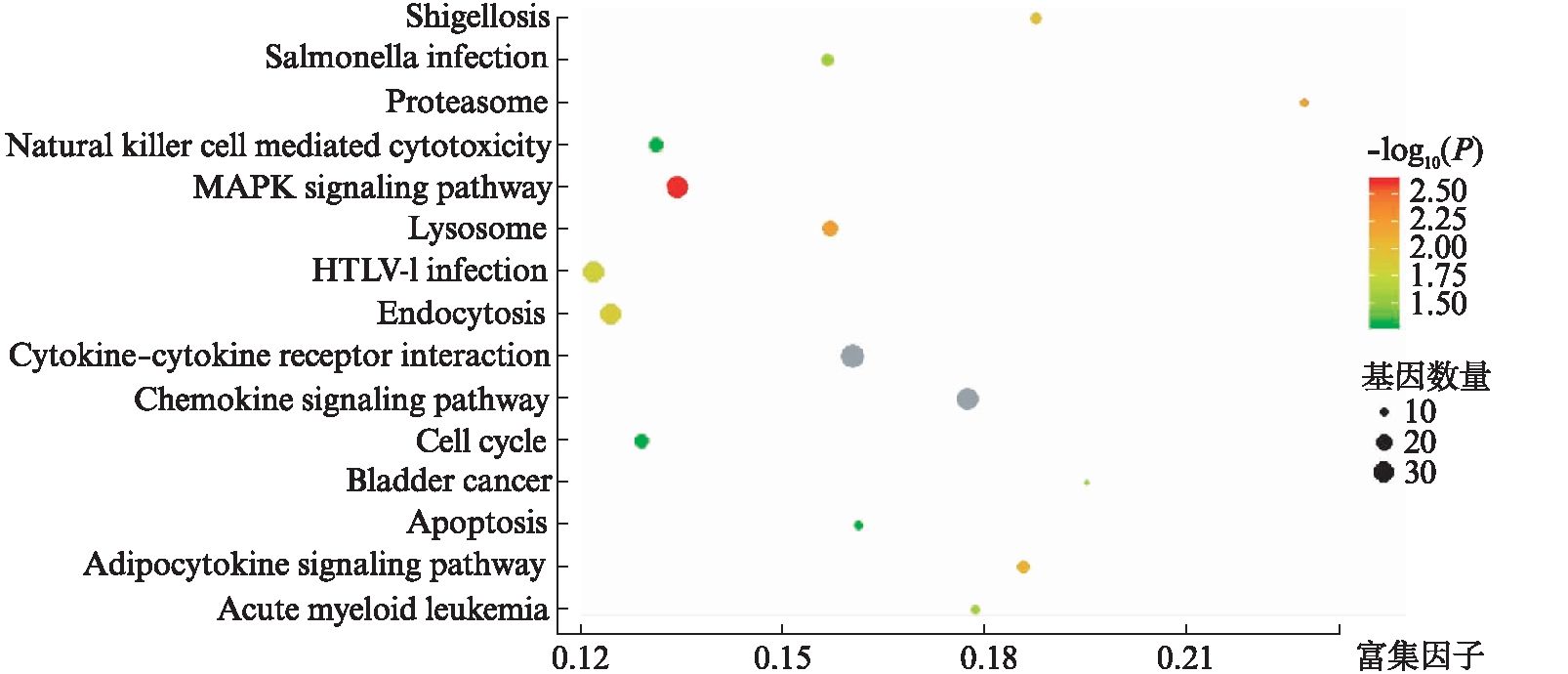
图3 218个DCNA中包含的1649个基因中富集最多的KEGG通路分类
Fig.3 The most enrichment KEGG pathway terms of 1649 genes in 218 DCNAs
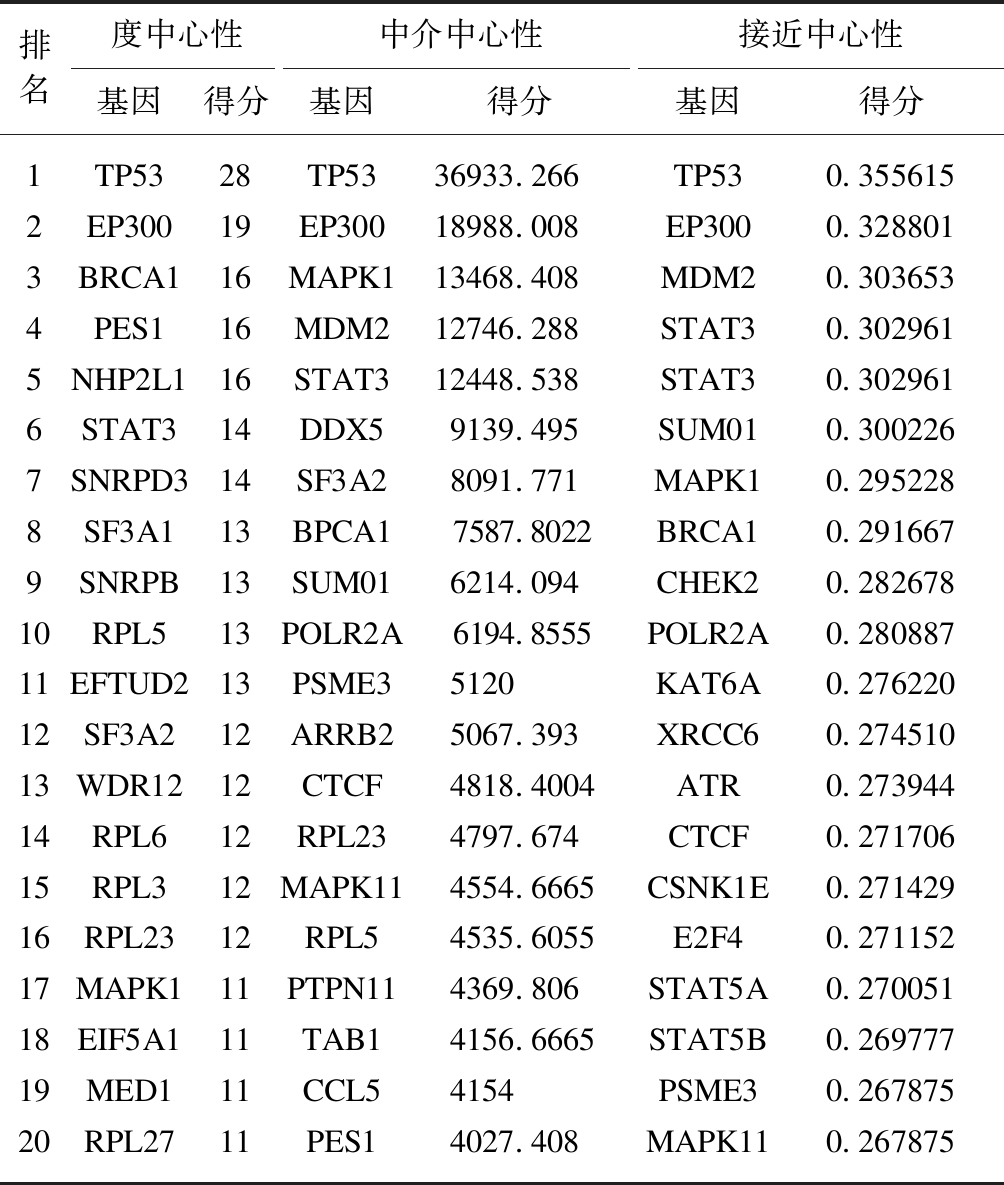
基于STRING数据库,构建了具有267个节点和534条关系线的PPI网络图,见图4。分别通过度中心性、中介中心性、接近中心性识别具有较高得分的前20个节点选择为关键基因,见表1。消除重复基因后,获得39个关键基因,包括TP53、EP300、MDM2、BRCA1、MAPK1等。
3 讨 论
结直肠癌的发生、发展是由多种因素共同参与的过程,发生转移是其难以根治的主要原因之一,也是结直肠癌常见的导致治疗失败的主要因素之一,严重影响患者生存预后。因此,寻找与转移相关的特异性基因,并分析其生物学功能,有助于更好地理解其发生机制,并可能为结直肠癌远处转移提供新的诊断标志物或治疗靶点。
目前,有很多研究集中于探究基因异常与结直肠癌转移的关系,希望能够找到结直肠癌转移的预测指标及治疗靶点[2-5]。本研究对47个散发性结直肠癌样本进行了基于基因芯片的CGH分析,发现在12p、9p、20p处检测到明显扩增,在22q、17q、8p处检测到明显缺失,与De Angelis等[6]、Brenner等[7]的大样本结直肠癌CGH检测结果基本一致。本研究中对发生(18例)与未发生(29例)转移的结直肠癌之间的比较显示,218个DCNA与结直肠癌转移显著相关,并且一半以上发生在22q、12p、17q、8p。Knösel、Nakao、Aragane等[8-10]的研究结果显示,与结直肠癌转移相关的DCNA主要位于22q、20q、19p、17q。本团队之前的一项关于结直肠癌脉管侵犯的CGH芯片分析结果显示,与之密切相关的DCNA主要位于22q、17q。既往研究表明,脉管侵犯是肿瘤发生局部侵犯与远处转移的早期事件[11],结合本次结果,本研究认为,DCNA的数量改变可能与结直肠癌侵袭性存在正相关。
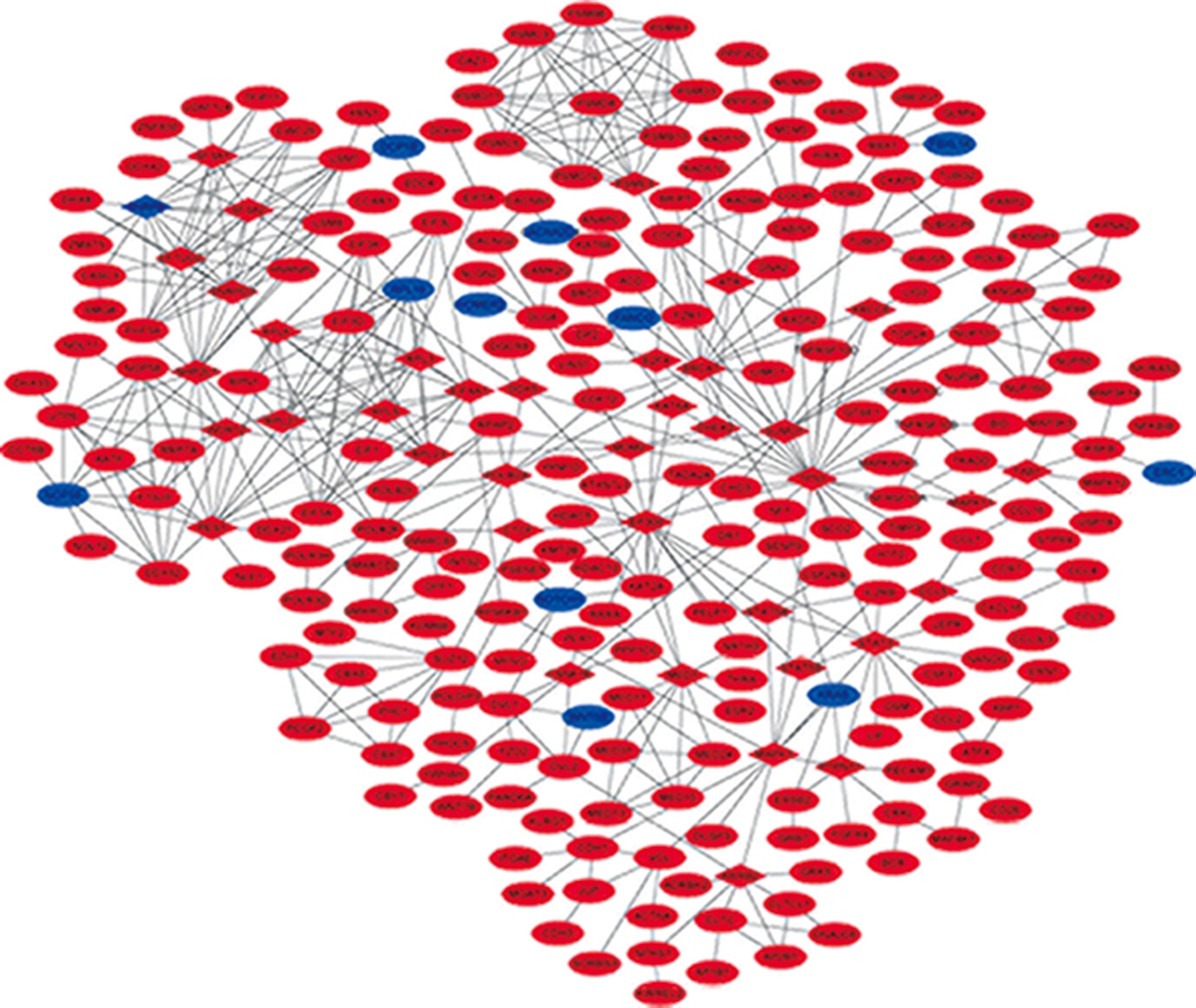
图4 结直肠癌远处转移相关基因的PPI网络图
Fig.4 PPI network of genes related to metastasis of colorectal cancer
表1 通过分析度中心性、接近中心性和中介中心性度量指标 识别的具有较高得分的前20个关键基因
Tab.1 Top 20 key genes with high value were identified by analyzing degree, closeness and betweenness
排名度中心性中介中心性接近中心性基因得分基因得分基因得分1TP5328TP5336933.266TP530.3556152EP30019EP30018988.008EP3000.3288013BRCA116MAPK113468.408MDM20.3036534PES116MDM212746.288STAT30.3029615NHP2L116STAT312448.538STAT30.3029616STAT314DDX59139.495SUM010.3002267SNRPD314SF3A28091.771MAPK10.2952288SF3A113BPCA17587.8022BRCA10.2916679SNRPB13SUM016214.094CHEK20.28267810RPL513POLR2A6194.8555POLR2A0.28088711EFTUD213PSME35120KAT6A0.27622012SF3A212ARRB25067.393XRCC60.27451013WDR1212CTCF4818.4004ATR0.27394414RPL612RPL234797.674CTCF0.27170615RPL312MAPK114554.6665CSNK1E0.27142916RPL2312RPL54535.6055E2F40.27115217MAPK111PTPN114369.806STAT5A0.27005118EIF5A111TAB14156.6665STAT5B0.26977719MED111CCL54154PSME30.26787520RPL2711PES14027.408MAPK110.267875
结肠直肠癌远处转移涉及一系列渐进性的体细胞遗传改变,使恶性细胞能够进行多个转移阶段,相关分子机制多种多样且十分复杂,常见步骤包括: 局部细胞外基质附着的蛋白水解、黏附改变、局部侵袭、血管生成、活血管扩散、免疫逃避、远处栓塞和新环境中的存活[12]。本研究中,在结直肠癌远处转移相关的218个DCNA中鉴定出1649个基因,并对这些基因进行了功能富集分析,发现它们在免疫球蛋白和免疫复合物介导的免疫反应和炎症、GTP酶活性的正调节、生物运输、结构分子活性、跨膜信号受体活性和细胞内蛋白运输、糖类结合等分类中显著富集。最新研究表明,肿瘤转移需要肿瘤细胞、免疫和炎性细胞、基质等成分间的密切协作[13]。肿瘤细胞侵袭需要在侵袭前沿对细胞外基质进行广泛的蛋白水解。而炎性细胞是降解细胞外基质的重要蛋白酶来源[14]。炎性细胞产生的炎性介质可增加血管渗透性从而促进肿瘤细胞侵入血管和淋巴管,进入循环的肿瘤细胞中约0.01%最终会存活并引起微转移[15]。而肿瘤患者循环中升高的几种促炎细胞因子上调了内皮细胞或靶器官中黏附分子的表达,从而增加了转移性细胞附着的可能性[16]。Andreyev等[17]的研究证实,由Ras基因家族的成员编码的GTP结合蛋白充当分子开关,作为核转录因子介导细胞外信号调节分子,使K-Ras突变持续保持活性。这种突变的存在可能会导致晚期结直肠癌的生物学行为更具侵略性。Nangia-Makker等[18]的研究表明,在肿瘤发生转移期间,糖类参与肿瘤细胞-肿瘤细胞,肿瘤细胞-细胞外膜或肿瘤细胞-内皮细胞相互作用,而肿瘤细胞则会使用糖类基团来逃避免疫细胞在体内迁移时的识别,从而成功进行转移。
此外,本研究还构建了一个PPI网络来筛选出一些关键基因,如TP53、EP300、MDM2、BRCA1、MAPK1,它们与细胞周期调控、同源染色体重组、上皮-间质转化(epithelial-mesenchymal transition, EMT)有关。有研究表明,EMT的异常发生和肿瘤的发生、发展、转移有着密切的联系[19-21],而在肿瘤细胞中干扰EMT的发生能够显著抑制肿瘤迁移和转移[22-25]。在PPI网络中TP53具有3个中心度量值的最高值,野生型p53(TP53)是一种肿瘤抑制蛋白,可控制细胞周期阻滞,细胞凋亡、衰老,DNA修复和细胞代谢[26-27]。TP53的稳定性受泛素依赖性降解的严格调控,其主要由E3泛素连接酶(murine double minute 2, MDM2)驱动[28]。目前已有多项研究证实MDM2与包括结直肠癌、肝癌等肿瘤的转移存在相关性[29-31]。吴也平等[32]的研究证实MDM2在EMT的调控中发挥了关键作用。EP300作为一些核蛋白的转录共激活因子,如HIF-1α,参与缺氧诱导的侵袭和EMT过程[33]。BRCA1在结直肠癌中作用的研究较少,文献报道其可与TP53协同作用,控制同源染色体重组,在肿瘤的发生、发展中起重要作用[34]。赵艳洁等[35]的研究证实,BRCA1结合蛋白能够通过激活NF-κB通路,促进食管癌的侵袭转移。MAPK1是MAPK通路的亚家族,其信号通路的激活可以显着促进EMT的发生[36-37]。本研究显示这些基因可能在远处转移的过程中发挥重要的作用,可为今后的结直肠癌治疗药物提供新的靶点。
本研究结果表明,与结直肠癌远处转移相关的遗传变异主要位于17q、22q、12p,其基因组改变与免疫反应、Wnt信号通路、同源染色体重组、趋化因子信号通路和MAPK信号通路等密切相关。这些发现有助于更好地理解结直肠癌远处转移中涉及的分子机制,并为结直肠癌患者的个体化治疗提供帮助。
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018,68(6): 394-424.
[2] KANAS G P, TAYLOR A, PRIMROSE J N, et al. Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors[J]. Clin Epidemiol, 2012,4: 283-301.
[3] 江慧洪,林谋斌.DNA甲基化在结直肠癌早期诊断中的研究进展[J].同济大学学报(医学版),2019,40(5): 639-643.
[4] XU J J, ZHOU J, DAI H J, et al. CHIP functions as an oncogene by promoting colorectal cancer metastasis via activation of MAPK and AKT signaling and suppression of E-cadherin[J]. J Transl Med, 2018,16(1): 169.
[5] SHAN Y J, MA J, PAN Y, et al. LncRNA SNHG7 sponges miR-216b to promote proliferation and liver metastasis of colorectal cancer through upregulating GALNT1[J]. Cell Death Dis, 2018,9(7): 722.
[6] DE ANGELIS P M, CLAUSEN O P, SCHJØLBERG A, et al. Chromosomal gains and losses in primary colorectal carcinomas detected by CGH and their associations with tumour DNA ploidy, genotypes and phenotypes[J]. Br J Cancer, 1999,80(3-4): 526-535.
[7] BRENNER B M, ROSENBERG D. High-throughput SNP/CGH approaches for the analysis of genomic instability in colorectal cancer[J]. Mutat Res, 2010,693(1/2): 46-52.
[8] KNÖSEL T, SCHLÜNS K, STEIN U, et al. Chromosomal alterations during lymphatic and liver metastasis formation of colorectal cancer[J]. Neoplasia, 2004,6(1): 23-28.
[9] NAKAO K, SHIBUSAWA M, ISHIHARA A, et al. Genetic changes in colorectal carcinoma tumors with liver metastases analyzed by comparative genomic hybridization and DNA ploidy[J]. Cancer, 2001,91(4): 721-726.
[10] ARAGANE H, SAKAKURA C, NAKANISHI M, et al. Chromosomal aberrations in colorectal cancers and liver metastases analyzed by comparative genomic hybridization[J]. Int J Cancer, 2001,94(5): 623-629.
[11] TSUBAMOTO H, YAMAMOTO S, KANAZAWA R, et al. Prognostic factors for locally advanced cervical cancer treated with neoadjuvant intravenous and transuterine arterial chemotherapy followed by radical hysterectomy[J]. Int J Gynecol Cancer, 2013,23(8): 1470-1475.
[12] RUDMIK L R, MAGLIOCCO A M. Molecular mechanisms of hepatic metastasis in colorectal cancer[J]. J Surg Oncol, 2005, 92(4): 347-359.
[13] POLYAK K, WEINBERG R A. Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits[J]. Nat Rev Cancer, 2009,9(4): 265-273.
[14] KITAMURA T, KOMETANI K, HASHIDA H, et al. SMAD4-deficient intestinal tumors recruit CCR1+ myeloid cells that promote invasion[J]. Nat Genet, 2007,39(4): 467-475.
[15] JOYCE J A, POLLARD J W. Microenvironmental regulation of metastasis[J]. Nat Rev Cancer, 2009,9(4): 239-252.
[16] MANTOVANI A, ALLAVENA P, SICA A, et al. Cancer-related inflammation[J]. Nature, 2008,454(7203): 436-444.
[17] ANDREYEV H J, NORMAN A R, CUNNINGHAM D, et al. Kirsten ras mutations in patients with colorectal cancer: the multicenter “RASCAL” study[J]. J Natl Cancer Inst, 1998,90(9): 675-684.
[18] NANGIA-MAKKER P, CONKLIN J, HOGAN V, et al. Carbohydrate-binding proteins in cancer, and their ligands as therapeutic agents[J]. Trends Mol Med, 2002,8(4): 187-192.
[19] SCHEEL C, EATON E N, LI S H, et al. Paracrine and autocrine signals induce and maintain mesenchymal and stem cell states in the breast[J]. Cell, 2011,145(6): 926-940.
[20] KYPRIANOU N. ASK-ing EMT not to spread cancer[J]. Proc Natl Acad Sci USA, 2010,107(7): 2731-2732.
[21] YANG J, WEINBERG R A. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis[J]. Dev Cell, 2008,14(6): 818-829.
[22] ZHENG J S, LI C, WU X, et al. Huaier polysaccharides suppresses hepatocarcinoma MHCC97-H cell metastasis via inactivation of EMT and AEG-1 pathway[J]. Int J Biol Macromol, 2014,64: 106-110.
[23] TAKAHASHI A, WATANABE T, MONDAL A, et al. Mechanism-based inhibition of cancer metastasis with(-)-epigallocatechin gallate[J]. Biochem Biophys Res Commun, 2014,443(1): 1-6.
[24] LIN Y C, LEE Y C, LI L H, et al. Tumor suppressor SCUBE2 inhibits breast-cancer cell migration and invasion through the reversal of epithelial-mesenchymal transition[J]. J Cell Sci, 2014,127(Pt 1): 85-100.
[25] ZHU X L, WANG Y L, CHEN J P, et al. Alternol inhibits migration and invasion of human hepatocellular carcinoma cells by targeting epithelial-to-mesenchymal transition[J]. Tumour Biol, 2014,35(2): 1627-1635.
[26] XU Y. Induction of genetic instability by gain-of-function p53 cancer mutants[J]. Oncogene, 2008,27(25): 3501-3507.
[27] VOUSDEN K H, PRIVES C. Blinded by the light: the growing complexity of p53[J]. Cell, 2009,137(3): 413-431.
[28] HORN H F, VOUSDEN K H. Coping with stress: multiple ways to activate p53[J]. Oncogene, 2007,26(9): 1306-1316.
[29] KHOR L Y, BAE K, PAULUS R, et al. MDM2 and Ki-67 predict for distant metastasis and mortality in men treated with radiotherapy and androgen deprivation for prostate cancer: RTOG 92-02[J]. J Clin Oncol, 2009,27(19): 3177-3184.
[30] SUGANO N, SUDA T, GODAI T I, et al. MDM2 gene amplification in colorectal cancer is associated with disease progression at the primary site, but inversely correlated with distant metastasis[J]. Genes Chromosomes Cancer, 2010,49(7): 620-629.
[31] KONDO I, IIDA S, TAKAGI Y, et al. MDM2 mRNA expression in the p53 pathway may predict the potential of invasion and liver metastasis in colorectal cancer[J]. Dis Colon Rectum, 2008,51(9): 1395-1402.
[32] 吴也平.MDM2通过正性调控Smad信号通路促进EMT的发生及肿瘤细胞迁移[D].杭州: 浙江大学,2014.
[33] HOU X, GONG R, ZHAN J H, et al. P300 promotes proliferation, migration, and invasion via inducing epithelial-mesenchymal transition in non-small cell lung cancer cells[J]. BMC Cancer, 2018,18(1): 641.
[34] DONG C, ZHANG F M, LUO Y, et al. P53 suppresses hyper-recombination by modulating BRCA1 function[J]. DNA Repair(Amst), 2015,33: 60-69.
[35] 赵艳洁.BRCA1结合蛋白BRAP促进食管癌侵袭转移[D].北京: 北京协和医学院,2017.
[36] WANG W X, CORRIGAN-CUMMINS M, HUDSON J, et al. MicroRNA profiling of follicular lymphoma identifies microRNAs related to cell proliferation and tumor response[J]. Haematologica, 2012,97(4): 586-594.
[37] DU L, RAO G H, WANG H Y, et al. CD44-positive cancer stem cells expressing cellular prion protein contribute to metastatic capacity in colorectal cancer[J]. Cancer Res, 2013,73(8): 2682-2694.