围手术期神经认知功能障碍(perioperative neurocognitive disorders, PND)在非心脏手术后的发生率为7%~26%[1],在心脏手术后的发生率高达14%~60%[2]。手术后的认知功能障碍多发生于65岁以上的老年人群[3]。多项研究发现,患者出现认知障碍与麻醉及手术有密切关系[4],因此,作为麻醉及外科医师应当了解当前的基础证据,并为患者提供适当的咨询,鉴别高危患者,尽可能采用更加安全的麻醉药物及技术。有研究显示,在外科手术后3个月内,高达10%的老年患者出现了持续性认知障碍。如果持续时间超过6~12个月,表明是一种更持久的状态,一些学者认为这是一种长期认知障碍[5]。随着认知功能障碍持续时间延长,患者的术后恢复及生活质量均会受到巨大影响,给社会及家庭造成沉重负担。
1 PND的定义
PND是由各国麻醉及神经学专家在“Reco-mmendations for the Nomenclature of Cognitive Change Associated with Anaesthesia and Surgery-2018.”一文中共同提出的最新专业名词,论文从2018年6—11月陆续刊登在6本国际知名期刊杂志(Br J Anaesth,Anesthesiology, Acta Anaesthesiol Scand, Anesth Analg, Can J Anaesth, J Alzheimers Dis)中。它是由原来的术后认知功能障碍(postoperative cognitive dysfunction, POCD)更名而来。POCD不同于临床上普通人群的神经认知障碍(neurocognitive disorders, NCD),它不是一种疾病的临床诊断。POCD作为麻醉和手术后出现的认知改变,一直缺乏统一的临床诊断标准,相关的临床管理与研究结果也并未得到其他相关学科和领域的广泛认可。既往POCD的筛查主要是借助于专业的神经心理学量表进行神经精神功能测验而确定,并未考虑患者术后是否存在认知功能降低的主诉,同时也未针对患者的日常生活活动(activities of daily living, ADL)进行评估,它与现有NCD的临床诊断标准脱节,因此在新的命名中将麻醉和手术后出现的认知改变归类到第五版神经障碍手册(The Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, DSM-5)中的NCD之下。在更名之后,建议用PND描述术前和术后发生的,包含术后谵妄(postoperative delirium, POD)在内的所有围手术期认知功能改变,不再采用“术后认知功能障碍”这一名词。根据发病时间,将PND分为5个亚类,见表1。
表1 围手术期认知功能障碍(PND)分类
Tab.1 Classification of perioperative neurocognitive disorders
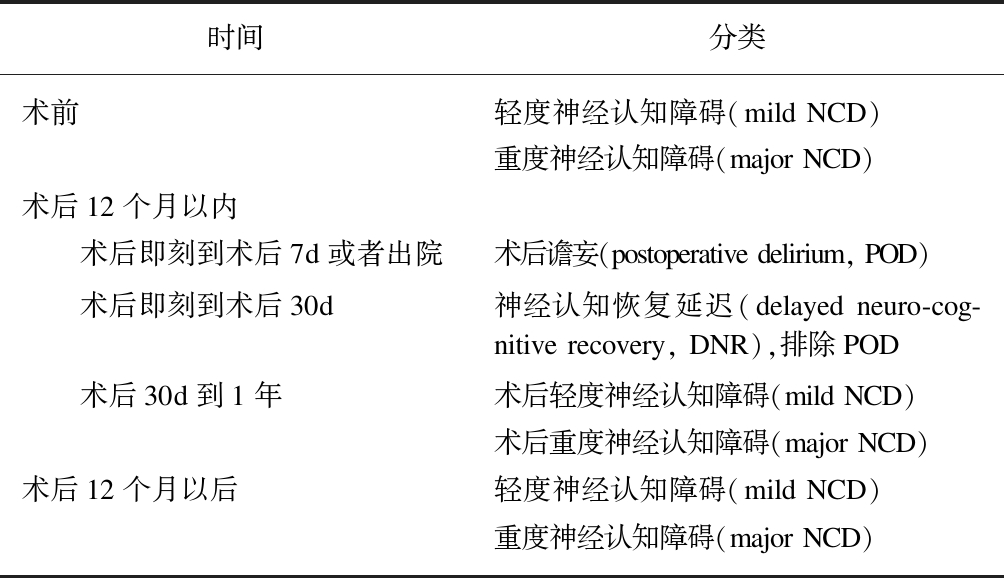
时间分类术前轻度神经认知障碍(mild NCD)重度神经认知障碍(major NCD)术后12个月以内 术后即刻到术后7d或者出院术后谵妄(postoperative delirium, POD) 术后即刻到术后30d神经认知恢复延迟(delayed neuro-cog-nitive recovery, DNR),排除POD 术后30d到1年术后轻度神经认知障碍(mild NCD)术后重度神经认知障碍(major NCD)术后12个月以后轻度神经认知障碍(mild NCD)重度神经认知障碍(major NCD)
更名之后,随访时间延长,对于POD的随访由原来的术后24~72h,延长至术后7d(或出院前),术后神经认知障碍的随访时间由之前的术后7d、1个月,延长至术后7d、1个月、12个月甚至更长;随访的内容也较之前有所增加,增加的主要内容包括对患者认知能力的主观评价和患者ADLs的评价。
2 PND的患病率和发病率
据报道,65岁以上成人手术后1周,术后认知功能障碍的发病率在9%~54%,与手术类型或麻醉剂的种类没有明确的关系[4]。PND的发病率和经济负担可能会随着老龄化的增加而进一步增高,每年都会有超过30%的老年人(>65岁)接受手术。既往术后认知功能障碍的发生率随患者数量和采样方法而变化,与研究和手术类型相关[6],例如,接受选择性髋关节手术患者的PND患病率估计为22%,而在接受心脏手术的患者中,PND患病率可能高达60%。
3 危险因素
危险因素的识别一直受到方法学问题的困扰,但许多病例对照、回顾性和前瞻性研究试图描述发生PND的危险因素,可分为以下几类。
3.1 与患者相关的危险因素
高龄、共存心脑血管疾病、低教育程度、糖尿病、遗传等都是与患者相关的危险因素。高龄是公认的PND危险因素,其原因包括大脑结构的改变、痴呆症的发展、较低的认知储备,大脑有限的恢复潜力耗尽[7]。心血管疾病的一个常见共存因素是动脉粥样硬化,其可能是由于斑块破裂和动脉狭窄,颈动脉和脑动脉中的微栓子和术中脑灌注不足导致PND[8]。此外,冠状动脉疾病是PND的一个独立危险因素[9],如果患者接受手术治疗或保守治疗,会发生相似的认知功能恶化。高血压和糖尿病破坏大脑自身调节和发展血管性脑病可能是PND发生的基础[10]。其次,慢性阻塞性肺疾病的脑血流改变,以及慢性肾脏疾病和肝脏疾病伴血管性脑病、血脑屏障破坏、高氨水平和贫血可能导致PND的发病[11-12],文献中也描述了受教育程度低[13]、吸烟史[14]、医院环境[15]与PND发生有关。
3.2 与手术相关的危险因素
心脏手术、体外循环(cardio-pulmonary bypass, CPB)持续时间、低灌注、血液稀释是与手术相关的危险因素。目前,PND发生的假设包括由心脏手术和CPB本身诱导全身炎症反应综合征(systemic infla-mmatory response syndrome, SIRS)[10,16]。CPB通过血液与旁路人工材料接触、缺血-再灌注损伤、补体激活以及肝素与鱼精蛋白的中和,导致免疫系统特异性激活炎症反应[16]。相比之下,心脏手术则是非特异性地引发炎症反应[17],然而,最近的研究表明,避免CPB并不能改善认知功能[16,18]。此外,尽管一般认为心脏直视手术比冠状动脉旁路移植术更容易发生PND,但最近的研究结果表明并非如此[19]。SIRS可导致血脑屏障渗漏及脑水肿和神经炎症[16,20],可能在PND发病机制中起重要作用。心脏手术应激反应也被研究为可能参与PND发病的因素之一。研究表明,手术后高糖皮质激素水平可能对神经结构有害,尤其是与记忆密切相关的海马[21]。然而,最近一项对围手术期皮质醇水平进行纵向评估的研究并不支持这一理论,研究表明,长时间且明显的皮质醇反应仅仅反映了手术过程中的应激反应,心脏手术会刺激昼夜节律改变,从而延长和加重皮质醇反应[22]。
3.3 与麻醉相关的危险因素
最近发现麻醉影响PND发生的研究结果特别值得怀疑。全身麻醉或局部麻醉的选择似乎不会改变PND发病率[18]。此外,反复麻醉和麻醉深度对PND的发展影响也不清楚[23]。研究表明,短时间接触异氟醚的动物不会出现记忆障碍[24]。影响麻醉药物毒性的因素有暴露特征、大脑和神经系统的敏感性以及机体的代谢能力。研究表明,神经退行性变的证据随着麻醉时间的延长、剂量的增加和麻醉暴露频率的增加而增加,与麻醉相关的神经毒性的一个关键因素是暴露在麻醉下的时间与神经成熟的关系[25]。总体而言,目前证据表明,与麻醉相关的危险因素相比,手术后低灌注和患者相关的危险因素对认知功能的影响更大。
4 PND的生物学机制
PND发生的机制知之甚少。迄今为止的转化研究主要集中在麻醉药的神经毒性,神经炎症以及与胆碱能神经退变和低灌注等方面。
4.1 麻醉药物的神经毒性
麻醉神经毒性的机制主要包括急性广泛的神经细胞死亡,导致长期记忆和学习异常。但神经细胞凋亡可能不是麻醉的唯一影响,以临床常用的静脉麻醉药丙泊酚为例,在少数关于丙泊酚研究中已经证实了几种异常变化,例如神经轴突的收缩和树突生长减少。丙泊酚诱导的毒性潜在机制,如Ca2+信号、线粒体分裂、神经炎症、microRNAs和神经营养蛋白表达失调均已有报道[26-27]。在树突形成的最初阶段,麻醉剂量的丙泊酚并没有导致γ-氨基丁酸(gamma aminobutyric acid, ABA)神经元的死亡,但确实大大减少了树突树状生长。在超麻醉剂量后,树突形成的减少伴随着神经细胞凋亡的显著增加。麻醉和超麻醉剂量的丙泊酚不仅能缩短树突长度,也会减少树突总数[28]。Ca2+是重要的细胞信号分子,调控其细胞内浓度对细胞的正常功能和生存至关重要。研究表明,使体外培养的海马神经元暴露于麻醉剂量的异丙酚5h,4d后的神经元中细胞内Ca2+浓度显著升高,神经细胞凋亡似乎遵循Ca2+水平的趋势,因为仅在第4天报告了显著的细胞死亡[29]。线粒体是参与许多细胞过程的极其重要的细胞器,包括能量产生,细胞信号转导和细胞凋亡。为了维持正常的功能,线粒体不断地经历融合和分裂的循环。不平衡的融合/分裂可能导致包括神经退行性变在内的多种病理状态。线粒体相关动态蛋白1(dynamin-related protein 1, RP1)是线粒体分裂的关键调控因子,Twaroski等[30]的研究表明,健康神经元暴露在比临床更高浓度的丙泊酚下6h,会增加神经元死亡,降低线粒体膜电位,并导致线粒体分裂的有害增加,在氯胺酮诱导的干细胞衍生的人神经元中也观察到线粒体裂变增加[6]。
4.2 神经炎症
外周手术创伤通过破坏血脑屏障(blood-brain barrier, BBB)引起CNS炎症,进而引起神经活动的功能性破坏,导致PND。通常,BBB由神经血管内皮细胞之间的跨膜蛋白紧密连接组成。该结构仅允许水、气体和小的脂溶性分子的被动扩散,无菌性手术创伤在手术部位引起炎症,炎症通过外周促炎细胞因子放大。损伤部位的受损细胞被动释放小分子生物分子,称为损伤相关分子模式(damage-associated molecular patterns, DAMPs),其中特别是响应手术创伤的高迁移率 族蛋白-1(high mobility group box-1 protein, HMGB1)释放。HMGB1激活骨髓源性单核细胞中核因子κB(nuclear factor-kappa B, NF-κB)信号通路,引起NF-κB核转位,环氧合酶2同工酶(cyclooxgenase-2,COX-2)表达上调,促进炎症表达细胞因子IL-1β、IL-6和TNF-α。这些促炎细胞因子可正反馈促进HMGB1的进一步释放,从而放大炎症反应[31]。外周促炎细胞因子通过COX-2上调和基质金属蛋白酶(matrix metallo-proteinases, MMPs)破坏血脑屏障通透性,允许促炎细胞因子进入中枢神经系统,并通过细胞因子表达和小胶质细胞激活增强神经炎症,导致神经元死亡和认知障碍。TNF-α、IL-1β和IL-6均已在大鼠海马组织和患者手术创伤后的脑脊液[32]中被发现。
4.3 中枢胆碱能系统退行性变
胆碱能突触在人类中枢神经系统中普遍存在。它们在丘脑,纹状体,边缘系统和新皮质中的高密度表明胆碱能传递可能对记忆,学习,注意力和其他更高的脑功能至关重要。有证据表明,乙酰胆碱具有多种基本功能,其在促进经验诱导的神经可塑性、神经元活动的同步和网络连接的多种基本功能中发挥作用。例如,对大鼠基底大细胞核(nucleus basalis magno-cellularis, NBM,基底前脑富含乙酰胆碱的区域,对皮质有广泛的投射)的可变刺激已经被证明可以产生广泛的皮质重构和调节皮质感觉地图[33]。通过内源性NBM和外源性(血管周围节后交感神经)的神经支配,胆碱能系统也显示出促进脑血管舒张和灌注。
基底前脑胆碱能神经元是最易受神经原纤维变性和神经原纤维缠结形成的细胞体之一,胆碱能异常与淀粉样蛋白-β病理学之间存在长期关系,动物实验表明,胆碱能退行性病变以促进淀粉样蛋白-β(Aβ)沉积和tau病理变化的方式导致PND。据报道,阿尔茨海默病啮齿动物模型的基底前脑中的胆碱能神经元的选择性损伤与海马和皮质中Aβ的沉积增加和过度磷酸化的tau蛋白水平有关[34],此外,中枢胆碱能系统通过胆碱能抗炎反射对神经炎症具有抑制作用[35]。受损的胆碱能系统可能无法有效抑制神经炎症,这也可能有助于PND的发展。
4.4 脑微血栓和低灌注
在手术中和手术后,尤其是心脏手术中栓塞和低灌注通常共存。低灌注破坏了对小栓子的冲洗和清除,这些小栓子又在手术后降低了脑血流供应。在心脏手术或主动脉造影术后死亡的患者尸检中发现了微栓子。颗粒可能由脂质,动脉粥样硬化碎片和血小板,纤维蛋白血栓组成。这些栓子通常会在几个小时到几天内通过大脑,而有些则持续数周或更长时间[36]。这些栓子闭塞的微血管可能是脑病或PND的主要原因。
5 PND的诊断
5.1 PND临床分型及诊断
PND描述术前和术后发生的所有围手术期认知功能改变,根据发病时间,PND可分为5个亚型,分别诊断如下。
5.1.1 术前存在的认知功能障碍 可根据DSM-5诊断标准确定为轻度NCD,即轻度认受损(mild cognitive impairment, MCI),或重度NCD,即痴呆。根据DSM-5,轻度神经认知紊乱(mild NCD)的诊断标准: (1) 患者自己、家属或者医务人员证明其存在认知紊乱;(2) 经客观的神经精神量表检测,结果低于对照组或者正常人群1~2个标准差;(3) 不 影响日常生活。严重神经认知紊乱(major NCD)诊断标准: (1) 患者自己、家属或者医务人员证明其存在认知紊乱;(2) 经客观的神经精神量表检测,结果低于对照组或者正常人群>2个标准差;(3) 影响日常生活。精神量表方面,建议使用简易精神状态检查(mini-mental state examination, MMSE,包括定向、记忆、语言、计算注意等方面)来做术前筛查。
5.1.2 POD 指发生在术后7d内或者出院前的谵妄,并且其诊断标准是沿用DSM-5谵妄的诊断标准。谵妄诊断的金标准: (1) 注意障碍(指向、集中、维持和转移注意力的能力降低)和意识障碍(对环境的定向减弱);(2) 急性发作(通常数小时至数日),与平常基线的注意力和意识相比有变化,在1d中症状有波动的趋势;(3) 伴有其他认知功能障碍(如记忆缺陷、定向不良、语言障碍、视觉空间能力障碍或知觉障碍);(4) 第1条及第3条的异常表现无法用已有的、已确定的或正在进行的神经认知疾病来更好地解释,患者无觉醒水平的严重下降(例如昏迷);(5) 病史、体格检查或实验室检查的证据支持以上的异常表现是由躯体疾病、物质中毒/戒断、药物不良反应或多种病因导致的。谵妄检测的量表推荐谵妄评定方法量表(the confusion assessment method, CAM),用于谵妄的临床辅助诊断具有较好的效度和信度。
5.1.3 神经认知恢复延迟(delayed neurocognitive recovery, DNR) 发生在出院以后到出院30d以内,符合上述轻度神经认知障碍(mild NCD)和严重神经认知障碍(major NCD)诊断标准,客观的神经精神量表建议使用相关的视觉再生(视觉记忆),韦氏词汇(听觉记忆),数字符号(视知觉、视觉扫描、眼球运动、记忆),数字广度(集中注意能力、瞬时记忆力以及抗信息干扰),关于注意和运动速度的经典测量理论(classical testing theory, CTT)等量表检测。
5.1.4 术后NCD 手术后30d~12个月,根据DSM-5中的诊断标准诊断为术后轻度神经认知障碍(postoperative mild NCD)或者术后重度神经认知障碍(postoperative major NCD)。
5.1.5 术后12个月后出现的认知障碍 根据DSM-5中的诊断标准诊断为轻度NCD或者重度NCD,但这部分患者如果是首次诊断NCD,其发病与手术及麻醉可能无任何关联。
5.2 认知评估神经心理学量表
既往POCD的筛查主要是借助于专业的神经心理学量表进行神经精神功能测验而确定,关于围手术期认知测试最佳时机的争论仍在继续。测试分数可能会受到焦虑、疼痛和急性药物的影响,由于这些混淆因素,最好避免在手术当天进行测试。在精神错乱和PND的风险分层中,必须对认知进行正式和适当的测试。认知评估工具,如简略的精神测试(abbre-viated mental test, AMT)和MMSE在全世界广泛应用于痴呆症的筛查和诊断,但都缺乏检测诸如轻度认知功能障碍等细微认知损害的灵敏度和特异度。神经认知测试可用于检测MCI,然而许多测试费时且缺乏灵敏度和特异度,不适用于围手术期患者。一些既往常见的用于围手术期的神经心理学测试,见表2。
表2 认知功能评估最常用的神经心理学测试[37]
Tab.2 neuropsychological tests most commonly used in cognitive function assessment

测试特点简易精神状态检查(mini-mental state examination, MMSE)简单的筛选工具,用于评估认知功能: 时间和地点导向,操作记忆、注意力和计算能力,语言能力(名字、理解命令,阅读和写作)和结构运用蒙特利尔认知评估(Montreal cognitive assessment, MoCA)检测轻度认知障碍的筛选工具;用于评估认知功能,如短期记忆,视觉空间功能,执行功能、语言功能、语言流利性、注意力、表达能力、想象力和对外精神态度韦氏成人智力量表(Wechsler a-dult intelligence scale, WAIS)包括11个子测试的智力测试韦氏记忆量表(wechsler memory scale, WMS)由一系列简短的子测试组成。它评估对单词、图片,意思和抽象材料的记忆,包括直接记忆和延迟记忆。共有5项获得指标: 一般记忆、言语和非言语材料记忆、注意力,以及延迟召回AB连线测试(Trail Making Test A and B, TMTA、TMTB)评估对视觉和空间材料的集中力,它同时评估视觉搜索的能力,在各种刺激之间切换注意力的能力,这认为是1种有决策能力的表现雷伊听觉语言学习测试(Rey auditory verbal learning test, RAVLT)包括学习1个无关联单词列表,要求在在短时间回忆和长时间(30min)休息后回忆,还有很多变化测试(比如配对伙伴学习测试)木插板实验(grooved pegboard, GPB)评估精神运动功能。测试可以上肢协调性差(用惯用手和非惯用手),在30s内尽可能多的将专用插销插入木底座的凹槽内(次数可用来左右手比较)[38]视力保持实验(visual retention test, VRT)包括在展示后直接绘制1个图形或1组3个几何图形,它测量直接视觉记忆。Stroop颜色单词实验(Stroop colour word test, SCWT)用于通过所谓的干扰效应来研究执行过程———包括将打印单词的颜色命名为不同颜色的名称(例如用黄色打印的单词蓝色等)数字符号替换测试(digit symbol substitution test, DSST)WAIS的1个子测验;用来衡量学习新技能的能力,集中注意力的能力以及视觉运动协调能力。在临床实践中,其结果被视为信息处理的一般指标波士顿命名测试(Boston naming test, BNT)该套包含20幅描绘常用物品、稀有物品和抽象物品的图片;评估正确命名物品的数量;注意无效名称、语法和释义的数量[39]符号数字形式测试(symbol digit modalities test, SDMT)对于数字1~9,分配了适当的符号。受试者必须按照正确的顺序将其复制到表格中控制口语联想测验(controlled oral word association test, COWAT)1项简短的临床试验,包括在1min内从给定的语义类别(语义流畅性)生成尽可能多的单词,或由受试者以特定字母(语音流畅性)开头的单词
5.3 MRI和fMRI评估
除神经测试外,一些采用其他的生物标志物或放射学手段进行诊断的研究仍在发展中,神经影像学的进展,特别是在核磁共振成像(magnetic reso-nance imaging, MRI)中,提供有用的工具深入测量神经元活动并捕捉详细信息人脑图像。MRI提供独特的研究与生理学和疾病变化相关的大脑微小神经可塑性变化的机会。但该领域内的神经影像学应用仍然有限,证据也很少。研究表明,丘脑体积减少、海马体积减少、先前存在的退行性白质病理学(白质疏松症或腔隙)或脑血流量(cerebral blood flow, CBF)减少可能与PND相关。PND通常包括记忆和执行功能的下降。这些大脑功能主要由高阶皮质(如前额皮质和颞叶)控制,丘脑充当这些皮质区域之间信息的中继站[40]。特别是,丘脑背内侧核对于获取新信息和执行功能至关重要。病变导致注意力受损,信息处理速度降低。在一些神经疾病中,如中风、丘脑也被发现与认知障碍有关[41]。因此,PND中出现的执行功能障碍可能是由于与丘脑的功能连接减少或丘脑体积减少所致。海马体积的减少与PND相关不仅在腹部手术人群中有报告,类似的结果也在心脏外科手术中有报告[42]。海马体在记忆中起着重要作用,对工作记忆功能和记忆巩固至关重要[43]。在一个大型神经影像数据库中,Kline等[44]发现非心脏手术后几个月海马萎缩加速,这也与持续性PND相关。此外,2项大型前瞻性MRI数据库研究发现,非心脏手术后10年内,大脑萎缩加速[45]。大脑结构和功能变化可能是神经刺激的结果。正常衰老的大脑,包括海马和丘脑,在感染和手术等后更容易受到认知障碍的影响,这是由于年龄引起的脑内小胶质细胞的高敏感作用[46]。
就MRI方法而言,大多数所包括的研究中采用的MRI方式仅限于有限的几个区域(即海马和丘脑)粗略的结构对比分析,只有部分研究采用更为先进的方法如CBF、基于体素的形态测量学分析(voxel-based morphometry, VBM)和扩散张量成像(diffusion tensor imaging, DTI )调查与PND相关的大脑区域[47-49]。此外,PND患者的白质高强度和白质疏松等非特异性影像学表现很难解释,因为在健康老年人的大脑中也会有这些发现,尽管白质疏松症在痴呆患者中的患病率较高。
随着功能性核磁共振成像(function magnetic resonance imaging, fMRI)的迅速发展(图1),功能成像生物标志物的改变,早期突触功能障碍和神经元损伤可以用PET和MRI来测量。总的来说,分子和功能的变化可能导致突触损失,炎症,白质损伤和神经细胞死亡,最终导致宏观变化,如结构MRI上看到的区域性和全局性脑萎缩,但目前PND的相关fMRI的研究还较少,一些较为成熟的痴呆的功能核磁成像研究可以为我们提供一些帮助。在氟脱氧葡萄糖(fluorodeoxyglucose, FDG)PET研究中,阿尔茨海默(Alzheimer’s dementia, AD)痴呆患者表现出用FDG-PET测定的葡萄糖低代谢的特征模式,这对患有MCI的受试者进展为痴呆有预测作用[50]。此外,FDG-PET显示出对MCI患者进展为AD痴呆的高阴性预测价值[52]。在认知正常受试者中,基线侧颞顶和后扣带- 楔前代谢减退可以预测临床进展到MCI或痴呆的精度在70%~80%[51]。动脉自旋标记(arterial spin labelling, ASL)可以检测患者脑血流与MCI和AD痴呆变化[52]。静息状态功能MRI(resting state functional MRI, rs-fMRI)中,患有AD痴呆的受试者可能表现出大脑连接性降低[53]。但关于rs-fMRI对临床进展的预测价值,仍缺乏证据,但潜力巨大。
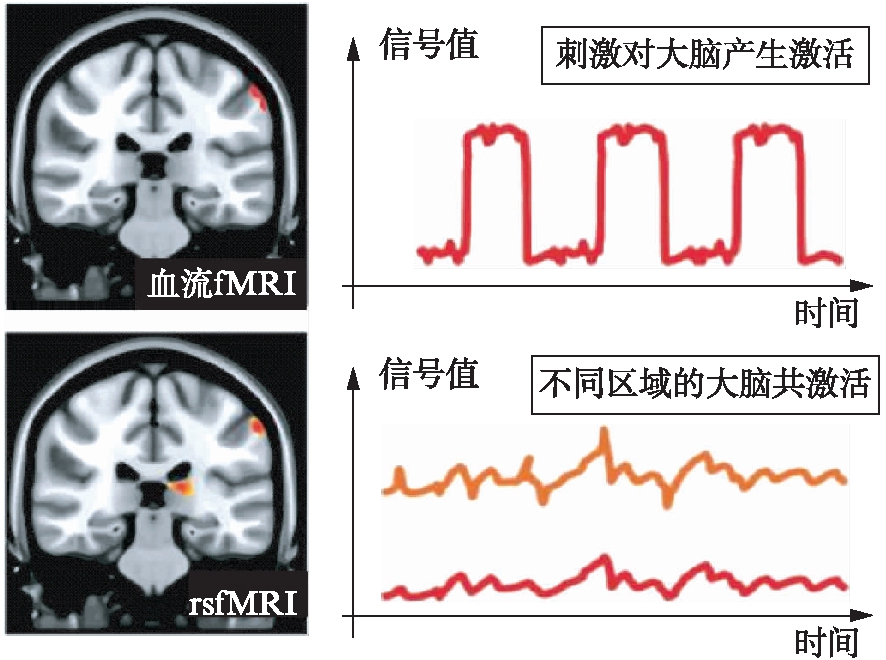
图1 血氧水平依赖fMRI(ASL)信号可用于 研究明确任务时的大脑激活
Fig.1 Blood oxygen level dependent fMRI(ASL) signals can be used to study brain activation for specific tasks
静息状态fMRI(rs-fMRI)可以揭示未执行明确任务的患者中大脑中不同区域的共激活[37](改自文献[46])
6 PND的预防
到目前为止,还没有针对PND的特殊治疗方法,但是这种情况对一些老年患者来说是值得关注的,麻醉师和外科医生必须考虑降低其发病率的方法,并在术前与患者讨论风险。由于PND可能是多因素的,预防方法应是多学科的,在适当的情况下还包括咨询老年护理专家。
6.1 术前预防
慢性疾病管理围手术期医学越来越被认为是一个多学科的专业,尤其是对于接受大手术的老年和虚弱患者[54]。2017年,提供术前评估服务的指南建议,年龄较大、体弱的患者可以咨询老年病学家,并且应考虑联合外科、老年病和麻醉门诊[55]。在计划干预研究时,需要考虑高血压、肥胖、糖尿病和吸烟等血管危险因素与普通人群的认知能力下降有关。因此,优化这些特征有助于降低PND和痴呆的风险。有研究显示,酒精过量与谵妄、长期认知障碍以及脑萎缩和维生素B1缺乏引起的痴呆症与PND密切相关,慢性酒精过量也是导致PND的危险因素,尤其是55岁以上的人[56]。因此,术前咨询应着重强调控制饮酒的认知益处,并在可能的情况下停止饮酒。
术前对一般健康的改善可能会产生间接的好处,例如纠正贫血和电解质异常,镁水平与认知功能有关。慢性缺乏会导致记忆障碍,同时伴有肌肉无力和嗜睡。服用镁盐被证明有助于痴呆患者尤其是阿尔茨海默病患者[57],对于有PND和谵妄风险的患者,应考虑禁食和生理盐水的注射时间,目的是防止脱水和电解质紊乱,使患者舒适[58]。一项研究的证据表明,术前苯二氮 类药物与术后认知功能的发生率有关,但这项研究并未发现其与PND的相关性,这些药物本身与谵妄有关。因此在围手术期不建议使用苯二氮
类药物与术后认知功能的发生率有关,但这项研究并未发现其与PND的相关性,这些药物本身与谵妄有关。因此在围手术期不建议使用苯二氮 类药物[59]。
类药物[59]。
6.2 术中预防
使用经过处理的脑电图(processed electroence-phalogram, pEEG)监测低脑电双频指数(bispectra-lindex, BIS)水平下的累积时间研究得出了混合的结果,越来越多的证据表明,pEEG监测可降低PND和谵妄的发生率[60-61],在最大的PND和脑电图随机研究中,非心脏手术的患者随机接受BIS目标为40~60或标准护理的麻醉,在BIS引导麻醉组中,术后3个月,PND发病率从14.7%显著降低到10.2%[62]。在心脏手术中使用近红外光谱(near infrared reflectance spectroscopy, NIRS)以避免低脑氧饱和度也可能是有用的,尽管观察性研究产生了不一致的结果[63],在非心脏病患者中没有发现缺氧和PND之间的任何联系。没有很好的临床证据表明任何单独的麻醉剂能降低术后PND的发病率,也没有一致的证据表明静脉麻醉技术有任何优势,Schoen等[64]对128名接受心脏泵浦手术的患者进行了一项研究,发现七氟醚与异丙酚用于维持全身麻醉后七氟醚第1周的PND明显减少,但180例腰椎手术患者的情况与此相反;在2年的随访中,随机分组的七氟醚组与对照组相比MCI有显著进展,而异丙酚组与对照组相比无明显下降,作者认为七氟醚麻醉用于腰椎手术可能会加速认知功能下降[65]。其他进展包括一项小的随机对照试验,表明心脏手术患者远程缺血预处理的好处[66]。
7 结 语
在老年人群中,手术事件和相关麻醉后认知功能的下降是公认的,但由于许多不确定性,向患者提供适当和准确的信息可能很困难。许多研究仍存在相当大的不确定性。为了确保研究方法的统一性,需要对认知功能障碍作出明确定义,并确定适当的评估工具。改善围手术期患者的护理,包括老年护理专家的参与,以及增加对参与围手术期患者相关工作人员的培训,帮助解决越来越多的患者需要,并提供更多防治的研究证据。
[1] MOLLER J T, CLUITMANS P, RASMUSSEN L S, et al. Long-term postoperative cognitive dysfunction in the elderly ISPOCD1 study. ISPOCD investigators. international study of post-operative cognitive dysfunction[J]. Lancet, 1998,351(9106): 857-861.
[2] KEIZER A M, HIJMAN R, KALKMAN C J, et al. The incidence of cognitive decline after(not) undergoing coronary artery bypass grafting: the impact of a controlled definition[J]. Acta Anaesthesiol Scand, 2005,49(9): 1232-1235.
[3] WHITAKER D, MOTALLEBZADEH R. Intraoperative cerebral high-intensity transient signals and postoperative cognitive function: a systematic review[J]. Am J Surg, 2009,198(2): 295-297.
[4] EVERED L, SCOTT D A, SILBERT B, et al. Postoperative cognitive dysfunction is independent of type of surgery and anesthetic[J]. Anesth Analg, 2011,112(5): 1179-1185.
[5] TSAI T L, SANDS L P, LEUNG J M. An update on postoperative cognitive dysfunction[J]. Adv Anesth, 2010,28(1): 269-284.
[6] CHOW W B, ROSENTHAL R A, MERKOW R P, et al. Optimal preoperative assessment of the geriatric surgical patient: a best practices guideline from the American college of surgeons national surgical quality improvement program and the American geriatrics society[J]. J Am Coll Surg, 2012,215(4): 453-466.
[7] KEAGE H A, SMITH A, LOETSCHER T, et al. Cognitive outcomes of cardiovascular surgical procedures in the old: an important but neglected area[J]. Heart Lung Circ, 2016,25(12): 1148-1153.
[8] TRUBNIKOVA O, TARASOVA I, BARBARASH O. The influence of low and moderate carotid stenosis on neurophysiologic status of patients undergoing on-pump coronary artery bypass grafting[J]. Front Neurol, 2012,3: 1.
[9] OTTENS T H, HENDRIKSE J, NATHOE H M, et al. Brain volume and cognitive function in patients with revascularized coronary artery disease[J]. Int J Cardiol, 2017,230: 80-84.
[10] BERGER M, TERRANDO N, SMITH S K, et al. Neurocognitive function after cardiac surgery: from phenotypes to mechanisms[J]. Anesthesiology, 2018,129(4): 829-851.
[11] GHAFFARY S, HAJHOSSEIN TALASAZ A, GHAELI P, et al. Association between perioperative parameters and cognitive impairment in post-cardiac surgery patients[J]. J Tehran Heart Cent, 2015,10(2): 85-92.
[12] MULLEN K D. Review of the final report of the 1998 Working Party on definition, nomenclature and diagnosis of hepatic encephalopathy[J]. Aliment Pharmacol Ther, 2007,25(Suppl 1): 11-16.
[13] OLIVEIRA F R, OLIVEIRA V H, OLIVEIRA  M, et al. Hypertension, mitral valve disease, atrial fibrillation and low education level predict delirium and worst outcome after cardiac surgery in older adults[J]. BMC Anesthesiol, 2018,18(1): 15.
M, et al. Hypertension, mitral valve disease, atrial fibrillation and low education level predict delirium and worst outcome after cardiac surgery in older adults[J]. BMC Anesthesiol, 2018,18(1): 15.
[14] PÉREZ-BELMONTE L M, FLORIDO-SANTIAGO M, MILL N-G
N-G MEZ M, et al. Research long-term cognitive impairment after off-pump versus on-pump cardiac surgery: involved risk factors[J]. J Am Med Dir Assoc, 2018,19(7): 639-640.e1.
MEZ M, et al. Research long-term cognitive impairment after off-pump versus on-pump cardiac surgery: involved risk factors[J]. J Am Med Dir Assoc, 2018,19(7): 639-640.e1.
[15] EVERED L, SILBERT B, SCOTT D A. Pre-existing cognitive impairment and post-operative cognitive dysfunction: should we be talking the same language?[J]. Int Psychogeriatr, 2016,28(7): 1053-1055.
[16] SALAMEH A, DHEIN S, D HNERT I, et al. Neuroprotective strategies during cardiac surgery with cardiopulmonary bypass[J]. Int J Mol Sci, 2016,17(11): E1945.
HNERT I, et al. Neuroprotective strategies during cardiac surgery with cardiopulmonary bypass[J]. Int J Mol Sci, 2016,17(11): E1945.
[17] THOMAIDOU E, ARGIRIADOU H, VRETZAKIS G, et al. Perioperative use of erythromycin reduces cognitive decline after coronary artery bypass grafting surgery: a pilot study[J]. Clin Neuropharmacol, 2017,40(5): 195-200.
[18] STEINMETZ J, RASMUSSEN L S. Peri-operative cognitive dysfunction and protection[J]. Anaesthesia, 2016,71(Suppl 1): 58-63.
[19] KNIPP S C, WEIMAR C, SCHLAMANN M, et al. Early and long-term cognitive outcome after conventional cardiac valve surgery[J]. Interact Cardiovasc Thorac Surg, 2017,24(4): 534-540.
[20] MERINO J G, LATOUR L L, TSO A, et al. Blood-brain barrier disruption after cardiac surgery[J]. AJNR Am J Neuroradiol, 2013,34(3): 518-523.
[21] KLINGER R Y, JAMES O G, BORGES-NETO S, et al. 18F-florbetapir positron emission tomography-determined cerebral β-amyloid deposition and neurocognitive performance after cardiac surgery[J]. Anesthesiology, 2018,128(4): 728-744.
[22] GLUMAC S, KARDUM G, ![]() A prospective cohort evaluation of the cortisol response to cardiac surgery with occurrence of early postoperative cognitive decline[J]. Med Sci Monit, 2018,24: 977-986.
A prospective cohort evaluation of the cortisol response to cardiac surgery with occurrence of early postoperative cognitive decline[J]. Med Sci Monit, 2018,24: 977-986.
[23] RADTKE F M, FRANCK M, LENDNER J, et al. Monitoring depth of anaesthesia in a randomized trial decreases the rate of postoperative delirium but not postoperative cognitive dysfunction[J]. Br J Anaesth, 2013,110(Suppl 1): i98-105.
[24] CIBELLI M, FIDALGO A R, TERRANDO N, et al. Role of interleukin-1β in postoperative cognitive dysfunction[J]. Ann Neurol, 2010,68(3): 360-368.
[25] XIAO H Y, LIU B, CHEN Y L, et al. Learning, memory and synaptic plasticity in hippocampus in rats exposed to sevoflurane[J]. Int J Dev Neurosci, 2016,48: 38-49.
[26] BAI X W, YAN Y S, CANFIELD S, et al. Ketamine enhances human neural stem cell proliferation and induces neuronal apoptosis via reactive oxygen species-mediated mitochondrial pathway[J]. Anesth Analg, 2013,116(4): 869-880.
[27] HAN X D, LI M, ZHANG X G, et al. Single sevoflurane exposure increases methyl-CpG island binding protein 2 phosphorylation in the hippocampus of developing mice[J]. Mol Med Rep, 2015,11(1): 226-230.
[28] ENGELHARDT T, MACDONALD J, GALLEY H F, et al. Selective phosphodiesterase 5 inhibition does not reduce propofol sedation requirements but affects speed of recovery and plasma cyclic guanosine 3′ 5′-monophosphate concentrations in healthy volunteers[J]. Anesth Analg, 2005,101(4): 1050-1053, table of contents.
[29] KAHRAMAN S, ZUP S L, MCCARTHY M M, et al. GABAergic mechanism of propofol toxicity in immature neurons[J]. J Neurosurg Anesthesiol, 2008,20(4): 233-240.
[30] TWAROSKI D M, YAN Y S, ZAJA I, et al. Altered mitochondrial dynamics contributes to propofol-induced cell death in human stem cell-derived neurons[J]. Anesthesiology, 2015,123(5): 1067-1083.
[31] SKVARC D R, BERK M, BYRNE L K, et al. Post-operative cognitive dysfunction: an exploration of the inflammatory hypothesis and novel therapies[J]. Neurosci Biobehav Rev, 2018,84: 116-133.
[32] CAO X Z, MA H, WANG J K, et al. Postoperative cognitive deficits and neuroinflammation in the hippocampus triggered by surgical trauma are exacerbated in aged rats[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2010,34(8): 1426-1432.
[33] KILGARD M P, MERZENICH M M. Plasticity of temporal information processing in the primary auditory cortex[J]. Nat Neurosci, 1998,1(8): 727-731.
[34] FIELD R H, GOSSEN A, CUNNINGHAM C. Prior pathology in the basal forebrain cholinergic system predisposes to inflammation-induced working memory deficits: reconciling inflammatory and cholinergic hypotheses of delirium[J]. J Neurosci, 2012,32(18): 6288-6294.
[35] HAMPEL H, MESULAM M M, CUELLO A C, et al. The cholinergic system in the pathophysiology and treatment of Alzheimer’s disease[J]. Brain, 2018,141(7): 1917-1933.
[36] BROWN W R, THORE C R. Review: cerebral microvascular pathology in ageing and neurodegeneration[J]. Neuropathol Appl Neurobiol, 2011,37(1): 56-74.
[37] HUANG C X, MÅRTENSSON J, GÖGENUR I, et al. Exploring postoperative cognitive dysfunction and delirium in noncardiac surgery using MRI: a systematic review[J]. Neural Plast, 2018,2018: 1281657.
[38] PROCH M, ![]() A,
A,  OJKO D, et al. Cognitive function assessment in patients undergoing transcatheter aortic valve implantation[J]. Nin, 2016,4: 135-142.
OJKO D, et al. Cognitive function assessment in patients undergoing transcatheter aortic valve implantation[J]. Nin, 2016,4: 135-142.
[39] RODÉS-CABAU J, DEBLOIS J, BERTRAND O F, et al. Nonrandomized comparison of coronary artery bypass surgery and percutaneous coronary intervention for the treatment of unprotected left main coronary artery disease in octogenarians[J]. Circulation, 2008,118(23): 2374-2381.
[40] MITCHELL A S. The mediodorsal thalamus as a higher order thalamic relay nucleus important for learning and decision-making[J]. Neurosci Biobehav Rev, 2015,54: 76-88.
[41] GRAFF-RADFORD J, WHITWELL J L, TRENERRY M R, et al. Focal brain atrophy in gastric bypass patients with cognitive complaints[J]. J Clin Neurosci, 2011,18(12): 1671-1676.
[42] MAEKAWA K, BABA T, OTOMO S, et al. Low pre-existing gray matter volume in the medial temporal lobe and white matter lesions are associated with postoperative cognitive dysfunction after cardiac surgery[J]. PLoS One, 2014,9(1): e87375.
[43] SQUIRE L R, DEDE A J. Conscious and unconscious memory systems[J]. Cold Spring Harb Perspect Biol, 2015,7(3): a021667.
[44] KLINE R P, PIRRAGLIA E, CHENG H, et al. Surgery and brain atrophy in cognitively normal elderly subjects and subjects diagnosed with mild cognitive impairment[J]. Anesthesiology, 2012,116(3): 603-612.
[45] SCHENNING K J, MURCHISON C F, MATTEK N C, et al. Surgery is associated with ventricular enlargement as well as cognitive and functional decline[J]. Alzheimers Dement, 2016,12(5): 590-597.
[46] BARRIENTOS R M, KITT M M, WATKINS L R, et al. Neuroinflammation in the normal aging hippocampus[J]. Neuroscience, 2015,309: 84-99.
[47] CAVALLARI M, DAI W Y, GUTTMANN C R, et al. Neural substrates of vulnerability to postsurgical delirium as revealed by presurgical diffusion MRI[J]. Brain, 2016,139(Pt 4): 1282-1294.
[48] HSHIEH T T, DAI W Y, CAVALLARI M, et al. Cerebral blood flow MRI in the nondemented elderly is not predictive of post-operative delirium but is correlated with cognitive performance[J]. J Cereb Blood Flow Metab, 2017,37(4): 1386-1397.
[49] SATO C, SEKIGUCHI A, KAWAI M, et al. Postoperative structural brain changes and cognitive dysfunction in patients with breast cancer[J]. PLoS One, 2015,10(11): e0140655.
[50] ARBIZU J, FESTARI C, ALTOMARE D, et al. Clinical utility of FDG-PET for the clinical diagnosis in MCI[J]. Eur J Nucl Med Mol Imaging, 2018,45(9): 1497-1508.
[51] MOSCONI L, DE SANTI S, LI J, et al. Hippocampal hypometabolism predicts cognitive decline from normal aging[J]. Neurobiol Aging, 2008,29(5): 676-692.
[52] BINNEWIJZEND M A, KUIJER J P, BENEDICTUS M R, et al. Cerebral blood flow measured with 3D pseudocontinuous arterial spin-labeling MR imaging in Alzheimer disease and mild cognitive impairment: a marker for disease severity[J]. Radiology, 2013,267(1): 221-230.
[53] BARKHOF F, HALLER S, ROMBOUTS S A. Resting-state functional MR imaging: a new window to the brain[J]. Radiology, 2014,272(1): 29-49.
[54] BRAUDE P, PARTRIDGE J S, HARDWICK J, et al. Geriatricians in perioperative medicine: developing subspecialty training[J]. Br J Anaesth, 2016,116(1): 4-6.
[55] GRIGORYAN K V, JAVEDAN H, RUDOLPH J L. Orthogeriatric care models and outcomes in hip fracture patients: a systematic review and meta-analysis[J]. J Orthop Trauma, 2014,28(3): e49-e55.
[56] HUDETZ J A, IQBAL Z, GANDHI S D, et al. Postoperative cognitive dysfunction in older patients with a history of alcohol abuse[J]. Anesthesiology, 2007,106(3): 423-430.
[57] XU Z P, LI L, BAO J, et al. Magnesium protects cognitive functions and synaptic plasticity in streptozotocin-induced sporadic Alzheimer’s model[J]. PLoS One, 2014,9(9): e108645.
[58] GRÖBER U, SCHMIDT J, KISTERS K. Magnesium in prevention and therapy[J]. Nutrients, 2015,7(9): 8199-8226.
[59] RASMUSSEN L S, STEENTOFT A, RASMUSSEN H, et al. Benzodiazepines and postoperative cognitive dysfunction in the elderly. ISPOCD group. International Study of Postoperative Cognitive Dysfunction[J]. Br J Anaesth, 1999,83(4): 585-589.
[60] PALANCA B J A, WILDES T S, JU Y S, et al. Electroencephalography and delirium in the postoperative period[J]. Br J Anaesth, 2017,119(2): 294-307.
[61] ESCALLIER K E, NADELSON M R, ZHOU D, et al. Monitoring the brain: processed electroencephalogram and peri-operative outcomes[J]. Anaesthesia, 2014,69(8): 899-910.
[62] CHAN M T, CHENG B C, LEE T M, et al. BIS-guided anesthesia decreases postoperative delirium and cognitive decline[J]. J Neurosurg Anesthesiol, 2013,25(1): 33-42.
[63] ROGERS C A, STOICA S, ELLIS L, et al. Randomized trial of near-infrared spectroscopy for personalized optimization of cerebral tissue oxygenation during cardiac surgery[J]. Br J Anaesth, 2017,119(3): 384-393.
[64] SCHOEN J, HUSEMANN L, TIEMEYER C, et al. Cognitive function after sevoflurane-vs propofol-based anaesthesia for on-pump cardiac surgery: a randomized controlled trial[J]. Br J Anaesth, 2011,106(6): 840-850.
[65] YANG C W, FUH J L. Exposure to general anesthesia and the risk of dementia[J]. J Pain Res, 2015,8: 711-718.
[66] HUDETZ J A, PATTERSON K M, IQBAL Z, et al. Remote ischemic preconditioning prevents deterioration of short-term postoperative cognitive function after cardiac surgery using cardiopulmonary bypass: results of a pilot investigation[J]. J Cardiothorac Vasc Anesth, 2015,29(2): 382-388.