脓毒症(sepsis)是指因感染引起宿主反应失调而导致危及生命的器官功能障碍[1-2]。在脓毒症时急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的发生率高达25%~50%,合并ARDS的脓毒症患者,死亡率高达40%[3]。目前临床上缺乏ARDS早期诊断和病情严重程度的监测标记物。近期有少数研究表明,反应内皮损伤的内皮细胞特异性分子-1(endothelial cell specific molecule-1, ESM-1)与脓毒症病情严重程度和预后相关[4-7],但是对血浆ESM-1和脓毒症性ARDS发生之间的关系没有明确的阐述。因此,本研究拟通过比较发生或不发生ARDS脓毒症患者血浆ESM-1的浓度水平,探索ESM-1可否作为脓毒症早期预测ARDS发生风险的标记物。同时探索ESM-1与生物标记物WBC、CRP、IL-6、PCT的关系。
1 资料与方法
1.1 研究对象
本研究为前瞻性队列研究。根据2016年国际拯救脓毒症运动指南的脓毒症的诊断标准,于2016年6月至2018年6月在同济大学附属东方医院中心监护室初选脓毒症患者90例作为研究对象。依据排除标准: 恶性肿瘤患者、免疫系统疾病患者、血液系统疾病患者、年龄<18岁的患者、心肺复苏术后患者、终末期肝或肾功能衰竭患者、入院24h内死亡患者,共排除掉19例患者;剔除入组时存在肺部感染的病例4例和入组时已存在ARDS病例13例,有效病例共54例。根据在72h内是否存并发ARDS将患者分为非ARDS组(n=42例)与ARDS组(n=12例)。其中4例患者在入组24h内并发ARDS,7例患者在入组48h内并发ARDS,仅1例患者在入组72h内并发ARDS。
1.2 方法
1.2.1 数据采集 患者入组后,记录一般资料,分别检测入组第1、2、3、7天患者血浆ESM-1、WBC、CRP、IL-6、PCT,并计算OI。并进行急性生理与慢性健康评分系统Ⅱ(Acute Physiology and Chronic Health Evaluation, APACHE-Ⅱ)评分、序贯器官功能衰竭评分(sequential organ failure assessment, SOFA)。记录患者ICU住院天数、总住院天数,并随访至入组后28d,计算28d死亡人数。
1.2.2 数据检测 ESM-1的标本为集中检测,用EDTA管采集静脉血3mL,在采集后的30min内于4℃ 1000×g离心15min,取上清液置于-80℃保存,避免反复冻融,集中送检,使用双抗体夹心酶联免疫反应法测定。ESM-1试剂盒(ELISA)购自MyBiosource公司。其它生物标记物检测均在我院临床检验科完成,采血后及时送检。
1.3 统计学处理
统计分析使用R软件包(Version 3.4.4)和SPSS 22.0软件包,计量资料采用![]() 表示,2组比较采用独立样本t检验、。采用Pearson相关系数进行参数相关性分析。用Logistic回归确定72h内发生ARDS的重要预测标记物,对ARDS的预测标记物生成ROC曲线。P<0.05为差异有统计学意义。
表示,2组比较采用独立样本t检验、。采用Pearson相关系数进行参数相关性分析。用Logistic回归确定72h内发生ARDS的重要预测标记物,对ARDS的预测标记物生成ROC曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 入组患者基线特征
共入选脓毒症患者54例,其中ARDS组患者12例,纳入病例的数据经正态分布检验符合正态分布。男性8例,女性4例;非ARDS组42例,男性23例,女性19例。患者基本资料见表1。
表1 基线特征表
Tab.1 Basic characteristics of patients ![]()

项目非ARDS组(n=42)ARDS组(n=12)统计值男性23(54.8)8(66.7)P=0.470(x2=0.541)年龄/岁72.95±12.0361.33±20.29P=0.160(t=1.503)慢性基础疾病 冠心病10(23.8)5(41.7)P=0.812(x2=0.159)
(续表1)
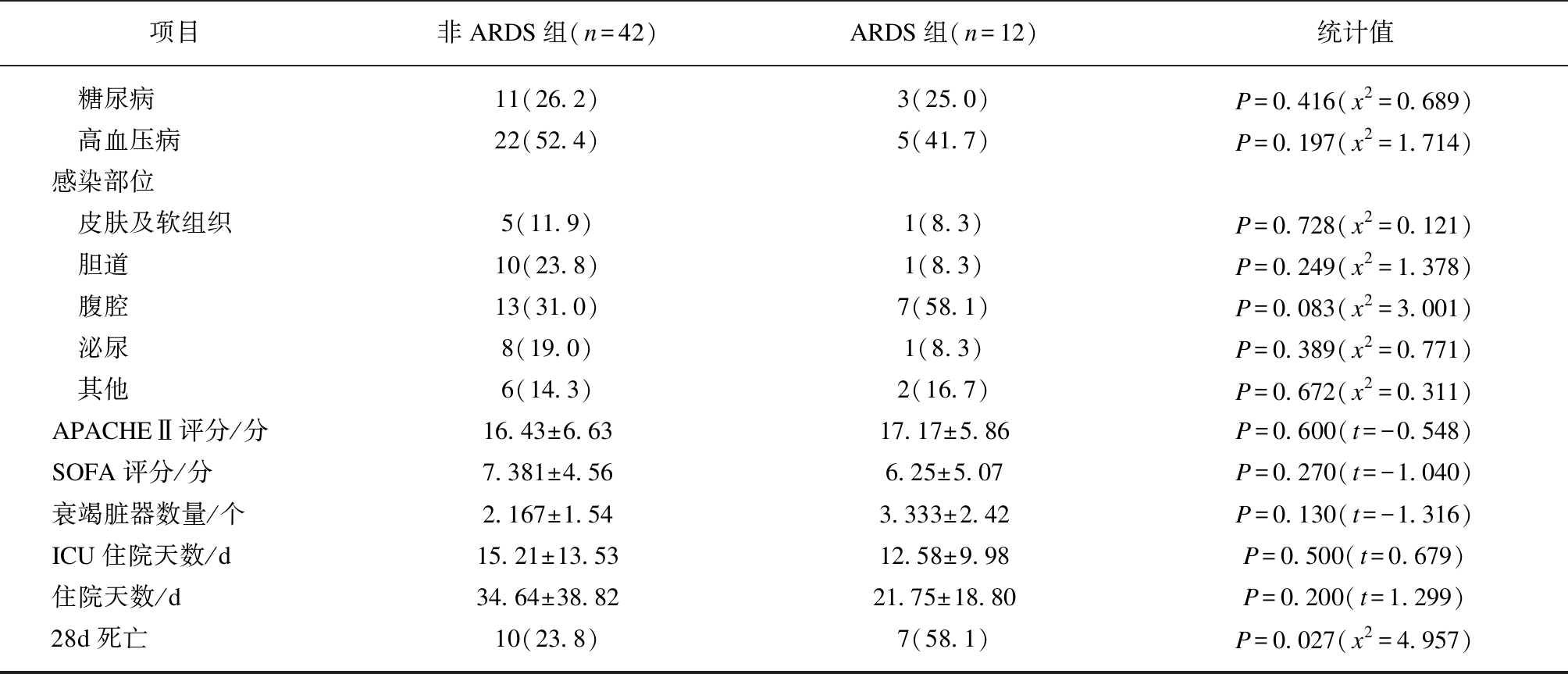
项目非ARDS组(n=42)ARDS组(n=12)统计值 糖尿病11(26.2)3(25.0)P=0.416(x2=0.689) 高血压病22(52.4)5(41.7)P=0.197(x2=1.714)感染部位 皮肤及软组织5(11.9)1(8.3)P=0.728(x2=0.121) 胆道10(23.8)1(8.3)P=0.249(x2=1.378) 腹腔13(31.0)7(58.1)P=0.083(x2=3.001) 泌尿8(19.0)1(8.3)P=0.389(x2=0.771) 其他6(14.3)2(16.7)P=0.672(x2=0.311)APACHEⅡ评分/分16.43±6.6317.17±5.86P=0.600(t=-0.548)SOFA评分/分7.381±4.566.25±5.07P=0.270(t=-1.040)衰竭脏器数量/个2.167±1.543.333±2.42P=0.130(t=-1.316)ICU住院天数/d15.21±13.5312.58±9.98P=0.500(t=0.679)住院天数/d34.64±38.8221.75±18.80P=0.200(t=1.299)28d死亡10(23.8)7(58.1)P=0.027(x2=4.957)
2.2 2组患者不同时间点血浆ESM-1的浓度水平比较
第1天ARDS组患者的血浆ESM-1浓度小于非ARDS组,差异有统计学意义(t=2.778,P=0.009)。在第2、3、7天ARDS组患者血浆ESM-1浓度均大于非ARDS组,差异有统计学意义(t=-4.632,P=0.000;t=-4.153,P=0.000;t=-2.518,P=0.016),见图1。
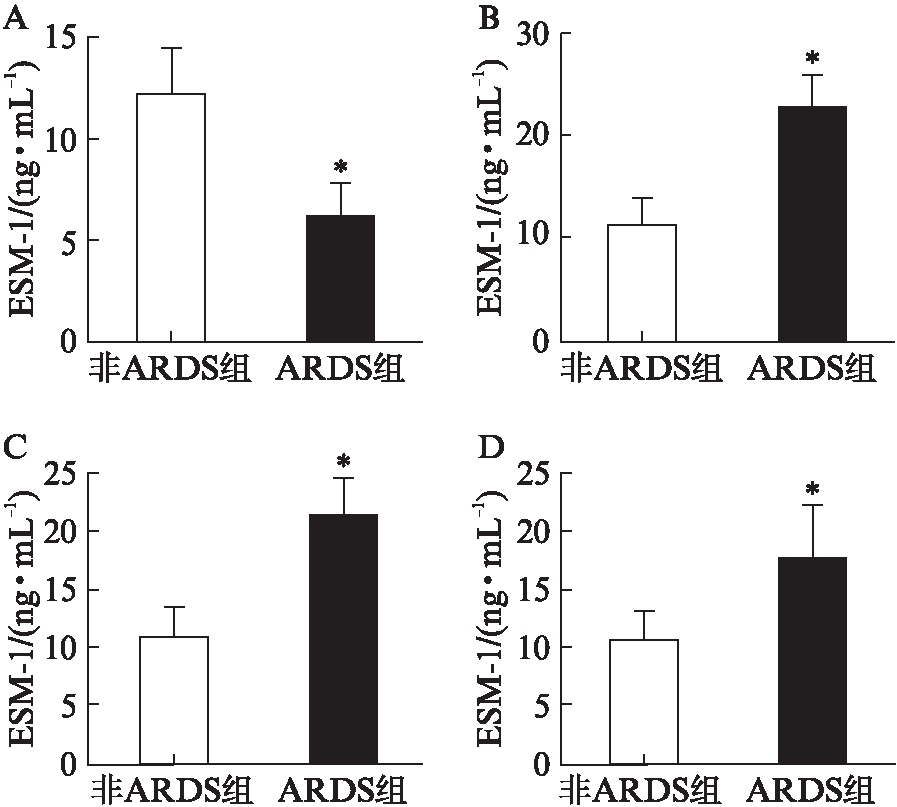
图1 脓毒症ARDS组与非ARDS组血浆ESM-1水平比较
Fig.1 Comparison of ESM-1 between two groups
A: 第1天;B: 第2天;C: 第3天;D: 第7天;与非ARDS组相比,*P<0.05
2.3 2组患者不同时间点OI水平比较
第1、2、3、7天ARDS组OI水平为315.50±52.40、213.00±72.20、181.42±59.13、195.50±54.44mmHg(1mmHg=0.133kPa);非ARDS组OI水平为360.36±46.84、377.24±41.68、391.25±63.03、347.96±50.23mmHg。ARDS组患者所有时间点的OI水平均低于非ARDS组,差异均有统计学意义(t=2.342,P=0.029;t=10.091,P=0.000;t=10.251,P=0.000;t=7.042,P=0.000)。
2.4 患者血浆ESM-1水平与OI相关性分析
血浆ESM-1浓度与OI相关性分析显示,第1天的ESM-1与第1天OI不相关,与第2天的OI呈正相关(r=0.321,P=0.018);第2天ESM-1与第2、3、7天的OI均呈负相关(P=0.002,P=0.006,P=0.000);第3天ESM-1与第3、7天的OI均呈负相关(P=0.023,P=0.000);第7天ESM-1与第7天OI呈负相关(P=0.008),见图2。
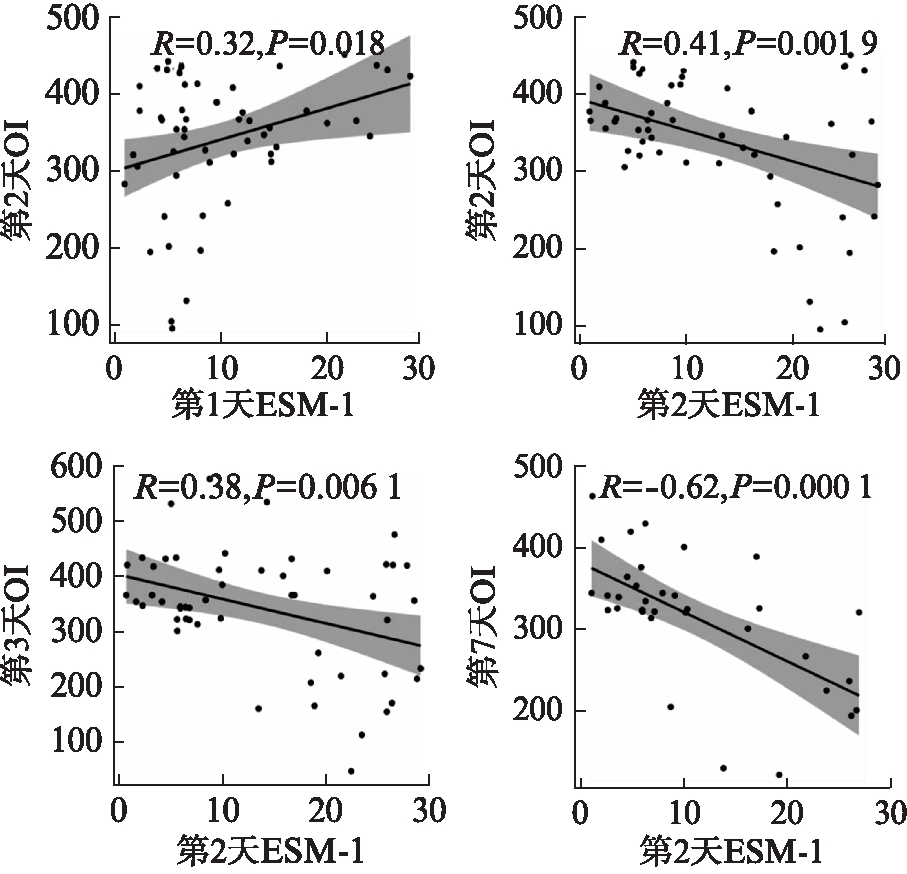
图2 两个参数的直线回归图
Fig.2 Correlation ESM-1 and OI
2.5 血浆ESM-1对早期ARDS的预测
2组间均数比较差异有统计学意义的4个变量为ESM-1(t=2.778,P=0.008)、CRP(P=0.019)、IL-6(P=0.019)和OI(t=2.842,P=0.006)。通过二元多因素Logostic回归分析排除混杂因素后,第1天的血浆ESM-1与CRP、IL-6具有统计学意义(P=0.031,P=0.016,P=0.044),见表2。
血浆ESM-1对脓毒症患者预测ARDS发生的独立危险因素,构建ROC曲线,曲线下面积为0.750(P=0.009),cut-off为5.865ng/mL时,其灵敏度为0.786,预测患者发生ARDS的准确率较高,漏诊率较少,特异度为0.583,但是假阳性率约为0.417,有误诊的可能性,血浆ESM-1水平小于5.865ng/mL会导致ARDS发生,见图3。
表2 脓毒症ARDS组和非ARDS组第1天指标比较结果
Tab.2 Comparison ofbiomarkersof day 1 between two groups
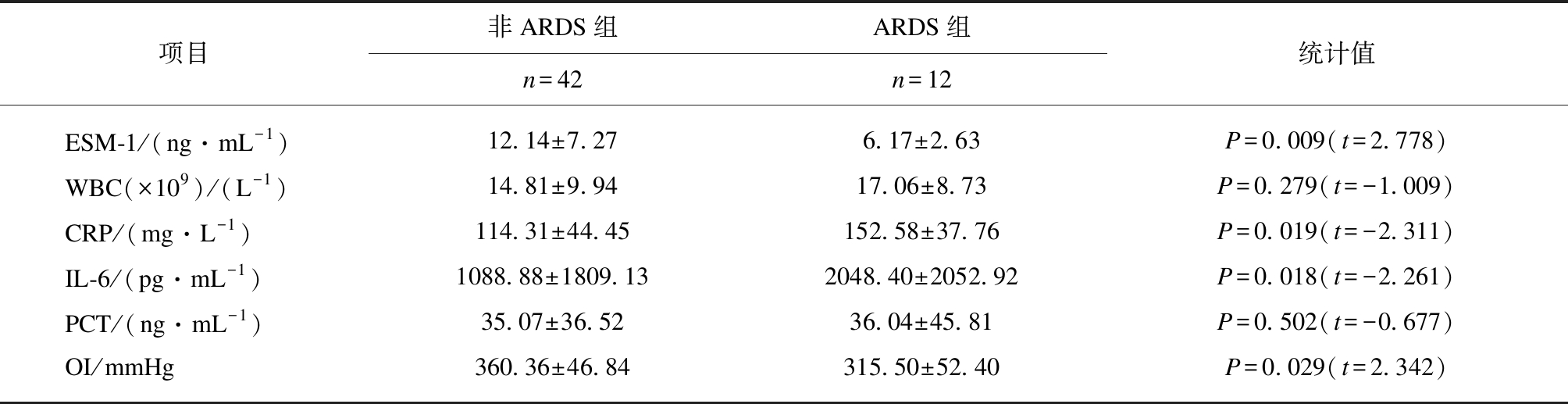
项目非ARDS组ARDS组n=42n=12统计值ESM-1/(ng·mL-1)12.14±7.276.17±2.63P=0.009(t=2.778)WBC(×109)/(L-1)14.81±9.9417.06±8.73P=0.279(t=-1.009)CRP/(mg·L-1)114.31±44.45152.58±37.76P=0.019(t=-2.311)IL-6/(pg·mL-1)1088.88±1809.132048.40±2052.92P=0.018(t=-2.261)PCT/(ng·mL-1)35.07±36.5236.04±45.81P=0.502(t=-0.677)OI/mmHg360.36±46.84315.50±52.40P=0.029(t=2.342)
1mmHg=0.133kPa
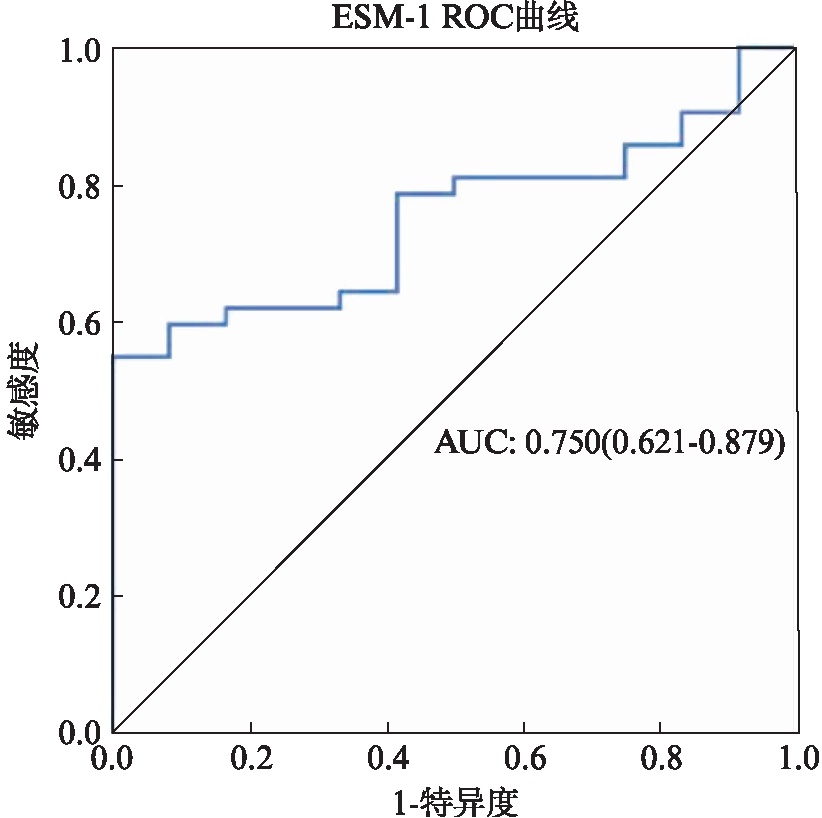
图3 血浆ESM-1的ROC曲线
Fig.3 The ROC of plasma ESM-1
CRP、IL-6构建ROC曲线对预测价值进行评估。CRP的AUC为0.736(95%CI: 0.571,0.901;P=0.018),IL-6的AUC为0.736(95%CI: 0.585,0.886;P=0.018)。CRP和IL-6对ARDS的预测价值略次于ESM-1,两者预测价值相当。CRP对ARDS发生预测的cut-off为117.93mg/L,其灵敏度为0.909,预测患者发生ARDS的准确率较高,漏诊率极少,特异度为0.500,假阳性率约为0.500,误诊的可能性较大,综合各项指标认为,预测价值一般。IL-6对ARDS发生预测的cut-off为257.80pg/mL,其灵敏度为0.909,预测患者发生ARDS的准确率较高,漏诊率极少,特异度为0.605,假阳性率约为0.395,有误诊的可能,综合各项指标认为,预测价值较好。CRP>117.93 mg/L,IL-6>257.80 pg/mL,可预测脓毒症ARDS的发生,见图4。
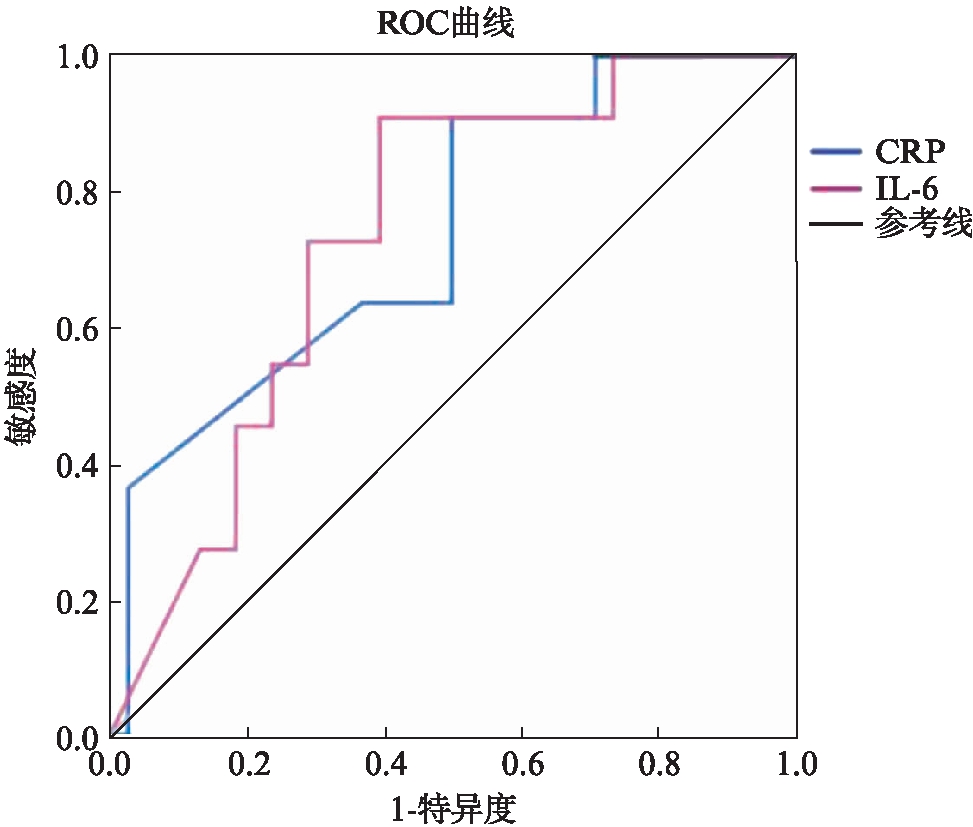
图4 CRP、IL-6的ROC曲线
Fig.4 The ROC of CRP and IL-6
3 讨 论
在脓毒症患者中,不仅ARDS的发病率高,而且并发ARDS后,患者病死率明显增高。本研究发现,脓毒症性ARDS的发病率为35.21%,文献报道为25%~50%。发生ARDS的患者病死率高达58.1%,而非ARDS组的病死率为23.8%(P=0.027),与文献报道[8-10]接近。因此,早期预测脓毒症性ARDS的发生,预防ARDS的发生,是非常重要的。
Scherpereel等[11]观察到入住ICU的脓毒症患者血浆ESM-1水平与脓毒症的严重程度相关,然而,这些结果并没有说明血浆ESM-1水平与器官衰竭的进一步发展之间的关系。Palud等[12]在一项小样本的研究中首次报道了严重脓毒症患者血液中ESM-1水平较低的患者在第3天内发生了呼吸衰竭,而血液中ESM-1水平较高的的患者没有发生呼吸衰竭。
本研究发现,脓毒症72h内发展成为ARDS的患者第1天的血浆ESM-1水平为(6.17±2.63) ng/mL,明显低于在72h内未发展成ARDS的患者[(12.14±7.27) ng/mL],2组比较,差异有统计学意义(P=0.009)。但是在第2、3、7天,ARDS组的血浆ESM-1水平明显高于非ARDS组。本实验数据支持脓毒症患者入组时低水平的血浆ESM-1可能诱导ARDS的发生,但一旦发生ARDS,血浆ESM-1则明显增高,高于未发生ARDS的患者。
为何会出现以上现象,目前普遍认为[13-15]内皮细胞分泌的ESM-1通过减弱白细胞对内皮细胞的黏附作用,保护肺损伤的发生。ESM-1可连接到LFA-1,作为LFA-1的配体,阻止LFA-1与ICAM-1的相互作用。ESM-1可抑制炎症过程发生的LFA-1/ICAM-1依赖的白细胞黏附,从而减轻内皮细胞损伤[15]。De Freitas等[16]提出了一种解释,通过中性粒细胞组织蛋白酶G的蛋白水解作用,将ESM-1水解成相对分子质量为14000的特殊片段(简称P14)。在体外实验发现,P14具有抑制ESM-1与LFA-1相结合的作用,参与全身炎症反应过程。因此,严重脓毒症急性期内皮细胞水平不足可导致白细胞过度聚集进入肺内,导致ARDS的发生。一旦出现ARDS,肺血管内皮损伤要比不出现ARDS的患者严重,所以发生ARDS后,血浆ESM-1则明显高于未发生ARDS的患者。
OI是ARDS诊断以及区分ARDS严重程度的重要依据。本课题组研究血浆ESM-1浓度与OI的相关性,发现血浆ESM-1浓度与OI两者的相关性好。ESM-1通过减弱白细胞对内皮细胞的黏附作用,保护肺损伤的发生,脓毒症患者入组时的血浆ESM-1浓度与患者第2天的OI呈正相关,考虑与入组时血浆ESM-1浓度越低越容易发生ARDS有关,发生ARDS后,内皮损伤启动,ESM-1快速上升,OI明显下降。本研究发现第2天ESM-1与第2、3、7天的OI均呈负相关;第3天的ESM-1与第3天、第7天OI均呈负相关,第7天ESM-1与第7天OI呈负相关,说明血浆ESM-1的浓度越高,患者的OI越低,ARDS越严重。
同时,本研究分析了入组时炎性生物标记物: WBC计数、CRP、IL-6、PCT水平,在发生ARDS组,患者的CRP、IL-6水平均高于非ARDS组(P=0.019、P=0.018),WBC计数与PCT 2组间差异无统计学意义。
通过二元Logostic回归分析得出,第1天的ESM-1 与CRP、IL-6为脓毒症患者预测ARDS发生的独立危险因素。使用ROC曲线分析方法评估第1天ESM-1对ARDS的预测价值,结果显示血浆ESM-1在预测72h 内ARDS的发生方面,有较高的预测价值(AUC 0.75),优于CRP(AUC 0.736)、IL-6(AUC 0.736),与文献报道[13]相似。血浆ESM-1水平5.865ng/mL 为预测ARDS发生的风险cut-off值,其灵敏度为0.786,预测患者发生ARDS的准确率较高,漏诊率较少,特异度为0.583,但是假阳性率约为0.417,有误诊的可能性,总体具有较好的诊断价值,血浆ESM-1水平小于5.865ng/mL可能会导致ARDS发生。
这些结果支持最初的假设: 脓毒症入组时低水平的血浆ESM-1浓度可能帮助早期识别72h内发生ARDS的患者。这些数据为进一步探索结合血浆ESM-1测定预测脓毒症患者ARDS发生开辟了道路。如果这一结果以后得到大样本的数据支持,则血浆ESM-1浓度的测定可以单独或与其他标志物联合预测ARDS发生,那么临床医师可以早期启动ARDS的预防治疗,从而改善这些可能发生ARDS的脓毒症患者的预后。
但本研究具有一定局限性: 在剔除了入组时已存在ARDS的13例患者后,仅有12例患者用作预测脓毒症患者在 72h 内ARDS的发生。因此,拟进一步扩大样本量进行研究,以加强这一结果可靠性。
[1] MANN-SALINAS E A, BAUN M M, MEININGER J C, et al. Novel predictors of Sepsis outperform the American Burn Association Sepsis criteria in the burn intensive care unit patient[J]. J Burn Care Res, 2013,34(1): 31-43.
[2] ORBAN C. Diagnostic criteria for Sepsis in burn patients[J]. Chirurgia(Bucur), 2012,107(6): 697-700.
[3] RUBENFELD G D, CALDWELL E, PEABODY E, et al. Incidence and outcomes of acute lung injury[J]. N Engl J Med, 2005,353(16): 1685-1693.
[4] COX L A, VAN EIJK L T, RAMAKERS B P, et al. Inflammation-induced increases in plasma endocan levels are associated with endothelial dysfunction in humans in vivo[J]. Shock, 2015,43(4): 322-326.
[5] LEE W, KU S K, KIM S W, et al. Endocan elicits severe vascular inflammatory responses in vitro and in vivo[J]. J Cell Physiol, 2014,229(5): 620-630.
[6] HSIAO S Y, KUNG C T, TSAI N W, et al. Concentration and value of endocan on outcome in adult patients after severe Sepsis[J]. Clin Chim Acta, 2018,483: 275-280.
[7] MIHAJLOVIC D M, LENDAK D F, BRKIC S V, et al. Endocan is useful biomarker of survival and severity in sepsis[J]. Microvasc Res, 2014,93: 92-97.
[8] KUMAR G, KUMAR N, TANEJA A, et al. Nationwide trends of severe sepsis in the 21st century(2000—2007)[J]. Chest, 2011,140(5): 1223-1231.
[9] 李嘉,宋艳丽,吴先正,等.心肌标记物在脓毒症患者预后评估中的意义[J].同济大学学报(医学版),2019,40(3): 338-342,348.
[10] FLEISCHMANN C, SCHERAG A, ADHIKARI N K, et al. Assessment of global incidence and mortality of hospital-treated Sepsis current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272.
[11] SCHERPEREEL A, DEPONTIEU F, GRIGORIU B, et al. Endocan, a new endothelial marker in human sepsis[J]. Crit Care Med, 2006,34(2): 532-537.
[12] PALUD A, PARMENTIER-DECRUCQ E, PASTRE J, et al. Evaluation of endothelial biomarkers as predictors of organ failures in septic shock patients[J]. Cytokine, 2015,73(2): 213-218.
[13] DE FREITAS CAIRES N, GAUDET A, PORTIER L, et al. Endocan, Sepsis pneumonia, and acute respiratory distress syndrome[J]. Crit Care, 2018,22: 280.
[14] LASSALLE P, MOLET S, JANIN A, et al. ESM-1 is a novel human endothelial cell-specific molecule expressed in lung and regulated by cytokines[J]. J Biol Chem, 1996,271(34): 20458-20464.
[15] BÉCHARD D, SCHERPEREEL A, HAMMAD H, et al. Human endothelial-cell specific molecule-1 binds directly to the integrin CD11a/CD18(LFA-1) and blocks binding to intercellular adhesion molecule-1[J]. J Immunol, 2001,167(6): 3099-3106.
[16] DE FREITAS CAIRES N, LEGENDRE B, PARMENTIER E, et al. Identification of a 14 kDa endocan fragment generated by cathepsin G, a novel circulating biomarker in patients with sepsis[J]. J Pharm Biomed Anal, 2013,78/79: 45-51.