卵巢癌是妇科致命恶性肿瘤,世界范围内每年超24万妇女被确诊,在发达国家和发展中国家,其发病率分别为9.4/10万和5.0/10万[1-2]。卵巢癌症状非特异性以及缺乏可靠的筛查手段,使得其难以被早期发现,绝大多数女性确诊时已处于Ⅲ~Ⅳ期,5年相对生存率仅为25%[3-4]。肿瘤转移是包括卵巢癌在内的多数癌症死亡的主要原因,大多数卵巢癌患者在确诊时已有了远处转移。与大多数通过淋巴或血流播散的肿瘤不同,卵巢癌主要通过腹膜腔种植转移。卵巢癌恶性腹水中已明确检测到单个肿瘤细胞和多细胞聚集物,而原发肿瘤细胞脱落的基础机制仍不清楚。有学者分析认为,基质/膜蛋白的降解是癌细胞脱落、局部侵袭的必要步骤[5]。中性粒细胞弹性蛋白酶(neutrophil elastase,NE)和金属基质蛋白酶9(matrix metalloproteinase-9,MMP-9)主要来源于肿瘤相关中性粒细胞,是近年各类肿瘤研究较热门的酶类。NE即丝氨酸弹性蛋白,降解几乎所有细胞外基质蛋白和重要血浆蛋白,与多种实体肿瘤(肺癌、乳腺癌)发生、发展密切相关[6]。MMP-9又称为明胶酶B、Ⅳ型胶原酶,主要降解具有独特螺旋结构的Ⅳ型胶原、层黏连蛋白等基膜成分和细胞外基质,在炎症的恶化过程和肿瘤新生血管形成中起重要作用[7]。荟萃分析[8]证实,MMP-9与卵巢癌分期和不良预后相关。然而,NE、MMP-9作为主体调控卵巢癌细胞早期脱落机制尚不明确。本实验从细胞形态学水平着手,直接观察中性粒细胞相关蛋白酶处理后,OVCAR3细胞形态变化,进一步分子生物学角度剖析蛋白酶对细胞跨膜功能蛋白表达的影响,对癌细胞间黏附丧失、早期脱落的机制进行初步探究,为卵巢癌的诊断和治疗提供新思路。
1 材料与方法
1.1 细胞来源及主要试剂
人卵巢癌OVCAR3细胞购自中国科学院上海生命科学研究院细胞资源中心。胎牛血清及0.25%胰酶购自美国Gibco公司,DMEM培养基购自美国Hyclone公司,青链霉素混合液(100×)购自美国Solarbio公司,NE、MMP9均购自美国Abcam公司,E-cadherin、MUC-16、GAPDH抗体均购自美国CST公司,4′,6-二脒基-2-苯基吲哚(DAPI)、Alexa Fluor 488标记山羊抗小鼠IgG(H+L)、羊抗兔HRP标记二抗均购自上海碧云天生物技术公司,BCA蛋白定量试剂盒购自美国Thermo公司,甲醛、异丙醇、无水乙醇及氯仿购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 细胞培养 人卵巢癌OVCAR3细胞培养于含10%胎牛血清、1%双抗(青链霉素混合液)的DMEM高糖培养液,置于37℃、5%CO2培养箱中培养。细胞密度达到70%~80%,按1∶3比例进行传代。
1.2.2 细胞处理 选择处于对数生长期,生长状态良好的OVCAR3细胞,0.25%胰酶消化后,显微镜下计数,将细胞以2×105/孔铺入24孔板中,37℃培养过夜。隔天细胞密度为90%左右开始实验。实验共设置4组。空白对照组: HBSS缓冲液;0.125%胰酶处理组;NE处理组: 浓度梯度2.5μg/mL、5μg/mL、10μg/mL;MMP-9处理组: 浓度梯度1.0μg/mL、2.0μg/mL、4.0μg/mL。每组设3个复孔。处理后4℃环境中[9]放置,0、12、24h,在光学显微镜下(100×)观察并拍照,观察细胞形态并筛选合适酶浓度,进行后续实验。本研究最终筛选条件: 贴壁细胞由多角形呈细长/纺锤状,细胞间逐渐分离、扩散形态,选择出现上述变化的最低浓度: NE浓度为2.5μg/mL,MMP-9浓度为2.0μg/mL。
1.2.3 Western印迹法检测蛋白表达 经酶处理24h 的细胞,小心吸取细胞培养液,无菌管收集待测。PBS冲洗细胞2~3次,加入RIPA裂解液,4℃充分裂解细胞,将细胞刮入1.5mL EP管中,离心半径8cm,12000r/min,离心10min,吸取上清液,BCA法测定蛋白浓度。蛋白按25μg/孔上样,进行8% SDS-PAGE电泳后转移至PVDF膜,封闭。按抗体说明书加入稀释一抗(E-cadherin 1∶1000;MUC16 1∶1000;GAPDH 1∶1000)4℃孵育过夜,TBST缓冲液洗涤后加稀释二抗(山羊抗兔1∶1000),室温封闭1h,底物化学发光试剂(chemiluminescence-substrate,ECL)法曝光显影,采用Tanon-5200成像系统测定条带灰度值。记录灰度值,计算目的蛋白与内参蛋白的灰度比值。试验重复3次。
1.2.4 免疫荧光测定 细胞爬片用4%甲醛固定30min。1%BSA封闭1h,滴加稀释一抗(E-cadherin抗体、MUC16抗体),湿盒孵育,4℃孵育过夜。滴加合适比例稀释的荧光二抗[Alexa Fluor 488标记山羊抗小鼠IgG(H+L)],湿盒孵育,室温下放置1h。防淬灭封片剂与DAPI 1∶500稀释封片,-20℃ 冰箱保存,荧光显微镜拍片。
1.2.5 ELISA检测 无菌管收集细胞培养液,离心半径8cm,2000~3000r/min,离心20min。ELISA试剂盒检测细胞培养上清液CA125含量。酶标仪检测各孔吸光度(A450)。
1.3 统计学处理
每项实验重复3次以上。数据采用Graphpad Prism 7进行统计学分析。结果用![]() 表示;2组间差异比较采用Student’s t检验,P<0.05为差异有统计学意义。
表示;2组间差异比较采用Student’s t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 光学显微镜观察细胞的生长状态、形态学变化
光学显微镜下的见空白对照组OVCAR3细胞呈鹅卵石样单层、圆形边界,细胞与相邻细胞间紧密黏附,细胞折光性好。0.125%胰酶处理后细胞明显收缩、呈圆形,24h后细胞未漂浮。经NE处理后,细胞形态发生剧烈变化,呈细长、纺锤状,细胞间逐渐分离、扩散,且具有时间、浓度依赖性,随着时间延长,浓度递增,细胞形态变化更剧烈,细胞间分离更明显。当NE浓度递增至10.0μg/mL时,光学显微镜下见大量细胞漂浮、凝聚。MMP-9处理后细胞形态学变化同NE,三个递增浓度下均未见大量细胞漂浮、凝聚,见图1。
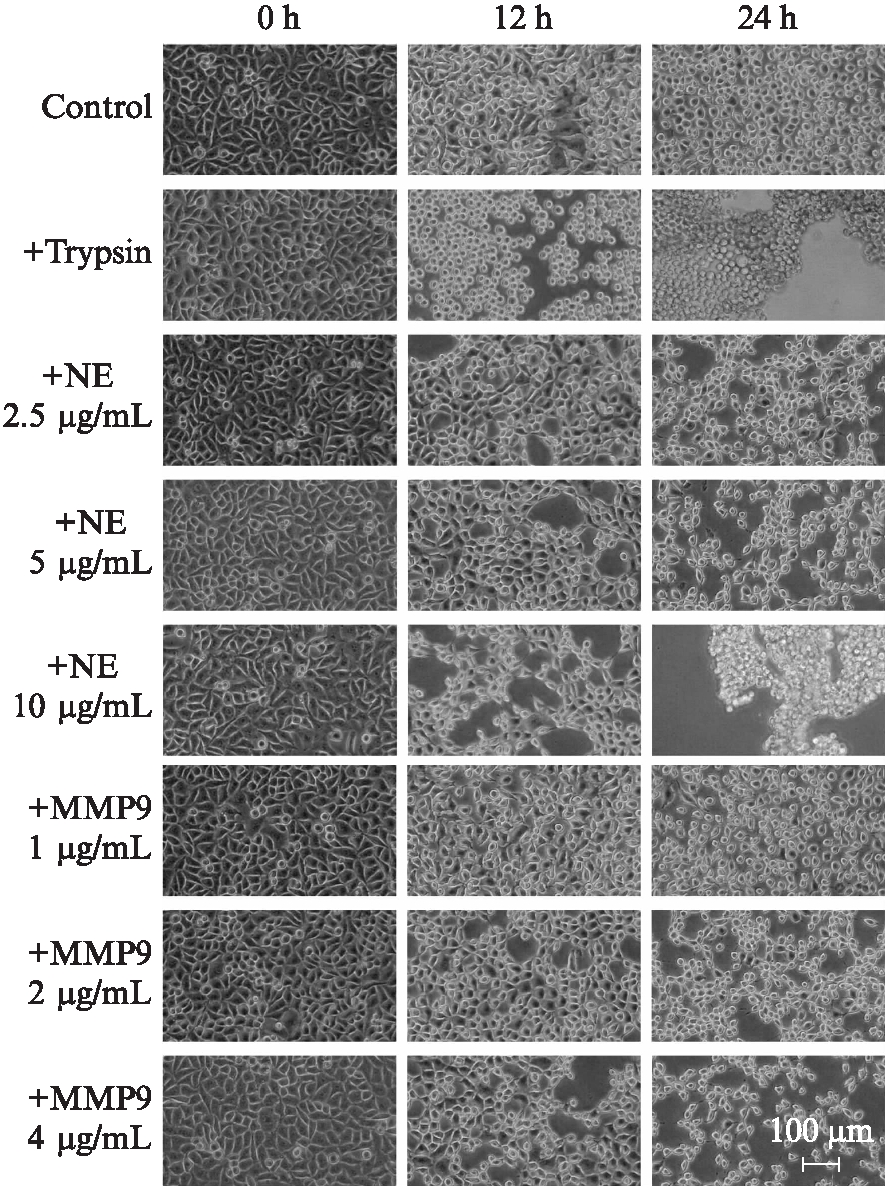
图1 光学显微镜下NE和MMP-9处理后OVCAR3细胞形态学变化
Fig.1 Morphological changes of OVCAR3 cells after NE and MMP-9 treatment
2.2 膜表面E-cadherin、MUC16表达变化及定位
Western印迹法结果显示,与对照组(0.679±0.040)相比,NE、MMP9处理24h后E-cadherin表达显著下降,相对表达量分别0.492±0.009、0.396±0.002,差异有统计学意义(P<0.05),而0.125%胰酶处理组(0.680±0.005)与对照组之间表达差异无统计学意义。NE、MMP9处理24h后MUC16蛋白表达下降,相对表达量分别为0.670±0.027、0.580±0.027 8,与对照组0.781±0.026相比,差异有统计学意义(P<0.05),胰酶组(0.728±0.023)与对照组之间表达差异无统计学意义,见图2。免疫荧光检验结果如图3所示,E-cadherin、MUC16定位于细胞膜,NE、MMP9处理后蛋白表达明显下降。
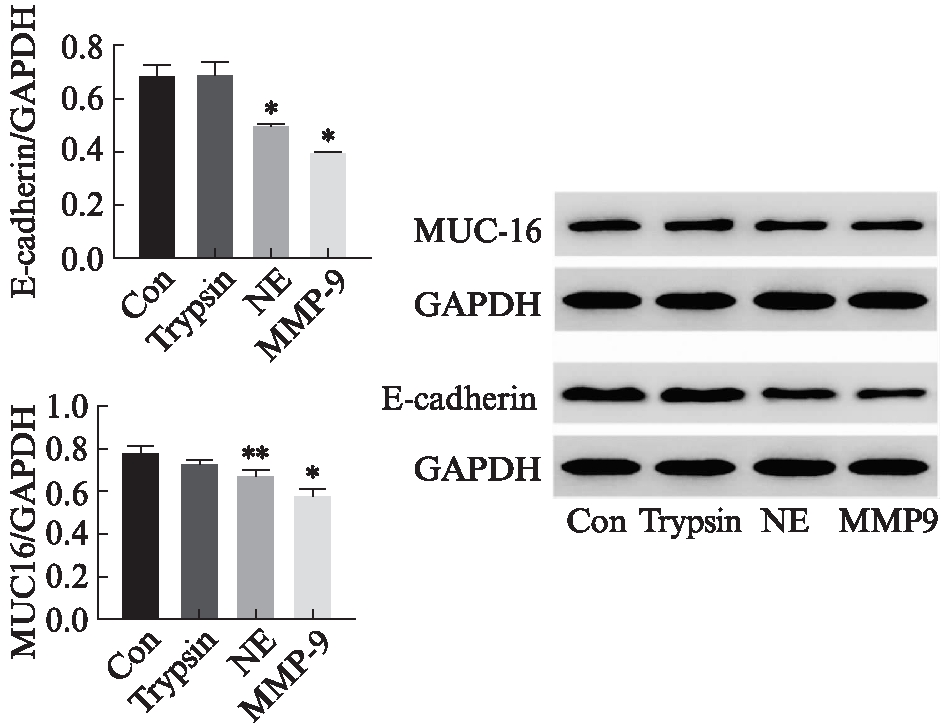
图2 不同处理OVCAR3细胞中E-cadherin、
MUC16表达情况
Fig.2 Expression of E-cadherin and MUC16 in OVCAR3 cells treated with different methods
*P<0.05,**P<0.01
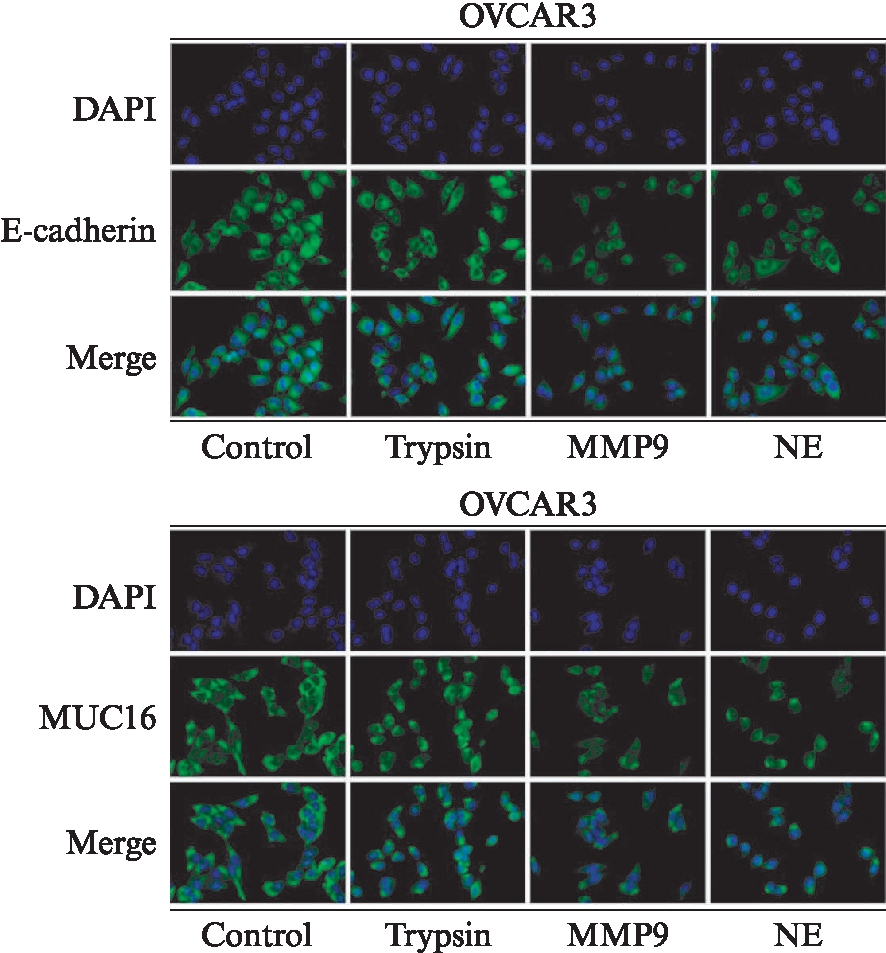
图3 OVCAR3细胞中E-cadherin、MUC16定位及表达情况
Fig.3 Localization and expression of E-cadherin and MUC16 in OVCAR3 cells
2.3 上清液脱落蛋白CA125变化
经MMP-9处理24h后,上清液中脱落蛋白CA125明显增高[(272.457±9.377) U/mL],与空的对照组[(243.134±7.026) U/mL]相比,差异有统计学意义(P<0.05),NE组[(268.181±9.604) U/mL]、0.125%胰酶处理组[(253.308±6.670) U/mL]培养基CA125与对照组之间表达差异无统计学意义。
3 讨 论
卵巢癌是世界范围内女性癌症死亡的第七大原因,每年全世界仍有约10万名妇女死于该疾病,其确切发病机制仍未明[10]。目前临床上标准治疗多采用细胞减灭术,术后辅以铂类和紫杉醇化疗,50%~80%的 Ⅲ、Ⅳ期患者能获得完全临床缓解,但其中多数患者在18个月内因化疗耐药而复发[11]。鉴于卵巢癌转移早,病变范围广,从根本上探究卵巢癌细胞脱落、转移机制,从源头控制肿瘤进展,寻求新的治疗方式显得刻不容缓。
与其他上皮性恶性肿瘤不同,上皮性卵巢癌细胞有其特有的转移方式,癌细胞直接从原发肿瘤脱落进入腹膜腔并播散至腹膜腔内器官,即“种子-土壤”学说[12]。首先癌细胞从原发肿瘤直接扩展到腹腔内进行播散,在腹腔内它们以单个细胞和多细胞聚集物的形式随腹腔液流存活和移动,随后黏附到腹膜组织,锚定在间皮下层基质中,并增殖形成继发性病变。有研究认为,在卵巢上皮性肿瘤转移潜能形成过程中,首要事件就是经历EMT[13]。EMT即上皮细胞失去细胞极性和细胞间黏附,上皮细胞标志物(E-cadherin、黏连蛋白等)降低,在向间叶细胞转化过程中获得迁移和侵袭能力。Takai等[14]对174例原发性卵巢癌和34例转移性卵巢癌进行组织芯片检测分析发现,EMT相关蛋白的表达与临床病理特征、预后密切相关,在肿瘤腹膜播散者中EMT相关蛋白显著升高,且与无进展生存期、总生存率紧密相关。本实验应用NE、MMP9处理OVCAR3细胞,光学显微镜观察细胞,结果发现细胞形态产生明显变化,由平铺鹅卵石样呈细长/纺锤状,细胞与细胞间逐渐分离、扩散,且具有时间、浓度依赖性,随着时间延长,浓度递增,细胞形态变化更剧烈,这与典型EMT形态学变化一致。由此猜测,在这一过程中,蛋白酶NE和MMP-9诱导卵巢癌细胞发生EMT改变,同时将伴随相关膜蛋白改变。
E-cadherin是钙离子依赖的跨膜黏着糖蛋白,在正常卵巢上皮几乎不表达,而在交界性、恶性卵巢肿瘤及转移灶中稳定表达[15]。Rosso等[16]研究76例卵巢癌患者病理免疫组化结果提示,随着FIGO分期增加,细胞总体和膜E-cadherin表达均显著下降;而与原发肿瘤相比,E-cadherin在转移性卵巢肿瘤中的表达反而显著增加,20例进展期患者腹水中E-cadherin mRNA水平显著升高。上述结果提示,E-cadherin 的调节可能是一个动态的过程,在早期上皮性卵巢癌细胞的脱落和迁移中下调表达,随后在转移部位的定植和浸润中又上调表达。本实验在明确细胞形态学变化后,通过Western印迹法和免疫荧光结果证实,NE、MMP9处理24h后细胞膜E-cadherin表达显著下降,而对照组无上述变化。因此认为NE、MMP-9通过降解细胞膜上E-cadherin,诱导细胞接触和极性的丧失,细胞向侵袭性表型转化。
CA125由MUC16基因编码,是卵巢癌重要血清肿瘤学标志,广泛用于卵巢癌早期诊断、监测治疗效果以及评价复发,MUC16在卵巢癌细胞膜上过表达并被酶解脱落,释放CA125入腹水和血液中,其脱落、水解机制尚未明确[17]。MUC16属于黏蛋白家族成员,是Ⅰ型跨膜高分子糖蛋白,相对分子质量>2M,由外向内通常分为3个结构域: 细胞外N-端结构域、串联重复段结构域(包含CA125区域)和包含胞质尾端的C-端结构域[18]。串联重复段结构域穿插着约56个含有海胆精子蛋白、肠激酶和聚集蛋白的(sea urchin sperm, enterokinase and agrin domains,SEA)结构域,据推测(未证实)蛋白水解可能通过裂解倒数第2个SEA结构域,使MUC16胞外段从细胞膜上脱落,产生循环CA125[19]。相反,Das等[20]则认为膜近端12个氨基酸是MUC16切割位点,MUC16切割发生在高尔基体/高尔基体后室中,并依赖酸性pH值。MUC16与卵巢癌的上皮间质转化相关,促进卵巢癌侵袭、转移。有研究发现敲低CA125/MUC16基因诱导NIH: OVCAR3细胞发生EMT改变,伴随上皮标志物(E-cadherin、细胞角蛋白18)降低及间充质标志物(N-cadherin、波形蛋白)表达增加,细胞间连接破坏,细胞运动性及迁移性增加[21]。Coelho等[22]则发现MUC16胞外段与腹膜表面间皮素特异性结合,介导同型和异型细胞间黏着,促进卵巢癌细胞与腹膜的黏着。本研究推测,中性粒细胞相关蛋白酶在MUC16水解中起一定作用,结果显示,体外MMP-9处理细胞24h后,培养基上清液中脱落蛋白CA125含量明显增高,进一步免疫荧光确认细胞膜MUC16蛋白表达降低,说明MMP-9可以降解细胞膜上MUC16蛋白,使MUC16胞外段脱落,而具体水解位点有待进一步实验证实。本研究结果显示,NE不能水解MUC16,这与Das等[20]研究结果一致,即MMP-7和NE不参与水解MUC16。
鉴于蛋白酶在肿瘤中的作用日益受到重视,有部分学者已经着手设计蛋白酶靶向药物以期防治肿瘤。西维来司钠是人工合成NE抑制剂,临床上广泛用于治疗全身炎症反应综合症和急性肺损伤,近期裸鼠肺癌胸腔移植模型证实西维来司钠也能抑制小鼠肺肿瘤生长、转移[23]。Lee等[24]研究发现安卓奎诺尔通过抑制MMP-9活性,削减乳腺癌细胞增殖、转移、侵袭能力。安卓奎诺尔可能通过ERK/核转录因子激活蛋白1/MMP-9或蛋白激酶B/核因子κB/MMP-9信号通路实现上述效应。尽管大量体外细胞实验证实蛋白酶抑制剂在肿瘤中的重要作用,但Ⅲ期临床试验未能证明晚期癌症患者能够从应用蛋白酶抑制剂中获益,而且接受蛋白酶抑制剂联合化疗的患者比单纯化疗患者预后更差,这可能与蛋白酶复杂网络系统,酶与酶相互作用有关。
综上,本文以卵巢癌OVCAR3细胞作为研究对象,采用NE、MMP9分别处理细胞,光镜观察细胞形态学变化,Western印迹法、ELASA检测膜蛋白变化,通过体外细胞实验验证NE、MMP-9对细胞膜E-cadherin、MUC16作用,解释体内卵巢癌细胞之间黏附丧失、脱落的机制,为相关蛋白酶靶向药物的设计与临床应用提供一定理论基础。当然,本实验仍有不足之处,仅以细胞形态学变化为基础探讨细胞脱落机制,未能进一步阐述细胞脱落后转移、侵袭等相关问题。今后可以建立体外卵巢癌3D类器官模型,进一步探讨功能学改变。此外,本研究对于MUC16具体水解位点、CA125产生具体机制未进一步说明,有待后续实验。
[1] REID B M, PERMUTH J B, SELLERS T A. Epidemiology of ovarian cancer: a review[J]. Cancer Biol Med, 2017,14(1): 9-32.
[2] TORRE L A, TRABERT B, DESANTIS C E, et al. Ovarian cancer statistics, 2018[J]. CA Cancer J Clin, 2018,68(4): 284-296.
[3] ROJAS V, HIRSHFIELD K M, GANESAN S, et al. Molecular characterization of epithelial ovarian cancer: implications for diagnosis and treatment[J]. Int J Mol Sci, 2016,17(12): E2113.
[4] LIU Y B, CHEN S F, ZHENG C Y, et al. The prognostic value of the preoperative c-reactive protein/albumin ratio in ovarian cancer[J]. BMC Cancer, 2017,17(1): 285.
[5] TAN D S, AGARWAL R, KAYE S B. Mechanisms of transcoelomic metastasis in ovarian cancer[J]. Lancet Oncol, 2006,7(11): 925-934.
[6] KRISTENSEN J H, KARSDAL M A, SAND J M, et al. Serological assessment of neutrophil elastase activity on elastin during lung ECM remodeling[J]. BMC Pulm Med, 2015,15: 53.
[7] GRÜNWALD B, VANDOOREN J, LOCATELLI E, et al. Matrix metalloproteinase-9(MMP-9) as an activator of nanosystems for targeted drug delivery in pancreatic cancer[J]. J Control Release, 2016,239: 39-48.
[8] LI L N, ZHOU X, GU Y, et al. Prognostic value of MMP-9 in ovarian cancer: a meta-analysis[J]. Asian Pac J Cancer Prev, 2013,14(7): 4107-4113.
[9] LI D, PENG S Y, ZHANG Z W, et al. Complete disassociation of adult pancreas into viable single cells through cold trypsin-EDTA digestion[J]. J Zhejiang Univ Sci B, 2013,14(7): 596-603.
[10] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2): 115-132.
[11] SAED G M, DIAMOND M P, FLETCHER N M. Updates of the role of oxidative stress in the pathogenesis of ovarian cancer[J]. Gynecol Oncol, 2017,145(3): 595-602.
[12] GRIGORE A D, JOLLY M K, JIA D Y, et al. Tumor budding: the name is EMT. partial EMT[J]. J Clin Med, 2016,5(5): E51.
[13] AMANKWAH E K, LIN H Y, TYRER J P, et al. Epithelial-mesenchymal transition(EMT) gene variants and epithelial ovarian cancer(EOC) risk[J]. Genet Epidemiol, 2015,39(8): 689-697.
[14] TAKAI M, TERAI Y, KAWAGUCHI H, et al. The EMT(epithelial-mesenchymal-transition)-related protein expression indicates the metastatic status and prognosis in patients with ovarian cancer[J]. J Ovarian Res, 2014,7: 76.
[15] TRILLSCH F, KUERTI S, EULENBURG C, et al. E-Cadherin fragments as potential mediators for peritoneal metastasis in advanced epithelial ovarian cancer[J]. Br J Cancer, 2016,114(2): 213-220.
[16] ROSSO M, MAJEM B, DEVIS L, et al. E-cadherin: A determinant molecule associated with ovarian cancer progression, dissemination and aggressiveness[J]. PLoS One, 2017,12(9): e0184439.
[17] SAVANT S S, SRIRAMKUMAR S, O’HAGAN H M. The role of inflammation and inflammatory mediators in the development, progression, metastasis, and chemoresistance of epithelial ovarian cancer[J]. Cancers(Basel), 2018,10(8): E251.
[18] DAS S, BATRA S K. Understanding the unique attributes of MUC16(CA125): potential implications in targeted therapy[J]. Cancer Res, 2015,75(22): 4669-4674.
[19] AITHAL A, JUNKER W M, KSHIRSAGAR P, et al. Development and characterization of carboxy-terminus specific monoclonal antibodies for understanding MUC16 cleavage in human ovarian cancer[J]. PLoS One, 2018,13(4): e0193907.
[20] DAS S, MAJHI P D, AL-MUGOTIR M H, et al. Membrane proximal ectodomain cleavage of MUC16 occurs in the acidifying Golgi/post-Golgi compartments[J]. Sci Rep, 2015,5: 9759.
[21] COMAMALA M, PINARD M, THÉRIAULT C, et al. Downregulation of cell surface CA125/MUC16 induces epithelial-to-mesenchymal transition and restores EGFR signalling in NIH: OVCAR3 ovarian carcinoma cells[J]. Br J Cancer, 2011,104(6): 989-999.
[22] COELHO R, MARCOS-SILVA L, RICARDO S, et al. Peritoneal dissemination of ovarian cancer: role of MUC16-mesothelin interaction and implications for treatment[J]. Expert Rev Anticancer Ther, 2018,18(2): 177-186.
[23] PU S L, WANG D X, LIU D S, et al. Effect of sivelestat sodium in patients with acute lung injury or acute respiratory distress syndrome: a meta-analysis of randomized controlled trials[J]. BMC Pulm Med, 2017,17(1): 148.
[24] LEE W T, LEE T H, CHENG C H, et al. Antroquinonol from Antrodia Camphorata suppresses breast tumor migration/invasion through inhibiting ERK-AP-1-and AKT-NF-κB-dependent MMP-9 and epithelial-mesenchymal transition expressions[J]. Food Chem Toxicol, 2015, 78: 33-41.