TMEFF2(transmembrane protein with EGF-like and two follistatin-like domains)基因是一种编码含有两个类卵泡抑制素区域和一个类表皮生长因子区域的Ⅰ型跨膜蛋白,已报道的TMEFF2是来自海马和中脑区域神经元的新型存活因子,并选择性表达于成人大脑和前列腺。近年来,许多体外和体内模型的研究[1-3]报道了TMEFF2的肿瘤抑制作用。TMEFF2在肿瘤组织中的表达明显低于正常组织且与肿瘤的发生发展相关,能减弱癌细胞的迁移[4-5],在抑制细胞增殖的过程中也观察到了TMEFF2基因表达的上调。Han等[6]发现,TMEFF2的肿瘤抑制作用是通过JAK-STAT-干扰素信号传导途径介导。然而亦有相反的研究报道[7]认为TMEFF2可发挥癌基因的作用,在肿瘤组织中的表达高于正常组织,其胞外区可引起ERK1/2的磷酸化,进而促进前列腺癌细胞生长[8]。由此可见,前期有关TMEFF2与细胞增殖的研究结果存在诸多不一致,其生物学功能还有待进一步阐明。本研究采用RNA干扰技术降低TMEFF2基因在HEK293细胞中的表达,并利用RNA-seq技术筛选差异表达基因,采用GO和KEGG富集分析对差异基因进行生物信息学分析;探索TMEFF2基因对HEK293细胞增殖、细胞周期、凋亡、迁移等生物学功能的影响。
1 材料与方法
1.1 试剂与仪器
HEK293细胞为同济大学医学院徐磊课题组存留,干扰载体H1-MCS-CMV-GFP-SV40-Neomycin(shRNA-TMEFF2)由上海吉凯基因科技有限公司合成;胰酶、青链霉素购自美国ThermoFisher公司;DMEM培养基、胎牛血清购自美国HyClone公司;转染用培养基;TRIzol试剂购自美国Invitrogen公司,引物合成、DEPC水购自上海生工生物技术有限公司;蛋白提取试剂盒、1×蛋白上样缓冲液购自中国碧云天生物技术公司;大剂量质粒提取试剂盒、SYBR Green Ⅰ、荧光定量RT-PCR试剂盒、cDNA反转录试剂盒购自中国天根生化科技有限公司;TMEFF2一抗、二抗,GAPDH一抗、二抗,ECL化学发光检测用试剂盒购自美国ProteinTech公司;氯仿、异丙醇、甲醇、乙醇购自中国国药集团化学试剂有限公司。流式细胞仪(FACS Verse)购自美国BD公司;荧光定量PCR仪(Step One Plus)购自美国赛默飞公司。
1.2 方法
1.2.1 细胞培养及转染 复苏HEK293细胞将其转入6孔板中,在37℃、5%CO2细胞培养箱中培养过夜。每1~2d传代1次;待细胞生长密度达50%以上时进行转染,2组分别进行以下处理: shRNA-TMEFF2组加入4μg质粒DNA、10μL质体转染剂Lip LipofectamineTM2000;NC-TMEFF2组加入4μg质粒DNA、10μL脂质LipofectamineTM2000作为对照,培养5h后再更换正常培养基继续培养24h,置于荧光显微镜下观察GFP的表达。
1.2.2 实时荧光定量PCR 分别提取转染后生长状态良好的实验组、对照组细胞的总RNA。按照反转录试剂盒操作说明将总RNA反转录为cDNA。以cDNA为模板进行荧光定量PCR,引物序列如下。TMEFF2基因上游引物: 5′-TTTGCCAGTTT-GGTGCAGA-3′,下游引物: 5′-GATTGAAGTTGG-TTTGAGAACAGTCA-3′;GAPDH上游引物: 5′-CGGGAAGCTTGTGATCAATGG-3′,下游引物: 5′-GGCAGTGATGGCATGGACTG-3′。反应条件如下: 95℃ 15min预变性,95℃ 10s,60℃ 30s共40个循环。以GAPDH的CT值作为参考基准,用2-ΔΔCt法计算mRNA的倍数变化。
1.2.3 蛋白质电泳 收集转染后生长状态良好的2组细胞,用蛋白抽提试剂盒提取实验组、对照组细胞的蛋白并进行定量计算,取30μL总蛋白进行SDS-PAGE凝胶电泳,转膜后以5%脱脂牛奶封闭1.5h,一抗(1∶300)4℃孵育过夜,二抗(1∶500)常温孵育2h,TBST洗膜3次,每次5min,曝光,以内参GAPDH为基准比较目的蛋白的表达量。使用Image J软件进行定量分析。
1.2.4 增殖实验 将HEK293细胞按每孔100μL(2.0×104个/mL)加入96孔板中培养,待细胞贴壁后进行转染。转染后0h、24h、48h、72h用CCK-8试剂盒检测细胞增殖情况。每次时间节点按照每孔加10μL CCK-8溶液于96孔板中,后放于培养箱中培养2h,用BIO-RAO酶标仪在450nm处测量吸光度(A450)值,连续测3d。
1.2.5 细胞周期实验 取转染后生长状态良好的细胞,用胰酶消化后收集细胞培养液到离心管内备用。1000×g离心5min,弃上清液,留细胞沉淀。加入1mL预冷的PBS,重悬细胞。再次离心沉淀细胞,弃上清液,分散细胞;加入1mL预冷的70%乙醇,吹打混匀,4℃固定12h。1000×g离心5min,弃上清液。PBS洗1遍,重悬细胞。再次离心沉淀细胞,弃上清液;每管细胞中加入0.5mL 碘化丙啶(PI)染色液,重悬细胞沉淀,37℃避光温浴30min,过滤细胞,用流式细胞仪检测细胞周期。
1.2.6 细胞凋亡实验 取转染后生长状态良好的细胞,胰酶消化加入细胞培养液,1000×g离心5min,弃上清液,收集细胞,PBS重悬细胞并计数;取5×104重悬的细胞,1000×g离心5min,弃上清液,加入195μL AnnexinV-FITC结合液重悬细胞,加入5μL AnnexinV-FITC,混匀,加入10μL PI染色液,混匀,室温避光孵育15min,随后冰浴,过滤细胞进行流式细胞仪检测。
1.2.7 侵袭实验 配制基质胶,加入到Transwell小室的上室,37℃细胞培养箱中干燥。在Transwell下室中加入500μL含10%FBS的培养基(趋化剂),将各组细胞用无血清培养基混匀后分别取200μL 加入上室中,置于培养箱中培养48h,用棉签擦去上室未穿过的细胞。由于本实验细胞表达绿色荧光蛋白,即48h后直接将下室置于显微镜下观察绿色荧光,每个样本随机选取3个视野,计数每个视野染色细胞的数量,取平均值即穿膜细胞数。
1.2.8 划痕实验 将细胞接种于6孔板,恒温细胞培养箱中培养,转染后备用。用10μL无菌枪头在6孔板底部,轻划一条力度和角度一致、粗细均匀的直线,分别于0、48h在显微镜下观察同一视野划痕的宽度并拍照。
1.2.9 转录组测序 抽提RNA样本,用Agilent 2100 bioanalyzer精确检测RNA完整性、用NanoPh-otometer spectrophotometer检测RNA 纯度、用Qubit 2.0 Fluorometer测RNA浓度;取1μg总RNA进行建库。建库NEBNext®ΜLtraTMRNA Library Prep Kit。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling,之后进行Illumina测序,并产生150bp配对末端读数。随后进行数据指控、序列比对到参考基因组、新转录本预测、基因表达水平定量、差异表达分析、差异基因富集分析(GO分析、KEGG分析)。
1.2.10 qPCR验证转录组测序 选取8个基因SIPA1L3、ADGRL1、RGCC、SPDYE2、CEACAM19、NECTIN4、BTG3和SDK2进行qPCR验证,采用2-ΔΔCt的方法进行相对定量,计算表达差异的倍数,引物序列见表1。
表1 引物序列
Tab.1 Primer sequences

基因名称引物序列(5′-3′)长度/bpSIPA1L3-FCGAGGAGGAGATGTACAACAAT22SIPA1L3-RGAAACCCCGTCTCTATCTTGAC20ADGRL1-FCGGACACACTGACTGAGTATG21ADGRL1-RATGGTAGTTGGCGGTATTGATG22RGCC-FTCAACCTTCTACCAGGCCACIC22RGCC-RGCAAGCAGGTAAACAAAGTCAG22SPDYE2-FTGAGCACCACAAGGACTTCAA-CAG24SPDYE2-RCTCCTCCTCCAACGACTCCTCAG23CEACAM19-FGAGGTCCAGGTAGCTGAAAAGA22CEACAM19-RGGATACAGCCGAGCACAAGA20NECTIN4-FTAGTCTCAAGGACAACAGTAGC22NECTIN4-RGTTTGATGCCTTCATCCTGATC20BTG3-FTGAAGTTAGATGGGCCAAAC20BTG3-RCCAACAGAGTTGATGCACAA20SDK2-FGGTCTACAGCAGTAAAGTCACC22SDK2-RGATGCTGTCTTGAAAGTTAGGC20
1.2.11 Western印迹法验证转录组测序 针对转录组测序结果中差异变化较大的3个基因ADGRL1、NECTIN4、RGCC进行蛋白水平验证,分析在TMEFF2基因低表达后这些基因的变化情况,进一步探究TMEFF2基因的功能。
1.3 统计学处理
作图用Graph Pad Prism 6.0软件、蛋白质印记呈像和细胞划痕宽度均采用Image J软件分析,计量资料用![]() 表示,数据使用SPSS 20.0分析,两独立样本t检验进行统计分析,P<0.05为差异有统计学意义。
表示,数据使用SPSS 20.0分析,两独立样本t检验进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 荧光显微镜观察、qPCR、Western印迹法检测目的基因TMEFF2在HEK293细胞中的表达
荧光显微镜下观察到GFP在HEK293细胞中表达,表明外源性TMEFF2基因成功转染进入HEK293细胞,见图1;qPCR显示实验组mRNA较对照组明显降低,见图2;Western印迹法检测到实验组在HEK293细胞中的表达量明显低于对照组,差异具有统计学意义(P<0.01),见图3,结合以上结果,表明TMEFF2基因低表达模型建立成功。
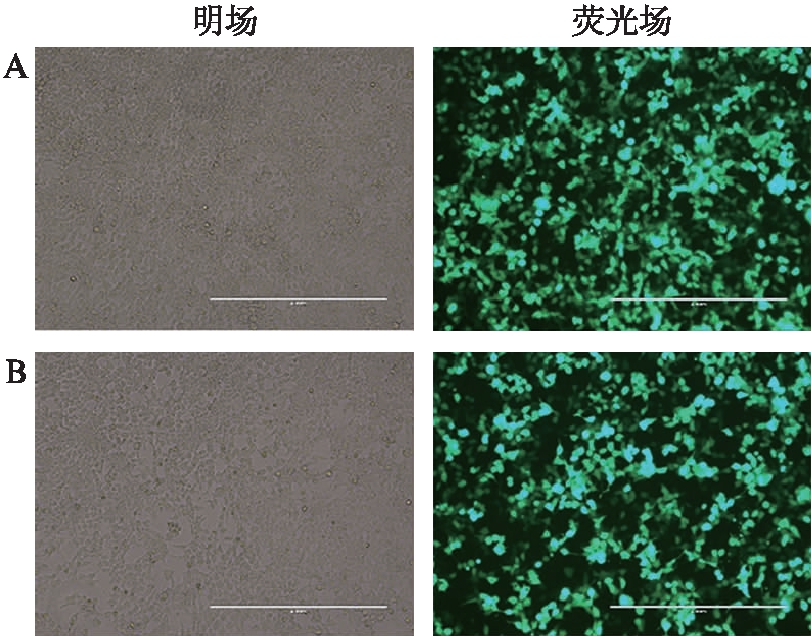
图1 GFP在HEK293细胞中的表达
Fig.1 Expression of GFP in HEK293 cells
A: 对照组;B: shRNA-TMEFF2组;标尺: 400μm
2.2 TMEFF2基因低表达抑制HEK293的增殖,且细胞阻滞在G1期
转染TMEFF2基因0h,2组之间细胞相对吸光值差异无统计学意义(P>0.05);转染24、48、72h 后,shRNA-TMEFF2细胞相对吸光值均明显低于NC-TMEFF2组,差异有统计学意义(P<0.05),表明TMEFF2基因低表达抑制了HEK293细胞的增殖,见图4。
流式细胞仪检测细胞周期,显示shRNA-TMEFF2组较NC-TMEFF2组处于G1期的细胞明显增多,S期的细胞明显降低,细胞呈G1期阻滞,差异有统计学意义(P<0.05),见图5。
2.3 细胞凋亡实验
用流式细胞仪收1.0×104个细胞,shRNA-TMEFF2组较NC-TMEFF2组Q3区间均出现早期凋亡细胞(即Annexin V-FITC染色阳性的细胞),差异具有统计学意义(P<0.05),说明TMEFF2基因低表达后可能影响HEK293细胞的凋亡,见图6。
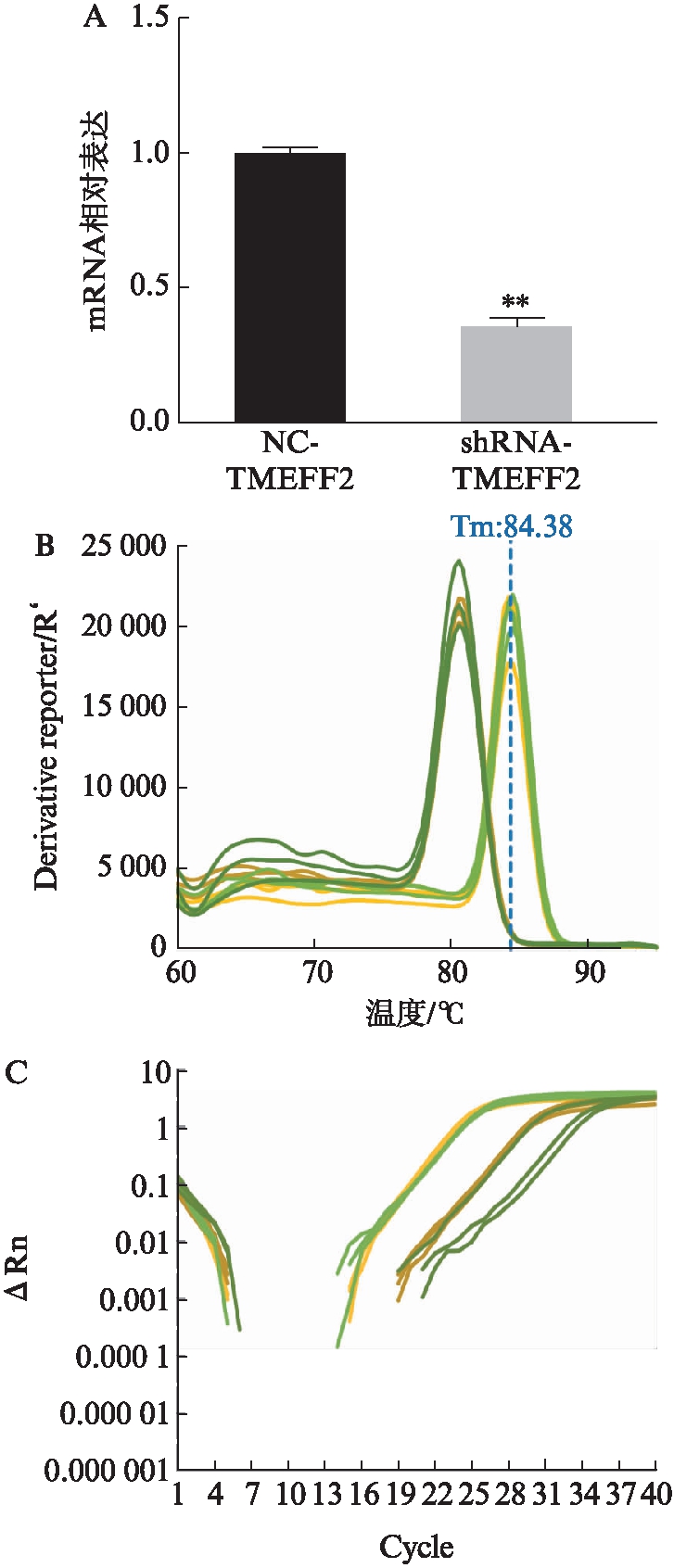
图2 qPCR检测HEK293细胞中TMEFF2的表达
Fig.2 qPCR detection of TMEFF2 expression in HEK293 cells
A: mRNA相对表达量;B: 熔解曲线;C:扩增曲线,与NC-TMEFF2组相比,**P<0.01
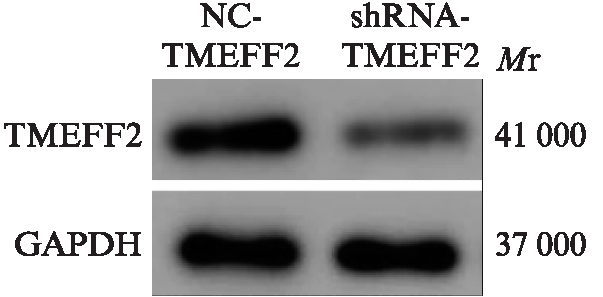
图3 Western印迹法检测HEK293细胞中
TMEFF2的表达
Fig.3 The expression of TMEFF2 in HEK293 cells identified by Western blotting
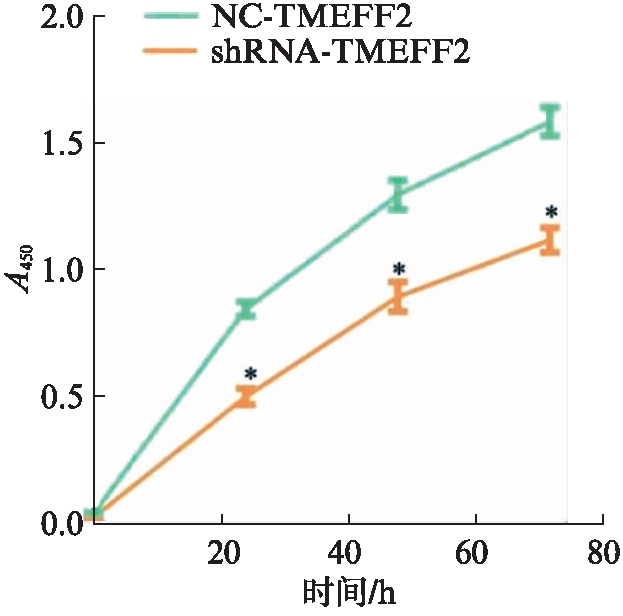
图4 HEK293细胞增殖实验
Fig.4 The proliferation assay of HEK293 cell
与NC-TMEFF2组相比,*P<0.05
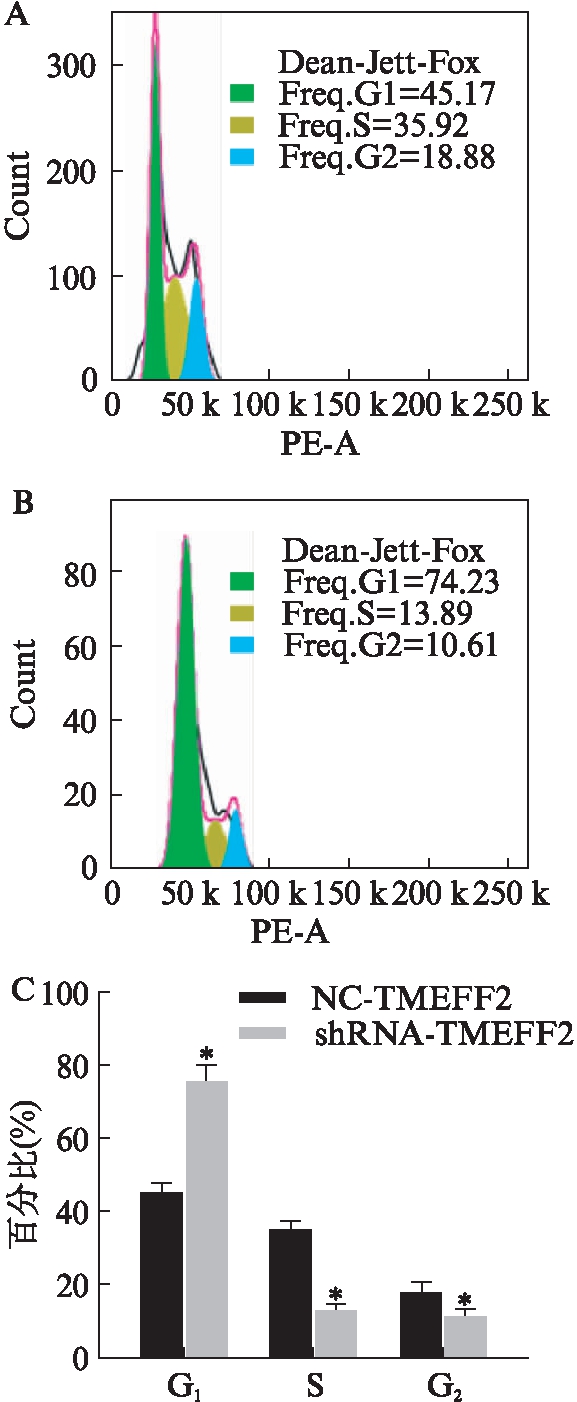
图5 2组HEK293细胞周期的变化情况
Fig.5 Cell cycle changes in 2 groups of HEK293
A: NC-TMEFF2组;B: shRNA-TMEFF2组;C: G1期、S期、G2期占比统计
2.4 细胞侵袭、迁移实验结果
与对照组相比实验组细胞处理48h后,穿过基膜的细胞数降低,差异有统计学意义(P<0.05),表明TMEFF2基因低表达后抑制了HEK293细胞的侵袭能力,见图7。
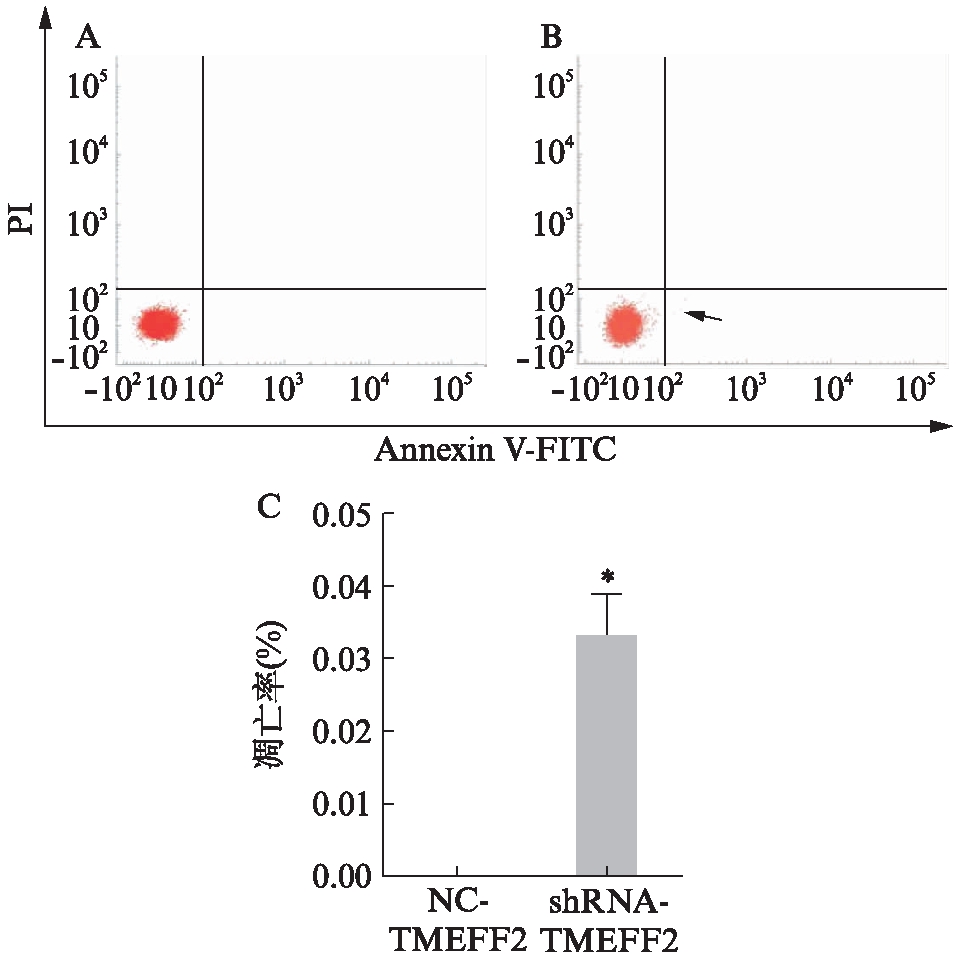
图6 HEK293细胞凋亡实验
Fig.6 HEK293 cell apoptosis experiment
A: NC-TMEFF2组;B: shRNA-TMEFF2组;C: 凋亡率统计图表;与NC-TMEFF2组相比,*P<0.05
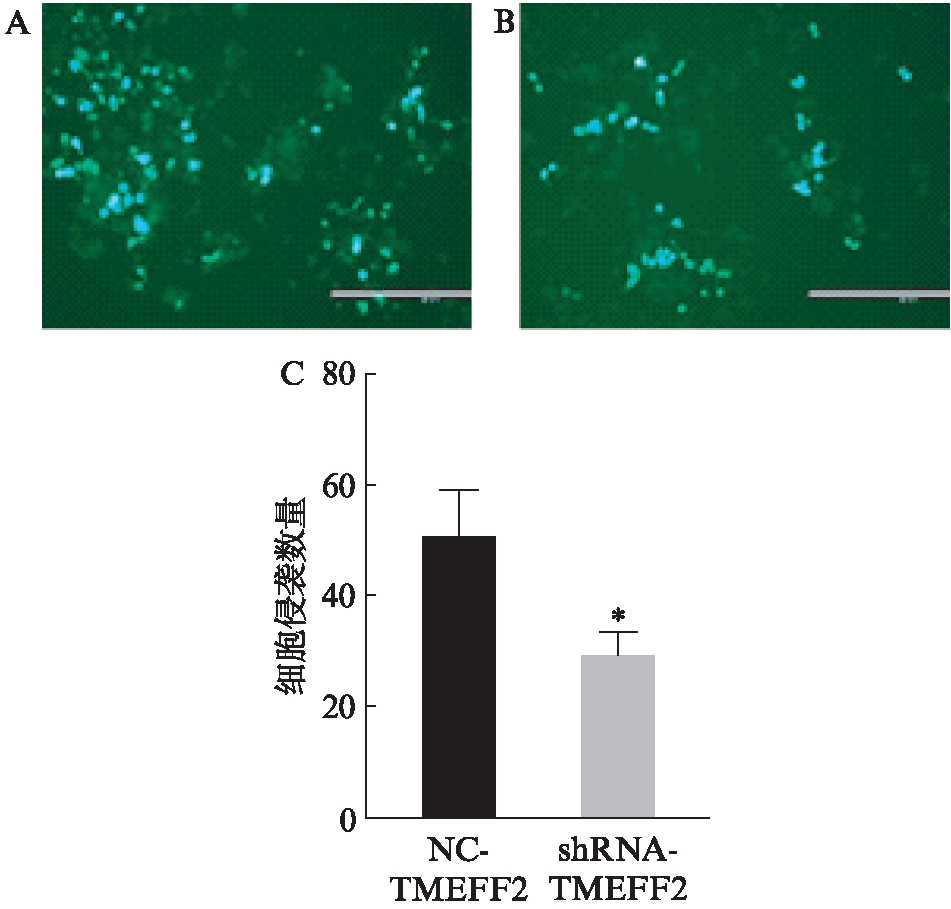
图7 Transwell法检测2组HEK293细胞侵袭能力
Fig.7 Transwell method to detect the invasive ability of 2 groups of HEK293 cells
A: NC-TMEFF2组,B: shRNA-TMEFF2组;C: 2组细胞侵袭数量统计图;与NC-TMEFF2组相比,*P<0.05;标尺=400μm
划痕实验显示,HEK293细胞在处理48h后,对照组和实验组宽度均变窄;与对照组相比,实验组细胞划痕愈合能力明显降低,差异有统计学意义(P<0.05),表明TMEFF2基因低表达后抑制了HEK293细胞的迁移能力,见图8。
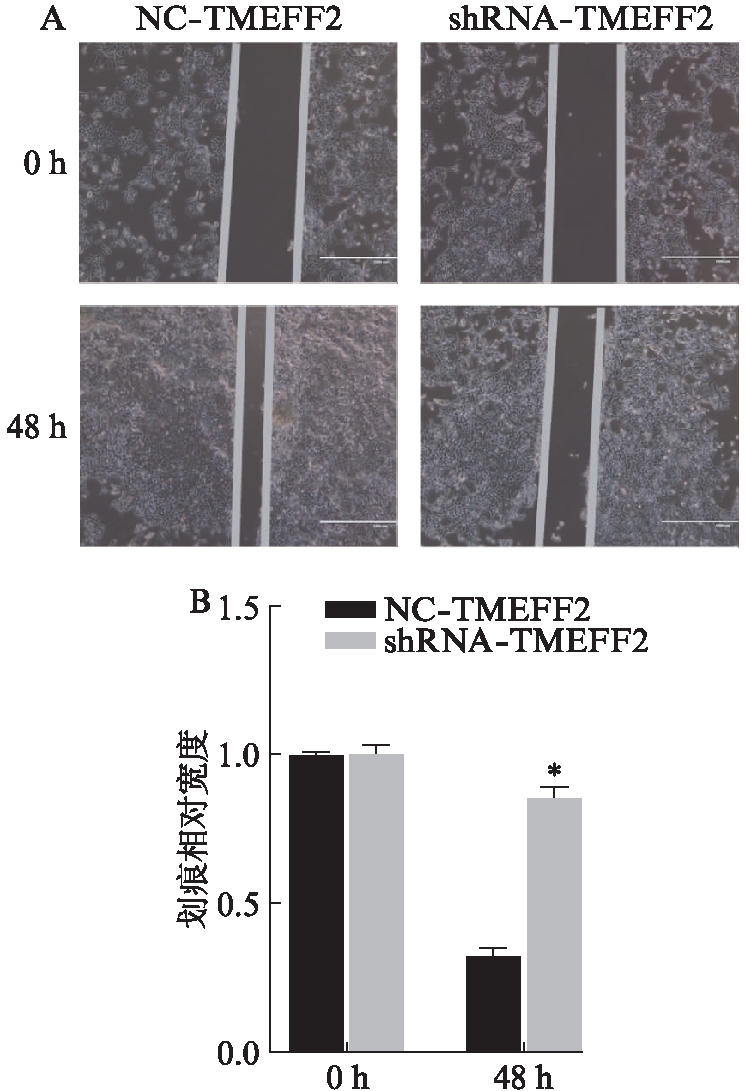
图8 2组HEK293细胞的划痕实验结果
Fig.8 Scratch test results of 2 groups of HEK293 cells
A: 划痕实验结果;B: 2组细胞划痕相对宽度统计;与NC-TMEFF2组相比,*P<0.05;标尺=1000μm
2.5 RNA-seq结果
本实验2组样品各有3个平行组,其中样本间相关性差异R2>0.977,对2组样品测序原始数据去除低值序列后,对照组和实验组过滤后的序列数分别为43和45,Q30分别为91.72%和89.95%。与对照组相比,实验组共有4769个基因表达差异有统计学意义,其中2355个基因上调,占49.4%,2414 个基因下调,占50.6%。对2组样品差异基因进行GO分析,分为生物过程、细胞组成和分子功能3类。在生物过程中,主要参与靶向蛋白质定位,其次为mRNA的分解代谢过程;在细胞组成中,主要为参与胞内细胞器形成的调控,在分子功能中,主要为表现为蛋白结合功能,其次是催化活性。通过对KEGG通路的分析,结果显示与细胞增殖、细胞周期及细胞黏附的基因发生显著变化,分别有8个、21个、13个发生显著变化,见图9。
2.6 qPCR验证结果
通过qPCR方法对8个差异表达基因(SIPA1L3、RGCC、CEACAM19、SPDYE2、NECTIN4、BTG3、SDK2、ADGRL1)进行验证,得到shRNA-TMEFF2组与NC-TMEFF2组基因表达量的比值,结果显示SPDYE2、SDK2、CEACAM19、ADGRL1和SIPA1L3表达均上调,RGCC、BTG3、NECTIN4表达均下调,与RNA-seq的测序结果相比较,8个基因的表达量趋势一致,证明了RNA-seq的结果是正确的,见图10。
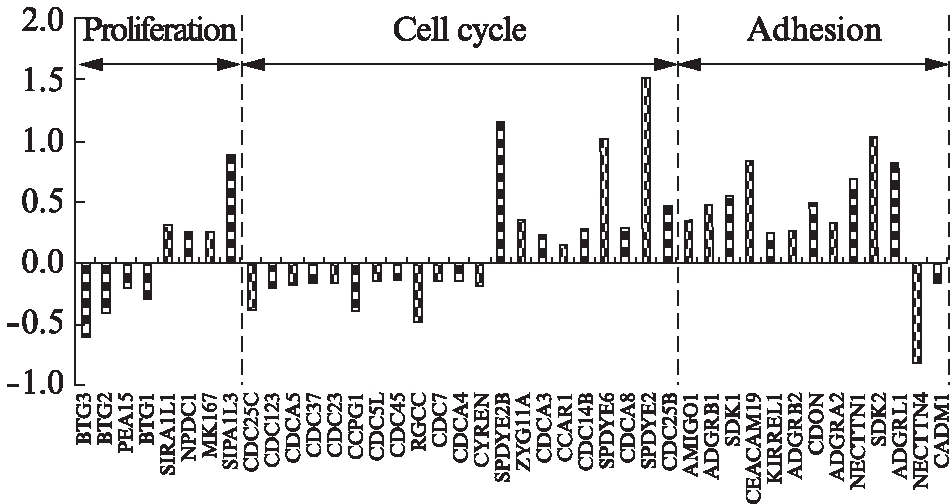
图9 与细胞增殖、细胞周期及黏附有关的差异表达基因
Fig.9 The different expression of genes associated with proliferation, cell cycle and adhesion
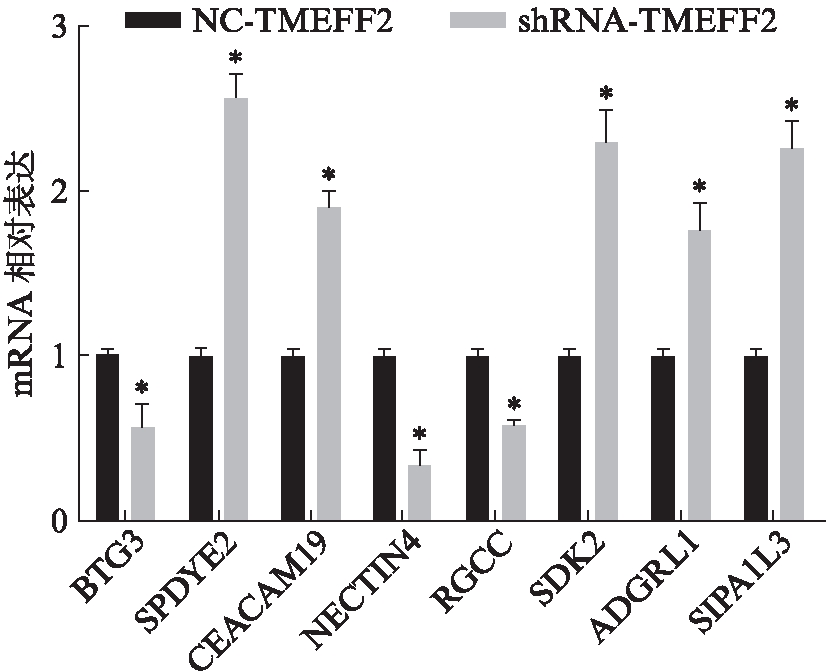
图10 通过qPCR方法验证RNA-seq
Fig.10 Validation of RNA-seq by qPCR
与NC-TMEFF2组相比,*P<0.05
2.7 Western免疫印记法验证转录组测序
培养HEK293细胞,转染低表达载体及其对照组的质粒DNA,抽提蛋白后做电泳实验。实验组3个蛋白的变化情况如下: 与NC-TMEFF2组相比,shRNA-TMEFF2组RGCC、NECTIN4蛋白表达水平显著下降,ADGRL1蛋白表达水平明显升高,3组差异均具有统计学意义(P<0.05),结果表明蛋白水平的变化同转录组测序的结果趋势相同,进一步验证了其正确性,见图11。
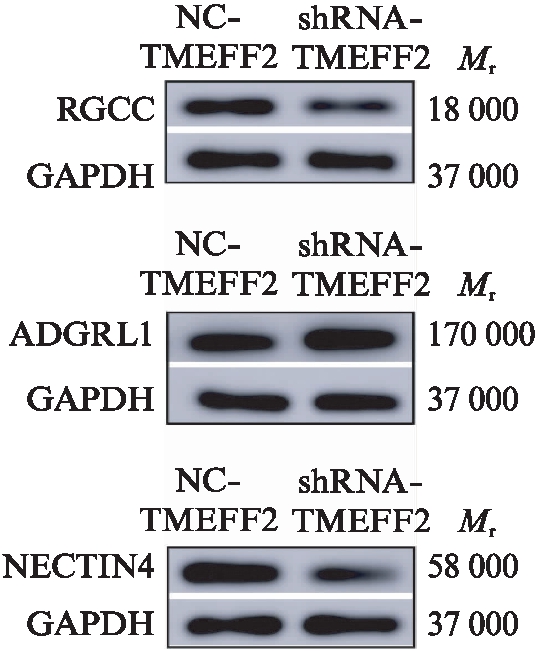
图11 Western印迹法验证RNA-seq结果
Fig.11 Results of validation of RNA-seq by Western blotting
3 讨 论
TMEFF2编码的是含有EGF(epidermal growth factor, EGF)样序列和两个卵泡抑制素结构域的跨膜蛋白,它在胚胎中有选择地表达在成人大脑和前列腺中早期的文献主要关注TMEFF2基因对肿瘤细胞生长的作用,既有肿瘤抑制作用也有促进作用,这说明TMEFF2基因在肿瘤中作用的发挥依赖一定的环境和条件,其中在原发性、转移性前列腺癌[9]和部分平滑肌瘤中表达上调,而在胶质瘤和胃癌[10]中表达下调。近年来,随着高通量测序等研究手段的进步,TMEFF2在许多实体肿瘤中作用的分子机制研究逐渐增多,比如TMEFF2基因在结直肠[11]、甲状腺恶性组织[12]、子宫内膜癌[13]、肾细胞癌[14]等多种肿瘤细胞中均可见TMEFF2的启动子呈甲基化[15]状态。
本实验发现,干扰TMEFF2基因表达后,人胚肾细胞HEK293的增殖受到明显的抑制。进一步通过流式细胞仪检测,发现TMEFF2基因低表达后,细胞主要阻滞在G1期。在细胞周期中,G1期即DNA合成前期,此期主要合成RNA和核糖体,该期物质代谢活跃,主要意义在于为下阶段S期的DNA复制作好物质和能量的准备。转录组测序显示: 细胞周期调节基因(regulator of cell cycle, RGCC)表达显著下降,研究[16]表明通过其与细胞周期蛋白依赖性激酶1的相互作用参与驱动G1/S和G2/M期转变,TMEFF2基因低表达后可能阻断了G1期向S的转变,导致细胞生长阻滞在G1期即抑制细胞生长;TMEFF2基因低表达后,信号诱导增殖相关蛋白1样蛋白3抗体(signal-induced proliferation-associated 1 like protein 3, SIPA1L3)基因表达量上升。研究[17]发现,SIPA1L3基因编码GTP酶活化蛋白,而IQGAPl表达上调可能通过激活ERKl/2信号通路参与诱导肾细胞凋亡的病理过程。推测TMEFF2基因低表达后可能通过影响SIPA1L3基因进一步影响GAP来诱导细胞凋亡;TMEFF2基因低表达后,ADGRL1(Latrophilin adhesion-GPCRs)表达量上升,研究[18]表明,ADGRL1与FLRT1-3(Fib-ronectin leucine-rich repeat transmembrane protein-3)相互作用,从而促进细胞黏附,推测TMEFF2基因低表达后,可能通过该途径抑制细胞迁移。本研究只是初步了解了TMEFF2基因低表达后对于HEK293细胞的生物学行为的影响,具体作用的机制待进一步研究。
[1] PHILIPP A B, STIEBER P, NAGEL D, et al. Prognostic role of methylated free circulating DNA in colorectal cancer[J]. Int J Cancer, 2012,131(10): 2308-2319.
[2] SUN T T, TANG J Y, DU W, et al. Bidirectional regulation between TMEFF2 and STAT3 may contribute to Helicobacterpylori-associated gastric carcinogenesis[J]. Int J Cancer, 2015,136(5): 1053-1064.
[3] CORBIN J M, OVERCASH R F, WREN J D, et al. Analysis of TMEFF2 allografts and transgenic mouse models reveals roles in prostate regeneration and cancer[J]. Prostate, 2016,76(1): 97-113.
[4] CHEN X F, CORBIN J M, TIPTON G J, et al. The TMEFF2 tumor suppressor modulates integrin expression, RhoA activation and migration of prostate cancer cells[J]. Biochim Biophys Acta, 2014,1843(6): 1216-1224.
[5] HAN H C, XU J, JI W W, et al. Upregulation of TMEFF2 is involved in the antiproliferative effects of vitamin C and tyrphostin AG490 on GES-1 and AGS cells[J]. Oncol Lett, 2019,17(1): 652-659.
[6] HERNANDEZ J M, ELAHI A, CLARK W, et al. The tumor suppressive effects of HPP1 are mediated through JAK-STAT-interferon signaling pathways[J]. DNA Cell Biol, 2015,34(8): 541-549.
[7] GAWE -B
-B![]() BEN K, ALI N, ELLIS V, et al. TMEFF2 shedding is regulated by oxidative stress and mediated by ADAMs and transmembrane serine proteases implicated in prostate cancer[J]. Cell Biol Int, 2018,42(3): 273-280.
BEN K, ALI N, ELLIS V, et al. TMEFF2 shedding is regulated by oxidative stress and mediated by ADAMs and transmembrane serine proteases implicated in prostate cancer[J]. Cell Biol Int, 2018,42(3): 273-280.
[8] ALI N, KNAÜPER V. Phorbol ester-induced shedding of the prostate cancer marker transmembrane protein with epidermal growth factor and two follistatin motifs 2 is mediated by the disintegrin and metalloproteinase-17[J]. J Biol Chem, 2007,282(52): 37378-37388.
[9] GEORGESCU C, CORBIN J M, THIBIVILLIERS S, et al. A TMEFF2-regulated cell cycle derived gene signature is prognostic of recurrence risk in prostate cancer[J]. BMC Cancer, 2019,19: 423.
[10] SUN T T, DU W, XIONG H, et al. TMEFF2 deregulation contributes to gastric carcinogenesis and indicates poor survival outcome[J]. Clin Cancer Res, 2014,20(17): 4689-4704.
[11] PATAI  V, VALCZ G, HOLL
V, VALCZ G, HOLL SI P, et al. Comprehensive DNA methylation analysis reveals a common ten-gene methylation signature in colorectal adenomas and carcinomas[J]. PLoS One, 2015,10(8): e0133836.
SI P, et al. Comprehensive DNA methylation analysis reveals a common ten-gene methylation signature in colorectal adenomas and carcinomas[J]. PLoS One, 2015,10(8): e0133836.
[12] CHANG H, SHIN B K, KIM A, et al. DNA methylation analysis for the diagnosis of thyroid nodules-a pilot study with reference to BRAFV600E mutation and cytopathology results[J]. Cytopathology, 2016,27(2): 122-130.
[13] CHEN Y C, TSAO C M, KUO C C, et al. Quantitative DNA methylation analysis of selected genes in endometrial carcinogenesis[J]. Taiwan J Obstet Gynecol, 2015,54(5): 572-579.
[14] CHEN E J, ZHENG F F, YUAN X X, et al. The effect of TMEFF2 methylation on the tumor stage and survival outcome of clear cell renal cell carcinoma[J]. Cancer Biomark, 2017,19(2): 207-212.
[15] 郁霞青,宋影春,李丹.TDG介导的去甲基化在细胞发育分化及肿瘤发生中的研究进展[J].同济大学学报(医学版),2019,40(4): 516-522.
[16] COUNTS S E, MUFSON E J. Regulator of cell cycle(RGCC) expression during the progression of Alzheimer’s disease[J]. Cell Transplant, 2017,26(4): 693-702.
[17] EVERS C, PARAMASIVAM N, HINDERHOFER K, et al. SIPA1L3 identified by linkage analysis and whole-exome sequencing as a novel gene for autosomal recessive congenital cataract[J]. Eur J Hum Genet, 2015,23(12): 1627-1633.
[18] JACKSON V A, MEHMOOD S, CHAVENT M, et al. Super-complexes of adhesion GPCRs and neural guidance receptors[J]. Nat Commun, 2016,7: 11184.