2型糖尿病和骨质疏松是内分泌代谢领域最常见的慢性疾病[1],两者在老年人中往往同时存在,并且2型糖尿病患者发生骨折的风险明显高于非糖尿病患者[2-3]。来自妇女健康倡议观察队列(women’s health initiative observational cohort, WHI)的研究结果显示,女性糖尿病患者桡骨远端、足踝和椎体等多部位骨折的发生率均升高,并发现2型糖尿病患者的髋部骨折发生风险增加40%[4]。统计数据显示,发生髋部骨折后1年之内,死于各种并发症者高达20%,而存活者中约50%致残,导致生活不能自理[5]。并且,发生初次骨折后再次骨折的发生风险明显升高[6]。另外,糖尿病合并骨折的治疗较非糖尿病患者更加复杂和困难,预后更差[7]。因此,及时识别出2型糖尿病患者中的高骨折风险人群具有重要的临床价值。
对一个特定的骨密度值,2型糖尿病患者的骨折发生风险高于非糖尿病患者[8],但其骨密度值较非糖尿病患者可升高[9]、降低[10]或无差异[11]。研究显示,在非糖尿病患者中血脂与骨折发生有关。血清高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)和三酰甘油(triglyceride, TG)水平降低可增加腰椎骨折的发生风险[12],且腰椎骨折患者的血清总胆固醇(total cholesterol, TC)水平高于非骨折患者[13],血清TC水平升高与腰椎骨折降低有关,TC水平每升高0.026mmol/L,腰椎骨折风险可降低2.2%[14]。但也有研究发现血清TC水平与骨质疏松的发生不相关[15]。但这些结果主要是在非亚洲人群中开展、未区分糖尿病人群、大部分研究没有纳入骨转换标志物,因此观察2型糖尿病患者中血脂谱与骨转换标志物和骨密度的关系,可更清晰地了解2型糖尿病患者中血脂与骨代谢指标和骨密度的关系。
本研究通过分析1182例2型糖尿病患者的血脂谱与骨代谢标志物和骨密度的关系,观察2型糖尿病患者血脂相关指标对骨代谢的影响,为2型糖尿病患者骨代谢异常和高骨折发生率的发生机制提供线索。
1 资料与方法
1.1 一般资料
该回顾性研究收集2016年6月—2018年6月在同济大学附属同济医院内分泌代谢科住院的2型糖尿病患者3430例,排除影响骨代谢性的疾病(甲状旁腺功能亢进症、血液系统疾病、肾脏疾病、严重肝功能不全及其他继发性骨质疏松的原因)、高钙血症、糖尿病酮症酸中毒、乳酸酸中毒、严重心血管疾病及血清肌酐>100μmol/L的患者,最终纳入2型糖尿病患者1182例,其中包括74例初发2型糖尿病患者。纳入人群的年龄为20~83岁。
1.2 诊断标准
根据1999年WHO糖尿病专家委员会提出的诊断标准: (1) 糖尿病症状加随机血糖≥11.1mmol/L,或(2) 空腹血糖≥7.0mmol/L,或(3) 口服葡萄糖耐量试验中2 h血糖≥11.1mmol/L,若无症状,需要隔日再测1次予以确定诊断。或有2型糖尿病病史的患者,或现在正在服用降糖药物或胰岛素治疗。
1.3 资料收集
所有研究对象接受常规体格检查,包括身高(cm)、体质量(kg)、血压(静息状态血压,mmHg,1mmHg=0.133kPa),并计算BMI(kg/m2)。
研究对象在空腹状态下进行血常规、尿常规、肝肾功能指标、糖代谢(空腹血糖、糖化白蛋白、糖化血红蛋白)、胰岛功能(空腹胰岛素和空腹C肽)、血脂谱[TC、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、HDL-C、TG和游离脂肪酸(free fatty acid, FFA)]、骨代谢相关指标(血钙、血磷、骨特异性碱性磷酸酶、抗酒石酸酸性磷酸酶5b、骨钙素、Ⅰ型前胶原N端肽、Ⅰ型胶原C端肽)及其调节激素甲状旁腺激素(parathyroid harmone, PTH)和25羟维生素D[25(OH)D]等测定。生化指标采用advia-1650化学自动分析仪(拜耳诊断,美国)检测,骨碱性磷酸酶和抗酒石酸酸性磷酸酶5b用固相单克隆抗体酶联免疫法测定,骨钙素、PTH、25(OH)D、Ⅰ型前胶原N端肽、Ⅰ型胶原C端肽用电化学发光法测定(Roche Diagnostics)。双能X线骨密度仪为豪洛捷公司生产(北京),所有患者均测定腰椎1~4、股骨颈和全髋的骨密度。
1.4 统计学处理
采用SPSS 17.0统计软件进行分析。计量资料符合正态分布且方差齐,以![]() 表示,非正态分布用中位数表示。应用Pearson相关分析和Logistic多元回归分析确定血脂各指标与骨代谢指标和骨密度的关系。其中组间差异应用t检验,相关性分析采用线性相关分析。P<0.05为差异有统计学意义。
表示,非正态分布用中位数表示。应用Pearson相关分析和Logistic多元回归分析确定血脂各指标与骨代谢指标和骨密度的关系。其中组间差异应用t检验,相关性分析采用线性相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的基本资料和临床特征
根据1182例2型糖尿病患者的骨密度值,分成骨量正常(n=323)、骨量减少(n=572)和骨质疏松(n=287)3组。骨质疏松组患者的年龄最大,绝经比例最高,男性所占比例最少,BMI最低,谷丙转氨酶和谷草转氨酶水平最低,伴碱性磷酸酶水平最高。糖代谢指标显示,骨质疏松组糖化血红蛋白水平最高且空腹C肽水平最低。3组间骨代谢相关指标比较显示,骨质疏松组的抗酒石酸酸性磷酸酶、骨钙素和校正后的血钙水平最高。其他指标3组间差异无统计学意义,见表1。
表1 研究对象的基本资料和临床特征
Tab.1 Basic data and clinical characteristics of the subjects
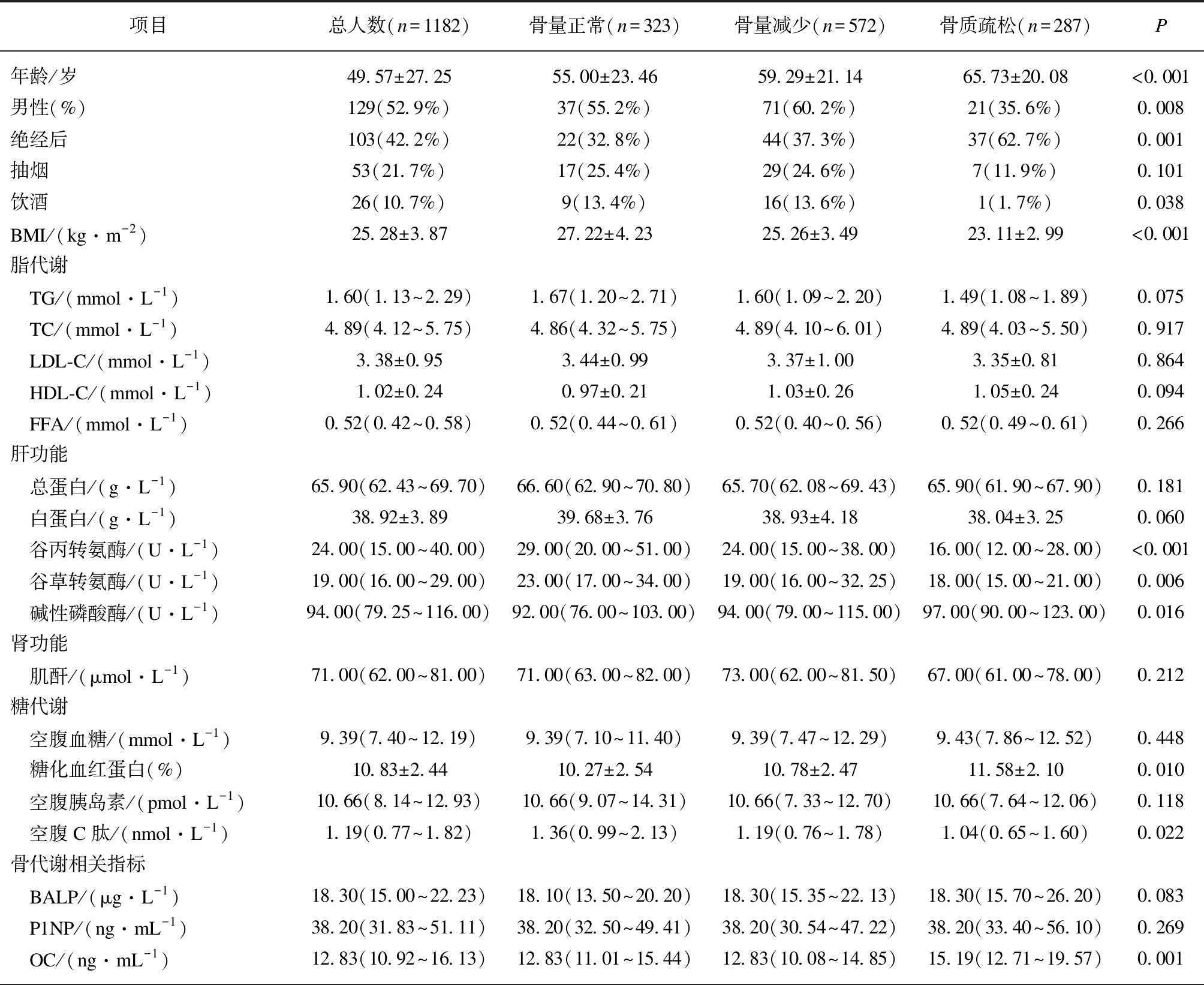
项目总人数(n=1182)骨量正常(n=323)骨量减少(n=572)骨质疏松(n=287)P年龄/岁49.57±27.2555.00±23.4659.29±21.1465.73±20.08<0.001男性(%)129(52.9%)37(55.2%)71(60.2%)21(35.6%)0.008绝经后103(42.2%)22(32.8%)44(37.3%)37(62.7%)0.001抽烟53(21.7%)17(25.4%)29(24.6%)7(11.9%)0.101饮酒26(10.7%)9(13.4%)16(13.6%)1(1.7%)0.038BMI/(kg·m-2)25.28±3.8727.22±4.2325.26±3.4923.11±2.99<0.001脂代谢 TG/(mmol·L-1)1.60(1.13~2.29)1.67(1.20~2.71)1.60(1.09~2.20)1.49(1.08~1.89)0.075 TC/(mmol·L-1)4.89(4.12~5.75)4.86(4.32~5.75)4.89(4.10~6.01)4.89(4.03~5.50)0.917 LDL-C/(mmol·L-1)3.38±0.953.44±0.993.37±1.003.35±0.810.864 HDL-C/(mmol·L-1)1.02±0.240.97±0.211.03±0.261.05±0.240.094 FFA/(mmol·L-1)0.52(0.42~0.58)0.52(0.44~0.61)0.52(0.40~0.56)0.52(0.49~0.61)0.266肝功能 总蛋白/(g·L-1)65.90(62.43~69.70)66.60(62.90~70.80)65.70(62.08~69.43)65.90(61.90~67.90)0.181 白蛋白/(g·L-1)38.92±3.8939.68±3.7638.93±4.1838.04±3.250.060 谷丙转氨酶/(U·L-1)24.00(15.00~40.00)29.00(20.00~51.00)24.00(15.00~38.00)16.00(12.00~28.00)<0.001 谷草转氨酶/(U·L-1)19.00(16.00~29.00)23.00(17.00~34.00)19.00(16.00~32.25)18.00(15.00~21.00)0.006 碱性磷酸酶/(U·L-1)94.00(79.25~116.00)92.00(76.00~103.00)94.00(79.00~115.00)97.00(90.00~123.00)0.016肾功能 肌酐/(μmol·L-1)71.00(62.00~81.00)71.00(63.00~82.00)73.00(62.00~81.50)67.00(61.00~78.00)0.212糖代谢 空腹血糖/(mmol·L-1)9.39(7.40~12.19)9.39(7.10~11.40)9.39(7.47~12.29)9.43(7.86~12.52)0.448 糖化血红蛋白(%)10.83±2.4410.27±2.5410.78±2.4711.58±2.100.010 空腹胰岛素/(pmol·L-1)10.66(8.14~12.93)10.66(9.07~14.31)10.66(7.33~12.70)10.66(7.64~12.06)0.118 空腹C肽/(nmol·L-1)1.19(0.77~1.82)1.36(0.99~2.13)1.19(0.76~1.78)1.04(0.65~1.60)0.022骨代谢相关指标 BALP/(μg·L-1)18.30(15.00~22.23)18.10(13.50~20.20)18.30(15.35~22.13)18.30(15.70~26.20)0.083 P1NP/(ng·mL-1)38.20(31.83~51.11)38.20(32.50~49.41)38.20(30.54~47.22)38.20(33.40~56.10)0.269 OC/(ng·mL-1)12.83(10.92~16.13)12.83(11.01~15.44)12.83(10.08~14.85)15.19(12.71~19.57)0.001
(续表1)
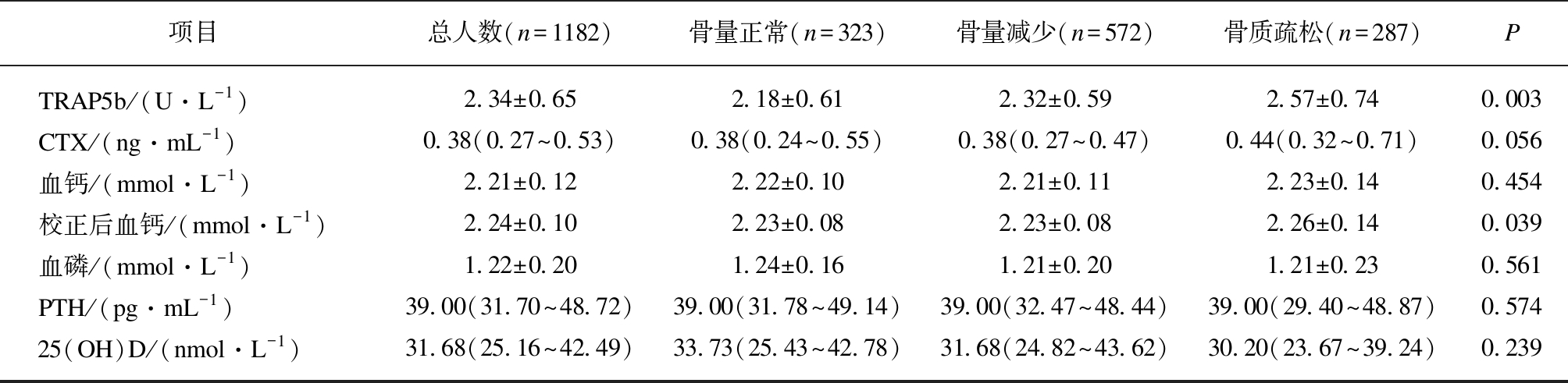
项目总人数(n=1182)骨量正常(n=323)骨量减少(n=572)骨质疏松(n=287)P TRAP5b/(U·L-1)2.34±0.652.18±0.612.32±0.592.57±0.740.003 CTX/(ng·mL-1)0.38(0.27~0.53)0.38(0.24~0.55)0.38(0.27~0.47)0.44(0.32~0.71)0.056 血钙/(mmol·L-1)2.21±0.122.22±0.102.21±0.112.23±0.140.454 校正后血钙/(mmol·L-1)2.24±0.102.23±0.082.23±0.082.26±0.140.039 血磷/(mmol·L-1)1.22±0.201.24±0.161.21±0.201.21±0.230.561 PTH/(pg·mL-1)39.00(31.70~48.72)39.00(31.78~49.14)39.00(32.47~48.44)39.00(29.40~48.87)0.574 25(OH)D/(nmol·L-1)31.68(25.16~42.49)33.73(25.43~42.78)31.68(24.82~43.62)30.20(23.67~39.24)0.239
BALP: 骨碱性磷酸酶;P1NP: Ⅰ型前胶原N端肽;OC: 骨钙素;TRAP5b: 抗酒石酸酸性磷酸酶5b;CTX: Ⅰ型胶原C端肽
2.2 2型糖尿病患者血脂谱与骨密度和骨代谢相关指标的关系
采用Pearson相关分析TG、TC、LDL-C、HDL-C和FFA与腰椎1~4、股骨颈和全髋部位骨密度的相关性,结果发现血脂各指标与各部位骨密度无相关关系,见表2。同时采用Spearman相关分析(非正态分布数据,包括BALP、P1NP、OC、CTX)和Pearson相关分析(正态分布数据,包括TRAP5b)测定TG、TC、LDL-C、HDL-C和FFA与骨代谢指标的关系,结果显示血脂各指标与骨代谢指标无相关关系,见表3。并进一步利用Pearson相关分析血脂各指标与白蛋白校正后血钙和血磷及利用Spearman相关分析PTH和25(OH)D的相关性,发现血清游离脂肪酸与血磷呈负相关(r=-0.148,P<0.000),其他均无相关性,见表2、图1。
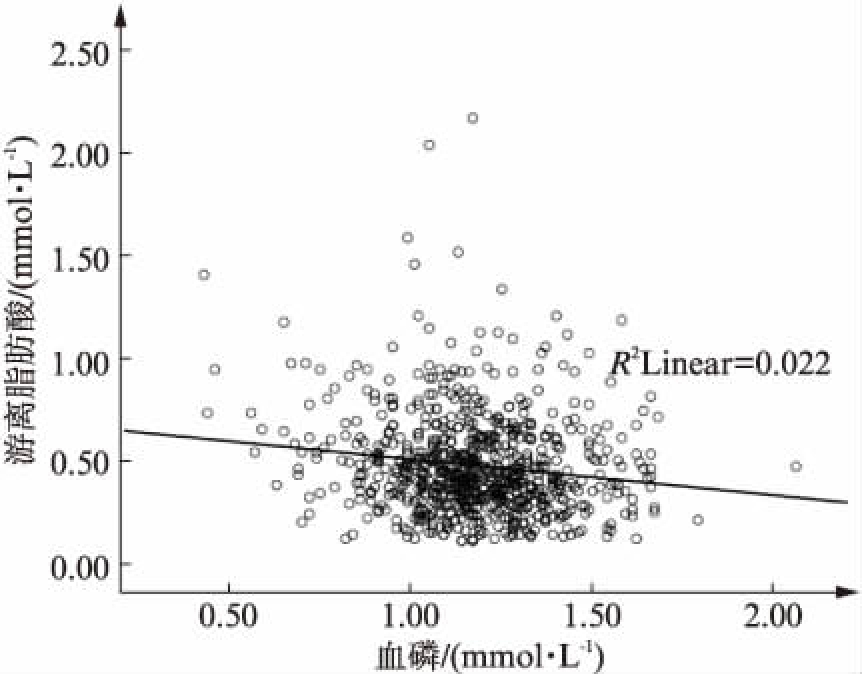
图1 血清FFA与血磷的相关性
Fig.1 Correlation between free fatty acid and phosphorus
2.3 校正相关因素后血清磷与FFA的相关性变化
由于FFA水平受影响因素较多,进一步通过校正年龄、是否绝经、血糖控制情况(糖化血红蛋白)、胰岛功能(C肽)、TG及血磷调节激素后,观察对游离脂肪酸和血磷相关性的影响。偏相关分析结果发现,无论是校正年龄和绝经状态,还是糖化血红蛋白、C肽和TG,均不影响FFA和血磷的相关性。进一步校正PTH或25(OH)D后,发现FFA和血磷仍呈显著负相关。同时校正上述各因素后,FFA和血磷的负相关关系仍存在(r=-0.202,P<0.000),见表3。
表2 2型糖尿病患者血脂各指标与骨密度和 骨代谢相关指标的关系
Tab.2 The relationship between serum lipids with bone mineral density and bone metabolic markers in type 2 diabetes patients
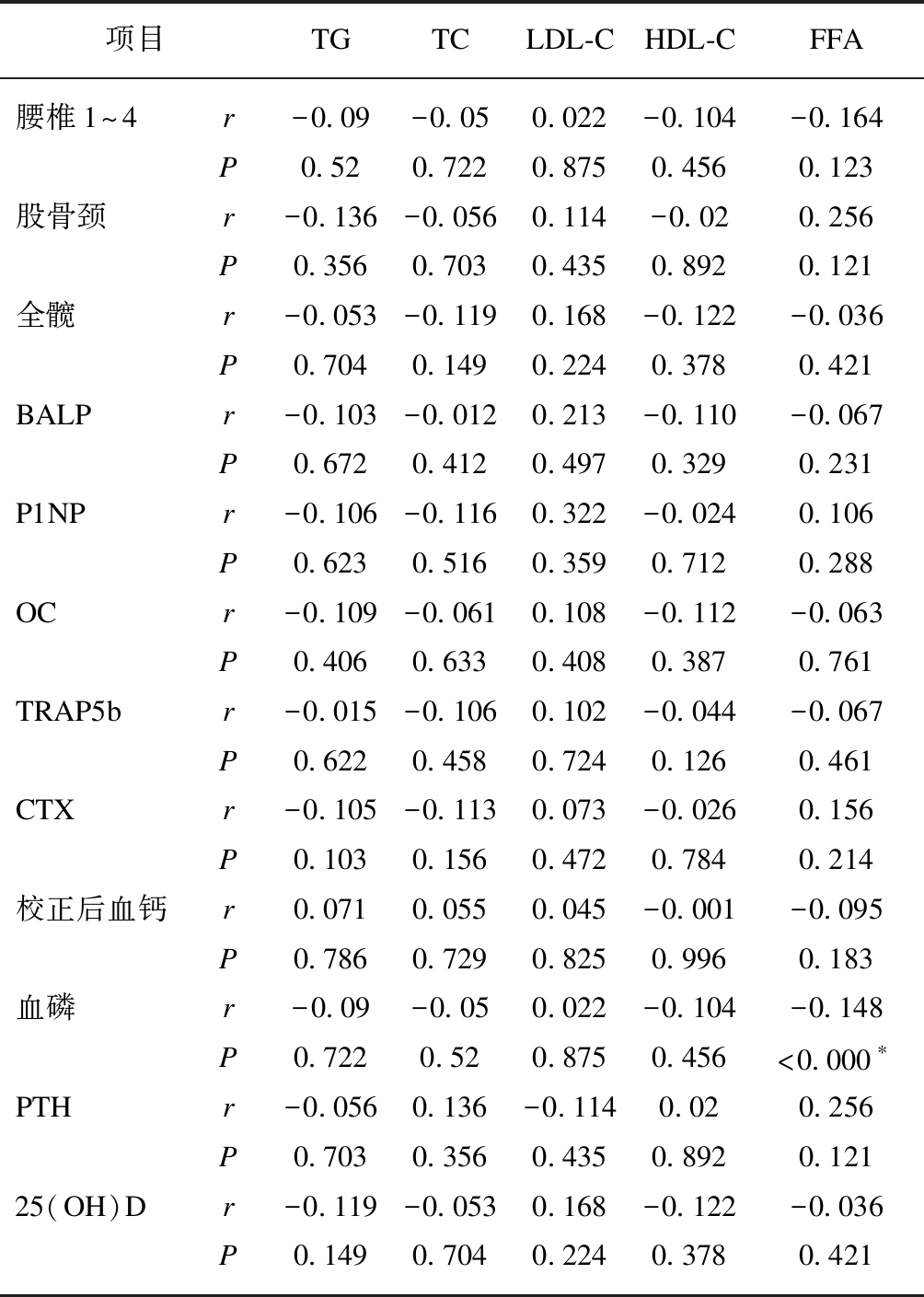
项目TGTCLDL-CHDL-CFFA腰椎1~4r-0.09-0.050.022-0.104-0.164P0.520.7220.8750.4560.123股骨颈r-0.136-0.0560.114-0.020.256P0.3560.7030.4350.8920.121全髋r-0.053-0.1190.168-0.122-0.036P0.7040.1490.2240.3780.421BALPr-0.103-0.0120.213-0.110-0.067P0.6720.4120.4970.3290.231P1NPr-0.106-0.1160.322-0.0240.106P0.6230.5160.3590.7120.288OCr-0.109-0.0610.108-0.112-0.063P0.4060.6330.4080.3870.761TRAP5br-0.015-0.1060.102-0.044-0.067P0.6220.4580.7240.1260.461CTXr-0.105-0.1130.073-0.0260.156P0.1030.1560.4720.7840.214校正后血钙r0.0710.0550.045-0.001-0.095P0.7860.7290.8250.9960.183血磷r-0.09-0.050.022-0.104-0.148P0.7220.520.8750.456<0.000∗PTHr-0.0560.136-0.1140.020.256P0.7030.3560.4350.8920.12125(OH)Dr-0.119-0.0530.168-0.122-0.036P0.1490.7040.2240.3780.421
表3 校正相关因素后FFA与血清磷的关系
Tab.3 The relationship between free fatty acid and serum phosphorus after adjusting related factors
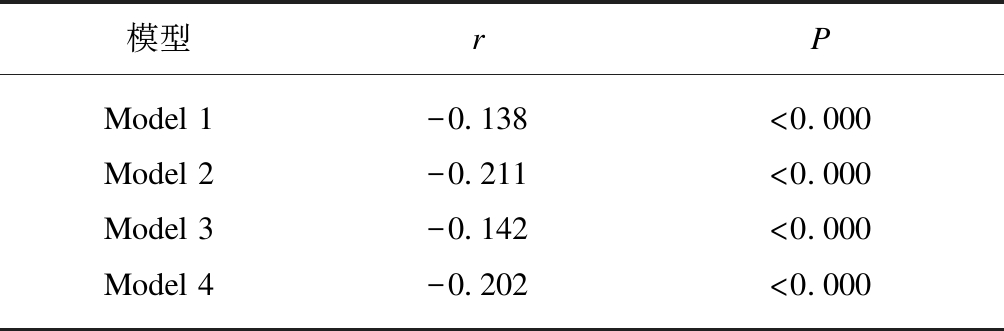
模型rPModel 1-0.138<0.000Model 2-0.211<0.000Model 3-0.142<0.000Model 4-0.202<0.000
Model 1: 校正年龄、是否绝经;Model 2: 校正糖化血红蛋白、C肽和TG;Model 3: 校正PTH和25(OH)D;Model 4: 校正年龄、是否绝经、糖化血红蛋白、C肽、TG、PTH和25(OH)D
2.4 初发2型糖尿病患者血清磷与FFA的关系
由于2型糖尿病患者常应用多种降糖药物,为排除降糖药物的影响,进一步研究分析了74例初发2型糖尿病患者血清磷与FFA的相关性。Pearson相关分析结果显示血清磷和游离脂肪酸呈负相关关系(r=-0.564,P<0.000),分别校正PTH和25(OH)D后,血清磷与FFA的相关关系仍存在,同时校正PTH和25(OH)D后,血磷和血清FFA仍呈负相关(r=-0.526,P=0.002),见表4、图2。
表4 初发2型糖尿病患者血清磷与FFA的关系
Tab.4 Relationship between serum phosphorus with free fatty acids in newly-diagnosed diabetic patients
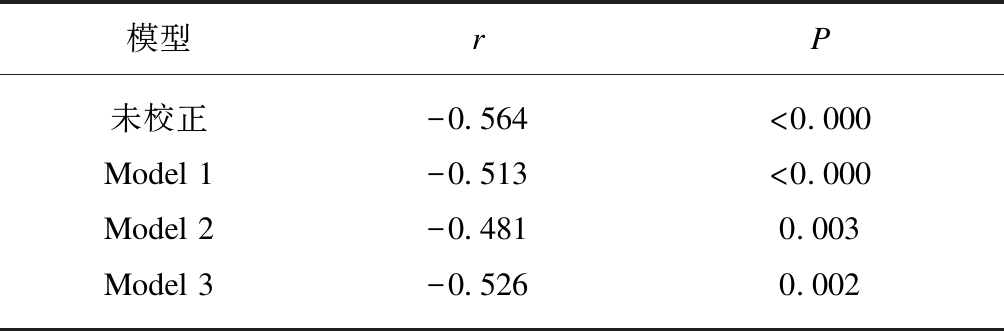
模型rP未校正-0.564<0.000Model 1-0.513<0.000Model 2-0.4810.003Model 3-0.5260.002
Model 1: 校正PTH;Model 2: 校正 25(OH)D;Model 3: 同时校正PTH和25(OH)D
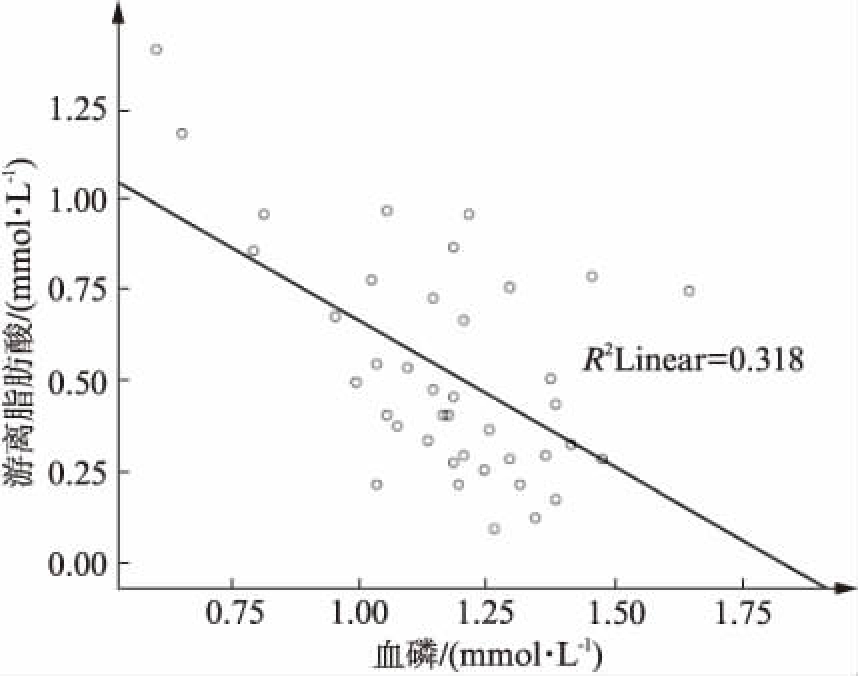
图2 初发2型糖尿病患者血清FFA与 血磷的相关关系
Fig.2 Correlation between serum free fatty acids and blood phosphorus in newly-diagnosed diabetic patients
2.5 不同骨密度的2型糖尿病患者中血清磷与FFA的关系及其影响因素
为观察血清磷与FFA的相关关系是否在不同骨密度人群中存在差异,分别在骨量正常、骨量减少和骨质疏松3个亚组中,用Pearson相关分析血清磷与FFA的相关性,结果发现,在上述3组中FFA与血磷均呈负相关关系,且各组间的相关性不存在差异(P>0.05),见表5。
表5 不同骨密度的2型糖尿病患者中FFA 与血清磷的相关性
Tab.5 Correlation between free fatty acids and serum phosphorus in type 2 diabetes patients with different level of bone mineral density

项目游离脂肪酸rP总人数 -0.148<0.000骨量正常-0.132<0.000骨量减少-0.157<0.000骨质疏松-0.144<0.000
为进一步观察2型糖尿病患者中导致骨量低下的危险因素,应用Logistic多元回归模型纳入绝经状态、CTX、PTH和总蛋白后,用于预测其是否存在骨质疏松的正确概率为80.2%,灵敏度和特异度分别为77.6%和73.3%,见图3。
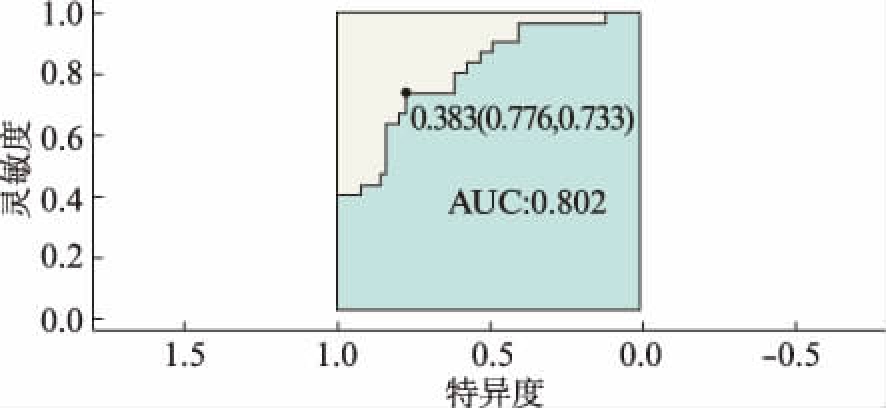
图3 2型糖尿病患者中影响骨量的危险因素分析
Fig.3 Analysis of the risk factors for low bone mass in type 2 diabetic patients
3 讨 论
本研究结果显示,在中国2型糖尿病患者中FFA与血清磷呈负相关关系,且该负相关关系在初发2型糖尿病患者中更显著。年龄、绝经状态、血糖水平、胰岛功能和血磷调节激素不影响FFA与血清磷的相关关系。
血磷与脂代谢之间的相关关系可能存在以下机制: 首先,肝脏在维持血磷水平和脂代谢中均发挥重要作用,由小肠吸收的膳食磷酸盐通过门静脉输送到肝脏,肝细胞中的磷酸钠共转运体能调节血清磷酸盐水平的变化[16],同时DNA微阵列分析显示,高磷饮食可促进大鼠肝脏消耗脂肪酸并促进全身能量消耗[17]。其次,磷酸盐浓度与空腹胰岛素、空腹血糖和晚期胰岛素反应呈负相关,且在慢性低磷血症患者中存在着葡萄糖代谢和胰岛素敏感性的改变[18],并能抑制胰岛素的分泌[19],而FFA水平升高是胰岛素抵抗的结果之一。但是,血磷对脂肪细胞是否存在直接调节作用尚不清楚,这也是本课题组将要进一步研究的方向。
研究也显示,调节血磷水平的激素可调节胰岛素敏感性和脂代谢,包括成纤维细胞生长因子23(fibroblast growth factor 23, FGF23)、维生素D和甲状旁腺激素。FGF23主要由骨细胞分泌,研究发现FGF23敲除的小鼠表现为低血糖和外周组织胰岛素敏感性的增加[20],且FGF23在代谢综合征的老年人中水平升高,与HDL-C、apoA1呈负相关,与TG呈正相关,并与代谢综合征的发生风险增加相关[21],但也有研究显示FGF23与代谢综合征的发生风险无相关性[22]。近年来的研究还发现,血清维生素D水平与肥胖和代谢综合征的发生风险呈负相关关系[23-24],血清25(OH)D的水平可影响3年后代谢综合征的发生率[25],并且前瞻性和横断面研究均发现维生素D缺乏与致动脉粥样硬化的血脂水平相关[26-27],可引起低总胆固醇血症、低HDL-C血症和高LDC-C血症,这可能与维生素D受体可结合于位点参与脂质转运和代谢的APOA5基因位点[28]。除了FGF23和维生素D外,研究还表明PTH水平或作用异常与代谢综合征发生相关[29]。最近在欧洲鲈鱼中的研究发现,PTH相关肽通过其受体可促进肝脏的脂解和β氧化[30],且临床研究也发现,正常血钙和高血钙的甲状旁腺功能亢进患者均出现糖耐量异常、脂代谢异常和高血压,且空腹TG水平与血清PTH水平呈正相关[31],但也有研究发现PTH水平升高并不影响脂代谢[32]。上述结果说明,FGF23、维生素D和PTH等血磷调节激素与脂代谢存在密切关系,但尚无研究探索这些激素与FFA的关系,本研究结果发现,即便校正维生素D和PTH后,2型糖尿病患者中FFA与血磷的负相关关系仍存在,提示FFA和血磷之间的关系不受这些磷调节激素的影响。
本研究的不足之处包括: (1) 未测定受试者血清FGF23的水平,FGF23不是常规临床开展项目,因此无法判断血磷对FFA的影响是否与FGF23有关;(2) 本研究为回顾性分析,仅显示血磷与FFA存在相关性,能否通过改善血磷水平影响脂代谢尚需要干预性的前瞻性研究证实;(3) 血磷如何影响血清FFA水平的机制未明,需要细胞和分子学实验进一步探索。
综上所述,由于2型糖尿病患者常合并脂代谢异常,在进行降糖和调脂治疗的同时,尚需关注其血磷水平,同时需要进一步探索2型糖尿病患者骨折发生率升高与FFA的关系。
[1] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1): 4-67.
[2] RUBIN M R. Skeletal fragility in diabetes[J]. Ann N Y Acad Sci, 2017,1402(1): 18-30.
[3] VESTERGAARD P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes: a meta-analysis[J]. Osteoporos Int, 2007,18(4): 427-444.
[4] BONDS D E, LARSON J C, SCHWARTZ A V, et al. Risk of fracture in women with type 2 diabetes: the women’s health initiative observational study[J]. J Clin Endocrinol Metab, 2006,91(9): 3404-3410.
[5] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南(2017)[J].中国全科医学,2017,20(32): 3963-3982.
[6] MAZZUCCHELLI R, PÉREZ-FERN NDEZ E, CRE-SP
NDEZ E, CRE-SP N, et al. Second hip fracture: incidence, trends, and predictors[J]. Calcif Tissue Int, 2018,102(6): 619-626.
N, et al. Second hip fracture: incidence, trends, and predictors[J]. Calcif Tissue Int, 2018,102(6): 619-626.
[7] KURRA S, FINK D A, SIRIS E S. Osteoporosis-associated fracture and diabetes[J]. Endocrinol Metab Clin N Am, 2014,43(1): 233-243.
[8] SCHWARTZ A V, VITTINGHOFF E, BAUER D C, et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes[J]. JAMA, 2011,305(21): 2184-2192.
[9] MODARRESI F, FAGHIHI M A, LOPEZ-TOLEDANO M A, et al. Inhibition of natural antisense transcripts in vivo results in gene-specific transcriptional upregulation[J]. Nat Biotechnol, 2012,30(5): 453-459.
[10] ADIL C,AYD N T, TA
N T, TA P
P NAR Ö, et al. Bone mineral density evaluation of patients with type 2 diabetes mellitus[J]. J Phys Ther Sci, 2015,27(1): 179-182.
NAR Ö, et al. Bone mineral density evaluation of patients with type 2 diabetes mellitus[J]. J Phys Ther Sci, 2015,27(1): 179-182.
[11] CAGLAYAN E K, ENGIN-USTUN Y, SARI N, et al. Evaluation of bone density measurement in type 2 diabetic postmenopausal women with hypertension and hyperlipidemia[J]. J Menopausal Med, 2015,21(1): 36-40.
[12] YAMAGUCHI T, SUGIMOTO T, YANO S, et al. Plasma lipids and osteoporosis in postmenopausal women[J]. Endocr J, 2002,49(2): 211-217.
[13] BROULIK P D, KAPITOLA J. Interrelations between body weight, cigarette smoking and spine mineral density in osteoporotic Czech women[J]. Endocr Regul, 1993,27(2): 57-60.
[14] SIVAS F, ![]() E, ELVERICI E, et al. Serum lipid profile: its relationship with osteoporotic vertebrae fractures and bone mineral density in Turkish postmenopausal women[J]. Rheumatol Int, 2009,29(8): 885-890.
E, ELVERICI E, et al. Serum lipid profile: its relationship with osteoporotic vertebrae fractures and bone mineral density in Turkish postmenopausal women[J]. Rheumatol Int, 2009,29(8): 885-890.
[15] SAMELSON E J, CUPPLES L A, HANNAN M T, et al. Long-term effects of serum cholesterol on bone mineral density in women and men: the Framingham Osteoporosis Study[J]. Bone, 2004,34(3): 557-561.
[16] FREI P, GAO B, HAGENBUCH B, et al. Identification and localization of sodium-phosphate cotransporters in hepatocytes and cholangiocytes of rat liver[J]. Am J Physiol Gastrointest Liver Physiol, 2005,288(4): G771-G778.
[17] CHUN S, BAMBA T, SUYAMA T, et al. A high phosphorus diet affects lipid metabolism in rat liver: a DNA microarray analysis[J]. PLoS One, 2016,11(5): e0155386.
[18] PAULA F, PLENS A, FOSS M. Effects of hypophosphatemia on glucose tolerance and insulin secretion[J]. Horm Metab Res, 1998,30(5): 281-284.
[19] OH H Y, FADDA G Z, SMOGORZEWSKI M, et al. Phosphate depletion impairs leucine-induced insulin secretion[J]. J Am Soc Nephrol, 1994,5(5): 1259-1265.
[20] HESSE M, FRÖHLICH L F, ZEITZ U, et al. Ablation of vitamin D signaling rescues bone, mineral, and glucose homeostasis in Fgf-23 deficient mice[J]. Matrix Biol, 2007,26(2): 75-84.
[21] MIRZA M A, ALSIÖ J, HAMMARSTEDT A, et al. Circulating fibroblast growth factor-23 is associated with fat mass and dyslipidemia in two independent cohorts of elderly individuals[J]. Arterioscler Thromb Vasc Biol, 2011,31(1): 219-227.
[22] KO B J, KIM S M, PARK K H, et al. Levels of circulating selenoprotein P, fibroblast growth factor(FGF)21 and FGF23 in relation to the metabolic syndrome in young children[J]. Int J Obes (Lond), 2014,38(12): 1497-1502.
[23] HA J, JO K, LIM D J, et al. Parathyroid hormone and vitamin D are associated with the risk of metabolic obesity in a middle-aged and older Korean population with preserved renal function: a cross-sectional study[J]. PLoS One, 2017,12(4): e0175132.
[24] LEE S J, LEE E Y, LEE J H, et al. Associations of serum 25-hydroxyvitamin D with metabolic syndrome and its components in elderly men and women: the Korean Urban Rural Elderly cohort study[J]. BMC Geriatr, 2019,19(1): 102.
[25] KAYANIYIL S, HARRIS S B, RETNAKARAN R, et al. Prospective association of 25(OH)D with metabolic syndrome[J]. Clin Endocrinol (Oxf), 2014,80(4): 502-507.
[26] LUPTON J R, FARIDI K F, MARTIN S S, et al. Deficient serum 25-hydroxyvitamin D is associated with an atherogenic lipid profile: The Very Large Database of Lipids(VLDL-3)study[J]. J Clin Lipidol, 2016,10(1): 72-81.e1.
[27] FARIDI K F, ZHAO D, MARTIN S S, et al. Serum vitamin D and change in lipid levels over 5 y: the atherosclerosis risk in communities study[J]. Nutrition, 2017,38: 85-93.
[28] SHIRTS B H, HOWARD M T, HASSTEDT S J, et al. Vitamin D dependent effects of APOA5 polymorphisms on HDL cholesterol[J]. Atherosclerosis, 2012,222(1): 167-174.
[29] CORBETTA S, MANTOVANI G, SPADA A. Metabolic syndrome in parathyroid diseases[J]. Front Horm Res, 2018,49: 67-84.
[30] PALMA P F S, BOCK C, SILVA T S, et al. STC1 and PTHrP modify carbohydrate and lipid metabolism in liver of a teleost fish[J]. Sci Rep, 2019,9(1): 723.
[31] YENER OZTURK F, EROL S, CANAT M M, et al. Patients with normocalcemic primary hyperparathyroidism May have similar metabolic profile as hypercalcemic patients[J]. Endocr J, 2016,63(2): 111-118.
[32] GODANG K, LUNDSTAM K, MOLLERUP C, et al. The effect of surgery on fat mass, lipid and glucose metabolism in mild primary hyperparathyroidism[J]. Endocr Connect, 2018,7(8): 941-948.