美国疾病控制中心(Centers for Disease Control and Prevention, CDC)建议所有孕妇在孕早期进行梅毒(treponema pallidum, TP)血清学筛查[1-2]。美国许多地区[3-4]和我国卫生健康委员会[5]规定第1次产前检查的所有孕妇均需筛查梅毒。在产前检查普及不理想的人群,孕妇一旦确诊妊娠应进行梅毒血清学检查,若发现感染应及时进行治疗[6]。在梅毒高发地区孕妇至少在孕晚期(28~32周)以及分娩前各复查1次,有再次感染风险或高发地区的产妇可以每月复查1次血清滴度[7]。国家卫生健康委员会《预防艾滋病、梅毒和乙肝母婴传播工作实施方案(2015年版)》[5](以下简称“方案”)规定我国孕妇孕期梅毒感染治疗期间应当定期随访,每月做1次非梅毒螺旋体抗原血清学试验定量检测,观察滴度变化,判断有无复发或再感染。很多孕早期梅毒阳性孕妇并未遵照执行。本研究观察了自孕(12±1)周起每月监测和非每月监测梅毒感染孕妇新生儿先天性梅毒(neonatal congenital syphilis, NCS)的发生情况和孕期治疗失败或再感染情况,探讨孕早期梅毒阳性的孕妇血清学监测的合理频次,期望既能有效防止NCS发生,又能避免孕妇滴度监测过频,从而减少孕妇不必要的精神负担和经济负担。
1 资料与方法
1.1 一般资料
2012年1月1日—2018年10月31日因母体梅毒感染入住上海市儿童医院(上海交通大学附属儿童医院,面向全上海市新生儿提供医疗服务,是上海市新生儿转运救治中心)新生儿科的新生儿,追问孕产史,该医院选取来自上海市各家医院的孕(12±1)周建卡时梅毒颗粒凝聚(treponema pallidum particle agglutination, TPPA)试验阳性(+)和快速血浆反应素(rapid plasma reagin, RPR)试验阳性(+),即TPPA+/RPR+,既往无梅毒感染和治疗史,且孕28~32周和临产前4周内完成梅毒血清学检查,同时至少完成2个疗程抗梅毒治疗的孕妇53例,根据自孕(12±1)周起是否每月复查,分为每月监测(monitor per month, MPM)组15例和非每月监测(monitor non per month group, MNPM)组(超过8周未复查)38例。排除标准: 梅毒分期不确定的孕妇,如孕(12±1)周TPPA+/RPR-孕妇(若有成功梅毒治疗史则为痊愈无感染,若无梅毒治疗史则可能在梅毒早期也可能在梅毒晚期,而晚期梅毒传染性较小,因无法确定梅毒分期而排除)。
1.2 观察指标
包括,孕妇年龄(>35岁/<35岁)、户籍(非本地/本地)、受教育程度(大专以上学历/大专以下学历)、弓形虫、巨细胞病毒、单纯疱疹病毒和风疹病毒(toxoplasmosis、other virus、rubella virus、cytomega-lovirus、herpes simplex virus, TORCH)感染情况(阳性/阴性),是否合并妊娠糖尿病(是/否)、妊娠高血压(是/否)和胎膜早破(是/否),感染孕妇明确孕期治疗失败或再感染病例比例,NCS确诊病例比例。孕期治疗失败或再感染患者进一步明确神经梅毒病例数。
1.3 诊断标准
(1) NCS: 出生时RPR定量检测阳性,滴度≥母亲分娩前滴度的4倍,且TPPA阳性[5];(2) 梅毒感染: TPPA+,且RPR+,无既往梅毒病史和治疗史[7-8];(3) 治疗失败或再感染: 治疗后3个月RPR没有4倍以上的下降,或治疗下降后再次升高4倍以上[7-8];(4) 神经梅毒: 梅毒感染基础上,脑脊液细胞数和蛋白升高,性病研究实验室试验(venereal disease research laboratory test, VDRL)阳性[7-8]。
1.4 治疗
孕(12±1)周感染孕妇均按照国家卫生健康委员会《预防艾滋病、梅毒和乙肝母婴传播工作实施方案(2015年版)》[5]和美国CDC《性传播疾病治疗指南》,在有资质的梅毒治疗机构完成了至少2个疗程的治疗[5,7]: 苄星青霉素240万单位,分两侧臀部肌内注射,每周1次,连续3次为1个疗程;普鲁卡因青霉素G,80万单位/d,肌内注射,连续15d为1个疗程。治疗失败或再感染或合并神经梅毒感染者: 静脉用青霉素G 300~400万单位,每4h静脉滴注1次,或者1800~2400万单位/d,持续24h静滴,疗程10~14d[7]。本研究中未发现有青霉素过敏者。
1.5 统计学处理
采用SPSS 19.0统计软件分析数据。所有观察指标均为计数资料,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 孕妇临床资料
MPM组,孕妇年龄(>35岁/<35岁),户籍(非本地/本地),受教育程度(大专以上学历/大专以下学历)比例均高于MNPM组(P<均0.05)。TORCH感染、妊娠期糖尿病、妊娠期高血压和胎膜早破比例组间无差异(P>0.05),见表1。
表1 孕(12±1)周时梅毒感染孕妇临床资料
Tab.1 The clinical data of pregnant women with syphilis infection at gestational (12±1) week
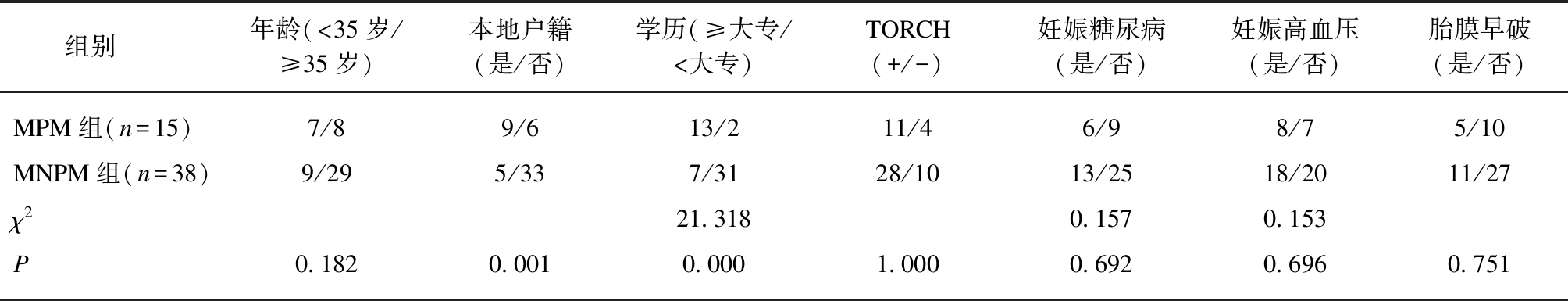
组别年龄(<35岁/≥35岁)本地户籍(是/否)学历(≥大专/<大专)TORCH(+/-)妊娠糖尿病(是/否)妊娠高血压(是/否)胎膜早破(是/否)MPM组(n=15)7/89/613/211/46/98/75/10MNPM组(n=38)9/295/337/3128/1013/2518/2011/27χ221.3180.1570.153P0.1820.0010.0001.0000.6920.6960.751
“TORCH”: 全部阴性为-,有一个以上感染为+;未列出χ2值的为Fisher精确概率计算
2.2 孕期检测频次对发现孕妇治疗失败或再感染以及NCS发生的影响
MPM组NCS病例比例(0/15)明显少于MNPM组(9/29,P<0.05),发现治疗失败或再感染病例比例(4/11)上高于MNPM组(2/36,P<0.05),见表2。MPM组孕妇有4例孕28~32周前发现治疗失败或再感染,增加了1个疗程青霉素静滴抗梅毒治疗,后期随访中RPR逐渐下降,分娩前4周内再次给予1个疗程抗梅毒治疗,整个孕期共3个疗程,无NCS发生。MNPM组分娩前发现治疗失败或再感染2例,分娩前抗体滴度较孕(12±1)周无升高7例;这9例孕妇均在分娩前完成了2个疗程抗梅毒治疗,仍发生了NCS。
2.3 治疗失败或再感染原因
孕(12±1)周时梅毒感染孕妇治疗失败或再感染病例共6例。MPM组4例均在孕28周前发现RPR治疗下降后再次升高4倍以上。MNPM组2例临产前4周内发现RPR较孕(12±1)周升高4倍以上。均无HIV感染。孕(12±1)周时均为苄星青霉素治疗,发现治疗失败或再感染后给予腰椎穿刺脑脊液检测,均证实存在神经梅毒,后续治疗均为青霉素静脉滴注治疗。
表2 孕(12±1)周时梅毒感染孕妇治疗失败或 再感染和NCS发生情况
Tab.2 Reinfection or treatment failure and neonatal congenital syphilis among pregnant women with syphilis infection at gestational (12±1) week
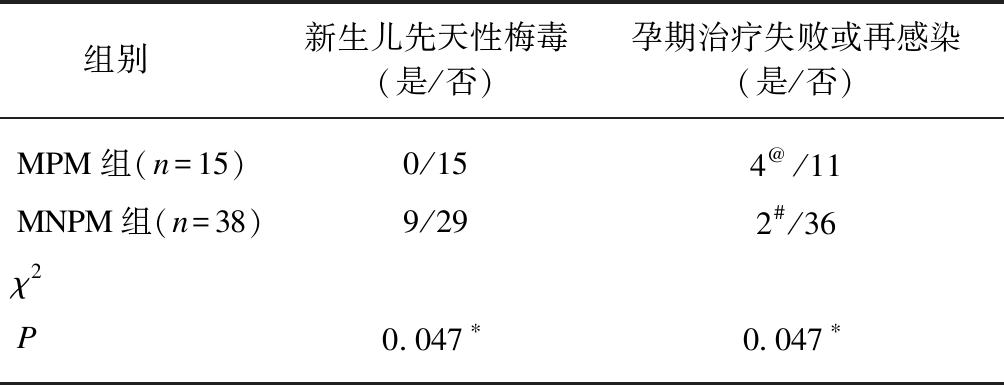
组别新生儿先天性梅毒(是/否)孕期治疗失败或再感染(是/否)MPM组(n=15)0/154@/11MNPM组(n=38)9/292#/36χ2P0.047∗0.047∗
@: 孕28~32周前发现孕期RPR较孕(12±1)周升高4倍以上,并临时增加1个疗程抗梅毒治疗;#: 临产前4周内发现RPR较孕(12±1)周升高4倍以上,共完成了2个疗程抗梅毒治疗;*为Fisher精确概率计算
3 讨 论
我国梅毒发病率由2000年的6.43/10万增至2013年的32.86/10万,发病率是欧美的2~9倍[9]。2014年,梅毒报告病例数在我国甲乙类传染病报告中居第3位[10]。2005年梅毒发病率最高的前2名分别是上海(55.3/10万)、浙江(35.9/10万)[11];2005—2010年,前3名是浙江、广西、上海;2011—2013年,前5名是广西、新疆、福建、浙江、上海[9]。女性隐性梅毒呈现两个发病高峰,其中1个高峰在20~34岁育龄期[9]。2000—2005年,我国孕产妇人群梅毒抗体阳性率为0.45%[12];2001—2015年,上海地区孕妇梅毒的患病率为0.2%~0.38%[13];2000年,NCS报告病例数为468例,报告发病率为2.63/10万活产数;2009年,报告病例数为10757例,报告发病率为60.81/10万活产数;2013年,报告病例数为10032例,报告发病率为69.9/10万活产数[9]。梅毒流行有加重趋势。我国梅毒流行的危险因素广泛存在,其中孕期梅毒滴度监测不规范也是原因之一。RPR滴度高和孕晚期诊治是NCS的独立危险因素[14],要做到早期诊治,需要密切监测。
本研究孕妇均无梅毒特异临床表现,根据TPPA+RPR+和既往阴性病史,属于早期隐性梅毒,而早期隐性梅毒对胎儿具有传染性[7]。一期和二期梅毒治疗后6个月和12个月复查滴度,若有反复感染担心可以适当增加频次[7]。隐性梅毒治疗后6、12、24个月需复查滴度[7]。孕妇梅毒滴度复查要求特殊,治疗后1、3、6、12、24个月复查,要求6个月内下降4倍以上,12~24个月转阴[15],至少在孕28~32周和分娩时复查滴度[5,7,16-17],再次感染高风险的孕妇和梅毒高发地区的孕妇,可以每个月复查滴度[5,7]。根据美国CDC建议或我国“方案”,孕期发现梅毒感染孕妇应该每月监测滴度。很多孕期梅毒感染的孕妇虽然在孕早期和孕晚期完成了2个疗程的抗梅毒治疗,但并未遵照上述规定每月监测滴度,本研究中仅15例进行了每月监测,而38例则未做到每月监测。
MPM组>35岁与<35岁比例、非本地户籍与本地户籍比例、大专以上学历与大专以下学历的比例均高于MNPM组,说明监测频次与教育经历、年龄和人口流动有关。而监测频次从一定程度上说明了孕妇对该病的认知和重视程度。梅毒感染人群中农民最多,占31.56%,其次是家政家务和待业,占17.48%,工人9.1%,离退休人员6.13%,商务人员4.8%;在各年龄段以20~39岁梅毒病例报告数最多[9],说明低教育经历和性活跃年龄段等因素与梅毒发生率有关;Li等[13]研究发现上海市流动人口孕妇梅毒患病率高于常驻人口孕妇。上述研究显示低教育经历、流动人口人群梅毒高发,与本研究发现监测频次不规范的人群一致。
MPM组NCS病例明显少于MNPM组。MNPM组分娩前发现治疗失败或再感染2例,分娩前抗体滴度较孕(12±1)周无升高7例,不能排除是否存在滴度下降后再次升高。这9例孕妇均在分娩前完成了2个疗程的抗梅毒治疗,仍发生了NCS。Bowon等[18]发现314例NCS新生儿母亲接受了1次或以上产前检查,43例孕妇(13.7%)在孕期接受了正规治疗但其新生儿仍发生了NCS,提示孕期可能发生了治疗失败或再感染未及时发现并追加治疗从而导致NCS,本研究结果与之相符。MPM组孕妇治疗失败或再感染多达4例,由于发现和治疗及时,并无NCS发生。以上说明每月监测可以及时发现孕期梅毒治疗失败或再感染,并及时进行补救和干预,可以明显减少NCS发生。本研究发现,MNPM组孕期发现治疗失败或再感染患者少于MPM组,可能是MNPM孕妇发生了治疗失败或再感染,没有就诊而漏诊。有研究发现早期梅毒治疗后3个月时RPR滴度下降超过4倍的患者达88%,6个月时下降超过8倍的达77.8%,发生RPR血清转换的有9.6%,12个月时发生RPR血清转换的有17%[19-22],即使没有治疗,梅毒滴度也可自然下降直至正常[8]。上述原因可以导致临产前例行检查不能发现孕期治疗失败或再感染,特别是滴度下降后再次升高的情况。孕妇血中梅毒螺旋体尤其是早期梅毒可传播给胎儿,通常发生在妊娠第16~28周,有些传播可以早达妊娠第9周[8]。孕期梅毒感染及时发现并治疗可以有效防止NCS发生[8]。
孕期再感染与治疗失败有时很难区分。本研究主要探讨孕期梅毒监测频次与防止NCS发生的关系,所以没有将二者进一步区分。再次感染与再次性接触梅毒患者有关,而治疗失败主要是因为治疗依从性不好,用青霉素类以外的药物治疗,免疫抑制状态,如HIV感染,或并发神经梅毒[23-24]。本研究孕期治疗失败或再感染的6例孕妇均并发神经梅毒,后均改为青霉素静脉滴注治疗。青霉素能很好的透过血脑屏障,达到有效的杀灭浓度,而长效青霉素苄星青霉素透过血脑屏障差,达不到有效的杀灭浓度。因此,在怀疑孕妇治疗失败或再感染时,应警惕神经梅毒发生。
NCS不规范治疗,危害巨大[25],可以造成多脏器损害,特别是神经梅毒,如未及时治疗可导致脑积水、视神经瘫痪、视神经萎缩、脑血管梗死、偏瘫、癫痫等后遗症。我国医疗水平发展不平衡,致使许多NCS新生儿未得到及时规范治疗。所以在大力提高新生儿治疗保健水平的同时[26],积极预防NCS发生就显得尤为重要[27-28],而孕早期梅毒阳性孕妇预防的关键就在于密切监测治疗失败或再感染并及时给予正规抗梅毒治疗。孕早期梅毒阳性的孕妇每月监测梅毒滴度并及时治疗,可以减少新生儿先天性梅毒的发生。
[1] U S PREVENTIVE SERVICES TASK FORCE. Screening for syphilis infection in pregnancy: US preventive services task force reaffirmation recommendation statement[J]. Ann Intern Med, 2009,150(10): 705-709.
[2] US PREVENTIVE SERVICES TASK FORCE, CURRY S J, KRIST A H, et al. Screening for syphilis infection in pregnant women: US preventive services task force reaffirmation recommendation statement[J]. JAMA, 2018,320(9): 911-917.
[3] HOLLIER L M, HILL J, SHEFFIELD J S, et al. State laws regarding prenatal syphilis screening in the United States[J]. Am J Obstet Gynecol, 2003,189(4): 1178-1183.
[4] WARREN H P, CRAMER R, KIDD S, et al. State requirements for prenatal syphilis screening in the United States, 2016[J]. Matern Child Health J, 2018,22(9): 1227-1232.
[5] 中华人民共和国国家卫生健康委员会.预防艾滋病、梅毒和乙肝母婴传播工作实施方案(2015年版)[Z].2015-06-16.
[6] NEWMAN L, KAMB M, HAWKES S, et al. Global estimates of syphilis in pregnancy and associated adverse outcomes: analysis of multinational antenatal surveillance data[J]. PLoS Med, 2013,10(2): e1001396.
[7] WORKOWSKI K A, CENTERS FOR DISEASE CONTROL AND PREVENTION. Sexually transmitted diseases treatment guidelines, 2015[J]. MMWR Recomm Rep, 2015,64(RR-03): 1-137.
[8] 中国疾病预防控制中心.全球消灭先天性梅毒: 依据和行动策略(中文版)[M].日内瓦: 世界卫生组织,2008: 3-5.
[9] 龚向东,岳晓丽,滕菲,等.2000—2013年中国梅毒流行特征与趋势分析[J].中华皮肤科杂志,2014,47(5): 310-315.
[10] 中华人民共和国国家卫生健康委员会.2014年度全国法定传染病疫情情况[EB/OL].(2015-02-16) [2019-03-18]http:∥www.nhc.gov.cn/jkj/s6873/201502/847c041a3bac4c 3e844f17309be0cabd.shtml.
[11] CHEN Z Q, ZHANG G C, GONG X D, et al. Syphilis in China: results of a national surveillanceprogramme[J]. Lancet, 2007,369(9556): 132-138.
[12] LIN CC, GAO X, CHEN X S, et al. China’s syphilis epidemic: a systematic review of seroprevalence studies[J]. Sex Transm Dis, 2006,33(12): 726-736.
[13] LI Y, ZHU L P, DU L, et al. Effects on preventing mother-to-child transmission of syphilis and associated adverse pregnant outcomes: a longitudinal study from 2001 to 2015 in Shanghai, China[J]. BMC Infect Dis, 2017,17(1): 626.
[14] ZHANG X, YU Y, YANG H J, et al. Surveillance of maternal syphilis in China: pregnancy outcomes and determinants of congenital syphilis[J]. MedSci Monit, 2018,24: 7727-7735.
[15] TSIMIS M E, SHEFFIELD J S. Update on syphilis and pregnancy[J]. Birth Defects Res, 2017,109(5): 347-352.
[16] SLUTSKER J S, HENNESSY RR, SCHILLINGER J A. Factors contributing to congenital syphilis cases-new york city, 2010-2016[J]. MMWR Morb Mortal Wkly Rep, 2018,67(39): 1088-1093.
[17] MATTHIAS J M, RAHMAN M M, NEWMAN D R, et al. Effectiveness of prenatal screening and treatment to prevent congenital syphilis, Louisiana and Florida 2013- 2014[J]. Sex Transm Dis, 2017,44(8): 498-502.
[18] BOWEN V, SU J, TORRONE E, et al. Increase in incidence of congenital syphilis-United States, 2012-2014[J]. MMWRMorb Mortal Wkly Rep, 2015,64(44): 1241-1245.
[19] SE A A C, WOLFF M, BEHETS F, et al. Rate of decline in nontreponemal antibody titers and seroreversion after treatment of early syphilis[J]. Sex Transm Dis, 2017,44(1): 6-10.
A A C, WOLFF M, BEHETS F, et al. Rate of decline in nontreponemal antibody titers and seroreversion after treatment of early syphilis[J]. Sex Transm Dis, 2017,44(1): 6-10.
[20] SE A A C, ZHANG X H, LI T, et al. A systematic review of syphilis serological treatment outcomes in HIV-infected and HIV-uninfected persons: rethinking the significance of serological non-responsiveness and theserofast state after therapy[J]. BMC Infect Dis, 2015,15: 479.
A A C, ZHANG X H, LI T, et al. A systematic review of syphilis serological treatment outcomes in HIV-infected and HIV-uninfected persons: rethinking the significance of serological non-responsiveness and theserofast state after therapy[J]. BMC Infect Dis, 2015,15: 479.
[21] ROMANOWSKI B, SUTHERLAND R, FICK G H, et al. Serologic response to treatment of infectious syphilis[J]. Ann Intern Med, 1991,114(12): 1005-1009.
[22] AUGENBRAUN M, ROLFS R, JOHNSON R, et al. Treponemal specific tests for the serodiagnosis of syphilis. syphilis and HIV study group[J]. Sex Transm Dis, 1998,25(10): 549-552.
[23] HOOK E W 3rd. Syphilis[J]. Lancet, 2017,389(10078): 1550-1557.
[24] BARNETT R. Syphilis[J]. Lancet, 2018,391(10129): 1471.
[25] GOMEZ G B, KAMB M L, NEWMAN L M, et al. Untreated maternal syphilis and adverse outcomes of pregnancy: a systematic review and meta-analysis[J]. Bull World Health Organ, 2013,91(3): 217-226.
[26] 胡淑怡,杜莉,朱丽萍.上海市孕前优生健康检查现状及影响因素调查分析[J].同济大学学报(医学版),2018,39(3): 114-118.
[27] RAC M W, REVELL P A, EPPES C S. Syphilis during pregnancy: a preventable threat to maternal-fetal health[J]. Am J Obstet Gynecol, 2017,216(4): 352-363.
[28] 王红兵,丘瑾,潘群.抗梅毒治疗对妊娠合并梅毒孕妇及胎儿的影响[J].同济大学学报(医学版),2003,24(5): 449-451.