恶性黑色素瘤是一种高度侵袭性的肿瘤,预后差、严重威胁人类健康[1]。据报道,中国的晚期黑色素瘤患者约25.5%存在鼠类肉瘤病毒癌基因同源B1(v-Raf murine sarcoma viral oncogene homolog B1, BRAF)基因突变[2]。2011年8月,维罗非尼(vemurafenib)被批准用于BRAF突变的转移性晚期黑色素瘤患者[3]。维罗非尼可提高患者的无进展生存期(progression-free survival, PFS),但大多数患者6~7个月出现耐药[4]。维罗非尼耐药以后,治疗手段有限且疗效不佳,因此需要探讨维罗非尼耐药后恶性黑色素瘤新的治疗手段。
溶瘤病毒(oncolytic virus, OVs)在肿瘤治疗方面取得重要突破,但是OVs在恶性黑色素瘤vemurafenib耐药治疗中的价值尚不清楚。既往文献[5-6]显示,OVs除对肿瘤细胞产生直接的溶解作用外,还可诱导表达或释放钙网蛋白(calreticulin, CRT)、三磷酸腺苷(adenosine triphosphate, ATP)、高迁移率族蛋白1(high mobility group protein 1, HMGB1)、热休克蛋白90(heat shock protein 90, HSP90)等激起细胞免疫原性的损伤相关分子模式(damage associated molecular patterns, DAMPs),进而诱发非耐药肿瘤细胞免疫原性死亡(immunogenic cell death, ICD)[8-9]。
肿瘤的发生发展与免疫机制关联密切[9-10],本研究旨在细胞水平上验证新城疫病毒毒株FMW(Newcastle disease virus, NDV/FMW)对恶性黑色素瘤WM3248/vemurafenib细胞株的杀伤效应,进一步探讨NDV/FMW对耐药细胞杀伤效应的可能免疫机制,为恶性黑色素瘤维罗非尼耐药的临床治疗提供依据。
1 材料与方法
1.1 实验材料与仪器
人BRAF突变的黑色素瘤WM3248细胞株和WM3248/vemurafenib细胞株由Joon Kim实验室提供[11];鸡胚成纤维细胞株DF1购自美国ATCC公司;NDV/FMW由大连医科大学孟松树实验室提供;DMEM培养基、0.25%胰酶(Trypsin-EDTA)、RPMI-1640培养基、胎牛血清(FBS)、双抗(Pen Strep)购自美国Gibco公司;兔抗人cleaved Caspase-3抗体、兔抗人poly(ADP-ribose)polymerase(PARP)抗体、兔抗人GAPDH抗体购自美国Cell公司;鼠抗人HN抗体和鼠抗人HSP90抗体购自美国Santa Cruz公司;兔抗人CRT多克隆抗体和兔抗人HMGB1抗体购自英国Abcam公司;羊抗兔Alexa Fluor488抗体和羊抗鼠Alexa Fluor 568抗体购自美国Invitrogen公司;米托蒽醌(MTX)购自美国Selleckchem公司;DAPI购自美国Sigma公司;Cell Counting Kit-8(CCK-8)试剂盒购自美国Med Chem Express公司;ATP检测试剂盒购自上海碧云天生物技术有限公司;Pierce蛋白浓缩管购自美国Thermo Scientific公司;多功能酶标仪-PE(多模式微孔板检测系统)购自美国Perkin Elmer公司;激光(扫描)共聚焦显微镜购自德国Leica公司;凝胶成像(蛋白)仪购自美国Bio-Rad公司;流式细胞分析系统-C6购自美国BD公司。
1.2 细胞培养
人BRAF突变的黑色素瘤WM3248细胞株和WM3248/vemurafenib细胞株用含5%胎牛血清、1%双抗的RPMI-1640培养基培养,鸡胚成纤维细胞株DF1用含10%胎牛血清、1%双抗的DMEM培养基培养。细胞置于37℃、5%CO2饱和湿度培养箱中按照常规方法培养。
1.3 病毒滴度测定
感染复数(multiplicity of infection, MOI)为0.01的NDV/FMW感染WM3248细胞株和WM3248/vemurafenib细胞株,收集上清液进行梯度稀释,用DF-1细胞株进行病毒滴度检测。
1.4 CCK8检测细胞存活率
将黑色素瘤细胞分为4组,WM3248CON组,WM3248NDV/FMW组,WM3248/vemurafenibCON组,WM3248/vemurafenibNDV/FMW组。除对照组外,其他组用MOI=1的NDV/FMW感染黑色素瘤细胞1h后,更换2%RPMI-1640培养基,将96孔板置于培养箱继续培养24、48、72h,每孔设5个复孔。待培养时间结束后向待测孔中加入10μL的CCK-8溶液,将细胞培养板放回培养箱中继续孵育1~4h。用酶标仪测定细胞培养板在450nm处的光密度值(D450),并计算分析。
1.5 Western印迹法检测凋亡及自噬相关蛋白变化
WM3248细胞株和WM3248/vemurafenib细胞株10×105个/皿,分别设为对照组与NDV/FMW组,MOI=1的NDV/FMW感染1h后,每皿更换3mL无血清RPMI-1640后放入培养箱继续培养。NDV/FMW感染24、48h后,收集上清液浓缩至100μL,并收集细胞裂解液,用考马斯亮蓝法测定裂解液中的蛋白浓度。取30μg蛋白用10%的分离胶和4%的浓缩胶进行SDS-PAGE电泳,电泳完毕后,将蛋白转印到NC膜上,5%的脱脂奶粉封闭2h,然后用兔抗人cleaved Caspase-3抗体,兔抗人PARP抗体,兔抗人GAPDH抗体,鼠抗人HN抗体,兔抗人HMGB1抗体,鼠抗人HSP90抗体4℃冰箱孵育过夜,用TBST洗涤2次,每次10min,后加入1∶10000的二抗室温孵育1h,用TBST洗涤2次后显影。
1.6 流式细胞术检测CRT表达
MOI=1的NDV/FMW处理WM3248细胞株和WM3248/vemurafenib细胞株48h,胰酶消化后PBS洗涤2次,加入1∶200稀释的兔抗人CRT多克隆抗体,冰上孵育1~2h,PBS洗涤,加入1∶1000的羊抗兔AlexaFluor 488抗体,冰上避光孵育30min,PBS洗涤,流式细胞术检测细胞表面CRT的表达。
1.7 激光共聚焦检测细胞表面CRT的表达
MOI=1的NDV/FMW感染WM3248细胞株和WM3248/vemurafenib细胞株48h,PBS洗涤2次,4%多聚甲醛固定15min后PBS洗涤2遍,加入1∶75稀释的兔抗人CRT多克隆抗体和鼠抗人HN抗体,孵育2~3h,PBS洗涤,加入1∶1000的羊抗兔Alexa Fluor 488抗体和羊抗鼠Alexa Fluor 568抗体,孵育30min,PBS洗涤后DAPI染色,清洗2次,激光共聚焦显微镜检测细胞表面CRT的表达。
1.8 荧光素酶法检测ATP释放
WM3248细胞株和WM3248/vemurafenib细胞株(1×105/孔)铺于12孔板,MOI=1的NDV/FMW感染48h后,收集上清液。根据ENLITEN ATP试剂盒说明书检测上清液中ATP的含量。
1.9 统计学处理
实验数据采用SPSS 20.0和Graphpad Prim软件分析,所有实验均重复3次,结果以![]() 表示。组间差异比较采用t检验分析。P<0.05表示差异有统计学意义。
表示。组间差异比较采用t检验分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 NDV/FMW在WM3248/vemurafenib细胞株中有效复制
通过病毒滴度检测考察病毒在细胞内的复制情况。NDV/FMW感染WM3248/vemurafenib细胞株24、48、72h后,病毒滴度逐渐增加。结果表明,NDV/FMW在WM3248/vemurafenib细胞株内有效复制,见图1。
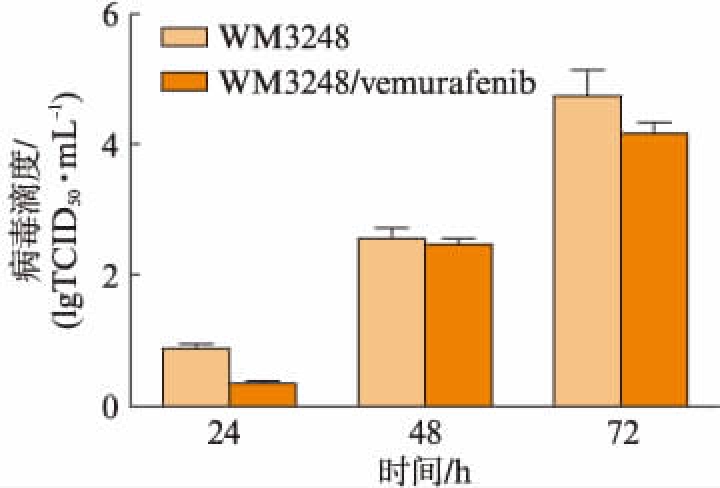
图1 NDV/FMW在WM3248/vemurafenib 细胞株中有效复制
Fig.1 NDV/FMW effectively replicated in WM3248/ vemurafenib cell line
2.2 NDV/FMW降低WM3248/vemurafenib细胞株存活率并促进细胞凋亡
NDV/FMW感染WM3248/vemurafenib细胞株24、48、72h后,细胞存活率逐渐降低(P<0.001),见图2A。Western印迹法检测凋亡相关蛋白变化,HN为NDV/FMW感染指示蛋白。NDV/FMW感染WM3248/vemurafenib细胞株后,cleaved-caspase-3和cleaved-PARP蛋白在48h明显增加,见图2B。上述结果表明,NDV/FMW显著降低WM3248/vemurafenib细胞株存活率并促进凋亡。

图2 NDV/FMW显著降低WM3248/vemurafenib 细胞株存活率并促进耐药细胞凋亡
Fig.2 NDV/FMW significantly reduced cell viability and induced apoptosis in WM3248/vemurafenib cells
A: NDV/FMW感染WM3248/vemurafenib细胞株24、48、72h后,细胞存活率逐渐降低,***P<0.001,亲本细胞用蓝色*代表,耐药细胞用红色*代表;B: Western印迹法检测NDV/FMW对WM3248/vemurafenib凋亡的影响
2.3 NDV/FMW诱导WM3248/vemurafenib细胞株免疫原性死亡相关分子表达或释放
NDV/FMW感染WM3248/vemurafenib细胞株48h后,细胞膜CRT阳性细胞数从1.3%±0.84%增至53.2%±2.56%(P<0.001),见图3A。激光共聚焦结果也显示NDV/FMW感染耐药细胞后,细胞膜表面CRT表达比对照组明显增加,HN也表达增加,见图3B。与对照组相比,NDV/FMW感染WM3248/vemurafenib细胞株后培养液上清液中的HMGB1和HSP90显著释放,ATP分泌增加,差异有统计学意义(P<0.05)。但NDV/FMW感染WM3248细胞48h后ATP比对照组有所消耗(P<0.01),见图3C、D。结果表明NDV/FMW诱导WM3248/vemurafenib细胞株表达或释放免疫原性死亡相关分子。
3 讨 论
新城疫病毒属溶瘤病毒的一种,目前应用于肿瘤治疗的MTH68/H、PV-701、73-T、90D和FMW等毒株均具有良好的溶瘤性[12-13]。既往研究已经证明,NDV/FMW可在神经胶质瘤亲本细胞株U251、肺癌顺铂(DDP)耐药细胞株A549/DDP和肺癌紫杉醇(PTX)耐药细胞株A549/PTX中复制,抑制肿瘤细胞存活率并诱导细胞凋亡或自噬[14-15]。本研究发现,NDV/FMW不仅对恶性黑色素瘤WM3248细胞株有杀伤作用,也对WM3248/vemurafenib细胞株起作用。
本研究进一步发现NDV/FMW对WM3248/vemurafenib细胞株发生ICD相关分子表达的影响,包括细胞膜表面CRT表达增加、ATP分泌、HMGB1和HSP90释放。上述分子的变化与ICD的发生密切相关。肿瘤细胞在死亡早期,CRT从内质网迅速翻转到细胞膜表面,肿瘤细胞膜上的CRT可作为一种“eat me”信号被DC细胞识别和结合,促进肿瘤细胞被DC细胞识别和吞噬,多种肿瘤模型中已证实抑制CRT的表达使肿瘤细胞的免疫原性清除[16]。HSP90同样作为“eat me”信号促进抗肿瘤的免疫原性[17]。HMGB1存在于细胞核和细胞质中,在细胞坏死和凋亡后的细胞均可释放HMGB1,HMGB1同样作为危险信号,有介导细胞免疫原性的潜力[17]。凋亡细胞释放出的ATP被认为是“find-me”信号,由此通过ATP的介导将吞噬细胞聚集在凋亡细胞周围,进而促进凋亡细胞的吞噬和清除[18]。但本研究结果提示NDV/FMW感染WM3248细胞后ATP未见释放增加。既往研究表明,ICD相关的ATP分泌是涉及多种分子的复杂途径,如自噬(ATG 5、ATG 7和BCN 1)、溶酶体外吞(LAMP 1、VAMP 1)、凋亡(Caspases)、膜泡(ROCK 1,肌球蛋白Ⅱ)和质膜透性(Panx 1)等[19]。这些系统中任何分子的缺失都可造成细胞分泌的ATP减少,这意味着细胞自噬、溶酶体功能、caspase活化、膜泡和质膜通透性的改变可能对WM3248细胞ATP的分泌产生影响,需做进一步探讨。
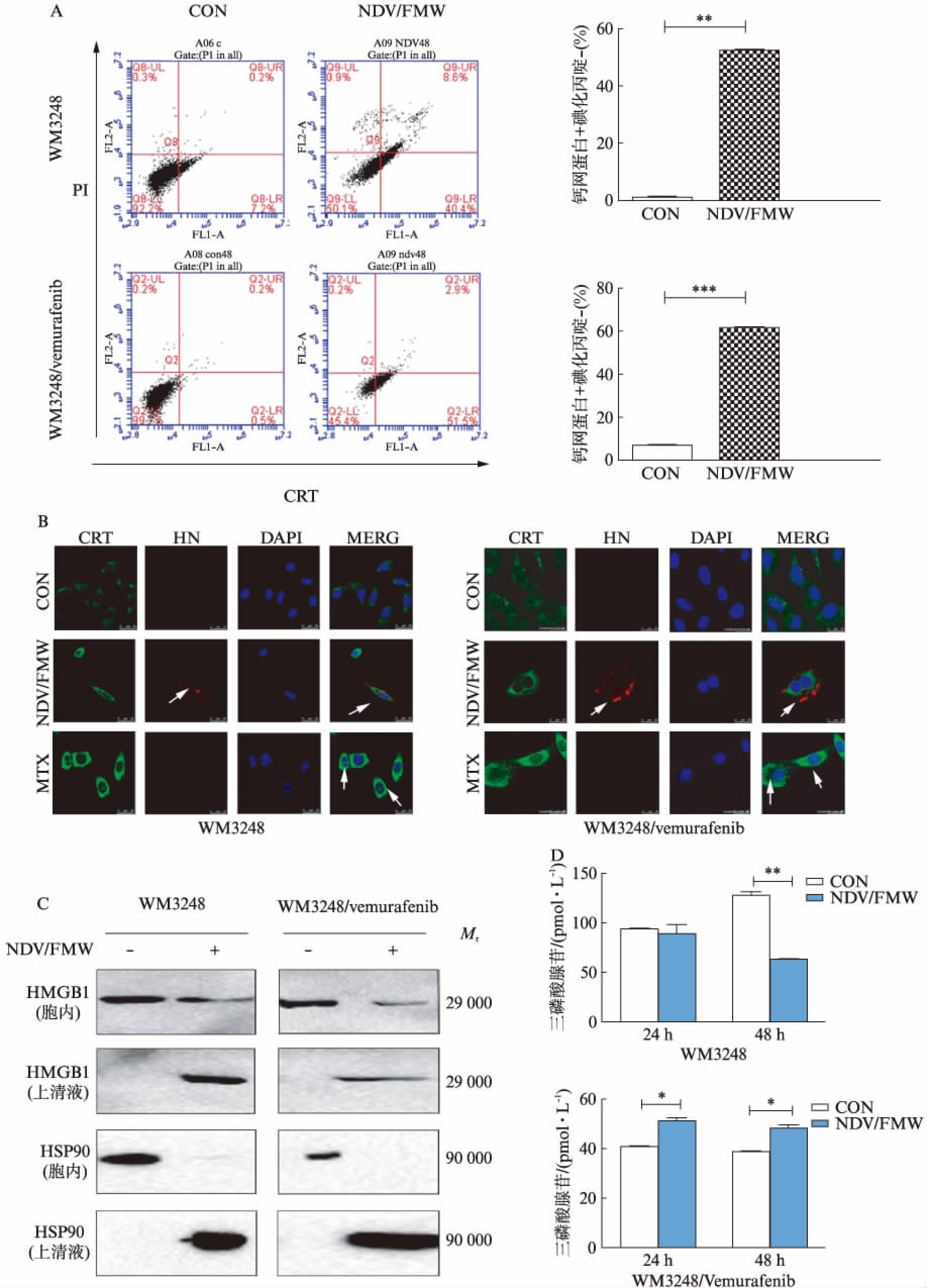
图3 NDV/FMW诱导WM3248/vemurafenib细胞株免疫原性死亡相关分子表达或释放
Fig.3 NDV/FMW induced the expression or release of immunogenic cell death related molecules in WM3248/vemurafenib cells
A: 流式细胞术检测耐药细胞表面CRT百分比,**P<0.01,***P<0.001;B: 激光共聚焦检测细胞表面绿色荧光增强,绿色荧光代表CRT,红色荧光代表NDV/FMW特异性HN蛋白,蓝色荧光代表DAPI,米托蒽醌(mitoxantrone,MTX)为阳性对照;C: Western印迹法检测耐药细胞上清液中HMGB1和HSP90的释放;D: 荧光素酶法检测ATP释放,*P<0.05,**P<0.01
本研究不仅在细胞水平上验证NDV/FMW对WM3248/vemurafenib细胞株有细胞毒作用,还进一步证明NDV/FMW可诱导WM3248/vemura-fenib细胞株ICD相关分子表达,进而增强耐药细胞的免疫应答,为NDV/FMW作为恶性黑色素瘤vemurafenib耐药治疗的可行方案提供实验依据。后期实验将进一步研究影响ATP分泌的相关因素,构建恶性黑色素瘤vemurafenib耐药的荷瘤小鼠,进一步探讨NDV/FMW对vemurafenib耐药的体内免疫机制。
[1] OWENS B. Melanoma[J]. Nature, 2014,515(7527): S109.
[2] SI L, KONG Y, XU X W, et al. Prevalence of BRAF V600E mutation in Chinese melanoma patients: large scale analysis of BRAF and NRAS mutations in a 432-case cohort[J]. Eur J Cancer, 2012,48(1): 94-100.
[3] HEAKAL Y, KESTER M, SAVAGE S. Vemurafenib(PLX4032): an orally available inhibitor of mutated BRAF for the treatment of metastatic melanoma[J]. Ann Pharmacother, 2011,45(11): 1399-1405.
[4] MCARTHUR G A, CHAPMAN P B, ROBERT C, et al. Safety and efficacy of vemurafenib in BRAF(V600E)and BRAF(V600K)mutation-positive melanoma(BRIM-3): extended follow-up of a phase 3, randomised, open-label study[J]. Lancet Oncol, 2014,15(3): 323-332.
[5] ZHAO L J, NIU C, SHI X M, et al. Dendritic cells loaded with the lysate of tumor cells infected with Newcastle Disease Virus trigger potent anti-tumor immunity by promoting the secretion of IFN-γ and IL-2 from T cells[J]. Oncol Lett, 2018,16(1): 1180-1188.
[6] TAKASU A, MASUI A, HAMADA M, et al. Immunogenic cell death by oncolytic herpes simplex virus type 1 in squamous cell carcinoma cells[J]. Cancer Gene Ther, 2016,23(4): 107-113.
[7] LI X Y. The inducers of immunogenic cell death for tumor immunotherapy[J]. Tumori, 2018,104(1): 1-8.
[8] YE T, JIANG K, WEI L W, et al. Oncolytic Newcastle disease virus induces autophagy-dependent immunogenic cell death in lung cancer cells[J]. Am J Cancer Res, 2018,8(8): 1514-1527.
[9] 包立豪,房林.NF-κB信号通路在乳腺癌发生及发展中作用的研究进展[J].同济大学学报(医学版),2017,38(3): 128-132.
[10] MA Y T, PITT J M, LI Q Q, et al. The renaissance of anti-neoplastic immunity from tumor cell demise[J]. Immunol Rev, 2017,280(1): 194-206.
[11] KIM M H, KIM J, HONG H, et al. Actin remodeling confers BRAF inhibitor resistance to melanoma cells through YAP/TAZ activation[J]. EMBO J, 2016,35(5): 462-478.
[12] LORENCE R M, ROBERTS M S, O’NEIL J D, et al. Phase 1 clinical experience using intravenous administration of PV701, an oncolytic Newcastle disease virus[J]. Curr Cancer Drug Targets, 2007,7(2): 157-167.
[13] SUI H, WANG K B, XIE R, et al. NDV-D90suppresses growth of gastric cancer and cancer-related vascularization[J]. Oncotarget, 2017,8(21): 34516-34524.
[14] MENG S S, ZHOU Z Z, CHEN F, et al. Newcastle disease virus induces apoptosis in cisplatin-resistant human lung adenocarcinoma A549 cells in vitro and in vivo[J]. Cancer Lett, 2012,317(1): 56-64.
[15] MENG C C, ZHOU Z Z, JIANG K, et al. Newcastle disease virus triggers autophagy in U251glioma cells to enhance virus replication[J]. Arch Virol, 2012,157(6): 1011-1018.
[16] VENKATESWARAN K, VERMA A, BHATT A N, et al. Emerging roles of calreticulin in cancer: implications for therapy[J]. Curr Protein Pept Sci, 2018,19(4): 344-357.
[17] GARG A D, ROMANO E, RUFO N, et al. Immunogenic versus tolerogenic phagocytosis during anticancer therapy: mechanisms and clinical translation[J]. Cell Death Differ, 2016,23(6): 938-951.
[18] DI BLASIO S, WORTEL I M, VAN BLADEL D A, et al. Human CD1c+ DCs are critical cellular mediators of immune responses induced by immunogenic cell death[J]. Oncoimmunology, 2016,5(8): e1192739.
[19] MARTINS I, WANG Y, MICHAUD M, et al. Molecular mechanisms of ATP secretion during immunogenic cell death[J]. Cell Death Differ, 2014,21(1): 79-91.