脑出血(intracerebral hemorrhage, ICH)是由于脑血管破裂导致血液溢出至脑实质或蛛网膜下而造成的神经损伤,我国脑出血发病率占脑卒中的17.1%~55.4%,远高于欧美发达国家的6.5%~19.6%[1-3];且脑出血易复发、预后差、死亡率高,患者即使存活,生活质量也大大降低[4-5]。目前较有前景的治疗手段为干细胞治疗法,其中内源性干细胞由于不存在细胞来源、排斥以及成瘤等问题[6],因此具有很强的治疗潜力。大脑中存在多种类型的干性细胞,如神经干细胞和血管干细胞等。而当大脑受到损伤后,周细胞以及星形胶质细胞等终末分化细胞在损伤因子的刺激下能发生重编程而获得干性,共同参与修复。CD133(prominin-1)在神经干细胞、外周血干细胞及血管祖细胞等多种干/祖细胞中均有表达[7],小鼠室管膜下区存在可被激活的CD133+神经干细胞,激活后能进一步分化成为神经元和胶质细胞[8-9]。本研究将CD133-Cre-ERT2转基因C57BL/6小鼠以及含Rosa26-CAG-LSL-ZsGreen报告基因C57BL/6小鼠杂交,得到可示踪CD133+干细胞的CD133-CreER;CAG-ZsGreen示踪小鼠,利用该小鼠制备纹状体出血性脑卒中动物模型,探究CD133+干细胞迁移、增殖与分化情况,分析评价CD133+干细胞对出血性卒中损伤的修复作用;同时观察损伤区域或附近的周细胞、星形胶质细胞等终末分化细胞受损伤因子刺激而参与损伤修复情况,为临床脑出血研究提供生物学基础。
1 材料与方法
1.1 仪器与试剂
他莫昔芬(tamoxifen,T5648)、三溴乙醇(T48402)、封片剂(O8015)、蔗糖(V900116)、玉米油(C8267)购自美国Sigma公司;4%多聚甲醛(PFA,p1110)、Tween20(T8220)、Triton-X100(T8200)购自北京索莱宝公司;驴血清(Y2-017-111-121-10)购自美国Jackson ImmunoResearch公司;兔抗小鼠GFAP多克隆抗体(Anti-GFAP,A0237)购自武汉爱博泰克生物科技有限公司;小鼠抗GFAP单隆抗体(anti-GFAP,MAB3402)购自美国Merck Millipore公司;兔抗小鼠双皮质素多克隆抗体(anti-DCX,ab18723)、兔抗小鼠血小板源性生长因子受体多克隆抗体(anti-PDGFRβ,ab32570)、小鼠抗Nestin单克隆抗体(anti-Nestin,ab6142)购自美国Abcam公司;驴抗兔Alexa Fluor 555二抗(A-31572)、驴抗小鼠Alexa Fluor 647二抗(A-31571)购自美国Invitrogen公司;无水乙醇(10009218)购自中国国药集团有限公司。
多聚赖氨酸包被载玻片(188105w)、粘附盖玻片(10212450c)购自江苏世泰实验器材有限公司;立体定位注射仪(68025)购自深圳市瑞沃德生命科技有限公司、冰冻切片机(CM1905)、石蜡切片机(RM2125)购自德国莱卡公司、汉密尔顿微量50μL进样针(765501)购自美国Hamilton公司;手术刀、眼科显微剪、弯镊、一次性1mL注射器、双针尼龙缝合针购自上海医疗器械股份有限公司;激光共聚焦显微镜成像系统(A1R)购自日本尼康公司。
1.2 实验动物
成年雄性CD133+细胞谱系示踪小鼠(CD133-Cre-ERT2;CAG-loxP-STOP-loxP-ZsGreen)由本实验构建。24只体质量25~30g雄性小鼠随机分为假手术组与出血组,每组12只,其中出血组再分为损伤后1、3、7、14d组,每组3只。
1.3 他莫昔芬的配制以及注射
将0.1g他莫昔芬溶加入55℃预热的1mL无水乙醇中,并于55℃水浴至晶体充分溶解,然后用55℃预热的吸头将其转移至37℃预热的9mL玉米油中,反复吹打混匀,得到终质量浓度为10mg/mL的他莫昔芬溶液,分装并置于-20℃保存。
小鼠每日200μL连续注射他莫昔芬溶液5d,注射7d后进行脑出血动物模型制备。
1.4 出血性脑损伤小鼠模型的构建
25mg/mL三溴乙醇腹腔注射麻醉,剔除小鼠头顶毛发并固定至立体定位注射仪上,75%乙醇消毒,由小鼠双眼连线中点起向鼠尾方向切一长约1cm切口,暴露小鼠前后囟,使用过氧化氢清洗前囟位置。参考小鼠脑图谱,于前囟右2.0mm、后0.2mm处用钻头钻一直径1mm左右的颅孔。取小鼠尾静脉自体血30μL并迅速转移至汉密尔顿微量注射器,经上述颅孔进针,待针尖全部没入小鼠颅孔,进针深度3mm,以2μL/min速度注射小鼠自体血5μL,停针5min后再垂直进针0.7mm,以同样速度注射剩余25μL血液,停针5min后缓慢抽出针头,用骨蜡填补颅孔并缝合创口。假手术组仅垂直进针3.7mm插入纹状体,不进行血液注射,其余操作与出血组一致。小鼠术后置于37℃电热毯保温至清醒,转移至干净鼠笼25℃恒温饲养,饲料用水浸泡后喂食,小鼠术后允许自由活动。
1.5 神经功能评价
出血组及假手术组分别于损伤后1、3、7、14d进行神经功能损伤评分,参考国际公认的小鼠神经功能损伤评分标准(modified neurological severity score, mNSS)进行评分[10]。评价最高为14分,包括动力测试、感官测试以及反射等方面,1~4分为轻度损伤,5~9分为中度损伤,10~14分为重度损伤。剔除损伤后第1天时轻度损伤小鼠,采用中重度损伤5~14分小鼠进行后续实验,剔除小鼠随机补充。
1.6 DCX、GFAP和PDGFRβ免疫荧光单标记染色
出血组小鼠分别于损伤后1、3、7、14d处死,取脑组织4%多聚甲醛固定过夜并脱水,OCT包埋,并置于-80℃冷冻过夜保存。使用冰冻切片机10μm厚度冠状连续切片,保留纹状体部位切片;每隔6张切片取1张切片PBS洗涤,4%驴血清、0.3%Triton X-100封闭液室温封闭1h,分别滴加兔抗小鼠DCX(1∶1000)多克隆抗体、兔抗小鼠GFAP(1∶200)多克隆抗体和兔抗小鼠PDGFRβ(1∶200)多克隆抗体一抗50μL后4℃过夜孵育。弃掉一抗并PBS洗涤后滴加对应二抗与DAPI免疫染色剂室温孵育1h,PBS洗5min重复3次,切片吸干水分后滴加Mount封闭液封片,4℃保存。
1.7 Ki67/GFAP和PDGFRβ/Nestin免疫荧光双标记染色
小鼠脑组织切片取出平衡室温,吹干后用1×PBS清洗3次并滴加上述封闭液室温封闭1h;每隔6张切片取1张,进行以下组合一抗染色: 兔抗小鼠Ki67多克隆抗体(1∶500)和小鼠抗GFAP单克隆抗体(1∶500)、兔抗小鼠PDGFRβ多克隆抗体(1∶200)和小鼠抗Nestin单克隆抗体(1∶200)。4℃孵育过夜后,1×PBS洗涤3次并滴加对应二抗与DAPI免疫染色剂室温孵育1h,1×PBS洗3次后滴加Mount封片剂封片,4℃保存。
1.8 共聚焦显微镜观察与细胞计数
采用激光共聚焦显微镜观察上述切片,DAPI、ZsGreen、Alexa Fluor 555以及Alexa Fluor 647荧光信号分别在激发波长405、488、561、640nm和发射波长461、505、568、668nm下检测并扫描。选取出血损伤后1、3、7、14d等4个时间点,每个时间点共3只小鼠,每只小鼠取3张脑片,拍摄损伤灶周以及对侧相应位置的3个20倍镜视野,分别计数PDGFRβ+和GFAP+细胞,以细胞完整处于视野中,且与DAPI信号共定位计算为1个阳性细胞,结合专业软件Image J分别计数每个视野阳性细胞数量,由图像标尺得出视野面积并计算单只小鼠PDGFRβ+和GFAP+细胞密度平均值;由于室管膜下区(subventricular zone, SVZ)为神经发生的主要区域,因此每只小鼠选取8张脑片拍摄出血侧与对侧SVZ区1个20倍镜视野,并以相同方式计数DCX+细胞数量和单只小鼠DCX阳性细胞密度平均值。
1.9 统计学处理
实验数据采用SPSS 19.0软件进行统计学分析,每组的细胞计数以![]() 表示。对损伤后各时间点两组(出血组与假手术组)间行为学损伤得分、出血组各时间点两组(出血侧纹状体区及对照侧相应位置)间的GFAP+细胞计数,PDGFRβ+细胞计数,出血组各时间点两组(出血侧SVZ区与对照侧SVZ)间DCX+/ZsGreen+双阳性细胞计数,DCX+细胞计数进行分别进行两独立样本t检验。P<0.05表示差异具有统计学意义。
表示。对损伤后各时间点两组(出血组与假手术组)间行为学损伤得分、出血组各时间点两组(出血侧纹状体区及对照侧相应位置)间的GFAP+细胞计数,PDGFRβ+细胞计数,出血组各时间点两组(出血侧SVZ区与对照侧SVZ)间DCX+/ZsGreen+双阳性细胞计数,DCX+细胞计数进行分别进行两独立样本t检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 神经功能损伤评分
参照mNSS神经功能损伤评分标准,分别于损伤后1、3、7、14d对出血组与假手术组进行神经功能损伤评分。所有脑出血组小鼠损伤后1d时神经功能损伤评分均高于4分,无剔除小鼠。损伤后1、3、7、14d各个时间点出血组的神经功能损伤明显,而假手术组无神经功能损伤,出血组与假手术组相比差异具有统计学意义(P<0.05)。且在出血组小鼠在损伤后1d时神经功能缺损最严重,随损伤后时间增多出血组的神经功能缺损逐渐降低,至损伤后14d时损伤明显改善,见图1。
2.2 脑出血可诱导损伤灶周的PDGFRβ+周细胞获得干性
周细胞的来源与间充质干细胞相同,也是中胚层,因此具有与间充质干细胞非常相似的干性特征。为探究血管周细胞在脑出血大脑中是否能获得干性,本研究中采用免疫荧光标记染色观察出血灶周的血管周细胞,发现出血损伤3d后出血灶周围PDGFRβ+与Nestin+共定位,见图2。
为进一步探究脑出血损伤对周细胞数量的影响,本实验对损伤后1、3、7、14d损伤侧纹状体区以及对侧同等位置的周细胞数量进行了统计,结果发现损伤后1、3、7、14d两侧周细胞数量差异无统计学意义,且均不随损伤后时间的变化而改变,提示出血损伤能诱导血管周细胞获得干性,具有重编程为神经细胞或血管细胞的潜能,但出血损伤对周细胞的数量并无影响,见图3。
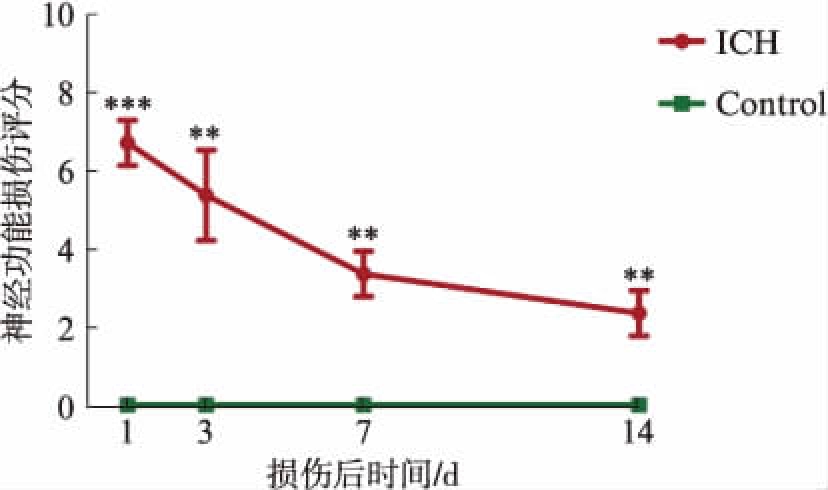
图1 损伤后各时间点神经功能行为学评分
Fig.1 Neurologic severity score test score points at different time points after injury
与假手术组相比,**P<0.01,***P<0.001
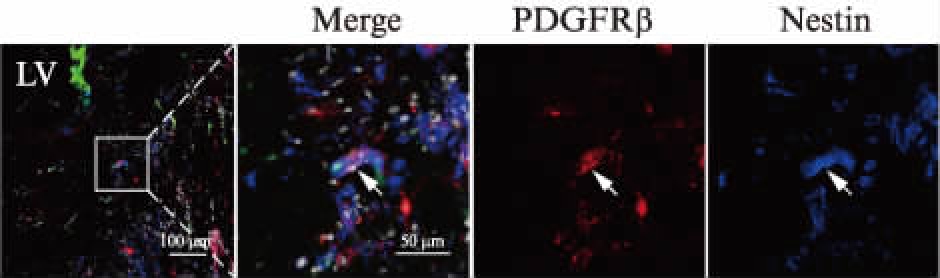
图2 损伤附近的血管周细胞与Nestin共定位
Fig.2 Co-expressing of PDGFRβ with neural stem/progenitor cell marker Nestin
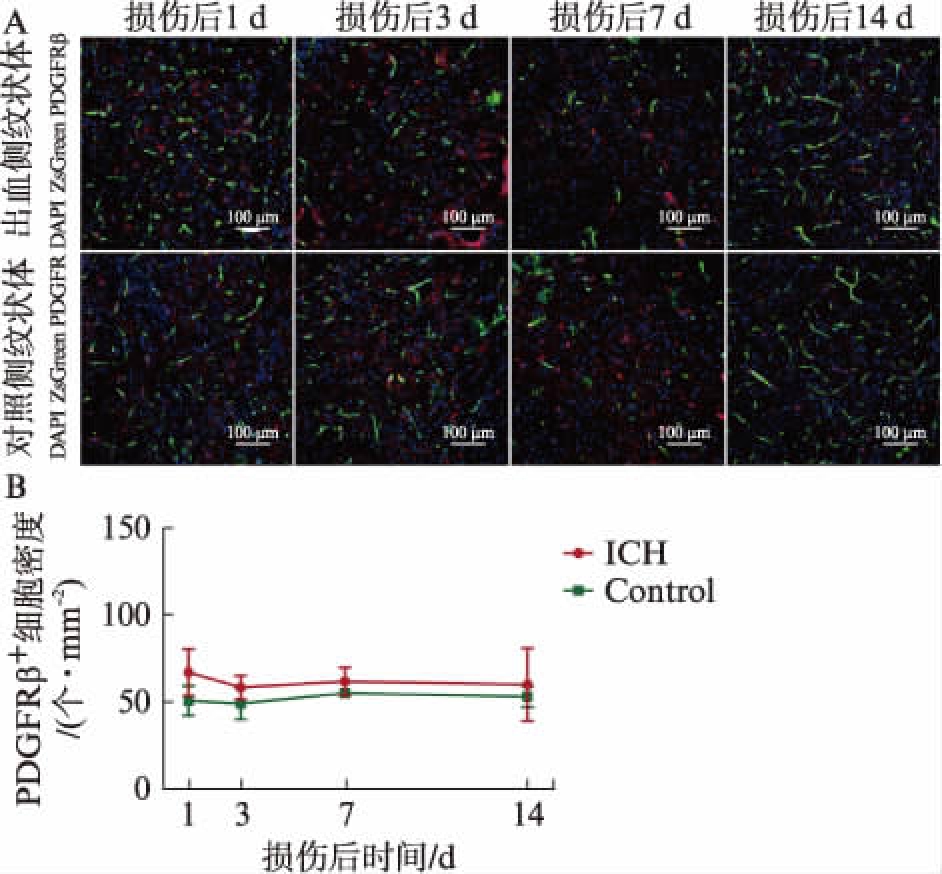
图3 损伤后两侧纹状体周细胞数量对比
Fig.3 Comparison the number of pericytes in hemorrhage side and non-surgery side at different time points after injury
2.3 脑出血损伤可促进星形胶质细胞增殖
为研究星形胶质细胞在脑出血后的变化,本实验对损伤后1、3、7、14d损伤侧纹状体区以及对侧同等区域的星形胶质细胞进行了数量统计。结果发现,损伤后1d起损伤侧纹状体区星形胶质细胞密度明显多于对侧同等位置,且数量会进一步随损伤后时间增加而递增,至损伤后14d时密度达到最大,与对照侧数量相比差异具有统计学意义(P<0.05),见图4。
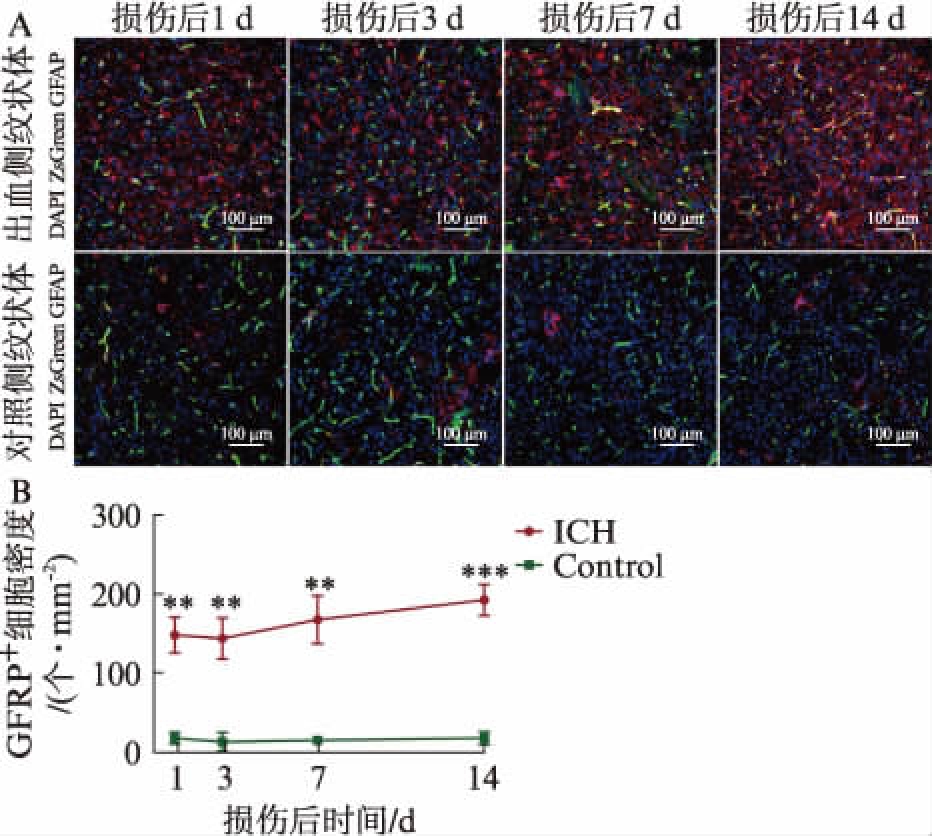
图4 损伤后不同时间点损伤侧纹状体区与对照侧 同等位置星形胶质细胞数量对比
Fig.4 Comparison the number of astrocytes in hemorrhage side and non-surgery side at different time points after injury
与对照侧相比,**P<0.01,***P<0.001
2.4 脑出血诱导CD133+干细胞向星形胶质细胞分化
在损伤后3d观察到损伤灶周出现大量新生细胞,其中有少量细胞为Ki67+/GFAP+/ZsGreen+三阳性细胞,这一结果提示脑出血能激活CD133+干细胞,产生新生的星形胶质细胞,见图5。
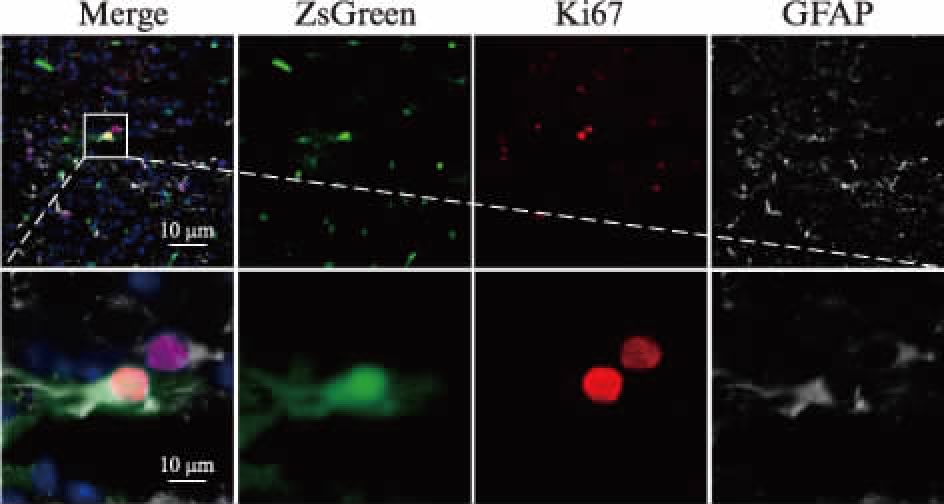
图5 损伤侧出现少量Ki67+、GFAP+、ZsGreen+细胞
Fig.5 Ki67+,GFAP+,ZsGreen+ labeled cells in intracerebral hemorrhage side
2.5 脑出血诱导CD133+细胞向神经祖细胞分化
为研究CD133+细胞在脑出血损伤后是否能向神经元方向分化,本实验使用成神经细胞特异性标志DCX进行免疫荧光染色并观察在损伤后ZsGreen标记的CD133+细胞是否与DCX共定位。结果发现,在脑出血损伤后1d两侧SVZ区出现少量DCX+细胞细胞且在两侧的数量差异具有统计学意义,见图6;到损伤后7d损伤侧SVZ区出现大量DCX+成神经细胞,数量明显多于对照侧同等位置,差异具有统计学意义(P<0.01),且DCX+成神经细胞沿胼胝体向损伤部位迁移;部分DCX+成神经细胞来源于ZsGreen标记细胞且已迁移至离室管膜较远区域,见图7,两侧来自ZsGreen的DCX+成神经细胞数量差异具有统计学意义(P<0.05);到损伤后14d,损伤侧DCX+细胞与DCX+/ZsGreen+细胞数量快速减少,但数量仍有高于对照侧细胞数量趋势。以上结果证明脑出血能诱导CD133+干性细胞向神经元方向分化以及增强SVZ的神经发生以及迁移,在出血后7d时达到峰值,随后降低。
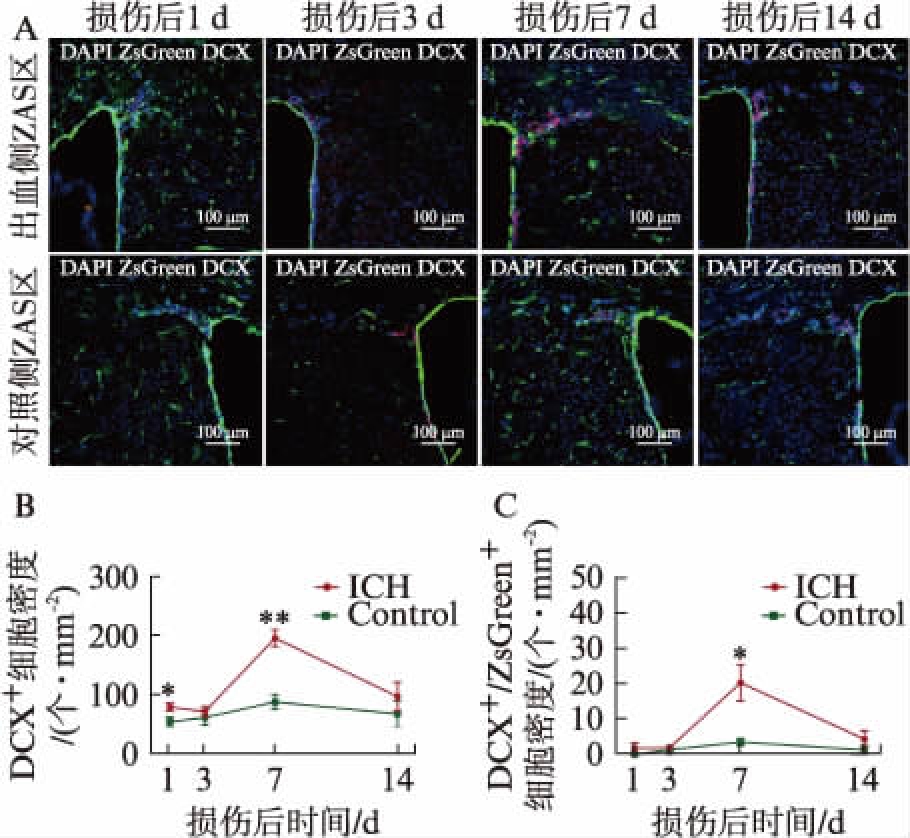
图6 不同时间点脑损伤两侧室管膜下区产生 DCX+成神经细胞对比
Fig.6 Comparison the DCX+ neural progenitor cells in two sides
A: 两侧DCX+细胞密度对比;B: 两侧DCX+细胞密度变化对比;C: 两侧DCX+/ZsGreen+细胞密度变化对比;与对照侧相比,*P<0.05,**P<0.01
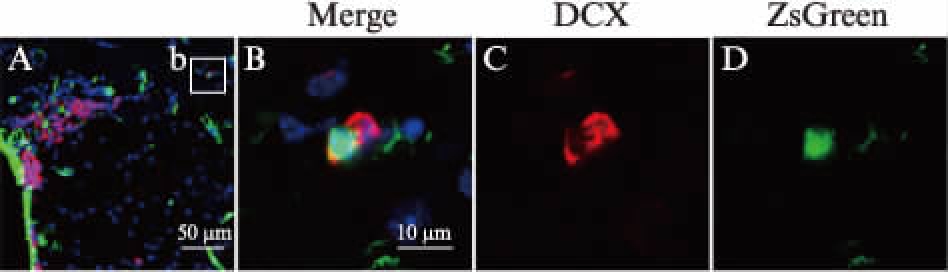
图7 出血损伤诱导ZsGreen标记的CD133+ 细胞分化为DCX+细胞并迁移
Fig.7 Hemorrhagic injury induces differentiation and migration of ZsGreen-labeled CD133+cells
A: 来自ZsGreen标记细胞的DCX+成神经细胞沿胼胝体迁移至较远离SVZ的区域;B~D: A图中b白框区域放大图像
3 讨 论
脑出血是一种致死率、致残率极高的神经系统疾病[11],目前已有的治疗方法仍然无法有效降低死亡率。内源性或外源性干细胞治疗脑出血具有极大的潜能,然而外源性的干细胞治疗则存在时间窗、成瘤等问题[6],因此如果能激活内源性干细胞的增殖分化以及使终末分化的细胞获得干性并重编程,对治疗脑损伤将具有重大的意义。周细胞是重要的神经血管单元成员细胞,脑微血管外包裹周细胞的比例是所有器官中最高的[12],且越来越多的研究证明周细胞能转化为多能干细胞并进一步分化为神经祖系或血管祖系的细胞[13-15]。周细胞在大脑中覆盖大部分微血管,且周细胞表达多种间充质干细胞标志物,与间充质干细胞一样具有多能分化的潜能,周细胞随脑微血管分布于中枢神经系统的各个角落,已有证据表明当损伤发生后血管周细胞能迅速感知信号并脱离血管参与修复[16]。在本研究发现脑出血损伤诱导血管周细胞去分化并重新获得干性,表达干细胞标志物Nestin,证明周细胞在脑出血损伤中具有分化的潜能。周细胞在大脑中数目众多且分布广泛,周细胞若能进一步重编程为神经细胞或血管细胞应具有非常重要的意义。
星形胶质细胞占大脑神经细胞的大多数,它们通过伸出足板与脑血管壁接触并包裹于管壁外,同时与神经元突触建立联系,这使得星形胶质细胞能耦合神经元的功能与血流的变化[17],因此星形胶质细胞与神经元和血管系统具有非常紧密的联系。正常生理状况下的星形胶质细胞具有形成血脑屏障、支持血管结构以及维持内环境等诸多功能,脑损伤后星形胶质细胞则具有神经保护等功能[18]。缺血与出血损伤均能引起星形胶质细胞的功能缺失以及增殖[19],在本实验中也发现在损伤侧纹状体存在大量的星形胶质细胞,它们的数量与未被损伤一侧相比具有明显优势(P<0.01),且损伤侧纹状体星形胶质细胞数量随损伤后时间增加而进一步增多。新生的星形胶质细胞可能替代受到损伤而造成功能缺失的星形胶质细胞,分泌神经营养物质并逐步改善损伤周围内环境。星形胶质细胞具有复杂的功能,虽然它们会形成胶质瘢痕阻碍神经再生,但近年来的证据已逐渐证明星形胶质细胞的增殖对神经功能的恢复是有利的[20-21]。
神经干细胞是指具有自我更新以及多项分化潜能的细胞,在不同的时间或条件下可分化为神经元或神经胶质细胞。CD133最初被发现于脐带及外周血干细胞中[22-23],近年来发现CD133在神经干细胞中也有表达,且已有许多证据证明室管膜存在CD133+静息态神经干细胞且能够在损伤或特定条件下被激活并增殖分化为神经元或胶质细胞[8-9,24]。本研究利用遗传学Cre-Loxp系统构建了可示踪CD133+细胞分化谱系的转基因小鼠并制备出血性脑卒中动物模型,在本研究中首次发现在出血损伤后CD133+细胞能分化为DCX+成神经细胞以及星形胶质细胞,这代表CD133+细胞在出血脑内具有向神经祖系细胞分化的能力。值得注意的是,在损伤后7d时的修复高峰期也仅10.35%±3.01%的DCX+成神经细胞来自CD133+细胞,更多的成神经细胞可能由其他干性细胞分化增殖而来,在未进行任何干预的情况下,CD133+细胞自发对损伤的修复所占比例并不大,而CD133+细胞修复脑损伤的机制还需进一步的研究;同时DCX+细胞以及来自CD133+细胞的ZsGreen+/DCX+细胞数量在损伤后7d达到峰值,随后损伤后14d两侧DCX+与DCX+/ZsGreen+细胞均降低,根据Gong等[25]的研究结果,脑出血损伤造成的炎性环境对神经细胞会造成进一步损伤,炎性环境可能是造成DCX+细胞数量大量减少的重要原因。
总而言之,进一步探究内源性干细胞对脑损伤的修复机制,促使神经干细胞释放其潜能,充分动员神经血管单元成员参与损伤应答与修复,并改善损伤灶微环境,将有望成为一种快捷有效的出血性脑卒中治疗手段。
[1] 赵芳芳,罗玉敏,徐敏,等.高血压性脑出血病理生理研究进展[J].卒中与神经疾病,2013,20(3): 189-192.
[2] FLAHERTY M L, HAVERBUSCH M, SEKAR P, et al. Long-term mortality after intracerebral hemorrhage[J]. Neurology, 2006,66(8): 1182-1186.
[3] WONG G K, WONG R, MOK V C, et al. Clinical study on cognitive dysfunction after spontaneous subarachnoid haemorrhage: patient profiles and relationship to cholinergic dysfunction[J]. Acta Neurochir (Wien), 2009,151(12): 1601-1607.
[4] 张燕飞,降建新,张巍峰,等.高龄脑出血微创手术治疗探讨[J].同济大学学报(医学版),2012,33(4): 97-99.
[5] BRODERICK J, CONNOLLY S, FELDMANN E, et al. REPRINT: guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care And Outcomes In Research Interdiscipliary Working Group: the American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists [J]. Circulation, 2007,116(16): e391-e413.
[6] LEKER R R. Fate and manipulations of endogenous neural stem cells following brain ischemia[J]. Expert Opin Biol Ther, 2009,9(9): 1117-1125.
[7] 唐楠,雷德强,赵洪洋.人CD133基因及蛋白分子生物学研究进展[J].临床神经外科杂志,2017,14(4): 318-320.
[8] LUO Y P, COSKUN V, LIANG A B, et al. Single-cell transcriptome analyses reveal signals to activate dormant neural stem cells[J]. Cell, 2015,161(5): 1175-1186.
[9] COSKUN V, WU H, BLANCHI B, et al. CD133+neural stem cells in the ependyma of mammalian postnatal forebrain[J]. Proc Natl Acad Sci USA, 2008,105(3): 1026-1031.
[10] LI Y, CHOPP M, CHEN J, et al. Intrastriatal transplantation of bone marrow nonhematopoietic cells improves functional recovery after stroke in adult mice[J]. J Cereb Blood Flow Metab, 2000,20(9): 1311-1319.
[11] 张苏明.脑出血部分治疗研究进展的评介与探讨[J].中华神经科杂志,2011,44(4): 225-228.
[12] WINKLER E A, BELL R D, ZLOKOVIC B V. Central nervous system pericytes in health and disease[J]. Nat Neurosci, 2011,14(11): 1398-1405.
[13] DAR A, DOMEV H, BEN-YOSEF O, et al. Multipotent vasculogenic pericytes from human pluripotent stem cells promote recovery of murine ischemic limb[J]. Circulation, 2012,125(1): 87-99.
[14] DORE-DUFFY P, KATYCHEV A, WANG X Q, et al. CNS microvascular pericytes exhibit multipotential stem cell activity[J]. J Cereb Blood Flow Metab, 2006,26(5): 613-624.
[15] CAPLAN A I. All MSCs are pericytes?[J]. Cell Stem Cell, 2008,3(3): 229-230.
[16] GÖRITZ C, DIAS D O, TOMILIN N, et al. A pericyte origin of spinal cord scar tissue[J]. Science, 2011,333(6039): 238-242.
[17] SCIMEMI A. Astrocytes and the warning signs of intracerebral hemorrhagic stroke[J]. Neural Plast, 2018,2018: 7301623.
[18] FANG M C, CUTLER D M, ROSEN A B. Trends in thrombolytic use for ischemic stroke in the United States[J]. J Hosp Med, 2010,5(7): 406-409.
[19] MAGAKI S D, WILLIAMS C K, VINTERS H V. Glial function(and dysfunction)in the normal & ischemic brain[J]. Neuropharmacology, 2018,134(Pt B): 218-225.
[20] WIRENFELDT M, BABCOCK A A, VINTERS H V. Microglia-insights into immune system structure, function, and reactivity in the central nervous system[J]. Histol Histopathol, 2011,26(4): 519-530.
[21] LIDDELOW S A, BARRES B A. Reactive astrocytes: production, function, and therapeutic potential[J]. Immunity, 2017,46(6): 957-967.
[22] MCKAY R. Stem cells in the central nervous system[J]. Science, 1997,276(5309): 66-71.
[23] BROWN D V, FILIZ G, DANIEL P M, et al. Expression of CD133 and CD44 in glioblastoma stem cells correlates with cell proliferation, phenotype stability and intra-tumor heterogeneity[J]. PLoS One, 2017,12(2): e0172791.
[24] BECKERVORDERSANDFORTH R, TRIPATHI P, NINKOVIC J, et al. In vivo fate mapping and expression analysis reveals molecular hallmarks of prospectively isolated adult neural stem cells[J]. Cell Stem Cell, 2010,7(6): 744-758.
[25] GONG C, HOFF J T, KEEP R F. Acute inflammatory reaction following experimental intracerebral hemorrhage in rat[J]. Brain Res, 2000,871(1): 57-65.