随着老龄化进程加快,人民生活水平提高,饮食方式的改变,糖尿病及肥胖的发病率在全球呈逐年升高趋势。糖尿病不仅会影响糖、脂肪、和蛋白质的代谢,还可引起骨代谢异常,发生不同程度的骨量减少,甚至骨质疏松(osteoporosis, OP)。二者均为严重影响老年人健康的常见病、多发病,给社会和家庭带来沉重的负担。1型糖尿病患者的骨密度(bone mineral density, BMD)是减低的[1],但对于2型糖尿病和骨密度的关联仍不明确,患者受到体内激素水平变化、肥胖程度、脂肪分布、胰岛素抵抗、年龄等因素的影响,骨密度可升高、降低或不变[2]。很多研究发现肥胖尤其是内脏脂肪的增多会引起骨密度减退[3],但是腹部脂肪的分布对骨密度的影响尚无定论。本研究通过定量CT(quantitative CT, QCT)测量女性腰椎(L1~L3)骨密度(bone mineral density, BMD),同时测量腹部皮下脂肪(subcutaneous adipose tissue, SAT)及腹部内脏脂肪(visceral adipose tissue, VAT),探讨绝经后2型糖尿病患者腹部脂肪分布与腰椎骨密度的关系,从而为绝经后2型糖尿病患者骨质疏松的治疗和预防提供更多依据。
1 资料与方法
1.1 研究对象
选取2017年1月至2017年12月于上海市第一康复医院内分泌科住院和体检的绝经后2型糖尿病患者71例。入选标准: (1) 年龄55~75岁;(2) 2型糖尿病患者诊断均符合2014美国糖尿病学会(American Diabetes Association, ADA)糖尿病诊断标准[4];(3) 糖尿病病程为1~20年。排除标准: (1) 其他类型的糖尿病(1型糖尿病、妊娠糖尿病、MODY等);患有糖尿病酮症酸中毒、糖尿病高渗状态及其他糖尿病急性并发症者,及糖尿病严重慢性并发症者;(2) 患有影响骨代谢的其他疾病,包括甲状腺和甲状旁腺疾病,严重的肝脏或肾脏疾病,多囊卵巢综合征,库欣综合征,恶性疾病史等;(3) 服用影响钙磷代谢药物(如双膦酸盐、降钙素、雌激素史,罗格列酮、选择性雌激素受体调节剂,糖皮质激素等;(4) 短期无法解释的体质量减轻。本研究经同济大学附属第十人民医院伦理委员会批准,所有临床资料及体检资料的收集均征得患者及家属的同意。
1.2 方法
1.2.1 一般资料 询问病史,记录患者的年龄、性别、基础疾病、糖尿病确诊时间、糖尿病病程等一般情况。测量研究对象的身高(m)、年龄、体质量(kg)、计算体质量指数(body mass index, BMI)。BMI=体质量(kg)/身高(m)2
1.2.2 生化采集指标 抽取患者空腹血,用葡萄糖氧化酶法测定空腹血糖。放射免疫法测定空腹胰岛素和空腹C肽。均于早晨空腹时采取肘正中静脉血,离心取血清,置-20℃冰箱保存,均采用全自动生化仪测定。
1.2.3 相关参数计算 稳态模型的胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(mU/L)×空腹葡萄糖(mmol/L)/22.5。
1.2.4 骨密度和脂肪含量测定 使用64排螺旋CT(美国GE公司),管电压120kV,管电流150mA,将校准体模(Mindway公司)紧贴于患者腰部,扫描范围选择L1~L3。将原始数据传至QCT工作站,通过三平面定位选取L3椎体中心层面设置感兴趣区(ROI),包括松骨质且避开骨皮质及椎体后中央静脉沟(图1),计算vBMD值。通过计算L1~L3骨密度的平均值得出平均骨密度(average volume bone mineral density, avBMD)。同时使用QCT分析软件测量L3椎体相应层面腹部内脏脂肪(visoaral adipose tissue, VAT)和皮下脂肪(subcutaneous adipose tissue, SAT)含量。SAT为皮肤和腹部和背部肌肉之间的区域,VAT为腹腔内脂肪组织的面积。QCT作为测量VAT的金标准,可以准确无误地分割SAT和VAT。一般将L3平面的脂肪面积作为评估腹部脂肪的指标,并定义L3水平内脏脂肪/皮下脂肪(VAT/SAT)为腹部脂肪分布。见图1~2。
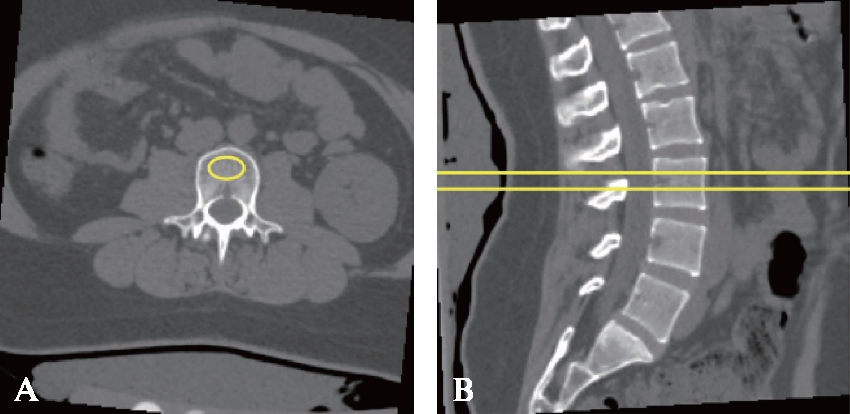
图1 QCT腰椎vBMD分析
Fig.1 Analysis of vBMD in QCT lumbar spine
A: L3椎体松质骨ROI不同浓度区域CT值;B: 腰椎正中矢状位图
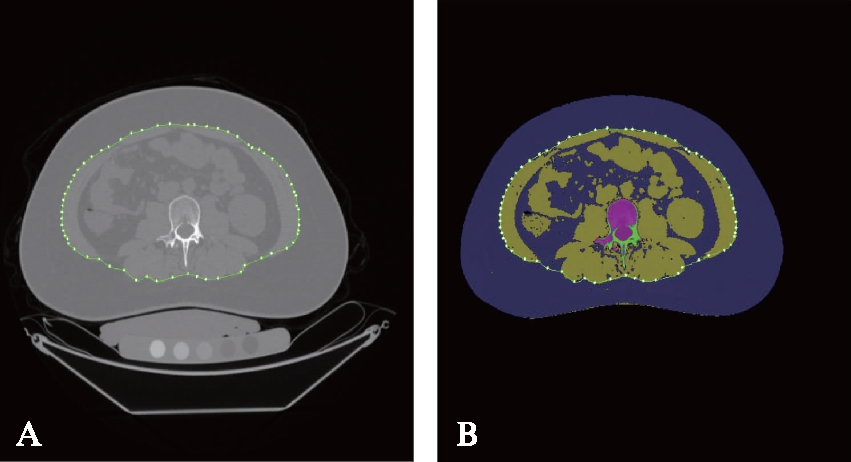
图2 QCT脂肪组织分析
Fig.2 QCT adipose tissue analysis
A: 以腹臂肌内侧边缘为界划分VAT存在区域;B: 染色区为腹部VAT
1.3 统计学处理
使用SPSS 22软件,通过Shapiro-Wilk检验分析数据的分布情况。正态分布计量资料用![]() 表示,采用独立样本t检验。对于非正态分布计量资料采用M(Q1,Q3),组间采用非参数检验。VAT/SAT进行对数转换[IN(VAT/SAT)]以服从正态分布。配对资料进行t检验,对于非正态分布资料,Mann Whitney U检验评估所获得测量值之间的差异。对糖尿病组和对照组的临床指标分别进行相关性分析,包括粘合、BMI、空腹血糖、HOMA-IR、VAT.SAT、VAT/SAT与BMD的相关分析。针对IN(VAT/SAT)和BMD的关联,用Pearson积差相关系数描述两变量的相关强度。用偏相关分析排除其他因素(年龄、BMI、FBG、HOMA-IR)对两者相关强度的影响。单因素分析中相关的变量纳入多元线性回归模型分析独立相关因素。P<0.05为差异有统计学意义。
表示,采用独立样本t检验。对于非正态分布计量资料采用M(Q1,Q3),组间采用非参数检验。VAT/SAT进行对数转换[IN(VAT/SAT)]以服从正态分布。配对资料进行t检验,对于非正态分布资料,Mann Whitney U检验评估所获得测量值之间的差异。对糖尿病组和对照组的临床指标分别进行相关性分析,包括粘合、BMI、空腹血糖、HOMA-IR、VAT.SAT、VAT/SAT与BMD的相关分析。针对IN(VAT/SAT)和BMD的关联,用Pearson积差相关系数描述两变量的相关强度。用偏相关分析排除其他因素(年龄、BMI、FBG、HOMA-IR)对两者相关强度的影响。单因素分析中相关的变量纳入多元线性回归模型分析独立相关因素。P<0.05为差异有统计学意义。
2 结 果
2.1 根据BMD的测量结果进行分组后分析
根据平均骨密度(avBMD),将患者分成3组: 成骨量正常(N)组(aBMD≥120mg/cm3),骨量减少组(120mg/cm3>aBMD>80mg/cm3),骨质疏松(O)组(T≤-80mg/cm3)。组间比较发现,O组数据在年龄、VAT、HOMA-RI、VAT/SAT与N组数据差异有统计学意义(P<0.05);T组数据在年龄、HOMA-IR、VAT/SAT与N组差异有统计学意义(P<0.05)。
表1 一般资料比较
Tab.1 The basic dates of 3 groups![]()
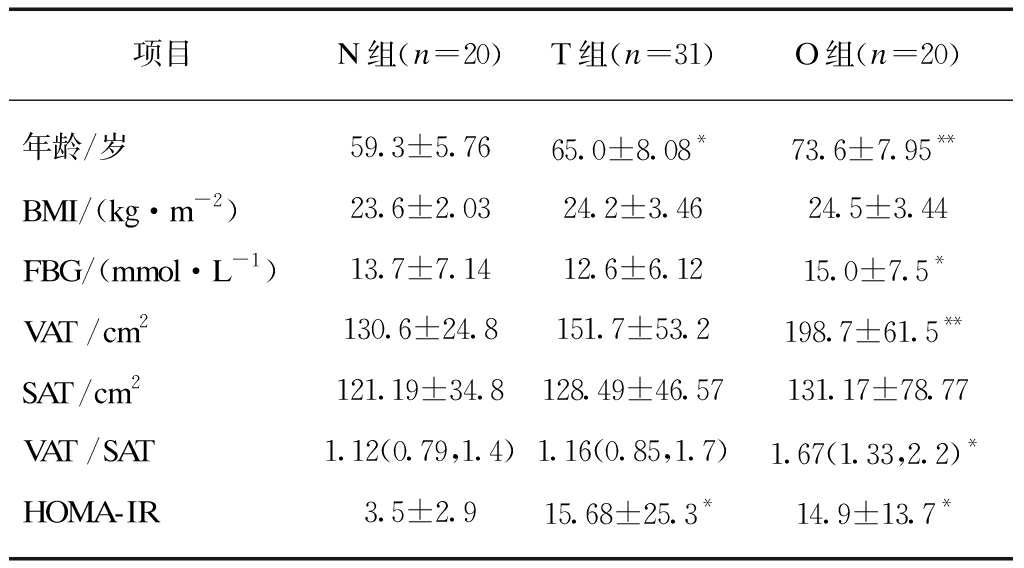
项目N组(n=20)T组(n=31)O组(n=20)年龄/岁59.3±5.7665.0±8.08*73.6±7.95**BMI/(kg·m-2)23.6±2.0324.2±3.4624.5±3.44FBG/(mmol·L-1)13.7±7.1412.6±6.1215.0±7.5*VAT/cm2130.6±24.8151.7±53.2198.7±61.5**SAT/cm2121.19±34.8128.49±46.57131.17±78.77VAT/SAT1.12(0.79,1.4)1.16(0.85,1.7)1.67(1.33,2.2)*HOMA-IR3.5±2.915.68±25.3*14.9±13.7*
与N组比较,*P<0.05,**P<0.01
2.2 各临床指标与骨密度的相关性分析
年龄、FBG、VAT、HOMA-IR、VAT/TAT与L1~L3 vBMD呈负相关,具有统计学意义(P<0.05),见表2。
2.3 多因素线性回归分析
多因素线性回归分析显示,年龄、空腹血糖和IN(VAT/SAT)均与vBMD负相关(P<0.05),见表3。
表2 BMD与各指标的相关分析结果
Tab.2 Correlations betwven clinical features and BMD in DM group
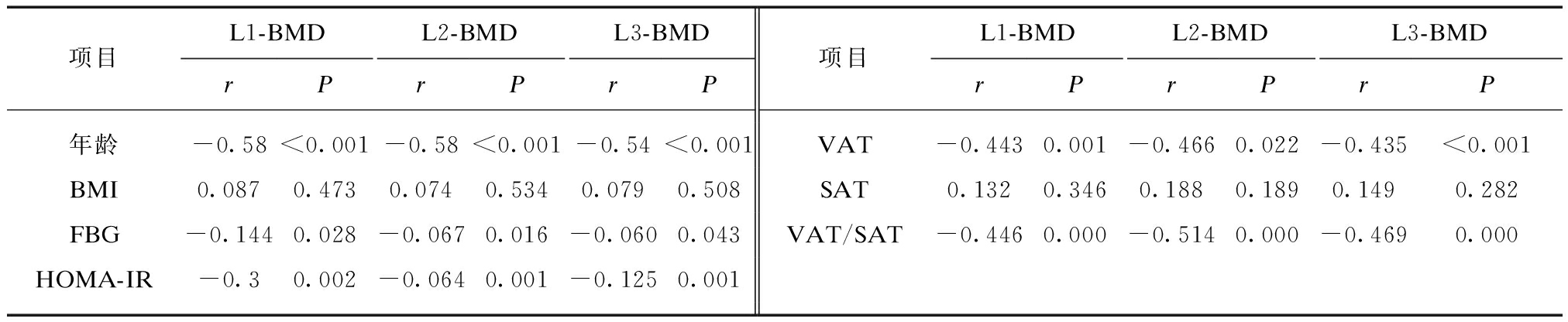
项目L1-BMDL2-BMDL3-BMDrPrPrP项目L1-BMDL2-BMDL3-BMDrPrPrP年龄-0.58<0.001-0.58<0.001-0.54<0.001VAT-0.4430.001-0.4660.022-0.435<0.001BMI0.0870.4730.0740.5340.0790.508SAT0.1320.3460.1880.1890.1490.282FBG-0.1440.028-0.0670.016-0.0600.043VAT/SAT-0.4460.000-0.5140.000-0.4690.000HOMA-IR-0.30.002-0.0640.001-0.1250.001
表3 vBMD和IN(VAT/SAT)多因素线性回归分析
Tab.3 Multivariate linear regression analysis in T2DM groups
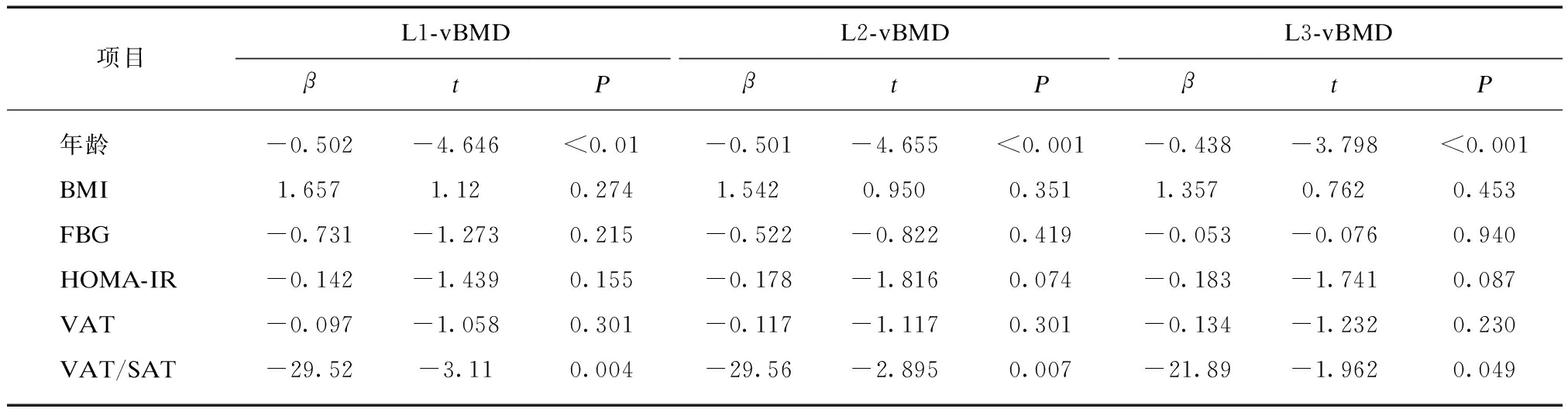
项目L1-vBMDL2-vBMDL3-vBMDβtPβtPβtP年龄-0.502-4.646<0.01-0.501-4.655<0.001-0.438-3.798<0.001BMI1.6571.120.2741.5420.9500.3511.3570.7620.453FBG-0.731-1.2730.215-0.522-0.8220.419-0.053-0.0760.940HOMA-IR-0.142-1.4390.155-0.178-1.8160.074-0.183-1.7410.087VAT-0.097-1.0580.301-0.117-1.1170.301-0.134-1.2320.230VAT/SAT-29.52-3.110.004-29.56-2.8950.007-21.89-1.9620.049
3 讨 论
2型糖尿病和骨质疏松是老年人常见的慢性疾病,且发病率随着年龄增长逐渐增加。OP作为T2DM的一种隐匿性并发症,常被T2DM患者所忽视[5]。目前老年2型糖尿病与OP的相关性越来越受到学者的关注。2型糖尿病患者的骨密度的改变机制受体内激素水平、肥胖程度、脂肪分布类型、胰岛素抵抗、年龄等因素的影响。有研究[6]认为,腹部脂肪分布的不同对于绝经后女性骨密度影响更重要。有研究发现,人体SAT与VAT存在明显差异[7],VAT有更高的代谢活性,更容易通过骨代谢来改变骨密度。本研究以VAT/SAT表示脂肪分布不同,探讨绝经后2型糖尿病妇女脂肪组织分布与脊椎骨密度之间关系。
本研究发现,绝经后2型糖尿病患者腹部VAT/SAT与脊柱vBMD呈负相关(P<0.05),随着内脏脂肪的增加以及糖尿病患者脂肪的重新分布,内脏脂肪比例增加,而出现骨密度降低。在排除年龄、BMI、FBG、HOMA-IR的影响因素后两者之间仍呈负相关。故认为在2型糖尿病患者中,内脏脂肪比例增高的患者更容易出现骨密度的降低。这可能是内脏脂肪旁分泌的原因,可影响脂肪组织附近骨骼[8],分析如下: (1) VAT可以分泌较多的瘦素[9],可以通过中枢和外周两方面调节骨代谢,可以透过血脑屏障进入颅内,激活下丘脑ob-Rb受体,刺激下丘脑分泌抑制成骨细胞因子。瘦素还间接作用于骨髓质细胞,促进其向骨细胞分化,同时抑制其向脂肪细胞分化。(2) VAT可分泌多种炎性细胞因子,如CRP、TNF-α、IL-1、IL-6等,IL-1、IL-6参与骨代谢,促进骨重吸收,骨量下降[10-11]。有报道指出,对于骨骼健康,SAT通过增加机械负荷从而影响骨密度,VAT主要通过骨代谢影响骨密度,对骨密度具有不良影响。SAT似乎是有保护作用的,或者至少是中立的[12-14]。两者对骨密度的影响不同,提示SAT与VAT的分布情况是骨状态的基本决定因素[15]。VAT的内分泌功能与其体积是平行增强的。VAT体积增加可以引起骨髓脂肪组织的积累,多项研究均证实骨髓腔脂肪组织与骨密度呈负相关[16-17]。
国外相关研究指出,腹部脂肪可能会影响骨健康,内脏脂肪占皮下脂肪比例较大的肥胖女性青少年的骨密度低于该比例较低的同龄人[18]。本研究通过多因素线性回归分析发现,腰椎骨密度与年龄、VAT/SAT均呈负相关,与空腹血糖、BMI、HOMA-RI均无明显相关性。2型糖尿病患者随着年龄的增加,体脂重新分布,内脏脂肪体积增大,VAT/SAT增加,会引起骨密度的降低。综上所述,绝经后2型糖尿病患者骨密度会受到脂肪分布类型的影响,内脏脂肪占比会增加骨质疏松的风险。
本研究有几个局限性: (1) 研究受样本量的限制,无法控制可能影响骨骼的所有潜在的混杂因素。(2) 只检测脊柱vBMD。为了更全面的研究,进一步的研究应集中在外周骨。(3) 糖尿病组的研究对象治疗手段存在差异,病程的长短都可能会影响到结果的分析。
本研究结果表明,绝经后的2型糖尿病患者,随着内脏脂肪/皮下脂肪比例的增加会引起骨密度的下降,内脏脂肪/皮下脂肪不同于传统意义上认为的内脏脂肪含量,且内脏脂肪/皮下脂肪与骨密度的相关性独立于年龄、BMI、空腹血糖和HOMA-IR。这为绝经后的2型糖尿病患者骨质疏松的防治及风险因素评估提供了新的依据。
[1] HAMILTONE J, RAKIC V, DAVISW A, et al. Prevalence and predictors of osteopenia and osteoporosis in adults with type 1 diabetes[J]. Diabet Med, 2009,26(1): 45-52.
[2] 李晓宇,冯正平.糖尿病性骨质疏松发病机制的研究进展[J].中国骨质疏松杂志,2014(5): 580-583.
[3] BREDELLA M A, TORRIANI M, GHOMI R H, et al. Determinants of bone mineral density in obese premenopausal women[J]. Bone, 2011,48(4): 748-754.
[4] American Diabetes Association. Standards of medical care in diabetes: 2014[J]. Diabetes Care, 2014,37(Supplement_1): S14-S80.
[5] 陆婷,张月华,李伟,等.2型糖尿病并发非酒精性脂肪肝的危险因素及其与骨密度的关系[J].同济大学学报(医学版),2016,37(5): 97-101.
[6] 邸彩霞,王战建.绝经后2型糖尿病患者腹腔内脏脂肪面积与骨密度的相关性[J].中华老年医学杂志,2012,31(10): 867-871.
[7] ARNER P, SPALDINGK L. Fat cell turnover in humans[J].Biochem Biophys Res Commun, 2010,396(1): 101-104.
[8] ZHANG P, PETERSON M, SUG L, et al. Visceral adiposity is negatively associated with bone density and muscle attenuation[J]. Am J Clin Nutr, 2015,101(2): 337-343.
[9] 滕士超,余江毅,刘沈林.维糖平对糖尿病大鼠体重、内脏重量、血清游离脂肪酸及瘦素的影响[J].江西中医学院学报,2008,20(1): 78-79.
[10] MOHITI-ARDEKANI J, SOLEYMANI-SALEHABADI H, OWLIAM B, et al. Relationshipsbetween serum adipocyte hormones (adiponectin, leptin, resistin), bone mineraldensity and bone metabolic markers in osteoporosis patients[J]. J Bone Miner Metab, 2014,32(4): 400-404.
[11] LIUC T, BROEK E, ZHOU Y H, et al. Visceral adipose tissue is associated with bone microarchitecture in the framingham osteoporosis study[J]. J Bone Miner Res, 2017,32(1): 143-150.
[12] FREITAS P M S S, GARCIA ROSA M L, GOMES A M, et al. Central and peripheral fat body mass have a protective effect on osteopenia or osteoporosis in adults and elderly?[J]. Osteoporos Int, 2016,27(4): 1659-1663.
[13] PALERMO A, TUCCINARDI D, DEFEUDIS G, et al. BMI and BMD: the potential interplay between obesity and bone fragility[J]. Int J Environ Res Public Health, 2016,13(6): 544.
[14] DEERE K, SAYERS A, VILJAKAINEN H T, et al. Distinct relationships of intramuscular and subcutaneous fat with cortical bone: findings from a cross-sectional study of young adult males and females[J]. J Clin Endocrinol Metab, 2013,98(6): E1041-E1049.
[15] HIND K, PEARCE M, BIRRELL F. Total and visceral adiposity are associated with prevalent vertebral fracture in women but not men at age 62 years: the newcastle thousand families study[J]. J Bone Miner Res, 2017,32(5): 1109-1115.
[16] VERMA S, RAJARATNAM J H, DENTON J, et al. Adipocytic proportion of bone marrow is inversely related to bone formation in osteoporosis[J]. J Clin Pathol, 2002,55(9): 693-698.
[17] DE ARA JO I M, SALMON C E G, NAHAS A K,etal. Marrow adipose tissue spectrum in obesity and type 2 diabetes mellitus[J]. Euro J Endocrinol, 2017,176(1): 21-30.
JO I M, SALMON C E G, NAHAS A K,etal. Marrow adipose tissue spectrum in obesity and type 2 diabetes mellitus[J]. Euro J Endocrinol, 2017,176(1): 21-30.
[18] RUSSELL M, MENDES N, MILLERK K, et al. Visceral fat is a negative predictorof bone density measures in obese adolescent girls[J]. J Clin Endocrinol Metab, 2010,95(3): 1247-1255.