根据WHO 2010版规范,免疫组织化学证实肿瘤组织中神经内分泌细胞及腺癌细胞比例均超过30%,定义为混合性腺神经内分泌癌(mixed adeno-neuroendocrine carcinoma, MANEC;WHO 2017版更名为mixed neuroendocrine-nonneuroendocrine neoplasms, MiNENs)[1-3]。MiNENs发病率极低,预后差,治疗存在争议[4-5]。而神经内分泌细胞在癌组织中少于30%则为胃癌伴神经内分泌分化(neuroe-ndocrine cell differentiation, NED),其治疗及预后均参考胃腺癌[1]。随着诊断体系的建立及规范化,目前病理报告具有NED特征的胃癌占比逐渐增高。一些回顾性研究认为,胃癌伴NED可能在胃癌进展中起促进作用,其预后差于单纯胃腺癌,故临床上应采取更积极有效的治疗措施[6-8]。综上,笼统地将胃癌伴NED归入胃癌处理不甚合理。本研究旨在回顾性分析胃癌伴NED患者的临床、病理及术后随访资料,探讨远处转移相关危险因素,以期为临床诊治、预后评估提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2007年1月—2018年8月于复旦大学附属华山医院收治的胃癌伴NED患者的临床、病理及术后随访资料。纳入标准: (1) 术后病理诊断为原发性胃癌,伴神经内分泌分化;(2) 所有病例均行手术根治R0切除;(3) 临床病理及随访资料完整。排除标准: (1) 根治术时发现合并其他原发肿瘤;(2) 术前已行放、化疗或转化治疗;(3) 失访或随访中出现非肿瘤相关死亡。共71例患者纳入研究。
1.2 观察指标
1.2.1 临床资料 手术前、后记录完整临床及病理资料,包括性别、年龄、体质量指数(body mass index, BMI)、临床症状、合并症(高血压、糖尿病等)、家族史、肿瘤大小、肿瘤位置、病理类型、TNM分期、组织脉管癌栓、淋巴结转移、外周血中性粒细胞计数和白蛋白水平、手术方式、术中出血及术后并发症。
1.2.2 病理诊断 标本常规H-E染色,光学显微镜下细胞形态学诊断,免疫组化法检测神经内分泌特异抗体标记包括嗜铬粒数(CgA)、突触素(Syn)。其中,CgA或Syn中1个指标阳性即为免疫组化神经内分泌标记物阳性。神经内分泌细胞在癌细胞中少于30%诊断为胃癌伴NED。同时检测Ki-67,用于计数核增殖指数。
1.3 随访
肿瘤分期为Ⅱ期及以上(参考第8版AJCC胃癌分期[9])患者术后常规行铂类+5-FU方案为主的辅助化疗。随访形式以门诊为主,电话随访补充。首次随访为手术后1个月,之后每隔3个月随访1次至术后2年;术后2~5年期间每隔6个月随访1次,术后5年起每年随访1次。终点事件为患者出现肿瘤转移。患者拒绝随访或死于非肿瘤相关性疾病定义为失访。
1.4 统计学处理
数据分析采用SPSS 23.0统计学软件。计量资料以![]() 表示,计数资料以率(%)表示。单因素分析: 分类变量用Kaplan-Meier的Log-rank检验法及Cox回归分析法,连续变量用单因素Cox回归分析法。纳入单因素分析中P<0.1的变量,用多因素Cox回归分析法进行多因素分析,以P<0.05为差异有统计学意义。
表示,计数资料以率(%)表示。单因素分析: 分类变量用Kaplan-Meier的Log-rank检验法及Cox回归分析法,连续变量用单因素Cox回归分析法。纳入单因素分析中P<0.1的变量,用多因素Cox回归分析法进行多因素分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床特点与肿瘤远处转移
本回顾性分析最终纳入胃癌伴NED患者71例,其中男性58例,女性13例,年龄26~83岁(中位年龄63岁),随访时间3个月~11年(中位随访时间为3年11个月)。随访期间出现远处转移23例,无转移48例,其中,最常见转移部位为肝脏(10/23,43.5%),其次为盆腹腔(7/23,30.4%);发生远处转移中位时间为8个月。2例肝转移患者2期手术切除转移灶,病理均提示为转移性腺癌。71例病例临床特点与远处转移相关单因素分析见表1。97.2%胃癌伴NED患者有临床表现,其中腹痛最常见(49.3%),其次是腹胀(43.7%)、消化道出血(23.9%),但均无类癌综合征表现。伴随疾病中,高血压为最常见合并症,且肿瘤转移组比例更高(43.5%,P<0.05)。仅肿瘤转移组有1例肿瘤家族史,因受病例数限制且偏倚较大,家族史不纳入后续转移相关因素分析模型。
2.2 手术情况与肿瘤远处转移
本研究分析了微创/开放手术、手术切除范围、手术时间、术中出血与肿瘤转移的相关性。结果显示,腹腔镜手术较开放手术、术中出血多较术中出血少组出现肿瘤转移比例较高,但差异均无统计学意义(P=0.072、0.078),见表2。
表1 胃癌伴NED患者临床特点与肿瘤远处转移相关因素分析
Tab.1 Univariate analysis of clinical risk factors for distant metastasis in gastric cancer patients with NED (n=71)
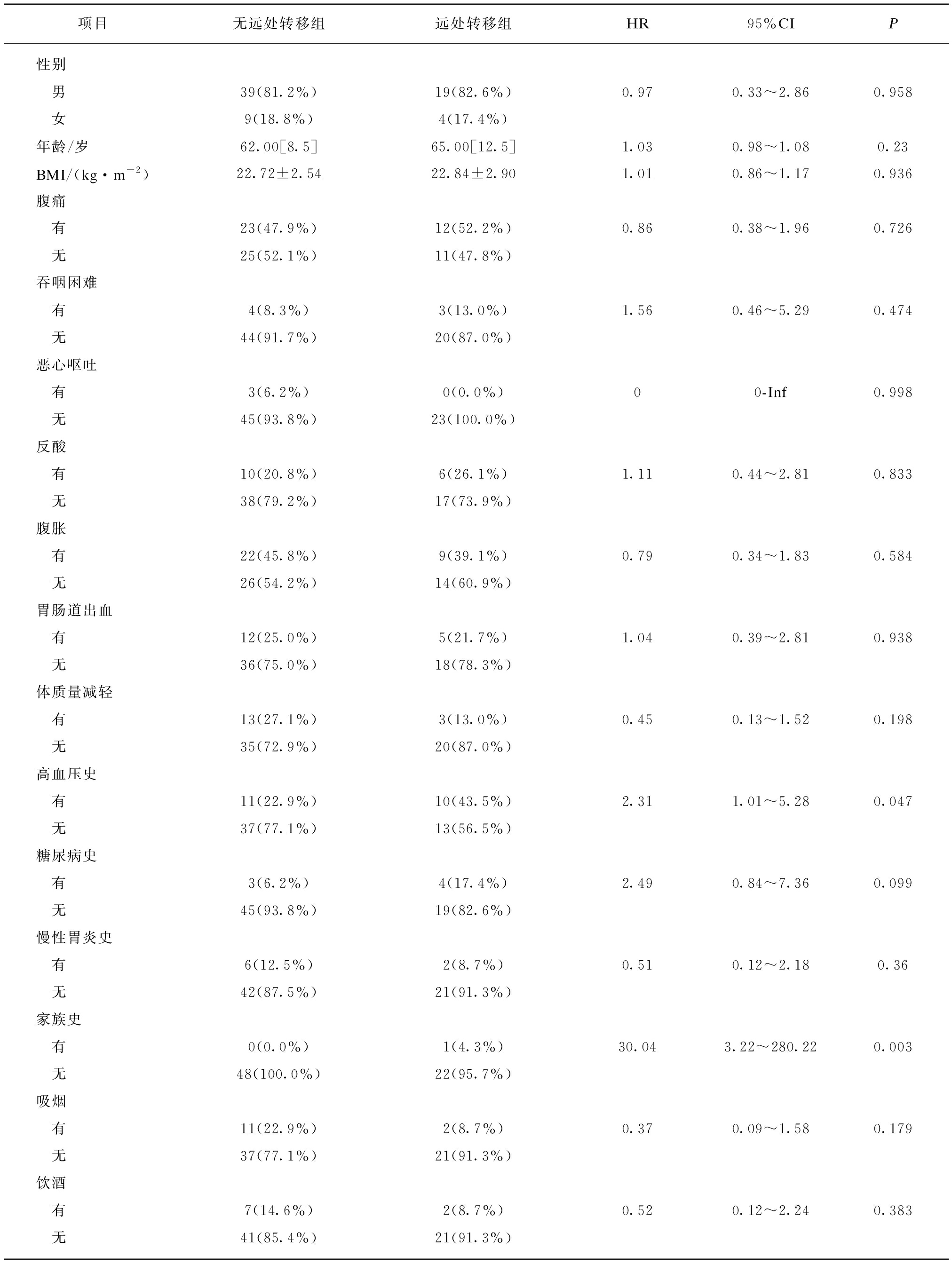
项目无远处转移组远处转移组HR95%CIP性别 男39(81.2%)19(82.6%)0.970.33~2.860.958 女9(18.8%)4(17.4%)年龄/岁62.00[8.5]65.00[12.5]1.030.98~1.080.23BMI/(kg·m-2)22.72±2.5422.84±2.901.010.86~1.170.936腹痛 有23(47.9%)12(52.2%)0.860.38~1.960.726 无25(52.1%)11(47.8%)吞咽困难 有4(8.3%)3(13.0%)1.560.46~5.290.474 无44(91.7%)20(87.0%)恶心呕吐 有3(6.2%)0(0.0%)00-Inf0.998 无45(93.8%)23(100.0%)反酸 有10(20.8%)6(26.1%)1.110.44~2.810.833 无38(79.2%)17(73.9%)腹胀 有22(45.8%)9(39.1%)0.790.34~1.830.584 无26(54.2%)14(60.9%)胃肠道出血 有12(25.0%)5(21.7%)1.040.39~2.810.938 无36(75.0%)18(78.3%)体质量减轻 有13(27.1%)3(13.0%)0.450.13~1.520.198 无35(72.9%)20(87.0%)高血压史 有11(22.9%)10(43.5%)2.311.01~5.280.047 无37(77.1%)13(56.5%)糖尿病史 有3(6.2%)4(17.4%)2.490.84~7.360.099 无45(93.8%)19(82.6%)慢性胃炎史 有6(12.5%)2(8.7%)0.510.12~2.180.36 无42(87.5%)21(91.3%)家族史 有0(0.0%)1(4.3%)30.043.22~280.220.003 无48(100.0%)22(95.7%)吸烟 有11(22.9%)2(8.7%)0.370.09~1.580.179 无37(77.1%)21(91.3%)饮酒 有7(14.6%)2(8.7%)0.520.12~2.240.383 无41(85.4%)21(91.3%)
不符合正态分布的变量以Median[IQR]表示,符合正态分布的变量以![]() 表示,分类变量以n(%)表示
表示,分类变量以n(%)表示
表2 胃癌伴NED患者手术情况与肿瘤远处转移相关因素分析
Tab.2 Univariate analysis of surgical risk factors for distant metastasis in gastric cancer patients with NED (n=71)
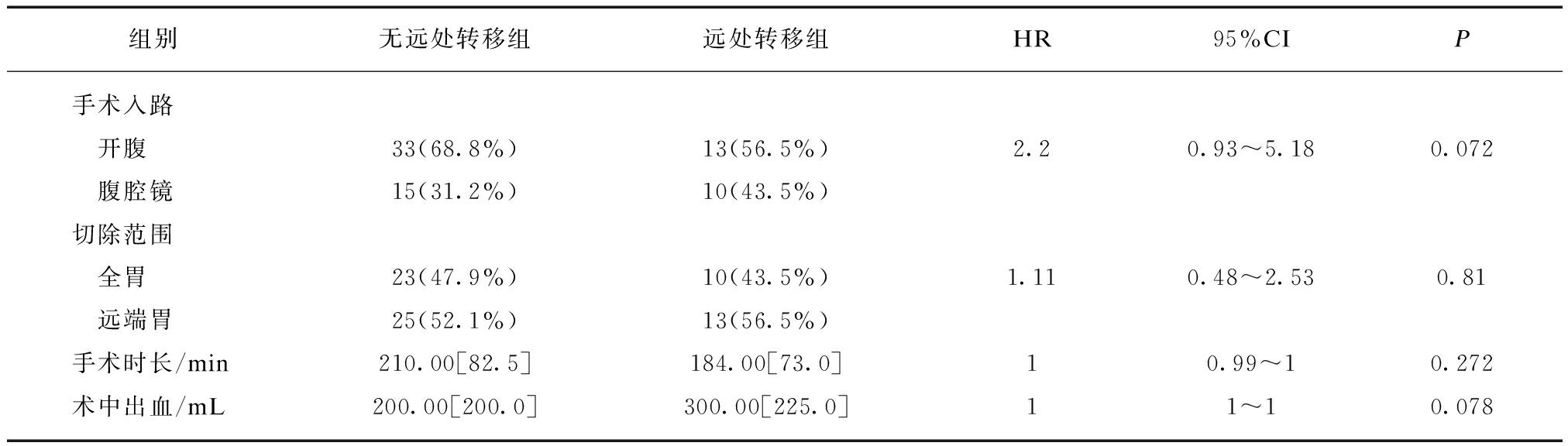
组别无远处转移组远处转移组HR95%CIP手术入路 开腹33(68.8%)13(56.5%)2.20.93~5.180.072 腹腔镜15(31.2%)10(43.5%)切除范围 全胃23(47.9%)10(43.5%)1.110.48~2.530.81 远端胃25(52.1%)13(56.5%)手术时长/min210.00[82.5]184.00[73.0]10.99~10.272术中出血/mL200.00[200.0]300.00[225.0]11~10.078
不符合正态分布的变量以Median[IQR]表示,分类变量以n(%)表示
2.3 病理特点与肿瘤远处转移
单因素分析显示,肿瘤浸润深度与肿瘤转移相关义(P<0.05)。肿瘤转移组虽肿瘤较大、区域淋巴结阳性、脉管受累、神经侵犯概率更高,但差异均无统计学意义。神经内分泌特异性抗体标记Syn、CgA及肿瘤细胞核增殖指数Ki-67表达在两组中差异也无统计学意义。见表3。
表3 胃癌伴NED患者病理与肿瘤远处转移相关因素分析
Tab.3 Univariate analysis of pathological risk factors for distant metastasis in 71 gastric cancer patients with NED (n=71)
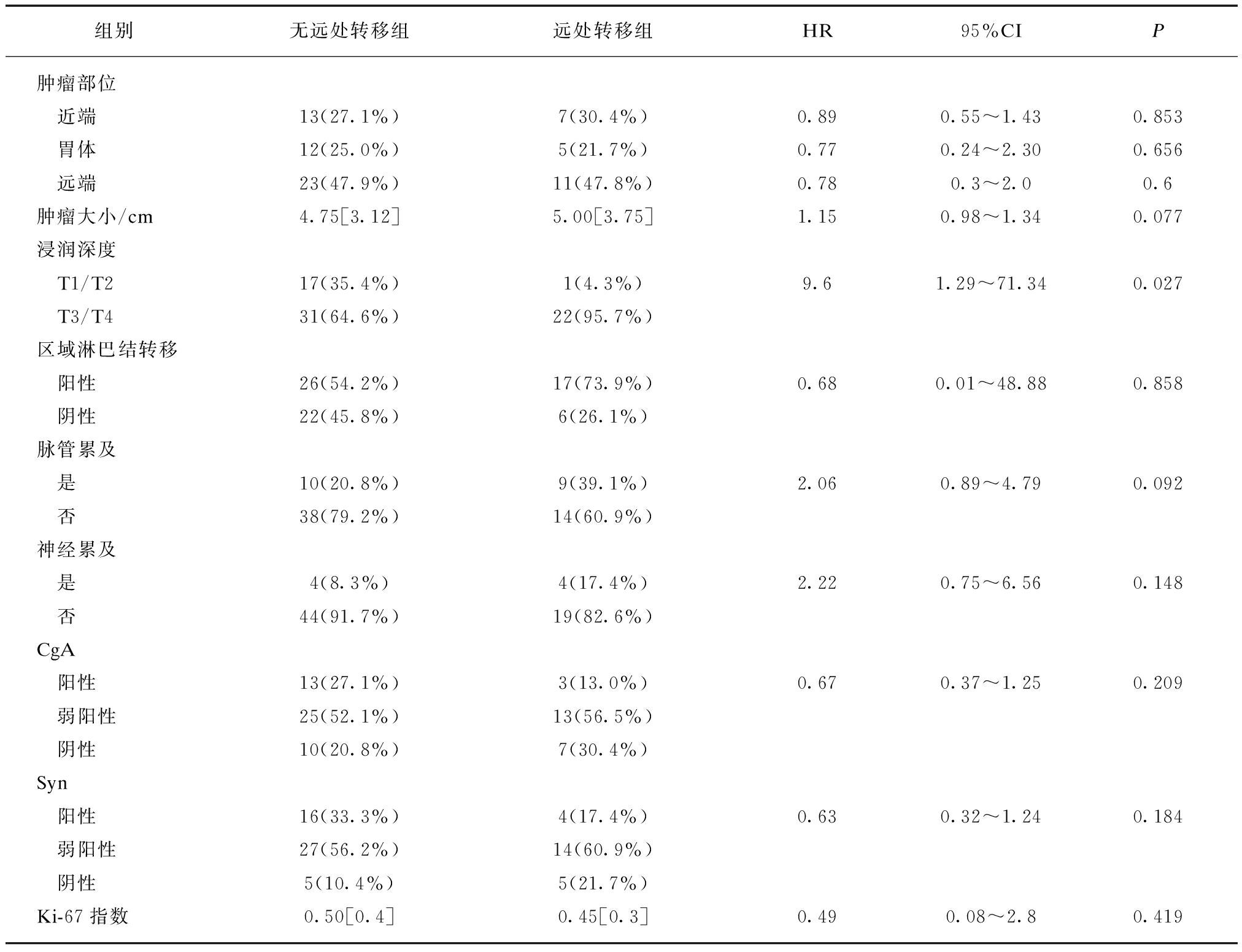
组别无远处转移组远处转移组HR95%CIP肿瘤部位 近端13(27.1%)7(30.4%)0.890.55~1.430.853 胃体12(25.0%)5(21.7%)0.770.24~2.300.656 远端23(47.9%)11(47.8%)0.780.3~2.00.6肿瘤大小/cm4.75[3.12]5.00[3.75]1.150.98~1.340.077浸润深度 T1/T217(35.4%)1(4.3%)9.61.29~71.340.027 T3/T431(64.6%)22(95.7%)区域淋巴结转移 阳性26(54.2%)17(73.9%)0.680.01~48.880.858 阴性22(45.8%)6(26.1%)脉管累及 是10(20.8%)9(39.1%)2.060.89~4.790.092 否38(79.2%)14(60.9%)神经累及 是4(8.3%)4(17.4%)2.220.75~6.560.148 否44(91.7%)19(82.6%)CgA 阳性13(27.1%)3(13.0%)0.670.37~1.250.209 弱阳性25(52.1%)13(56.5%) 阴性10(20.8%)7(30.4%)Syn 阳性16(33.3%)4(17.4%)0.630.32~1.240.184 弱阳性27(56.2%)14(60.9%) 阴性5(10.4%)5(21.7%)Ki-67指数0.50[0.4]0.45[0.3]0.490.08~2.80.419
不符合正态分布的变量以Median[IQR]表示,符合正态分布的变量以![]() 表示,分类变量以n(%)表示
表示,分类变量以n(%)表示
2.4 外周血特点与肿瘤远处转移
有关炎症、营养等外周血指标与肿瘤转移预后的单因素分析如表4所示。其中仅前白蛋白水平与肿瘤转移相关,远处转移患者术前前白蛋白较低(P<0.05%)。
2.5 肿瘤远处转移多因素分析
将以上单因素分析中P<0.1的变量包括高血压及糖尿病病史、开腹/微创手术、术中出血、肿瘤大小、浸润深度、脉管受累、前白蛋白水平纳入影响胃癌伴NED转移的多因素分析,结果显示浸润深度是影响胃癌伴NED患者转移的独立因素(HR: 9.471;95%CI: 1.274~70.395;P=0.028)。其中,淋巴结以是/否发生转移作为分类变量处理,单因素分析与肿瘤转移无相关性(P=0.86)。
进一步将淋巴结转移数目作为连续变量行单因素分析的结果显示,淋巴结转移数与肿瘤转移显著相关(HR: 1.1;95%CI: 1.02~1.17;P=0.008);并且将这一变量加入多因素Cox分析后,显示淋巴结转移数与术中出血量是影响伴NED胃癌转移的独立因素,见表5,淋巴结转移数目(≥4枚)及术中出血量(≥300mL)较多的患者更易出现远处转移。见图1~2。
表4 胃癌伴NED患者外周血特点与肿瘤远处转移相关因素分析
Tab.4 Univariate analysis of serum biochemical risk factors for distant metastasis in 71 gastric cancer patients with NED (n=71)

组别无远处转移组远处转移组HR95%CIPNLR(中性粒/淋巴细胞比值)2.40[2.4]2.49[2.41]0.950.78~1.150.577LMR(淋巴/单核细胞比值)3.34[2.33]2.91[2.42]1.010.87~1.180.881血小板/(×109L-1)223.00[84.75]192.00[84.0]10.99~10.434血红蛋白/(g·L-1)120.96±22.78118.43±22.680.990.97~1.010.278白蛋白/(g·L-1)38.65±3.9138.09±4.280.960.87~1.060.411前白蛋白/(mg·L-1)206.29±47.49182.04±62.640.990.98~10.029血糖/(mmol·L-1)5.15[0.82]5.40[1.4]0.930.7~1.230.605
表5 胃癌伴NED多因素Cox回归分析(n=71,含淋巴结转移数)
Tab.5 Multivariate analysis of clinical risk factors of distant metastasis in 71 patients (including lymphatic metastasis)

变量PHR95%CI淋巴结转移数0.0021.1181.041~1.201术中出血量 0.0171.2081.035~1.409
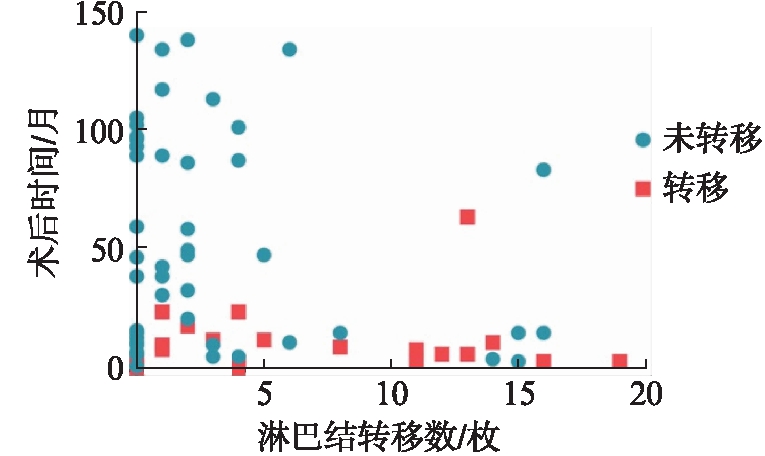
图1 淋巴结转移数与肿瘤出现转移的关系
Fig.1 Relation of lymphatic metastasis number with tumor metastasis
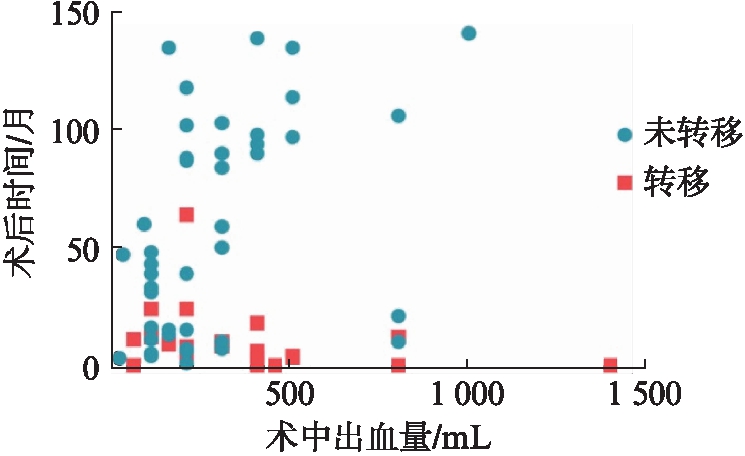
图2 术中出血量与肿瘤出现转移的关系
Fig.2 Correlation of intraoperative blood loss volume with tumor metastasis
3 讨 论
临床上腺癌伴神经内分泌分化的诊断主要依靠免疫组化染色。目前,WHO[1]、中国GEP-NEN病理诊断专家共识[10]及中国胃肠胰神经内分泌肿瘤专家共识[11]均指出,CgA及Syn作为特异性神经内分泌标志物,是诊断神经内分泌细胞除H-E染色形态学观察以外的必查项目。CgA是核蛋白,特异性高;Syn为跨膜蛋白,敏感度高。本研究中,CgA和Syn在伴NED胃癌患者中的阳性率分别为76.1%和85.9%。Syn阳性表达率高于CgA,灵敏度更好,这与宋魏等[12]及陈美丽等[7]的研究结果一致,反映了这两个指标的联合检测对于提高疾病诊断敏感性及特异性的重要性。
临床表现方面,胃癌伴NED男女发病率约为4.5∶1。主要临床症状依次为: 腹痛、腹胀、消化道出血、体质量减轻和反酸。所有病例均无明显面部潮红等类癌症状,符合胃癌及G-NET的临床表现特点[11]。在71例NED胃癌患者中,仅1例没有任何临床症状,为体检所发现。针对胃癌、胃癌伴NED、G-NET这些胃恶性肿瘤而言,有症状再诊治往往都已处于疾病进展期,如何通过早期筛查方法,在无症状表现的潜在患者中提高早癌的诊断率,从而改善患者整体预后水平,仍任重道远。
肿瘤家族史是胃癌疾病发生的高危因素[13],但与预后的关系尚有争议。如Liu等[14]、Han等[15]的报道均指出,阳性癌症家族史的进展期胃癌患者复发或死亡风险均较无家族史患者低。也有部分研究认为胃癌患者是否有肿瘤家族史,其临床病理特征和生存率并没有显著差异[16]。在本项回顾性分析中,仅转移组有1例患者有一级肿瘤家族史,各分组人数极不平衡,另一方面考虑到回顾性研究病史采集的数据质量受限,所以此项数据虽然具有统计学差异(P<0.05),但欠缺临床参考意义。
除外肿瘤家族史,单因素分析显示胃癌伴NED患者合并高血压病、原发肿瘤浸润深度深、前白蛋白指数低等指标与肿瘤转移相关(P<0.05)。高血压为常见的代谢紊乱性疾病。胃癌患者中,代谢紊乱尤多见于肿瘤进展期,是患者疾病分期较晚、预后较差的相关性因素[17]。而白蛋白水平反映了肿瘤患者的营养情况,尤其是前白蛋白水平可以体现患者近期营养状况。前白蛋白浓度(<180mg/L)被鉴定为与胃癌进展及较差的整体存活率(overall survival, OS)、无病生存(disease-free survival, DFS)有独立相关性[18]。结合原发肿瘤浸润深度,这些伴NED胃癌转移的危险因素均也是提示胃腺癌进展、预后较差的危险因素,体现这两种疾病具有一致性。
多因素分析结果显示肿瘤浸润深度是胃癌伴NED患者出现远处转移的独立危险因素,而淋巴结是否转移无相关性。这与胃腺癌预后最常规使用的TNM分期评判标准不甚相符。是否将区域淋巴结以有/无转移作为分类变量处理不合理呢?本研究将区域淋巴结转移个数作为连续变量再次与肿瘤转移作单因素分析,结果显示区域淋巴结转移数越多,远处转移风险更大(P<0.01)。进一步的多因素分析结果表明,区域淋巴结转移数多(≥4枚,P<0.01)及术中出血多(≥300mL,P<0.05)取代了肿瘤浸润深度,是促进胃癌伴NED患者出现转移的独立因素。
根据以上多因素分析结果,对于术前超声胃镜、影像学检查等手段评判淋巴结没有转移的患者,肿瘤浸润深度是决定转移的关键因素。那么,对于cT1/2N0M0的患者做ESD/手术根治、cT3/4N0M0的患者做手术根治/新辅助治疗的决策是合理的。但对于术前判断有淋巴结转移的患者,因为转移淋巴结个数及术中出血量成为影响转移的主要因素,是否有扩大这一部分患者新辅助治疗的必要?以通过新辅助治疗来减少淋巴结转移的个数,及通过肿瘤的降期以达到减少术中出血量的控制?而结合研究背景中所介绍的多项生存分析研究,胃癌伴NED患者预后较单纯胃腺癌更差,那么,对于术后病理提示区域淋巴结转移数≥4枚的患者,术后辅助治疗是否需要更积极?这些问题,都需要更高级别的前瞻性研究数据来论证。
综上,本项研究表明胃癌伴NED患者出现转移的主要危险因素包括: 肿瘤浸润深度(≥T3)、淋巴结转移个数(≥4枚)以及术中出血量(≥300mL)等。但因为研究样本量的限制及随访时限等的问题,无法再进一步细化完成各个TN分期的胃癌伴NED患者发生转移的预测模型。目前胃癌伴NED的相关研究尚较少,因为发病率的关系,国外近期关于此类疾病更以个案报道为主[19-20],但文末都有关于开展更多研究的需求,以及建议标准化治疗的呼吁。希望通过推进多中心的相关研究等方式,在更高的证据水平来认识、推进胃癌伴NED患者的诊治,以期实现这部分患者的个体化治疗。
[1] The International Agency for Research on Cancer. WHO classification of tumours of the digistive system[M]. 4th ed. Lyon: IARC Press, 2010: 1089.
[2] RV L, RY O, G K et al. WHO Classification of Tumours of Endocrine Organs[M]. 4th ed. Lyon: International Agency for Research on Cancer (IARC), 2017.
[3] WALDUM H L, ÖBERG K, SØRDAL Ø F, et al. Not only stem cells, but also mature cells, particularly neuroendocrine cells, may develop into tumours: time for a paradigm shift[J]. Therap Adv Gastroenterol, 2018,11: 1756284818775054.
[4] BRATHWAITE S, ROCK J, YEARSLEY M M, et al. Mixed adeno-neuroendocrine carcinoma: an aggressive clinical entity[J]. Ann Surg Oncol, 2016,23(7): 2281-2286.
[5] XIE J W, LU J, WANG J B, et al. Prognostic factors for survival after curative resection of gastric mixed adenoneuroendocrine carcinoma: a series of 80 patients[J]. BMC Cancer, 2018,18(1): 1021.
[6] 于红梅,刘晓文,龙子雯,等.胃癌伴神经内分泌分化的临床病理及预后分析[J].中国癌症杂志,2013,23(1): 42-46.
[7] 陈美丽,杨觅,陈洁宇,等.伴神经内分泌分化胃癌的临床病理特征及预后分析[J].临床肿瘤学杂志,2018,23(7): 615-620.
[8] ZHANG T T, SU D, MAO Z Y, et al. Prognostic role of neuroendocrine cell differentiation in human gastric carcinoma[J]. Int J Clin Exp Med, 2015,8(5): 7837-7842.
[9] MBES. A, AL. G F E. American Joint Committee on Cancer (AJCC) cancer staging manual [M]. 8th ed. New York: Springer, 2016.
[10] 2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组.中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J].中华病理学杂志,2013,42(10): 691-694.
[11] 中国临床肿瘤学会神经内分泌肿瘤专家委员会.中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J].临床肿瘤学杂志,2016,21(10): 927-946.
[12] 宋魏,于庆凯.胃癌伴神经内分泌分化和胃混合性腺神经内分泌癌临床病理及预后分析[J].天津医药,2014,42(8): 799-801,849.
[13] YAGHOOBI M, BIJARCHI R, NAROD S A. Family history and the risk of gastric cancer[J]. Br J Cancer, 2010,102(2): 237-242.
[14] LIU X W, CAI H, YU L, et al. Prognostic significance of cancer family history for patients with gastric cancer: a single center experience from China[J]. Oncotarget, 2016,7(24): 37305-37318.
[15] HAN M A, OH M G, CHOI I J, et al. Association of family history with cancer recurrence and survival in patients with gastric cancer[J]. J Clin Oncol, 2012,30(7): 701-708.
[16] JEONG O, JUNG M R, PARK Y K, et al. Clinicopathological features and survival of patients with gastric cancer with a family history: a large analysis of 2, 736 patients with gastric cancer[J]. J Gastric Cancer, 2017,17(2): 162-172.
[17] LI F X, DU H, LI S X, et al. The association between metabolic syndrome and gastric cancer in Chinese[J]. Front Oncol, 2018,8: 326.
[18] SHEN Q, LIU W, QUAN H, et al. Prealbumin and lymphocyte-based prognostic score, a new tool for predicting long-term survival after curative resection of stage Ⅱ/Ⅲ gastric cancer[J]. Br J Nutr, 2018,120(12): 1359-1369.
[19] KITANO Y, KINOSHITA J, OYAMA K, et al. A case of esophagogastric junction adenocarcinoma with neuroendocrine differentiation[J]. Gan To Kagaku Ryoho, 2017,44(12): 1226-1228.
[20] PARK J Y, RYU M H, PARK Y S, et al. Prognostic significance of neuroendocrine components in gastric carcinomas[J]. Eur J Cancer, 2014,50(16): 2802-2809.