脓毒症(sepsis)是机体对感染的反应失调而导致危及生命的器官功能障碍。流行病学调查显示,脓毒症发病率呈逐年增加的趋势,每年全球有超过180万脓毒症的病例,发病率大约为0.3%,临床病死率约25%,若合并脓毒症休克,病死率可高达80%[1-3]。心肌损伤是脓毒症严重并发症之一,40%~50%的脓毒症患者可发生心肌抑制,7%的脓毒症患者合并心力衰竭[4]。脓毒症合并心肌损伤是预后不良的重要原因之一,早期准确评估病情并及时干预,可明显降低死亡率及改善预后[5-6]。本研究探讨心肌损伤标记物BNP、cTn-I以及APN在脓毒症预后评估中的价值。
1 资料与方法
1.1 研究对象
采用前瞻性队列研究,收集2016年1月至2018年6月同济大学附属同济医院EICU符合入选标准的脓毒症患者125例。入选标准: 符合Sepsis 3.0诊断标准[7],对感染或可疑感染患者,SOFA≥2分或qSOFA≥2分即收缩压≤100mmHg(1mmHg=0.133kPa),呼吸频率≥22次/min,意识改变,可诊断为脓毒症。脓毒性休克诊断标准: 经积极液体复苏仍无法纠正的低血压(平均动脉压≤65mmHg),需使用血管活性药物及血乳酸升高>2mmol/L。
排除标准: (1) 慢性心力衰竭终末期、急性冠脉综合征及急性心肌梗死;(2) 恶性肿瘤;(3) 孕妇;(4) 慢性肾功能不全或慢性肾功能衰竭;(5) 妊娠;(6) HIV感染者;(7) 糖尿病;(8) 重度肥胖,体质量指数(body mass index, BMI)>35kg/m2;(9) 入院前6个月内使用免疫抑制剂或细胞毒药物;(10) 24h 内死亡或转出ICU以及自动出院要求终止治疗。
本研究获得同济大学附属同济医院伦理委员会同意,患者或家属签署知情同意书。
1.2 研究方法
收集所有入组患者详细临床资料,包括一般病史资料、既往病史、感染部位、ICU住院时间等。记录所有患者入EICU时氧合指数(PaO2/FiO2)、平均动脉压(MAP)、体温、心率及呼吸频率等生理参数,记录患者入EICU时APACHE Ⅱ、SOFA及qSOFA评分。同时于入EICU 24h内留取血标本用于APN、IL-6、IL-8、TNF-α、BNP、cTn-I及Lac检测。入EICU第1、3、7天动态监测血BNP、cTn-I及Lac水平。所有患者均按照Sepsis3.0指南进行规范化治疗,以住院期间死亡为观察终点。
1.3 实验室检测方法
APN检测采用酶联免疫(ELISA)试剂盒(上海博普生物技术有限公司提供)定量检测。BNP、cTn-I检测采用Beckman DXI 800化学发光仪进行定量检测(试剂盒由美国贝克曼公司提供);IL-6、IL-8、TNF-α检测采Immulite/Immulite 1000化学发光分析仪与配套试剂盒进行定量检测(试剂盒由德国西门子公司提供)。
1.4 统计学处理
应用SPSS 22.0统计软件处理数据。所有计量资料采用非参数K-S法进行正态性检验,其中符合正态分布的计量资料以![]() 表示,组间比较采用t检验;非正态分布的计量资料以中位数(P25~P75)表示,组间比较采用非参数Mann-Whitney U检验;正态分布资料与非正态分布资料之间的比较采用秩和检验;计数资料以率或构成比表示,组间比较采用χ2检验;相关性检验采用Spearman相关性分析;采用生存曲线分析脓毒症患者死亡影响因素。P<0.05为差异有统计学意义。
表示,组间比较采用t检验;非正态分布的计量资料以中位数(P25~P75)表示,组间比较采用非参数Mann-Whitney U检验;正态分布资料与非正态分布资料之间的比较采用秩和检验;计数资料以率或构成比表示,组间比较采用χ2检验;相关性检验采用Spearman相关性分析;采用生存曲线分析脓毒症患者死亡影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
研究共收集脓毒症患者125例,其中男性53例,女性41例,年龄24~97岁,平均72.61±14.10岁。生存组94例(75.2%),死亡组31例(24.8%),合并脓毒症休克35例(28.0%)。
生存组与死亡组之间的年龄、性别、发病时间、体温、基础疾病及感染部位间均无显著差异(P>0.05);死亡组ICU住院天数、入院时呼吸频率及心率明显高于存活组(P=0.000、0.027、0.021)而平均动脉压及氧合指数(P=0.026、0.001)则显著低于存活组,见表1。
2.2 脓毒症患者生存组及死亡组危重评分及炎症因子水平的比较
死亡组患者入院时qSOFA、SOFA及APACHE Ⅱ评分均明显高于存活组(P=0.000、0.000、0.004),死亡组患者入院时IL-6、TNF-α水平均明显高于存活组(P=0.001、0.042、0.000),两组间IL-8 水平差异无统计学意义(P=0.191),见表2。
表1 脓毒症患者生存组与死亡组之间基线资料比较
Tab.1 Comparison of baseline data between survival and death groups of sepsis patients

项目生存组(n=94)死亡组(n=31)P年龄/岁72.61±14.1076.39±13.650.194女性/[n(%)]41(43.6)14(45.2)1.000发病时间/h45.5(24.00,72.00)24(12.00,48.00)0.082ICU住院时间/d7.5(0.75,12.00)15(11.00,17.00)0.000住院时间/d10.81±7.0011.03±11.650.920既往病史/[n(%)] 吸烟史12(12.9)4(12.9)1.000 高血压54(57.4)17(54.8)0.836 冠心病26(27.7)8(26.7)1.000 脑梗死24(25.5)10(32.3)0.490 慢性阻塞性肺疾病4(4.3)4(12.9)0.104感染源/[n(%)] 肺部感染33(35.11)12(38.71)0.830 泌尿系统感染35(37.23)11(35.48)1.000 肠道感染15(15.96)3(9.68)0.558 胆道感染6(6.38)1(3.23)0.680 肝脓肿5(5.32)0(0.00)0.331 其他感染4(4.26)3(9.68)0.363入院时 体温/℃37.88±2.3537.57±1.230.492 呼吸次数/(次·min-1)19.18±2.8721.42±5.150.027 心率/(次·min-1)94.17±18.26102.77±16.350.021 氧合指数/mmHg289.40±85.44211.10±116.830.001 平均动脉压/mmHg84.20±17.0072.57±26.170.026
1mmHg=0.133kPa
表2 脓毒症患者生存组与死亡组间危重评分及炎症因子水平比较
Tab.2 Comparison of critical scores and inflammatory factor levels in survival and death group

项目生存组(n=94)死亡组(n=31)P值SOFA5.03±3.2310.16±4.610.000qSOFA0.5(0,1.00)2.0(1.50,2.50)0.000APACHEⅡ13.78±4.6817.52±5.90.004IL-6/(pg·mL-1)22.95(11.02,65.05)58.5(28.85,127.00)0.001IL-8/(pg·mL-1)37.01±3.86164.15±95.220.191TNF-α/(pg·mL-1)26.27±2.044.03±8.700.042
2.3 生存组与死亡组间BNP、cTn-I及Lac动态水平比较
与生存组相比,死亡组患者血浆BNP水平在入院第1天差异无统计学意义(P=0.069),但是在第3、7天则明显高于生存组(P=0.038、0.043);两组间cTn-I在入院第1、3天水平差异无统计学意义(P=0.201、0.174),但第7天死亡组cTn-I水平明显高于存活组(P=0.007);死亡组患者血Lac水平在入院第1、3、7天均明显高于存活组(P=0.000、0.013、0.011)。见表3~5。
表3 生存组与死亡组间BNP动态水平比较
Tab.3 Comparison of dynamic levels of BNP between survival and death groups in patients with sepsis (pg·mL-1)

组别第1天第3天第7天生存组600.24±71.02498.17±77.15389.66±88.96死亡组1000.88±201.641116.50±270.801123.8±343.64P0.0690.0380.043
表4 生存组与死亡组间cTn-I动态水平比较
Tab.4 Comparison of dynamic levels of cTn-I between survival and death groups in patients with sepsis (pg·mL-1)
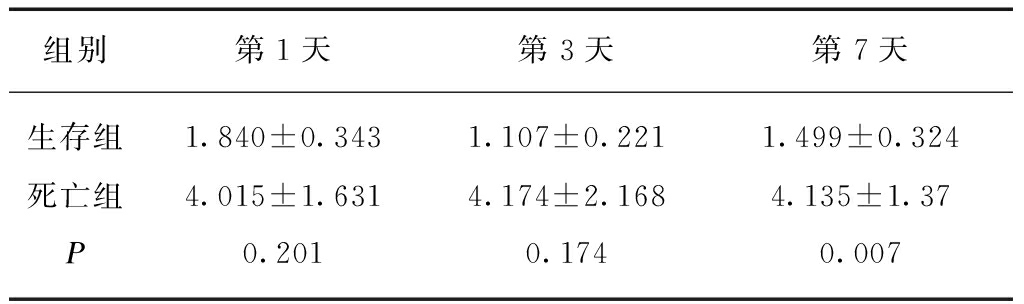
组别第1天第3天第7天生存组1.840±0.3431.107±0.2211.499±0.324死亡组4.015±1.6314.174±2.1684.135±1.37P0.2010.1740.007
表5 生存组、死亡组脓毒症患者的Lac动态水平比较
Tab.5 Comparison of dynamic levels of Lac between survival and death groups in patients with sepsis (mmol·L-1)
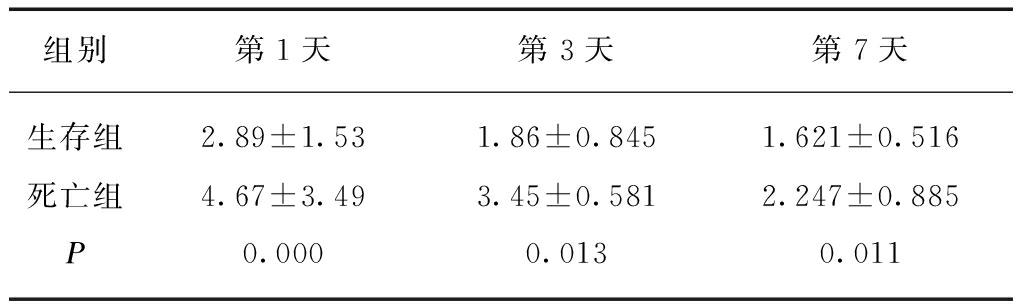
组别第1天第3天第7天生存组2.89±1.531.86±0.8451.621±0.516死亡组4.67±3.493.45±0.5812.247±0.885P0.0000.0130.011
2.4 生存组与死亡组间APN水平比较
生存组患者入院时血浆APN水平[(1132.48±56.37) pg/mL]明显高于死亡组[(843.34±40.49) pg/mL],差异有统计学意义(P=0.012)。
2.5 脓毒症患者APN与BNP、cTn-I水平的相关性
脓毒症患者入院当天血浆APN水平与BNP、cTn-I、IL-6、IL-8及TNF-α水平均有显著负相关性(OR=-0.395、-0.432、-0.397、-0.346、-0.425,P=0.021、0.011、0.020、-0.045、-0.012)。
2.6 入院时BNP、cTn-I、APN对脓毒症患者住院期间生存预后评估
利用生存曲线评估患者住院期间死亡影响因素,发现脓毒症患者入院第1天BNP>1200pg/mL时,其住院期间死亡风险明显增加(P=0.027);当cTn-I>0.11ng/mL时,其住院期间死亡风险明显增加(P=0.011);当APN<1016.05pg/mL时,住院期间死亡风险明显增加(P=0.021)。见图1~3。

图1 第1天BNP水平对脓毒症患者住院期间预后评估的生存曲线
Fig.1 Survival curve ofhospitalized septic patients with different BNP levels at D1
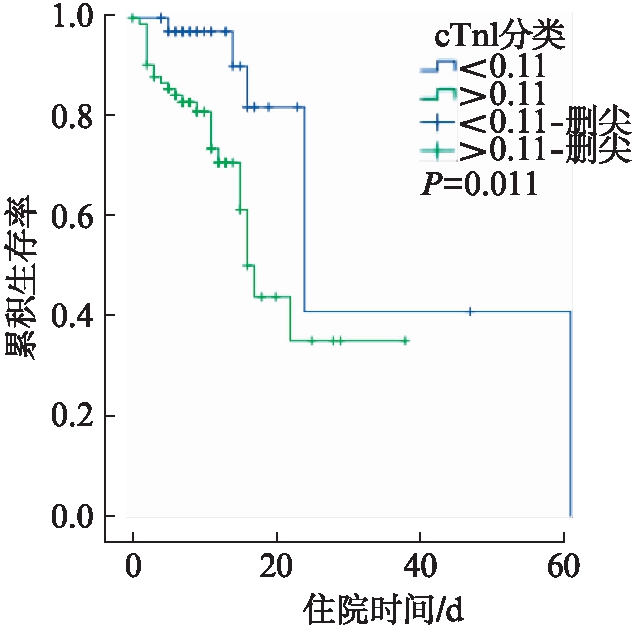
图2 第1天cTn-I水平对脓毒症患者住院期间预后评估的生存曲线
Fig.2 Survival curve of hospitalized septic patients with different cTn-I levels at D1

图3 APN对脓毒症患者住院期间预后评估的生存曲线
Fig.3 Survival curve of hospitalized septic patients with different APN levels
3 讨 论
本研究通过对脓毒症患者心肌标记物的动态监测,表明血APN、BNP、cTn-I及Lac水平对脓毒症患者预后评估有一定的临床价值。脓毒症患者入院时BNP>1200pg/mL、cTn-I>0.11ng/mL及APN<1016.05pg/mL,其住院期间死亡率明显增加。脓毒症患者APN水平降低,其死亡风险增加,且APN水平与BNP、cTn-I及炎症因子水平呈明显负相关。
脓毒症患者常合并心肌损伤,可能与心肌能量代谢障碍、炎症及细胞因子释放等有关,心肌损伤标记物的出现提示患者预后不佳。由于心肌cTn-I的生物特性,在脓毒症所致心肌损伤中具有一定的诊断价值,cTn-I升高的脓毒症患者死亡风险增加91%,可作为识别具有高死亡风险脓毒症患者的临床指标之一[8]。血浆BNP水平与心功能衰竭严重程度相关,随着脓毒症患者血浆BNP水平的升高,其死亡率增加,血浆BNP水平是预测脓毒症患者严重程度和死亡的独立危险因子[9-10]。本研究结果表明脓毒症患者死亡组在入院第3、7天BNP水平及第7天cTn-I明显高于存活组,当BNP>1200pg/mL、cTn-I>0.11ng/mL时,其住院期间死亡风险明显增加(P=0.027),动态监测BNP及cTn-I水平对脓毒症预后评估有一定价值。
APN作为保护性因子,在糖尿病及其它代谢疾病过程中,可调节胰岛素抵抗、代谢及炎症反应等。动物实验及临床研究均发现APN在脓毒症代谢及炎症反应中也起着重要作用[11]。研究表明,APN可通过抑制LPS诱导的脓毒症大鼠早、晚期炎症介质的表达,显著提高脓毒症大鼠的生存率[12]。脓毒症预后良好的患者其APN水平有上升趋势,与炎性因子(IL-1、IL-6、TNF-α)间存在负相关,随APN水平的升高,炎性因子水平呈下降趋势,提示APN在脓毒症患者体内发挥着一定的负性调控作用[13]。脓毒症患者血浆APN水平与疾病危重评分呈显著负相关,认为APN是机体康复的重要指标,其水平越高,越有利于机体恢复[14]。本研究显示,脓毒症患者血浆APN水平与IL-6、TNF-α之间存在显著负相关,血浆APN水平越高,其炎症因子水平越低,血浆APN水平与BNP、cTn-I之间存在显著负相关,APN可能通过抑制脓毒症患者炎症反应来减轻心肌损害,从而起到保护心肌的作用。APN水平可能作为脓毒症患者的预后评估的重要指标,当脓毒症患者血浆APN水平低于1016.05pg/mL时,其死亡风险明显增加。
总之,单一指标评估脓毒症患者预后均存在一定的局限性,联合多种生物学标记物及动态监测在一定程度上可弥补不足。动态监测心肌损伤标记物在脓毒症患者预后评估中有重要意义,APN作为保护性因子在脓毒症心肌损伤及其预后评估中有一定价值。本研究样本量相对较小,且由于一些原因未能获得血浆APN及炎症因子入院后动态监测的数据,是为本研究的不足之处,有待进一步大样本前瞻性队列研究的结果。
[1] GALLEY H F. Oxidative stress and mitochondrial dysfunction in sepsis[J]. Br J Anaesth, 2011,107(1): 57-64.
[2] 王春梅,唐伦先,徐慧晖,等.老年脓毒症患者血浆降钙素原和乳酸浓度动态变化特征及其预后意义[J].同济大学学报(医学版),2018,39(1): 89-93.
[3] MARTIN G S, MANNINO D M, EATON S, et al. The Epidemiology of Sepsis in the United States from 1979 through 2000[J]. N Engl J Med, 2003,348(16): 1546-1554.
[4] ESPER A M, MARTIN G S. Extending international sepsis epidemiology: the impact of organ dysfunction[J]. Crit Care, 2009,13(1): 120.
[5] XUAN W, ZHOU Q J, YAO S L, et al. Mechanical ventilation induces an inflammatory response in preinjured lungs in late phase of sepsis[J]. Oxid Med Cell Longev, 2015,2015: 364020.
[6] YOO J W, LEE J R, JUNG Y K, et al. A combination of early warning score and lactate to predict intensive care unit transfer of inpatients with severe sepsis/septic shock[J]. Korean J Intern Med, 2015,30(4): 471-477.
[7] SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016,315(8): 801-810.
[8] WANG X F, BUECHLER N L, YOZA B K, et al. Adiponectin treatment attenuates inflammatory response during early sepsis in obese mice[J]. J Inflamm Res, 2016,9: 167-174.
[9] 陈德珠,刘长智,卢剑海,等.肌钙蛋白I、B型脑钠肽对脓毒症性心肌功能障碍发生的预测与预后评估价值[J].中华临床医师杂志(电子版),2015,9(12): 2286-2289.
[10] Zhang X H, Dong Y, Chen Y D, et al. Serum N-terminal pro-brain natriuretic peptide level is a significant prognostic factor in patients with severe sepsis among Southwest Chinese population[J]. Eur Rev Med Pharmacol Sci, 2013,17(4): 517-521.
[11] WATANABE Y, SHIBATA R, OUCHI N, et al. Adiponectin ameliorates endotoxin-induced acute cardiac injury[J]. Biomed Res Int, 2014,2014: 382035.
[12] 陈建南,丁毅鹏.脓毒症大鼠APN的表达变化及与TNF-α 的关系[J].中国老年学杂志,2014,34: 2561-2562.
[13] Salman B, Y lmaz TU, Tezcaner T,et al. Exogenous recombinant adiponectin improves survival in experimental abdominal sepsis[J]. Balkan Med J, 2014,31(3): 244-248.
lmaz TU, Tezcaner T,et al. Exogenous recombinant adiponectin improves survival in experimental abdominal sepsis[J]. Balkan Med J, 2014,31(3): 244-248.
[14] WATANABE Y, SHIBATA R, OUCHI N, et al. Adiponectin ameliorates endotoxin-induced acute cardiac injury[J]. Biomed Res Int, 2014,2014: 382035.