原发性肝癌是我国第4位常见恶性肿瘤和第3位的肿瘤致死病因,严重地威胁我国人民的生命和健康[1-3]。在我国,由于乙型肝炎病毒(hepatitis B virus, HBV)和/或丙型肝炎病毒(hepatitis C virus, HCV)感染等多种原因引起的肝硬化等危险因素的存在,肝癌发病率居高不下,且多数患者就诊时已发展至进展期或存在远处转移,已经失去手术机会而难以达到理想疗效,预后极差。
程序性死亡受体1(programmed cell death 1, PDCD1,也称PD-1)作为重要的免疫检查点,可见于多种免疫细胞如活化的T细胞、NK细胞、B细胞等[4]。肿瘤微环境可诱导肿瘤细胞高表达PD-1的配体程序性死亡受体配体1(programmed cell death 1 ligand 1, PDCD1LG1,也称PD-L1),PD-L1通过与PD-1结合,负性调节T细胞功能,抑制T细胞增殖,抑制细胞毒性T淋巴细胞的活性,同时抑制细胞因子如白细胞介素-2、干扰素-γ等的产生,从而促进肿瘤的免疫逃逸[5-6]。因此,使用阻断剂阻断PD-1和PD-L1间的相互作用,可恢复T细胞的活性和杀伤肿瘤细胞的能力,这是目前临床治疗中使用PD-1/PD-L1抗体进行免疫治疗的理论依据。近年来以PD-1/PD-L1为免疫检查点的免疫新疗法取得突破性进展,也为肝癌治疗带来了新的曙光[7]。根据中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南推荐,晚期肝细胞癌的一线治疗策略推荐索拉非尼、仑伐替尼、奥沙利铂为主的系统化疗,二线推荐瑞戈非尼、PD-1单抗(包括纳武单抗、派姆单抗等)。PD-L1在肝脏肿瘤中的表达研究已见报道[8],但多数研究选用抗体并非FDA指定的诊断试剂,本研究拟使用FDA指定的诊断试剂检测我国肝胆系统肿瘤组织内PD-L1的表达水平,并探讨其表达与临床病理参数之间的关系,为进一步研究奠定基础。
1 资料与方法
1.1 一般资料
选取2018年1月1日—2018年10月31日于东方肝胆外科医院行手术治疗、由同一病理科医师进行诊断的肝胆系统原发恶性肿瘤病例,共434例,包括347例肝细胞癌(hepatocellular carcinoma, HCC)、37例肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)、7例肝细胞-胆管细胞混合型肝癌(combined hepatocellular-cholangiocarcinoma, cHCC-CCA)、43例肝外胆管癌(包括肝门部胆管细胞癌及末端肝外胆管细胞癌)。收集347例HCC病例的年龄、性别、AFP、HBsAg、肿瘤大小、组织学类型、分化程度、微血管侵犯(microvascular invasion, MVI)、子灶、肝硬化情况、T分期等临床病理参数。
其中分化程度采用国际上常用的Edmondson-Steiner级(Ⅰ~Ⅳ)分级法;组织学类型常见有细梁型、粗梁型、假腺管型和团片型等,特殊细胞类型如透明细胞型、富脂型、梭形细胞型和未分化型等。MVI是指在显微镜下于内皮细胞衬覆的脉管腔内见到癌细胞巢团,以门静脉分支为主(含包膜内血管),分为: M0,未发现MVI;M1(低危组),≤5个MVI且发生于近癌旁肝组织;M2(高危组),>5个MVI或MVI发生于远癌旁肝组织[9]。根据国际癌症联盟/美国癌症联合会肝癌分期标准进行原发灶分期、即T分期。
1.2 仪器与试剂
PD-L1抗体、试剂盒为安捷伦公司的诊断试剂套装(PD-L1 IHC PharmDx, Santa Clara, CA,美国),并使用配套免疫组化检测系统(Dako Autostainer Link 48 platform, Dako, Carpinteria, CA)。鼠抗人肝细胞(Hep Par 1)单克隆抗体(Clone OCH1E5)、细胞角蛋白19(Cytokeratin 19, CK19)抗体购自Dako公司。二抗及显色试剂盒采用Leica公司的BondTM PolymerRefine Detection,Hep Par 1及CK19免疫组化由全自动免疫组化染色机(Leica BOND-MAX)完成。切片观察采用Nikon ECLIPSE TE2000-U型显微镜。
1.3 方法
1.3.1 H-E染色 按照常规方法(取材、固定、脱水、包埋、切片、展片、捞片)制作石蜡切片,二甲苯脱去切片中的石蜡,再经由高浓度到低浓度乙醇脱水、最后入蒸馏水进行水化,之后即可进行苏木精-伊红(H-E)染色。具体步骤如下: 将已入蒸馏水后的切片放入苏木精水溶液中染色5min,盐酸乙醇分化15s后自来水冲洗15min后入蒸馏水2min。入75%和85%乙醇中脱水各2min。入乙醇伊红染色液染色1min。染色后的切片经无水乙醇脱水,再经二甲苯使切片透明、中性树胶封片后镜检。
1.3.2 免疫组化染色 常规石蜡包埋组织切片,PD-L1免疫组化染色应用上述指定的Dako诊断试剂、按照说明书操作步骤进行,根据PD-L1表达情况分为PD-L1阳性及PD-L1阴性组。阳性定义为肿瘤比例评分(tumour proportion score, TPS)≥1%[9]。Hep Par 1及CK19免疫组化采用上述一抗试剂、配套试剂盒、全自动生化仪按照说明书步骤进行染色,根据染色结果判断为阳性及阴性。
1.4 统计学处理
比较PD-L1阳性及PD-L1阴性组上述临床病理参数之间的差异,采用SPSS 18.0统计软件,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 PD-L1在不同类型肝胆系统恶性肿瘤中的表达情况
347例HCC肿瘤组织内PD-L1的阳性率为21.6%(75/347),略低于ICC组的29.7%(11/37),但差异无统计学意义(P=0.26),高于cHCC-CCA组及肝外胆管癌组的14.3%(1/7,P=0.536)和6.98%(3/43,P=0.024)。PD-L1在不同病理类型肝胆恶性肿瘤组织内的表达结果见图1。图1A、B显示HCC肿瘤细胞排列呈梁索状,包膜内癌栓组织PD-L1呈细胞膜/质表达;图1C、D显示ICC呈腺管或巢状排列,纤维间质丰富,PD-L1以细胞膜表达为主;图1E、F显示cHCC-CCA中的肝细胞癌成分呈梁索状,但细胞间排列较松散,细胞异型性大,PD-L1在肿瘤细胞中呈细胞膜/质表达;图1G、H显示低分化肝外胆管癌肿瘤排列呈巢状或腺样,细胞异型明显,间质内见淋巴细胞浸润,PD-L1在肿瘤细胞中呈细胞膜/质表达。
2.2 双表型肝细胞癌组织内PD-L1的表达情况
347例HCC各组织学亚型的PD-L1阳性率分别为: 粗梁型21.5%(60/279)、细梁型5.9%(1/17)、团片型25%(1/4)、假腺管型0(0/3)、透明细胞型15.4%(2/13)、DPHCC 39.3%(11/28)、硬化型0(0/2)、紫癜型0(0/1)。28例DPHCC组织内PD-L1的阳性率(39.3%,11/28)显著高于其他亚型的PD-L1阳性率(20.1%,64/319),差异具有统计学意义(P=0.018)。
双表型肝细胞癌(dual-phenotype hepatocellular carcinoma, DPHCC)是HCC的一种特殊亚型,常规H-E染色提示显示肿瘤细胞排列呈粗梁型,细胞多边形,核大深染,异型明显(图2A,×200),Hep-Par-1免疫组化染色显示肿瘤细胞胞质染色阳性(图2B,×200),CK19染色显示肿瘤细胞胞膜及胞质染色阳性(图2C,×200),PD-L1染色显示肿瘤细胞胞膜及胞质染色阳性(图2D,×400)。
2.3 HCC中PD-L1的表达与临床病理参数之间的关系
统计分析结果见表1。PD-L1阳性组与阴性组患者以下临床病理参数间差异无统计学意义,包括年龄、性别、AFP阳性、HBsAg阳性、肝硬化有无、肿瘤大小、子灶有无。在微血管侵犯方面,PD-L1阳性组的MVI阳性率为37.3%,显著高于PD-L1阴性组的21%(P=0.003);PD-L1阳性组的Ⅲ~Ⅳ级分化比例显著高于PD-L1阴性组(P=0.016),说明PD-L1阳性组病例分化较差;PD-L1阳性组的CK-19阳性率为12%,显著高于PD-L1阴性组的5.1%(P=0.035);在T分期方面,PD-L1阳性组病例的T3期(包括T3a及T3b)比例为20%,显著高于PD-L1阴性组病例的11%(P=0.004),说明PD-L1阳性病例的分期较晚。

图1 PD-L1在不同病理类型肝胆恶性肿瘤组织内的表达(H-E,×200)
Fig.1 PD-L1 expression of in different pathological types of malignant hepatobiliary tumor tissues (H-E,×200)
A、B: HCC;C、D: ICC;E、F: cHCC-CCA;G、H: 肝外胆管癌

图2 DPHCC免疫组织化学染色结果
Fig.2 Results of DPHCC immunohistochemical staining
A: H-E染色,×200;B: Hep-Par-1染色,×200;C: CK19染色,×200;D: PD-L1染色,×400
3 讨 论
美国FDA已批准PD-1或PD-L抗体治疗多种恶性肿瘤,包括非小细胞肺癌、晚期肾癌、复发或转移性尿路上皮癌、经典霍奇金淋巴瘤、晚期复发的头颈部鳞癌、黑色素瘤、不可切除的晚期或复发型胃癌、经过标准治疗后进展的微卫星不稳定型或错配修复基因缺陷型实体肿瘤,当然也包括肝细胞癌[10]。2017年9月23日,FDA批准纳武单抗(nivolumab)用于接受过索拉非尼治疗后的HCC患者,成为首个在肝癌上获FDA批准的免疫药物,标志着肝癌治疗正式进入免疫时代。2018年11月上旬美国FDA加速批准默沙东公司的派姆单抗(pembrolizumab,商品名Keytruda)用于治疗已经接受过索拉非尼治疗的晚期HCC患者。本次批准是基于Keytruda在名为KEYNOTE-224的2期临床研究中的表现[10]。在这项非随机、多中心、开放标签的2期临床试验中,104例HCC患者接受了Keytruda的治疗。他们曾经接受过索拉非尼的治疗,但是对疗法不耐受或者疾病继续恶化。试验结果表明,患者的客观缓解率为17%,其中1%的患者出现完全缓解,44%的患者疾病状态稳定。在出现缓解的患者中,89%的患者缓解期超过6个月,56%的患者缓解期超过12个月。但PD-1或PD-L1抗体治疗原发性肝癌等恶性肿瘤,其治疗效果决定于肿瘤细胞是否表达PD-1和PD-L1,低表达或不表达PD-L1或PD-1的肿瘤抗体治疗效果欠佳,反之则具有较好的疗效[10,12]。
Dai等[7]检测到90例HCC病理组织内PD-L1的高表达率为41.11%(37/90),Ma等[13]研究表明,70例肝外胆管癌组织内的PD-L1阳性率为42.86%(30/70),而Walter等[14]在11.6%(8/69)的肝外胆管癌组织内发现了PD-L1的表达。但上述研究所用的检测抗体均为科研试剂,并非FDA批准的纳武单抗或派姆单抗的配套检测试剂。KEYNOTE-224试验[10]使用了派姆单抗的配套检测试剂,检测出PD-L1 TPS≥1%的比例仅为13%(7/52),但根据该试验标准入选的病例不能代表总体HCC人群,且样本量较少。本研究报道了派姆单抗的配套PD-L1检测试剂在大样本肝胆系统恶性肿瘤组织内的阳性率,类似结果未见报道。
表1 PD-L1的表达与临床参数之间的关系
Tab.1 Relationships between PD-L1 expression and clinicopathological parameters ![]()
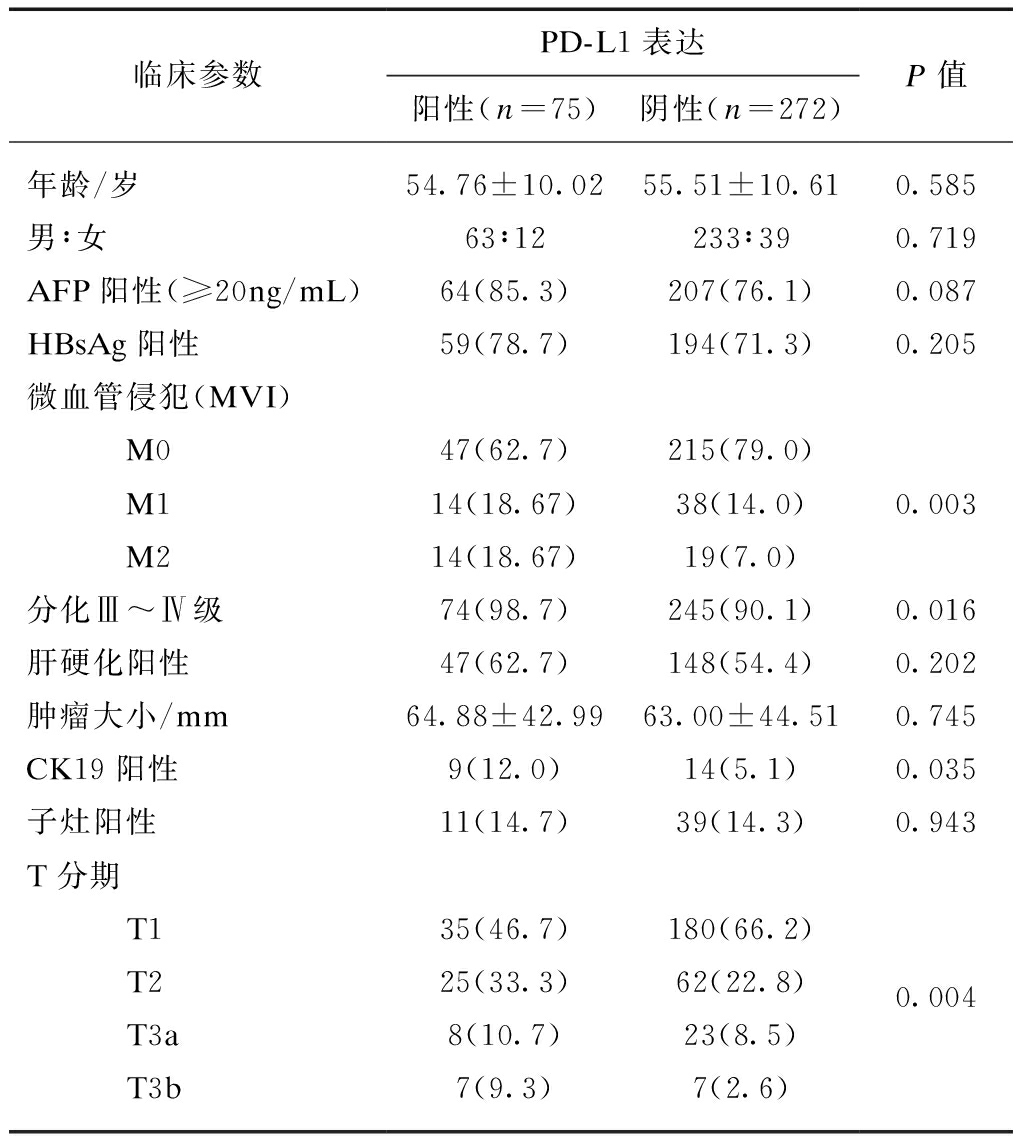
临床参数PD-L1表达阳性(n=75)阴性(n=272)P值年龄/岁54.76±10.0255.51±10.610.585男∶女63∶12233∶390.719AFP阳性(≥20ng/mL)64(85.3)207(76.1)0.087HBsAg阳性59(78.7)194(71.3)0.205微血管侵犯(MVI) M047(62.7)215(79.0) M114(18.67)38(14.0)0.003 M214(18.67)19(7.0)分化Ⅲ~Ⅳ级74(98.7)245(90.1)0.016肝硬化阳性47(62.7)148(54.4)0.202肿瘤大小/mm64.88±42.9963.00±44.510.745CK19阳性9(12.0)14(5.1)0.035子灶阳性11(14.7)39(14.3)0.943T分期 T135(46.7)180(66.2) T225(33.3)62(22.8)0.004 T3a8(10.7)23(8.5) T3b7(9.3)7(2.6)
Calderaro等[15]分析了PD-L1在217例肝癌组织中的表达及其与临床病理学参数的关系。结果显示,17%(36/217)的肝癌细胞存在PD-L1表达,肝癌细胞中PD-L1的高表达与肿瘤侵袭性呈正相关如高血清AFP水平、子灶存在、MVI、低分化、CK19表达。本研究通过对347例HCC病例深入研究发现,伴微血管浸润、T分期较晚(T3a/3b)、DPHCC、分化差(Ⅲ~Ⅳ)的HCC组织内PD-L1阳性率较高,提示该类人群可能成为PD-1/PD-L抗体治疗的优势人群。本研究通过对我国人群更大样本的病例研究,发现HCC组织中PD-L1的阳性率为21.6%、略高于Calderaro研究结果,因本研究采用的抗体试剂为病理诊断试剂、与前述Calderaro等所用的科研试剂有所不同,故而结果不同。
DPHCC是2011年报道的一种HCC亚型,发生率约占HCC的10%[16]。DPHCC是指在组织病理学上表现为典型的HCC,但以同时表达任意HCC标志物(如HepPar-1、pCEA、arginase等)和任意ICC标志物(如CK19、CK7、MUC-1等)为基本特征,因具有HCC和ICC的双重生物学行为,微血管侵犯和肝内外转移的发生率更高,临床预后更差,相比较于CK7和MUC-1等胆管细胞标志物,CK19显示出较高的敏感性和特异性,是病理学诊断胆管癌和DPHCC的最常用标志物之一。DPHCC仅表现出单一的HCC组织学成分,但其细胞呈双向分化和双向基因开放的特点,这不同于经典的cHCC-CCA[16-17],后者是指在一个肿瘤结节内含有明确的HCC和ICC两种组织学成分,并分别表达HCC和ICC的免疫组织化学标志物[18]。DPHCC可能来源于具有双向分化潜能的肝脏干/祖细胞[16]。Almozyan等[19]对TCGA侵袭性乳腺癌基因表达数据库进行分析,发现PD-L1的表达与乳腺癌干细胞密切相关,并且证实了PD-L1通过调节PI3K/AKT通路,在维持乳腺癌干细胞的干性中发挥关键作用,提示抗PD-L1治疗可杀伤乳腺癌干细胞从而提升乳腺癌的疗效。Miller等[20]亦研究发现结肠癌中SOX2阳性的结肠癌干细胞受到免疫相关因子FoxP3及PD-L1的调节。Calderaro等[15]亦发现PD-L1表达于特定肝癌亚型如CK19表达>5%的肝细胞癌,这一肝细胞癌亚型被认为来源于肝脏干/祖细胞,推测PD-L1的表达可能通过抑制免疫杀伤效应而加强其侵袭性,但未就其机制进行深入探讨。本研究提示,DPHCC的PD-L1阳性率显著高于其他HCC亚型,与Calderaro等研究一致。因此大胆提出假设: 推测PD-L1的表达水平可能与肿瘤细胞的“干性”有一定关系。这一假设可部分解释DPHCC的生物学特性与PD-L1高表达之间的联系,有待于未来分子生物学实验的进一步证实。
本研究采用标本诊断试剂和大样本检测了我国肝胆肿瘤组织内PD-L1的表达情况,并且较为深入地分析了PD-L1的表达与临床病理参数间的关系,并且观察到PD-L1在DPHCC这一特定亚型的高表达情况。今后研究方向应着眼于探究PD-L1的表达在DPHCC发生、发展中的作用及机制,以期为DPHCC这一高侵袭性HCC的治疗提供初步的理论依据。
[1] 谷晓媛,陆新元,张为强.MicroRNA-133a在复发性肝细胞癌中差异表达及临床病理意义[J].同济大学学报(医学版),2017,38(6): 23-26.
[2] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2): 87-108.
[3] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2): 115-132.
[4] SUNSHINE J, TAUBE J M. PD-1/PD-L1 inhibitors[J]. Curr Opin Pharmacol, 2015,23: 32-38.
[5] MESSAL N, SERRIARI N E, PASTOR S, et al. PD-L2 is expressed on activated human T cells and regulates their function[J]. Mol Immunol, 2011,48(15-16): 2214-2219.
[6] FREEMAN G J, LONG A J, IWAI Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J]. J Exp Med, 2000,192(7): 1027-1034.
[7] COUZIN-FRANKEL J. Breakthrough of the year 2013. Cancer immunotherapy[J]. Science, 2013,342(6165): 1432-1433.
[8] DAI X M, PI G L, YANG S L, et al. Association of PD-L1 and HIF-1α coexpression with poor prognosis in hepatocellular carcinoma[J]. Transl Oncol, 2018,11(2): 559-566.
[9] 中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等.原发性肝癌规范化病理诊断指南(2015年版)[J].中华肝胆外科杂志,2015,40(11): 865-872.
[10] ZHU A X, FINN R S, EDELINE J, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial[J]. Lancet Oncol, 2018,19(7): 940-952.
[11] BRAHMER J R, TYKODI SS, CHOW L Q M, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J]. N Engl J Med, 2012,366(26): 2455-2465.
[12] TAUBE J M, KLEIN A, BRAHMER J R, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy[J]. Clin Cancer Res, 2014,20(19): 5064-5074.
[13] MA K, WEI X, DONG D F, et al. PD-L1 and PD-1 expression correlate with prognosis in extrahepatic cholangiocarcinoma[J]. Oncol Lett, 2017,14(1): 250-256.
[14] WALTER D, HERRMANN E, SCHNITZBAUER A A, et al. PD-L1 expression in extrahepatic cholangiocarcinoma[J]. Histopathology, 2017,71(3): 383-392.
[15] CALDERARO J, ROUSSEAU B, AMADDEO G, et al. Programmed death ligand 1 expression in hepatocellular carcinoma: relationship with clinical and pathological features[J]. Hepatology, 2016,64(6): 2038-2046.
[16] LU X Y, XI T, LAU W Y, et al. Hepatocellular carcinoma expressing cholangiocyte phenotype is a novel subtype with highly aggressive behavior[J]. Ann Surg Oncol, 2011,18(8): 2210-2217.
[17] BRUNT E, AISHIMA S, CLAVIEN P A, et al. CHCC-CCA: consensus terminology for primary liver carcinomas with both hepatocytic andcholangiocytic differentation[J]. Hepatology, 2018,68(1): 113-126.
[18] 王瀚, 丛文铭. 双表型肝细胞癌新亚型的临床病理学研究进展[J]. 中国肿瘤临床, 2017,44(12): 616-619.
[19] ALMOZYAN S, COLAK D, MANSOUR F, et al. PD-L1 promotes OCT4 and Nanog expression in breast cancer stem cells by sustaining PI3K/AKT pathway activation[J]. Int J Cancer, 2017,141(7): 1402-1412.
[20] MILLER T J, MCCOY M J, HEMMINGS C, et al. The prognostic value of cancer stem-like cell markers SOX2 and CD133 in stage Ⅲ colon cancer is modified by expression of the immune-related markers FoxP3, PD-L1 and CD3[J]. Pathology, 2017,49(7): 721-730.