大肠癌作为常见的消化道恶性肿瘤,在我国的发病率和病死率分别位居恶性肿瘤的第三位和第五位[1],其中晚期和转移性患者的总生存率仅为15%左右[2]。微小RNAs(miRNAs)是一类新近发现的短链非编码RNA,其通过特异性抑制靶基因的表达,参与肿瘤的演进过程。含PHD及指环结构域的类泛素蛋白1(ubiquitin-like containing PHD and ring finger domain 1, UHRF1)作为ICBP90蛋白家族的重要成员,在多种恶性肿瘤中发挥癌基因的作用。研究表明,低分化宫颈癌中UHRF1的表达显著高于高分化宫颈癌组织[3];膀胱癌中也发现UHRF1的高表达,且其表达水平与肿瘤分期明显相关[4]。本课题组前期研究发现,UHRF1在大肠癌组织中表达上调,且与淋巴结及远处转移显著相关[5]。本研究筛选出UHRF1上游可能发挥调控作用的miRNA-506-3p,并进一步探讨两者的调控对大肠癌细胞转移能力的影响。
1 材料与方法
1.1 一般资料
选取2015年5月1日—2017年5月1日于同济大学附属第十人民医院胃肠外科手术切除的大肠癌及其相应的癌旁组织标本20组,所有组织标本术后立即液氮保存,以备后用。取用组织经医院伦理委员会批准并获得患者知情同意。所有病例均无其他恶性肿瘤病史,临床资料和病理资料完整。
1.2 细胞及主要试剂
大肠癌细胞株LoVo、SW480、HT29及Caco-2购置于中科院细胞库,正常肠上皮永生化细胞株NCM460购于美国Incell生物公司。miR-506-3p mimics(5′-UAAGGCACCCUUCUGAGUAGA-3′)及对照序列(mimics control: 5′-UUCUCCGAACGUG-UCACGUTT-3′)购自上海吉玛基因;TRIzol和Lipofectamine 2000转染试剂购自美国Invitrogen公司;反转录试剂盒购自德国Qiagen公司;PCR试剂盒购自日本Takara公司;Polybrene购于美国Sigma公司;突变型UHRF1的3′端非编码区(3′-UTR)的荧光素酶报告载体(Mut-UHRF1 3′UTR)和野生型UHRF1的3′-UTR的荧光素酶报告载体(UHRF1 3′UTR),包含UHRF1全长编码序列的重组慢病毒pReceiver-Lv182(lenti-UHRF1)及对照慢病毒载体(lenti-control)均购自美国GeneCopoeia公司;荧光素酶检测试剂盒均购自美国Promega公司;Transwell小室购自美国BD公司;抗UHRF1抗体(货号: ab57083)购自美国Abcam公司。
1.3 方法
1.3.1 总RNA的提取及qRT-PCR检测 按照TRIzol试剂说明书提取细胞及组织总RNA,按照反转录试剂盒的操作步骤将总RNA反转录为cDNA,根据PCR试剂盒说明书进行qRT-PCR检测,在ABI 7900型荧光定量PCR仪上进行扩增。以β-actin及U6为内参。所用引物序列如下。UHRF1上游引物: 5′-CAAGATTGAGCGGCCGGGTGAAGG-3′;下游引物: 5′-TGAGGGGCGGGTCCAGGCAG-TAGA-3′。β-actin上游引物: 5′-CCTGTACGCCAA-CACAGTGC-3′;下游引物: 5′-ATACTCCTGCTTG-CTGATCC-3′。miR-506-3p上游引物: 5′-TAAGGC-ACCCTTCTGAGTAGA-3′;下游引物: 5′-GCGAGC-ACAGAATTAATACGAC-3′。U6上游引物: 5′-GT-GCTCGCTTCGGCAGCACAT-3′;下游引物: 5′-TA-CCTTGCGAAGTGCTTAAAC-3′。
1.3.2 Western印迹法检测 待检测细胞经预冷磷酸盐缓冲液(PBS)漂洗后,提取细胞蛋白。按照BCA蛋白定量试剂盒测定蛋白浓度。100℃下变性8min。每孔上样30μg蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转膜,后用10%脱脂牛奶封闭1h后加入一抗(1∶500)4℃孵育过夜,TBST清洗5min,共6次,二抗37℃孵育1h,TBST清洗5min,共3次,随后行化学发光(ECL)反应并显影。
1.3.3 细胞培养及转染 大肠癌细胞株LoVo、SW480、HT29、Caco-2及正常肠上皮永生化细胞株NCM460分别以含有10%胎牛血清的F12K(LoVo)、Leibovitz’s L-15(SW480)、RPMI-1640(HT29)、DMEM(Caco-2)及Incell M3(NCM460)培养基于5% CO2、37℃恒温培养箱中培养。以对数期生长的LoVo细胞为转染对象,转染前24h,将细胞接种于6孔板。当细胞汇合度约为50%时进行转染,转染前30min更换细胞培养基为含10%胎牛血清的DMEM,参照Lipofectamine 2000说明书操作。分别转染终浓度为50nmol/L的miR-506-3p mimics及mimics control,24h后更换完全培养基。
1.3.4 稳转细胞株的构建 慢病毒转染前24h,将对数生长的LoVo细胞转置于12孔板,调整细胞密度为1×105个/孔,当细胞汇合度约为50%时进行转染,用含有6μg/mL聚凝胺的2mL新鲜培养基替换原培养基,加入适量病毒悬液。37℃孵育24h后,用新鲜培养基替换含有病毒的培养基。48h后荧光显微镜下观察转染效率,继续培养24h后培养基中加入8μg/mL neomycin行抗生素筛选。每72h更换培养基,待细胞克隆形成后挑选鉴定。建立的UHRF1过表达细胞株及对照细胞株分别命名为LoVo-F1及LoVo-NC。
1.3.5 生物信息学预测和双荧光素酶报告基因实验 采用StarBase数据库(starbase.sysu.edu.cn)预测UHRF1上游调控miRNAs。双荧光素酶报告基因用以验证miR-506-3p与UHRF1 3′UTR的特异性结合。将miR-506-3p mimics与UHRF1 3′UTR、miR-506-3p mimics与Mut-UHRF1 3′UTR、mimics control与UHRF1 3′UTR,mimics control与Mut-UHRF1 3′UTR分别共转染LoVo细胞,48h后收集细胞。按双荧光素酶报告基因检测试剂盒说明书操作,用荧光检测仪检测荧光素酶活性。每组实验重复3次。
1.3.6 细胞迁移试验 在Transwell小室中加入200μL(5×104个细胞)不同处理后的无血清细胞悬液,底部加入500μL含10%胎牛血清的RPMI 1640培养液。置于37℃培养箱中孵育24h,将小室置于4%多聚甲醛溶液中固定后,用5%结晶紫染色,PBS轻轻冲洗小室,用棉棒将室顶细胞轻轻擦去,晾干后膜底面朝上,于倒置显微镜下观察,随机取3个100×视野进行拍照,计算细胞迁移率。
1.4 统计学处理
数据处理运用SPSS 19.0统计软件包和GraphPad Prism软件系统。两组间比较采用t检验;ANOVA进行多组间变量分析;运用Spearman检验进行相关关系分析;qRT-PCR数据采用2-ΔΔCT方法处理。P<0.05为差异有统计学意义。
2 结 果
2.1 UHRF1上游调控miRNA的预测分析
利用StarBase数据库预测可能通过结合UHRF1 3′UTR从而对其产生调控作用的miRNAs,该数据库整合了7个常用的miRNA靶基因数据库信息。为了提高预测的准确性,选择在其中3个及以上数据库均被预测到的miRNAs作为UHRF1的候选调控miRNAs。通过预测分析,有3个miRNAs符合条件,分别是: miR-124-3p、miR-9-5p和miR-506-3p,见表1。另一方面,通过文献检索分析发现,miR-506-3p在包括大肠癌在内的多种肿瘤中表达降低,并且其表达水平与肿瘤淋巴转移及远处转移呈负相关[6-7],有研究报道的肿瘤组织中UHRF1的表达趋势正好相反[4],提示其可能通过调控UHRF1参与大肠癌细胞的转移。因此,本研究最终选择miR-506-3p作为UHRF1的候选调控miRNA开展进一步的研究。
2.2 miR-506-3p和UHRF1在大肠癌细胞及组织中的表达水平及相关性
4个大肠癌细胞株中miR-506-3p的表达均显著低于正常肠上皮细胞株(均P<0.01),见图1A;20对大肠癌及癌旁组织中,有13个大肠癌组织中的miR-506-3p表达显著低于癌旁组织(均P<0.05),见图1B;相比较而言,13个miR-506-3p下调的大肠癌组织中,UHRF1在其中10个的表达显著高于对应的癌旁组织(均P<0.05),见图1C;Spearman相关分析发现,miR-506-3p及UHRF1在大肠癌组织中的表达呈负相关(r=-0.456,P=0.044),见图1D。
表1 通过结合UHRF1 3′UTR从而对其产生调控的miRNAs
Tab.1 A list of miRNAs predicted to bind to 3′UTR of the UHRF1 mRNA
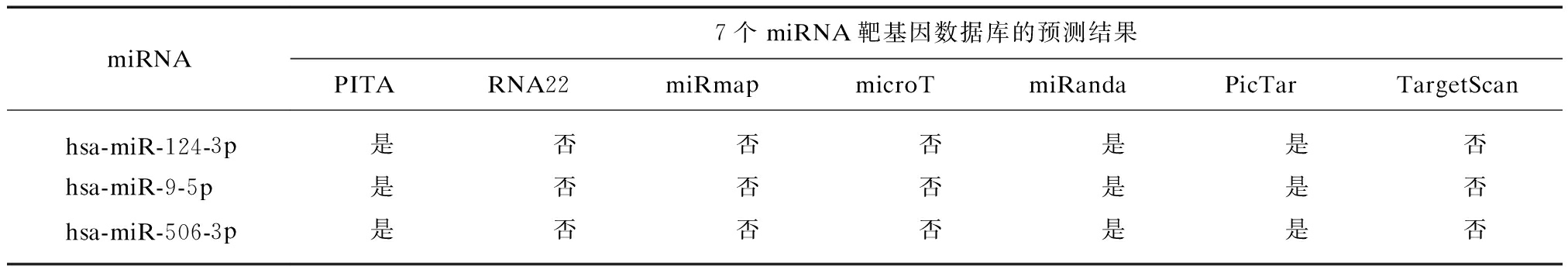
miRNA7个miRNA靶基因数据库的预测结果PITARNA22miRmapmicroTmiRandaPicTarTargetScanhsa-miR-124-3p是否否否是是否hsa-miR-9-5p是否否否是是否hsa-miR-506-3p是否否否是是否

图1 miR-506-3p和UHRF1在大肠癌中的表达及相关性
Fig.1 Inverse correlation between the expression of miR-506-3p and UHRF1 in CRC
A: 荧光实时定量PCR检测细胞株中miR-506-3p的表达情况,与NCM460细胞相比,**P<0.01;B: 荧光实时定量PCR检测组织中miR-506-3p的表达情况,与相应癌旁组织相比,*P<0.05,**P<0.01;C: 荧光实时定量PCR检测组织中UHRF1 mRNA的表达情况,与相应癌旁组织相比,*P<0.05,**P<0.01;D: 组织中miR-506-3p及UHRF1 mRNA表达的相关性,相对于对应的癌旁组织,肿瘤组织中miR-506-3p与UHRF1 mRNA的表达呈负相关
2.3 miR-506-3p与UHRF1调控关系的验证
转染miR-506-3p mimics后,UHRF1 3′UTR荧光素酶表达载体的相对活性下降至0.341±0.058,而其他3个对照组的相对活性分别为0.977±0.111、1.090±0.060和0.815±0.018(均P<0.01),见图2A、2B。可见,miR-506-3p与UHRF1 3′UTR发生了特异性结合。LoVo细胞中转染miR-506-3p mimics及其对照序列,通过比较转染后UHRF1在mRNA及蛋白水平的表达发现,转染miR-506-3p mimics下调了UHRF1的表达(P<0.01),见图2C、2D。
2.4 miR-506-3p通过下调UHRF1抑制了大肠癌细胞的转移能力
上调miR-506-3p降低了大肠癌细胞中UHRF1的mRNA和蛋白表达水平(P<0.01),见图3。同时,转染miR-506-3p mimics抑制了LoVo细胞的转移能力,而在此基础上增加UHRF1的表达则逆转了miR-506-3p的抑制作用(P<0.01),见图4。
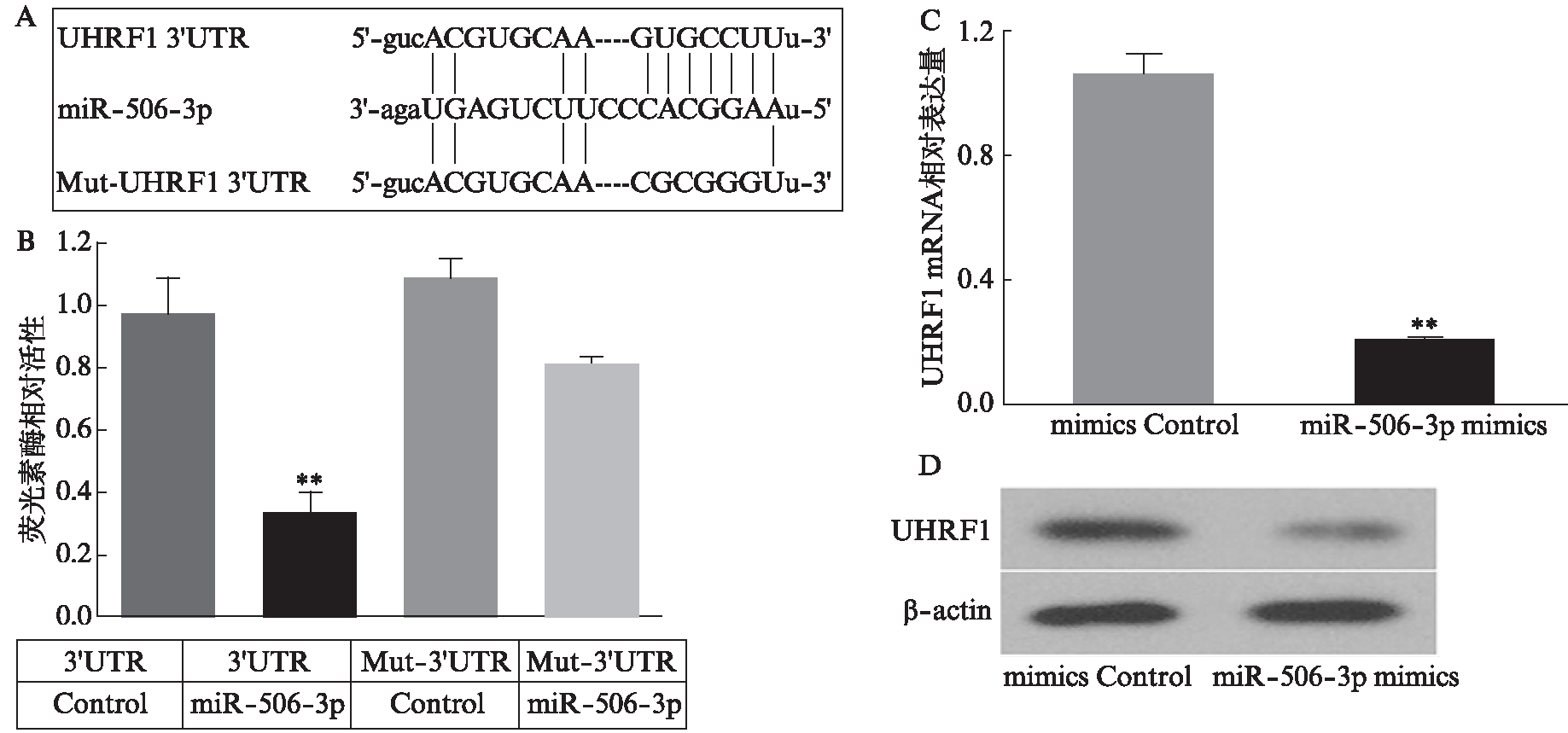
图2 miR-506-3p通过3′UTR负性调控UHRF1的表达
Fig.2 miR-506-3p negatively regulates UHRF1 expression via the UHRF1 3′UTR
A: miR-506-3p与UHRF1 mRNA 3′UTR结合位点;B: 各组共转染细胞中荧光素酶相对活性,与其他3组相比,**P<0.01;C: 荧光实时定量PCR检测UHRF1 mRNA表达水平,与转染mimics Control组相比,**P<0.01;D: Western印迹法检测UHRF1蛋白表达
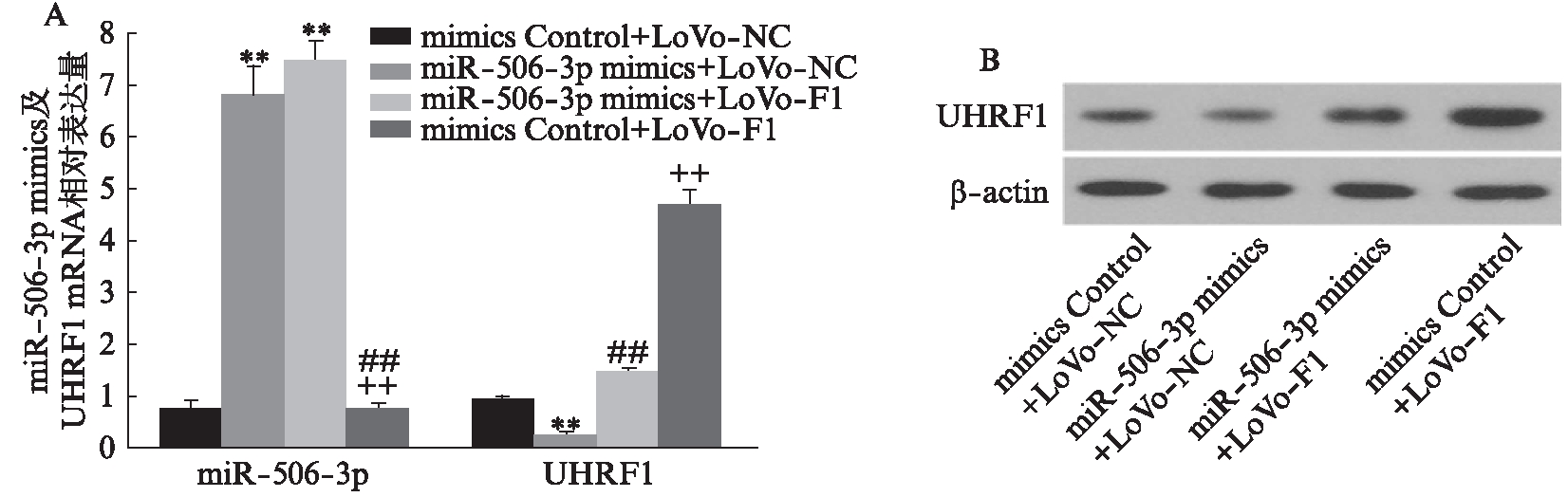
图3 过表达UHRF1的细胞株中转染miR-506-3p mimics对UHRF1表达水平的影响
Fig.3 Effect of microRNA-506-3p mimics transfected into CRC cell lines overexpressing UHRF1 on the expression level of UHRF1
A: 荧光实时定量PCR检测细胞株中miR-506-3p及UHRF1的表达情况;B: Western印迹法检测UHRF1蛋白表达情况,与mimics Control+LoVo-NC组相比,**P<0.01;与miR-506-3p mimic+LoVo-NC相比,##P<0.01;与miR-506-3p mimics+LoVo-F1相比,††P<0.01
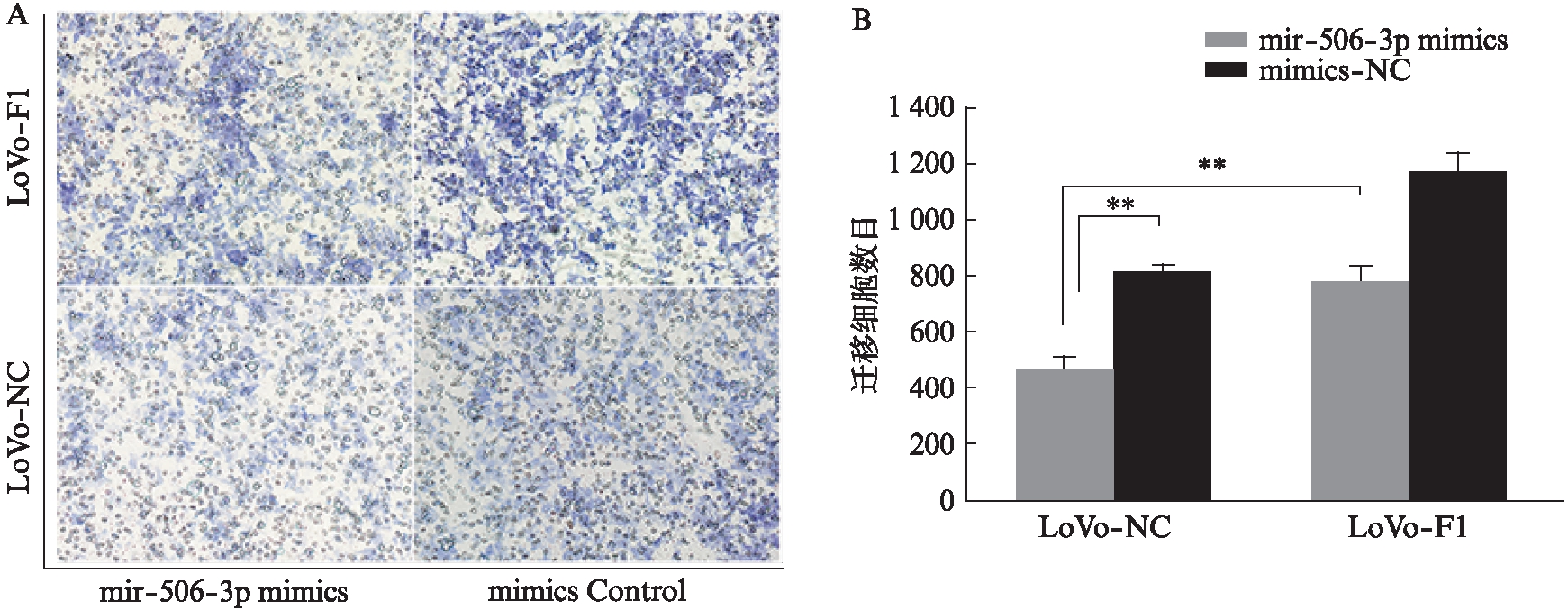
图4 过表达UHRF1的细胞株中转染miR-506-3p mimics对细胞转移能力的影响
Fig.4 Effect of microRNA-506-3p mimics transfected into UHRF1 overexpressing CRC cell lines on cell metastasis
A: 各组细胞迁移情况(5%结晶紫染色,×100);B: 各组细胞迁移数量比较;**P<0.01
3 讨 论
转移是大肠癌患者死亡的最重要最直接原因,约50%的患者死于转移相关并发症[8]。大肠癌细胞转移是一系列复杂的多步骤生物学过程,涉及众多基因及蛋白的改变。miRNA是一类进化保守的、内源性非编码微小RNA,广泛存在于动物、植物、病毒等多种有机体,成熟miRNA的一条单链可整合进RNA诱导基因沉默复合体中,通过与靶基因mRNA的3′UTR结合发挥生物学作用,引起靶基因的表达下降,或通过加快mRNA降解的方式下调靶基因翻译成蛋白质的数量,参与调控细胞的分化、个体发育、器官形成和肿瘤的发生发展。越来越多的研究证实miRNA具有类似原癌基因/抑癌基因的作用,与肿瘤的侵袭转移密切相关[9]。Toiyama等[10]发现,miR-200c与大肠癌转移相关;进一步研究表明,miR-200c通过靶向作用于锌指结合蛋白而促进细胞上皮-间质转化,进而促进大肠癌肝转移的发生。Zhou等[11]发现,有肝转移患者大肠癌原发灶内miR-320b水平较无转移患者明显上调;通过对下游靶基因的研究证实,miR-320b通过竞争性抑制与其同源的miR-320a表达,进而上调miR-320a下游靶基因如细胞表面跨膜糖蛋白(NRP-1)基因、Ras相关的C3肉毒素底物1(RAC-1)基因的表达,从而发挥促进肿瘤侵袭转移的作用。Ma等[12]发现,miRNA-17-92家族通过减少肿瘤血管形成而抑制大肠癌细胞的转移;而miR-145则通过作用于E2F转录因子5、Bcl-2相关抗凋亡蛋白4及形成素2,发挥抑制大肠癌细胞增殖和侵袭的作用[13]。
UHRF家族的主要功能是作为转录因子参与到细胞增殖周期的调节。UHRF1是研究最为深入的UHRF家族蛋白,在多种恶性肿瘤中发挥癌基因的作用[3]。本研究发现,大肠癌组织和细胞中UHRF1的表达均显著高于邻近癌旁组织和正常肠上皮细胞,且其表达水平与淋巴结浸润和远处转移相关;而干扰UHRF1的表达后,大肠癌细胞增殖和侵袭转移能力均受到抑制,这提示UHRF1在大肠癌的演进过程,尤其在其转移进程中发挥重要作用[5]。有研究发现,作为下游靶基因,UHRF1在miRNA调控肿瘤进展中发挥重要作用。如Wotschofsky等[14]运用芯片技术比较了发生与未发生转移的肾癌组织中miRNA与mRNA的表达差异,结果发现,miR-146a-5p通过调控下游靶基因CXCL8和UHRF1抑制肾癌细胞的侵袭转移;此外,作为甲基化调控的重要因子,UHRF1在小细胞肺癌中通过甲基化失活的方式调控ERBB4/PIK3R3/mTOR/S6K2信号通路,促进肿瘤细胞的侵袭和转移,而miR-193a-3p和miR-193a-5p则抑制靶基因UHRF1的表达,进而在小细胞肺癌中发挥抑癌基因的作用。
以计算机技术为基础的生物信息学预测方法及相应的验证实验技术为miRNA及其靶基因的鉴定提供了方便。鉴于miRNA在大肠癌发生发展中的重要作用,及其在肿瘤诊治中的独特优势,本课题组针对大肠癌中UHRF1上游调控miRNA进行研究。首先,利用miRNA靶基因预测数据库StarBase预测可能调控UHRF1的miRNA,并通过文献检索比较,初步确定将miR-506-3p作为UHRF1的候选调控miRNA开展进一步的研究;经检测,发现miR-506-3p在大肠癌组织及细胞中表达下调,且与UHRF1的表达水平呈负相关;随后,荧光素酶报告基因实验显示,miR-506-3p通过与UHRF1 3′UTR的结合抑制了后者的翻译过程,且大肠癌细胞转染miR-506-3p mimics在mRNA及蛋白水平均下调了UHRF1的表达;最后,在细胞水平证实,增加miR-506-3p的表达通过下调UHRF1的表达抑制了大肠癌细胞的迁徙转移能力。
总之,本研究发现,miR-506-3p在大肠癌中表达下调,并通过抑制下游靶基因UHRF1在大肠癌转移中发挥抑癌基因的作用,提示其可作为大肠癌潜在的生物标志物和治疗靶点,为大肠癌的诊治提供新的思路。miR-506-3p抑制UHRF1后,下游分子通路的调控机制,将是课题组今后深入研究的重点。
[1] 陈万青,孙可欣,郑荣寿,等.2014年中国分地区恶性肿瘤发病和死亡分析[J].中国肿瘤,2018,27(1): 1-14.
[2] 韩俊毅,赵中辛,胡海.高龄结直肠癌手术治疗的生存分析[J].同济大学学报(医学版),2016,37(5): 107-113.
[3] ZHANG Q, QIAO L, WANG X, et al. UHRF1 epigenetically down-regulates UbcH8 to inhibit apoptosis in cervical cancer cells[J]. Cell Cycle, 2018,17(3): 300-308.
[4] SAIDI S, POPOV Z, JANEVSKA V, et al. Overexpression of UHRF1 gene correlates with the major clinicopathological parameters in urinary bladder cancer[J]. Int Braz J Urol, 2017,43(2): 224-229.
[5] WANG F, YANG Y Z, SHI C Z,et al. UHRF1 promotes cell growth and metastasis through repression of p16(ink4 a) in colorectal cancer[J]. Ann Surg Oncol, 2012, 19(8): 2753-2762.
[6] ZHANG Y, LIN C, LIAO G, et al. MicroRNA-506 suppresses tumor proliferation and metastasis in colon cancer by directly targeting the oncogene EZH2[J]. Oncotarget, 2015,6(32): 32586-32601.
[7] GUO S, YANG P, JIANG X, et al. Genetic and epigenetic silencing of mircoRNA-506-3p enhances COTL1 oncogene expression to foster non-small lung cancer progression[J]. Oncotarget, 2017,8(1): 644-657.
[8] GROTHEY A, SCHMOLL H J. New chemotherapy approaches in colorectal cancer[J]. Curr Opin Oncol, 2001,13(4): 275-286.
[9] 沙杰,范理宏.miRNA-146b-3p在早期非小细胞肺癌中的诊断价值[J].同济大学学报(医学版),2018,39(2): 73-78.
[10] TOIYAMA Y, HUR K, TANAKA K, et al. Serum miR-200c is a novel prognostic and metastasis-predictive biomarker in patients with colorectal cancer[J]. Ann Surg, 2014,259(4): 735-743.
[11] ZHOU J, ZHANG M, HUANG Y, et al. MicroRNA-320b promotes colorectal cancer proliferation and invasion by competing with its homologous microRNA-320a[J]. Cancer Lett, 2015,356(2 Pt B): 669-675.
[12] MA H, PAN J S, JIN L X, et al. MicroRNA-17~92 inhibits colorectal cancer progression by targeting angiogenesis[J]. Cancer Lett, 2016,376(2): 293-302.
[13] XIE H, REN X, XIN S, et al. Emerging roles of circRNA_001569 targeting miR-145 in the proliferation and invasion of colorectal cancer[J]. Oncotarget, 2016,7(18): 26680-26691.
[14] WOTSCHOFSKY Z, GUMMLICH L, LIEP J, et al. Integrated microRNA and mRNA signature associated with the transition from the locally confined to the metastasized clear cell renal cell carcinoma exemplified by miR-146-5p[J]. PLoS One, 2016,11(2): e0148746.