宫颈癌是全球常见的妇科恶性肿瘤之一,其发病率占女性恶性肿瘤的第二位,死亡率占第三位[1]。目前对高危人群的人乳头瘤病毒(human papilloma virus, HPV)筛查的普及使宫颈癌的发病率呈下降趋势[2],但近20年,我国宫颈癌发病率和死亡率仍呈现上升趋势,探索宫颈癌关键发病机制可为其早期发现和早期干预提供重要靶点。
微小RNAs(miRNAs)是一类分布广泛的小的非编码蛋白质的RNAs,由21~25个核苷酸组成。生物信息学数据显示,每个miRNA可以调节数百个靶基因,影响多条信号通路,参与调控肿瘤细胞的增殖、侵袭、转移、凋亡等生物学功能[3]。
三叶因子3(trefoil factor 3, TFF3)属于肠三叶因子家族的成员,基因定位于染色体21q22.3上,编码的蛋白相对分子质量约为7000或14000(二聚体)[4-5]。已有研究发现TFF3能通过激活信号转导及转录激活因子3α(signal transducers and activators of transcription 3α, STAT3α)和STAT3β亚基磷酸化而激活STAT3信号通路,从而参与肿瘤细胞的增殖、分化及凋亡等过程[6],通过激活核因子κB(nuclear factor kappa B, NF-κB)和Twist信号通路抑制细胞凋亡促进细胞的迁移[7-8]。在胃癌、乳腺癌、结肠癌、前列腺癌等肿瘤中表达均异常升高。有研究表明miR-7-5p/TFF3信号通路在胶质母细胞瘤的增殖、迁移功能中发挥重要作用,且该信号通路与炎症性疾病有关[9-10]。
本研究通过探讨miR-7-5p靶向调控TFF3的表达,进一步明确miR-7-5p/TFF3与宫颈癌细胞的增殖和迁移的关系,从细胞水平阐明miR-7-5p/TFF3对宫颈癌发生发展的意义。
1 材料与方法
1.1 主要材料和试剂
30例宫颈癌肿瘤组织和癌旁正常组织取自2013—2015年在同济大学附属第十人民医院进行手术治疗的宫颈癌患者,研究经同济大学附属第十人民医院伦理委员会批准(编号: SHSY-IEC-4.0/19-45101)。人宫颈癌细胞株HeLa、SiHa、C-33 A和HeLa 299购自中国科学院上海生命科学院细胞库;DMEM高糖培养基购自美国Hyclone公司;胎牛血清、细胞用青霉素和链霉素购自美国Gibco公司;CCK-8购自日本同仁化学研究所;总RNA分离提取试剂TRIzol和小干扰RNA(siRNA)转染试剂LipofectamineTM 3000试剂购自美国Invitrogen公司;反转录试剂盒及实时荧光定量PCR检测试剂盒购自日本TaKaRa公司;RIPA裂解液、BCA蛋白定量检测试剂盒、鼠抗人β-actin单克隆抗体及辣根过氧化物酶(HRP)标记的抗鼠及抗兔二抗购自上海碧云天生物技术有限公司。ECL化学发光试剂盒购自美国Millipore公司。荧光素酶报告系统质粒购自美国Promega公司。引物由生工生物工程(上海)股份有限公司合成;Transwell小室购自美国Corning公司;靶向TFF3的siRNA和1条阴性对照siRNA购自上海吉玛制药技术有限公司,序列见表1;miR-7-5p mimics和1条阴性对照microRNA购自上海吉玛制药技术有限公司,序列见表2。
表1 小干扰RNA序列
Tab.1 Sequences of small interfering RNAs (siRNAs)

siRNAsiRNA序列(5'→3')TFF3-siR-NA 上游引物GGAGCUGCAGUGCAUGCAAdTdT 下游引物UUGCAUGCACUGCAGCUCCdTdTNC-siRNA 上游引物UUCUCCGAACGUGUCACGUTT 下游引物ACGUGACACGUUCGGAGAATT
NC siRNA: 阴性对照siRNA
表2 微小RNA序列
Tab.2 Sequences of microRNAs
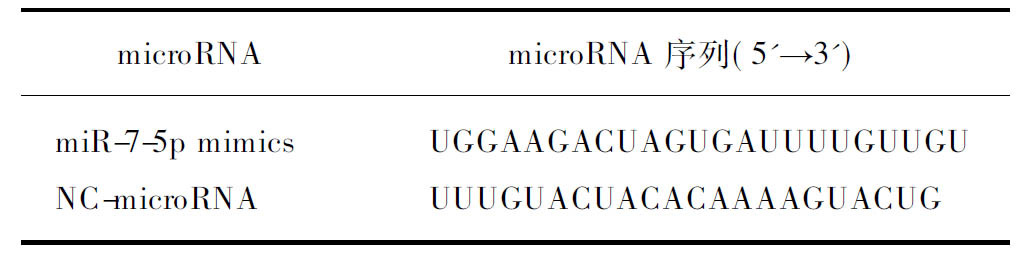
microRNAmicroRNA序列(5'→3')miR-7-5p mimicsUGGAAGACUAGUGAUUUU-GUUGUNC-microRNAUUUGUACUACA-CAAAAGUACUG
NC microRNA: 阴性对照microRNA
1.2 研究方法
1.2.1 宫颈癌组织标本TFF3表达水平的检测 所有标本于液氮中保存。TRIzol裂解组织标本,抽提总RNA,反转录获得cDNA。取稀释10倍后cDNA样本为模板,β-actin为内参,按照实时荧光定量PCR检测试剂盒说明书提供的方法在ABI 7900实时荧光定量PCR仪进行PCR扩增。PCR所需引物见表3。PCR反应条件: 第1步,预变性95℃ 30s;第2步,95℃ 5s、60℃ 30s,共40个循环。以2-ΔΔCt表示目的基因mRNA的相对表达水平。
表3 聚合酶链反应引物序列
Tab.3 Sequences of PCR primers
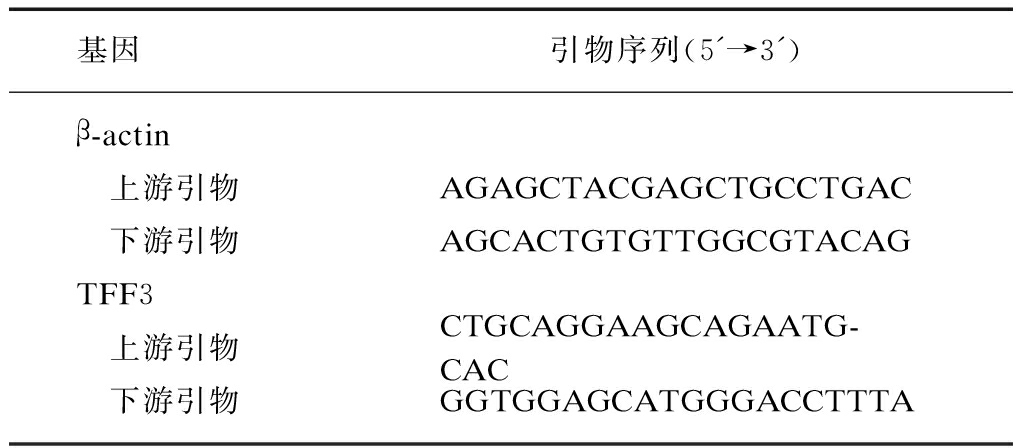
基因引物序列(5'→3')β-actin 上游引物AGAGCTACGAGCTGCCTGAC 下游引物AGCACTGTGTTGGCGTACAGTFF3 上游引物CTGCAGGAAGCAGAATG-CAC 下游引物GGTGGAGCATGGGACCTTTA
1.2.2 细胞培养及转染 宫颈癌细胞株HeLa、SiHa贴壁生长于含10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的DMEM培养液,置于37℃、5% CO2及饱和湿度条件下培养。按转染试剂LipofectamineTM3000说明书提供的方法进行细胞转染。转染前1d,将处于对数生长期的HeLa、SiHa细胞以(2~2.5)×105个/孔的密度接种于6孔板中,细胞用配制好的完全培养液进行培养;次日,当细胞融合度达30%~50%时进行转染。转染设计为2组: 处理组(TFF3-siRNA或miR-7-5p mimits)、阴性对照组(NC-siRNA或NC-miR)。将上述TFF3-siRNA、miR-7-5p mimics、NC-siRNA或者NC-miR转染宫颈癌细胞HeLa、SiHa 6h后,更换新鲜完全培养液继续培养。
1.2.3 CCK-8法检测宫颈癌细胞株HeLa和SiHa的增殖活性 收集转染7h后的细胞,分别继续培养1d,以3000个/孔的密度分别接种于96孔板中,细胞悬液为100μL/孔,每组设5个复孔;细胞分别继续培养1、2、3、4和5d后,加入10μL/孔CCK-8溶液继续培养1h,通过酶联免疫检测仪在波长450nm处检测各孔的光密度值(D450),光度大小与细胞增殖活性成正比。
1.2.4 克隆形成实验检测宫颈癌细胞株HeLa、SiHa克隆形成能力 收集转染24h后的细胞,按1500个/孔的细胞密度接种于6孔板中,每组设3个平行样品,静置培养10d,直到6孔板中出现肉眼可见的克隆时终止培养。采用4%多聚甲醛溶液固定细胞,风干后,用0.1%结晶紫染色,观察并计数细胞克隆数,结果取平均值。
1.2.5 Transwell迁移实验检测宫颈癌细胞株HeLa、SiHa迁移能力变化 转染7h后消化细胞,以含0.1%牛血清白蛋白(BSA)的DMEM培养液重悬细胞,5×104个/小室接种于Transwell上室中,补足培养液至100μL,下室为500μL完全培养液,24h后取出,将上室内面擦净,4%多聚甲醛固定,结晶紫染色,清洗,拍照,对穿过小室的细胞数量进行计数,穿过小室的细胞数与细胞迁移能力正相关。
1.2.6 Western印迹法检测宫颈癌细胞株HeLa、SiHa中TFF3蛋白水平的变化 在宫颈癌细胞株HeLa、SiHa中转染上述siRNA或mimics,48h后抽提蛋白,用Western印迹法检测TFF3蛋白水平的变化。RIPA裂解2×106个细胞总蛋白进行蛋白定量,每孔上样50μg蛋白进行电泳、转膜、封闭,一抗兔抗人TFF3,一抗鼠抗人β-actin(1∶1000)4℃孵育过夜,再加入HRP标记的羊抗兔、羊抗鼠二抗(1∶2000)室温孵育1h,经ECL发光液反应后,暗室曝光,以β-actin为内参,进行比较。
1.2.7 双荧光素酶报告实验 为分析miR-7-5p是否可以在体外与TFF3 3′UTR相互结合作用,本实验采用双荧光素酶报告系统检测miR-7-5p靶向结合TFF3 3′ UTR情况。将野生型TFF3 3′ UTR和突变型TFF3 3′ UTR克隆至pGL3-Promoter质粒萤火虫荧光素酶下游,将待测细胞铺于12孔板中,当细胞融合度达80%时,共转染质粒和microRNA,并将海肾荧光素酶表达质粒共转染至细胞中作为内参。转染48h后,按照Promega双荧光素酶报告系统试剂盒说明书进行荧光素酶活性检测,活性强度与miR-7-5p抑制作用呈反向关系。
1.3 统计学处理
应用SPSS 20.0软件对实验结果进行统计分析,所有实验重复3次,实验数据以![]() 表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TFF3在宫颈癌组织及人宫颈癌细胞细胞系中高表达
实时荧光定量PCR结果显示TFF3在73.33%(22/30)的宫颈癌组织中较其癌旁组织高表达,其mRNA水平在宫颈癌组织和癌旁组织之间有显著差异(P<0.001)。在宫颈癌细胞系C-33 A、HeLa 299、HeLa、SiHa中均有表达,其中在HeLa和SiHa中表达较高,见图1。
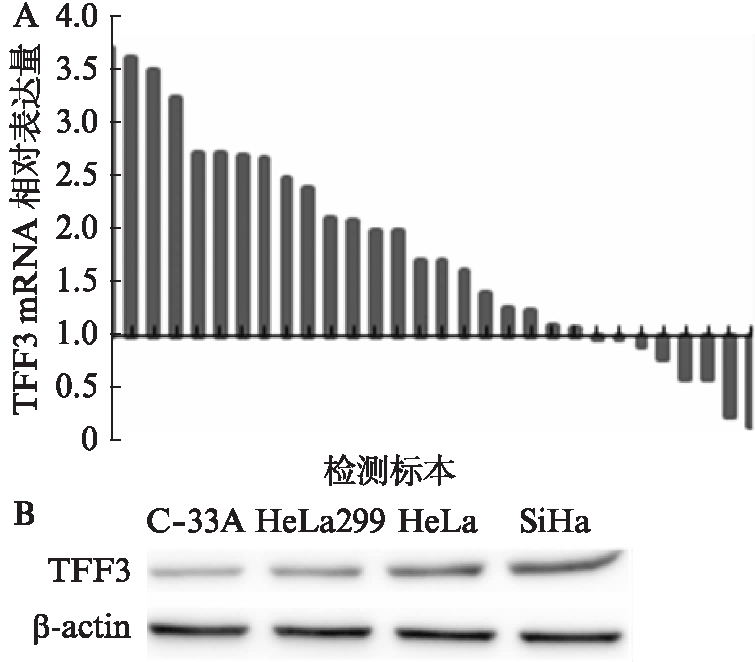
图1 TFF3在宫颈癌组织和细胞系中的表达情况
Fig.1 TFF3 expression of TFF3 mRNA in cervical cancer tissues and cell lines
2.2 实时荧光定量PCR及Western印迹法检测TFF-siRNA在宫颈癌细胞中的干扰效率
siRNA转染24h后,与阴性对照组比较,TFF3-siRNA组的HeLa和SiHa细胞中TFF3 mRNA和蛋白的表达水平均明显降低,差异有统计学意义(t=37.34、17.33,均P<0.01),见图2。
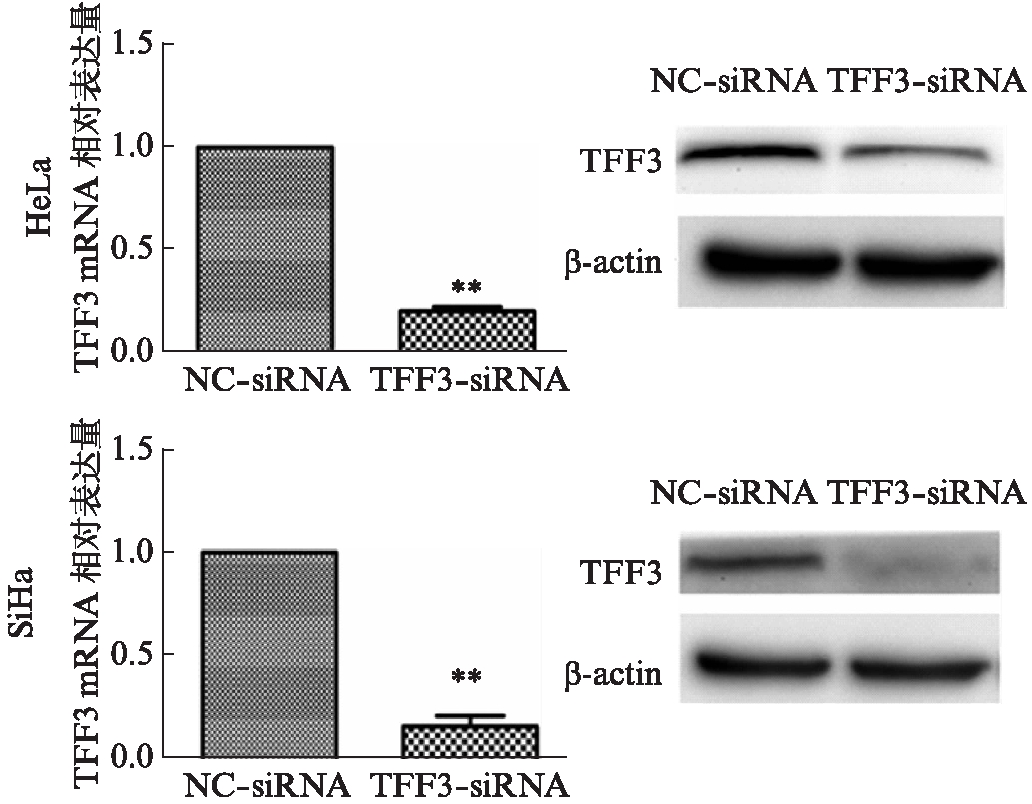
图2 TFF3-siRNA在宫颈癌HeLa和SiHa细胞中的干扰效率鉴定
Fig.2 Knock down efficiency of TFF3-siRNA in HeLa and SiHa cells
**P<0.01
2.3 敲减TFF3基因的表达对宫颈癌细胞增殖、迁移及克隆形成能力的影响
CCK-8检测结果显示,siRNA转染宫颈癌细胞株HeLa和SiHa后1、2d,各组细胞的增殖能力无明显差异;在siRNA转染后3、4和5d时,TFF3-siRNA组细胞的增殖明显受到抑制,差异有统计学意义(P<0.05),见图3A。
Transwell检测结果显示,siRNA转染宫颈癌细胞株HeLa和SiHa 24h,结晶紫染色后,显微镜(×100)下进行拍照并计数,TFF3-siRNA转染组细胞穿过小室膜的细胞数较阴性对照组明显减少,差异均有统计学意义(t=5.78、13.124,均P<0.05),见图3B。
细胞克隆形成实验结果显示,siRNA干扰10d,计数6孔板中阴性对照组和TFF3-siRNA组的克隆形成数,结果显示,TFF3-siRNA组细胞集落形成能力明显弱于阴性对照组,差异有统计学意义(t=5.213,P<0.05;t=13.635,P<0.05),见图3C。
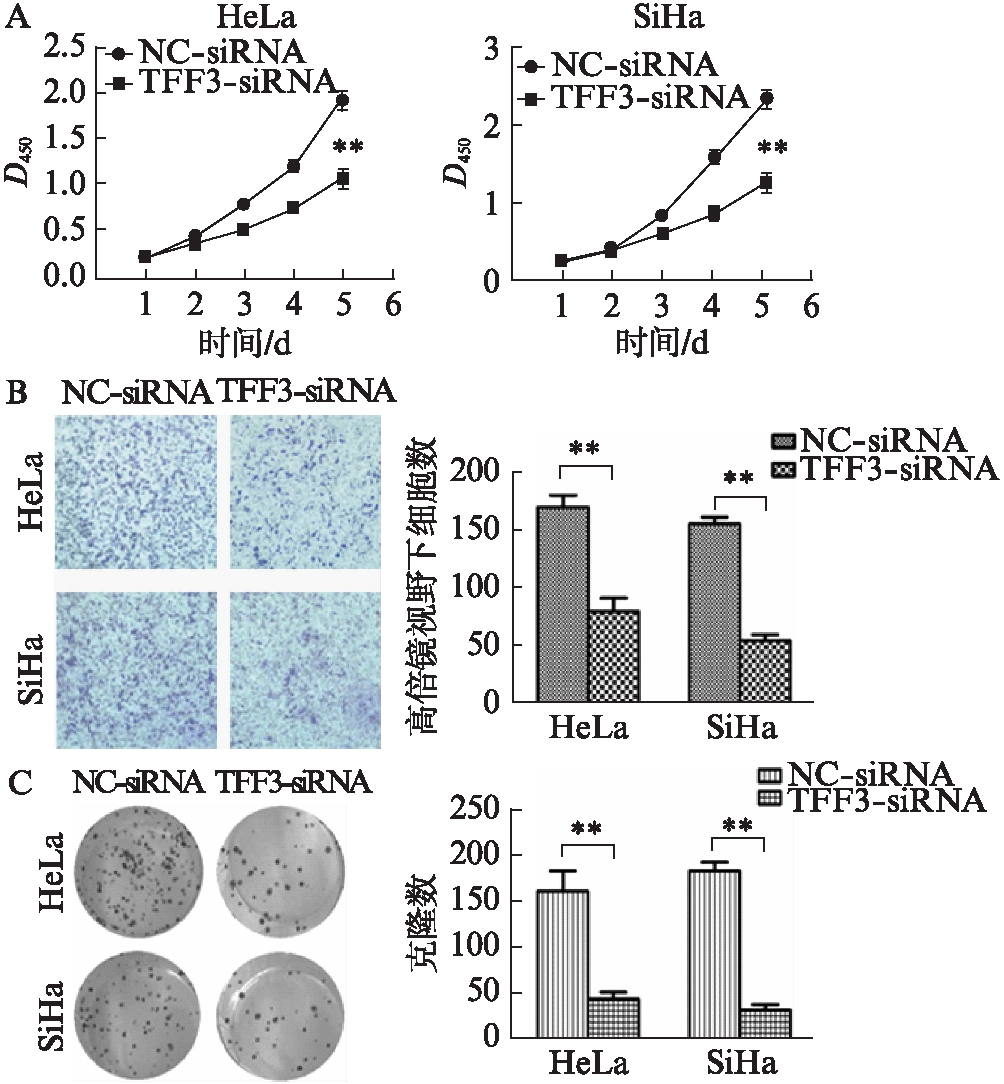
图3 敲减TFF3抑制宫颈癌细胞的增殖、转移和克隆能力
Fig.3 Knockdown of TFF3 inhibits proliferation, invasion and colony formation capacity of cervical cancer cells
**P<0.01
2.4 miR-7-5p靶向结合TFF3 3′UTR抑制TFF3的表达
本研究利用生物信息学技术手段,结合TargetScan(http://www.targetsca.org)、miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/)等数据库预测miR-7-5p是一个潜在的microRNA可靶向结合TFF3 3′UTR。并利用双荧光素酶报告实验进行验证,结果显示miR-7-5p直接调控TFF3的表达。采用Western印迹法进一步对TFF3蛋白表达进行检测,发现转染miR-7-5p mimics之后,TFF3的蛋白表达明显降低。实验结果表明,miR-7-5p通过与TFF3基因3′UTR位点结合从而抑制其表达。见图4。
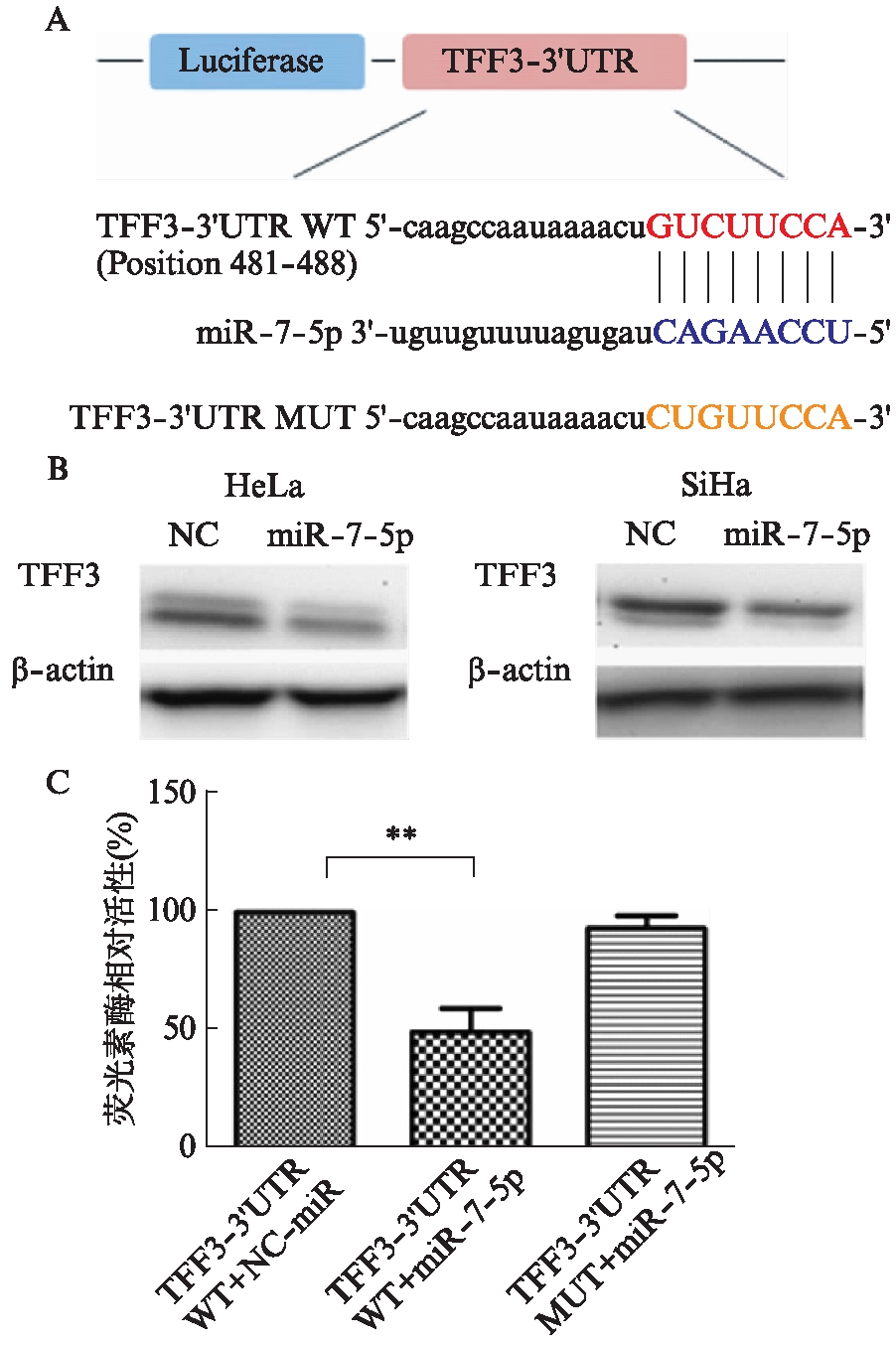
图4 miR-7-5p靶向调控TFF3 抑制其在宫颈癌细胞中的表达
Fig.4 miR-7-5p is a direct regulator of TFF3 in cervical cancer cells
A: TFF3 3′UTR的荧光素酶报告载体构建;B: 在宫颈癌细胞中转染miR-7-5p后TFF3蛋白表达水平;C: 在HeLa细胞中转染荧光素报告载体或miR-7-5p后,荧光酶活性变化;**P<0.01
2.5 过表达miR-7-5p对宫颈癌细胞增殖、迁移及克隆形成能力的影响
CCK-8检测结果显示,宫颈癌细胞株HeLa和SiHa过表达miR-7-5p后,经过4d和5d的培养,转染miR-7-5p mimics组细胞的增殖明显受到抑制,差异有统计学意义(P<0.05),见图5A。
Transwell检测结果显示,过表达miR-7-5p使宫颈癌细胞株HeLa和SiHa迁移能力明显下降,转染后24h,在显微镜(100×)下计数,miR-7-5p mimics转染组(165±15、100±208)的细胞穿过小室膜的细胞数较阴性对照组(364±48、411±27)少,差异有统计学意义(t=2.610、10.124,均P<0.05)。见图5B。
细胞克隆形成实验结果显示,宫颈癌细胞株HeLa和SiHa过表达miR-7-5p 10d后,6孔板中阴性对照组和miR-7-5p mimics转染组的克隆形成数分别为(83±11)个和(129±21)个、(25±7)个和(14±8)个,过表达miR-7-5p的细胞集落形成能力明显弱于空阴性对照组,差异有统计学意义(t=5.359、9.641,均P<0.05),见图5C。
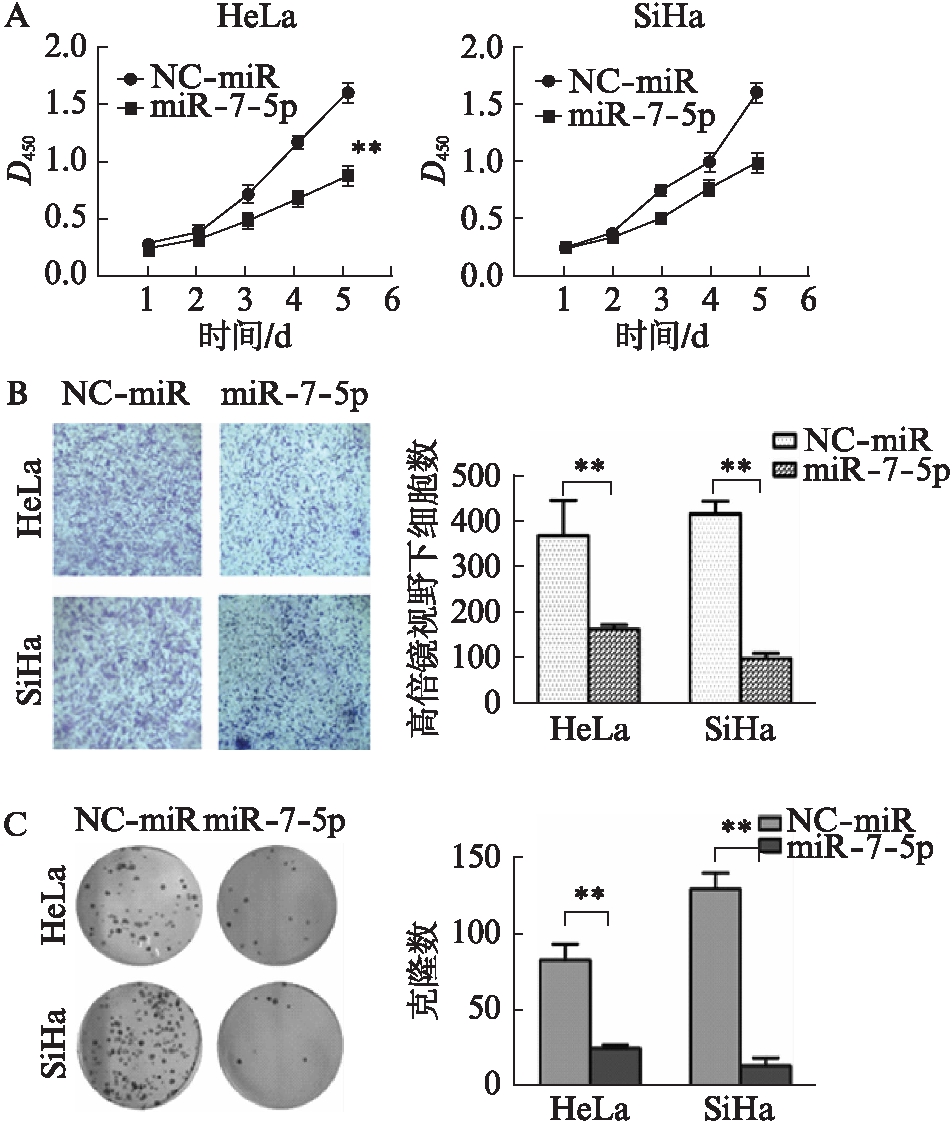
图5 过表达miR-7-5p抑制宫颈癌细胞的增殖、迁移和克隆形成能力
Fig.5 miR-7-5p inhibits the proliferation, invasion and colony formation capacity of cervical cancer cells
A: miR-7-5p过表达后对HeLa细胞和SiHa细胞增殖能力的影响;B: miR-7-5p过表达后对HeLa细胞和SiHa细胞转移能力的影响;C: miR-7-5p过表达后对HeLa和SiHa细胞克隆形成能力的影响;**P<0.01
3 讨 论
目前,TFF3在恶性肿瘤中的表达与功能已有报道。有研究显示TFF3高表达的乳腺癌患者更容易发生骨转移[11],TFF3与乳腺癌患者淋巴结转移以及较晚的TNM分期具有明显的相关性,TFF3高表达的患者生存期明显缩短[12]。本研究发现,在宫颈癌中,TFF3的表达也呈高水平;敲减TFF3的表达,可使宫颈癌细胞的增殖、迁移和克隆形成能力明显减弱。说明TFF3在促进肿瘤增殖、转移和实现自我更新的过程中发挥重要作用,或以癌基因的形式推进宫颈癌的发生发展。
miRNA在转录后基因的调控中扮演至关重要的角色。miRNA通过参与癌症发生的代谢网络,并改变机体的表观遗传而与肿瘤发展和预后发生密切的关联。目前,利用小分子成合成抑制剂抑制蛋白质编码基因表达的技术有很大进步,但在实际应用中却困难重重,所以对于肿瘤的治疗需要更有效的方法,而以miRNA模拟物或抑制剂作为肿瘤靶向治疗技术是一种潜在治疗策略,受到广泛关注[14-15]。因此,开展针对癌基因的miRNA验证研究可能为肿瘤的防治提供新的思路。在本研究中,体外细胞实验证明TFF3促进了宫颈癌的发生发展,而深入研究该基因发现,miR-7-5p可靶向结合TFF3 3′UTR位点,并显著下调宫颈癌细胞TFF3的表达,在细胞功能方面,过表达miR-7-5p可抑制宫颈癌细胞的增殖、转移和克隆形成能力。
综上,本研究初步证明miR-7-5p靶向调控TFF3可抑制宫颈癌的增殖和转移功能。肿瘤的靶向治疗一直以来都是肿瘤研究的热点,期望本研究为肿瘤靶向治疗提供新的靶点,同时为宫颈癌的防治提供新的思路。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J].CA Cancer J Clin, 2018,68(1): 7-30.
[2] MOON J Y, SONG I C, KO Y B, et al. The combination of cisplatin andtopotecan as a second-line treatment for patients with advanced/recurrent uterine cervix cancer[J]. Medicine (Baltimore), 2018,97(14): e0340.
[3] BRACKEN C P, SCOTT H S, GOODALL G J. A network-biology perspective of microRNA function and dysfunction incancer[J]. Nat Rev Genet, 2016,17(12): 719-732.
[4] XIAO P, LING H, LAN G, et al. Trefoil factors: gastrointestinal-specific proteins associated with gastriccancer[J]. Clin Chim Acta, 2015,450: 127-134.
[5] WANG X N, WANG S J, PANDEY V, et al. Trefoil factor 3 as a novel biomarker to distinguish between adenocarcinoma and squamous cell carcinoma[J]. Medicine (Baltimore), 2015, 94(20): e860.
[6] PERRY J K, KANNAN N, GRANDISON P M, et al. Are trefoil factors oncogenic?[J]. Trends Endocrinol Metab, 2008,19(2): 74-81.
[7] RIVAT C, CHRISTINE R, RODRIGUES S, et al. Implication of STAT3 signaling in human colonic cancer cells during intestinal trefoil factor 3 (TFF3): and vascular endothelial growth factor-mediated cellular invasion and tumor growth[J]. Cancer Res, 2005,65(1): 195-202.
[8] CHEN Y H, LU Y, DE PLAEN I G, et al. Transcription factor NF-kappaB signals antianoikic function of trefoil factor 3 on intestinal epithelial cells[J]. Biochem Biophys Res Commun, 2000,274(3): 576-582.
[9] SHUKLA A, GUPTA P, SINGH R, et al. Glycolytic inhibitor 2-Deoxy-d-Glucose activates migration and invasion in glioblastoma cells through modulation of the miR-7-5p/TFF3 signaling pathway[J]. Biochem Biophys Res Commun, 2018,499(4): 829-835.
[10] GUO J, SUN M, TENG X, et al. MicroRNA-7-5p regulates the expression of TFF3 in inflammatory bowel disease[J]. Mol Med Rep, 2017,16(2): 1200-1206.
[11] SMID M, WANG Y X, KLIJN J G, et al. Genes associated with breast cancer metastatic to bone[J]. J Clin Oncol, 2006,24(15): 2261-2267.
[12] AHMED A R, GRIFFITHS A B, TILBY M T, et al.TFF3 is a normal breast epithelial protein and is associated with differentiated phenotype in early breast cancer but predisposes to invasion and metastasis in advanced disease[J]. Am J Pathol, 2012,180(3): 904-916.
[13] MELO S, VILLANUEVA A, MOUTINHO C, et al. Small moleculeenoxacin is a cancer-specific growth inhibitor that acts by enhancing TAR RNA-binding protein 2-mediated microRNA processing[J]. Proc Natl Acad Sci USA, 2011,108(11): 4394-4399.
[14] 陆新元,谷晓媛,纪义梅,等.microRNA-133a在复发性肝细胞癌中差异表达及其生物学功能研究[J].同济大学学报(医学报),2017,38(2):33-38.