胃癌是世界上第五大肿瘤,据统计,3/4新发病例位于亚洲,而中国新发病例占亚洲一半以上[1-2]。由于早期胃癌发病隐匿,加之胃镜等早期筛查在国内开展不普遍,多数患者在出现症状时才前往医院就诊,而此时部分患者已经处于中晚期,丧失根治性手术的机会。研究胃癌发病机制对于提高其早期诊断率、改善治疗效果具有重要意义。近年来,非编码RNA与肿瘤之间的关系备受瞩目。环状RNA(circular RNA, circRNA)是一类双链闭合的非编码RNA,由外显子、内含子或二者反向剪接共同组成,无3′帽子结构及5′poly A尾,长度从几百到几千不等,不受RNA外切酶降解,稳定且广泛地存在于生物的细胞质、细胞核、外泌体中,具有进化保守性[3-4]。现已发现多个与胃癌发生发展相关的circRNA,它们主要通过调控其靶基因表达进而发挥促进或抑制肿瘤发生发展的作用。如circRNA_0023642在胃癌组织中表达异常增高,可以调控癌细胞上皮间质转化(epithelial-mesenchymal transition, EMT)进而促进胃癌细胞迁移和侵袭,提示其具有促癌作用[5];而circRNA_PVRL3在胃癌中表达显著降低,并且沉默其表达可以促进胃癌细胞增殖和迁移,提示其具有抑癌作用[6]。近期一项研究发现circ-VANGL1可以促进膀胱癌的发生发展[7],但circ_VANGL1与胃癌之间的关系尚未见报道。本研究就circ_VANGL1与胃癌发生发展之间的关系进行探讨。
1 材料与方法
1.1 标本来源
收集2016年1月—2018年1月于上海健康医学院附属嘉定区中心医院普外科行胃癌根治术患者100例,切取至少1cm3肿瘤组织及距肿瘤2cm以上区域癌旁组织。术后将每例样本迅速置于液氮中保存,用于RNA提取和qRT-PCR检测。以癌旁组织作为阴性对照。所有患者均签署知情同意书。
1.2 仪器与试剂
DMEM高糖细胞培养基购自美国Gibco公司;胎牛血清购自美国Hyclone公司;TRIzol裂解液购自美国Sigma公司;PCR引物由上海生物工程技术服务公司合成;反转录试剂盒购自日本TaKaRa公司;Annexin Ⅴ-FITC/PI双染试剂盒购自美国BD公司;蛋白提取试剂盒购自中国碧云天公司;PVDF膜购自美国Millipore公司;一抗和二抗购自美国Santa Cruz公司;ECL化学发光试剂盒购自美国Pierce公司;X-OMAT-Blue film购自美国Kodak公司;荧光定量PCR仪7500购自美国ABI公司;细胞培养箱(ERAcell BB15)购自德国Heraeus公司;流式细胞仪(FACSCanto Ⅱ)购自美国BD公司。
1.3 方法
1.3.1 细胞培养 胃癌细胞株NCI-N87和HGC-27均购自中国科学院上海生命科学研究院细胞资源中心。两株细胞采用高糖DMEM培养液培养,添加10% FBS、100U/mL青霉素和100μg/mL链霉素。细胞培养皿放置在37℃,5%CO2的培养箱中。两种细胞均为贴壁生长细胞,在生长至80%融合时进行传代。
1.3.2 慢病毒构建 本研究采用慢病毒转染胃癌细胞上调或下调circ_VANGL1的表达水平。携带circ_VANGL1全长序列的慢病毒(Lenti-circ_VANGL1)和携带circ_VANGL1 shRNA的慢病毒(Lenti-circ_VANGL1-shRNA)由吉凯基因公司构建,设计2条shRNA,序列见表1。
表1 circ_VANGL1引物和shRNA序列
Tab.1 The sequence of circ-VANGL1 primer and shRNA

引物和shRNA名称序列(5'→3')circ_VANGL1F: CTTCTACAGCCTGGGACACR: CTGACCCTCTGCCGTCTTTAcirc_VANGL1 shR-NAF: AGAAUGAGGAGUUUGAAUGCCR: CAUUCAAACUCCUCAUUCUGCGAPDHF: GTCAACGGATTTGGTCTGTATTR: AGTCTTCTGGGTGGCAGTGAT
1.3.3 qRT-PCR 采用TRIzol试剂提取组织和细胞总RNA,Primer-Script一步法RT-PCR试剂盒反转录成cDNA。利用SYBR Premix Dimmer Eraser试剂盒通过qRT-PCR扩增cDNA,每个样本的基因表达用内参GAPDH均一化。试验重复3次,计算方法为2-ΔΔCt法。
1.3.4 CCK-8实验 将细胞接种于96孔板,分为对照组、Lenti-circ_VANGL1处理组和Lenti-circ_VANGL1-shRNA处理组。在慢病毒处理72h后,吸弃上清液,向每孔加入10mL的CCK-8溶液在培养箱内孵育2h。用酶标仪测定在450nm处的光密度(D450)。
1.3.5 Annexin V/PI实验 细胞分组同1.3.4,在慢病毒处理24、48、72h后,用预冷PBS洗涤细胞,4℃离心5min(300×g)。收集至少1×105个细胞,吸弃PBS,加入100μL结合缓冲液重悬细胞,然后加入5μL Annexin Ⅴ-FITC和10μL PI染色液在避光、室温下孵育15min。样品在15min内上流式细胞仪进行荧光检测。
1.3.6 JC-1实验 JC-1实验检测Lenti-circ_VANGL1和Lenti-circ_VANGL1-shRNA对细胞线粒体势能的影响。将细胞接种于6孔板,在慢病毒处理24、48、72h后,吸弃培养液,用PBS洗涤细胞,加入1mL JC-1染色工作液,充分混匀。细胞培养箱中37℃孵育20min。孵育结束后,吸除上清液,用JC-1染色缓冲液洗涤2次后上流式细胞仪进行荧光检测。
1.3.7 Western印迹法 收集细胞提取蛋白,将25μg蛋白进行电泳后转膜至PVDF膜,经过封闭、一抗孵育、二抗孵育后在暗室中发光、定影、显影。
1.3.8 circ_VANGL1的miRNA靶基因预测 通过PubMed网站(www.pubmed.com)查询circ_VANGL1的全长序列后,采用miRDB在线软件(http://mirdb.org/miRDB/index.html)对circ_VANGL1的miRNA靶基因进行预测。
1.4 统计学处理
所有数据采用SPSS 20.0进行统计学分析,所有数据表示为![]() 所有实验均重复3次及以上。统计方法根据实验设计分别采用t检验、单因素为差分析、 χ2检验等。P<0.05为差异有统计学意义。
所有实验均重复3次及以上。统计方法根据实验设计分别采用t检验、单因素为差分析、 χ2检验等。P<0.05为差异有统计学意义。
2 结 果
2.1 circ_VANGL1表达水平与胃癌临床病理因素的相关性分析
qRT-PCR结果显示,circ_VANGL1在癌组织中的表达水平显著高于癌旁组织(2.329±0.315 vs 1.032±0.128),差异有统计学意义(P<0.05)。根据表达水平中位值将患者分为两组: 高表达组(n=50例)和低表达组(n=50例)。χ2检验分析,circ_VANGL1表达水平与性别、年龄、病理类型并无显著关系,但它与肿瘤体积、TNM分期以及淋巴转移显著相关,见表2。
表2 circ_VANGL1表达水平与临床病理因素的关系
Tab.2 The relationship of circ-VANGL1 with clinicopathological features

项目circ_VANGL1低表达组(n=50)circ_VANGL1高表达组(n=50)χ2(P)性别 男(n=70)33370.762(0.383) 女(n=30)1713年龄 ≥60岁(n=68)37311.654(0.198) <60岁(n=32)1319肿瘤体积 ≥5cm(n=60)223810.667(0.001) <5cm(n=40)2812TNM分期 Ⅰ~Ⅱ(n=48)30185.769(0.016) Ⅲ(n=52)2032Lauren分型 肠型(n=65)30351.099(0.295) 弥漫型(n=35)2015淋巴转移 阳性(n=62)26364.244(0.039) 阴性(n=38)2414
2.2 circ_VANGL1表达水平对胃癌细胞增殖的影响
Lenti-circ_VANGL1可以上调NCI-N87和HGC-27细胞内circ_VANGL1表达水平;而Lenti-circ_VANGL1-shRNA可以下调circ_VANGL1表达水平,见表3。CCK-8结果显示,经过慢病毒处理72h后,Lenti-circ_VANGL1可以促进胃癌细胞株NCI-N87和HGC-27细胞增殖,而Lenti-circ_VANGL1-shRNA可以抑制细胞增殖,差异有统计学意义(P<0.05),见表4。
表3 NCI-N87和HGC-27细胞中circ_VANGL1表达水平
Tab.3 Expressions of circ_VANGL1 in NCI-N87 and HGC-27 cells

细胞类型对照组Lenti-circ_VANGL1Lenti-circ_VANGL1-shRNANCI-N870.996±0.1043.855±0.577*0.405±0.038*HGC-271.034±0.0354.424±0.738*0.341±0.066*
与对照组相比,*P<0.05
表4 CCK-8实验检测circ_VANGL1表达水平对胃癌细胞增殖的影响
Tab.4 Effects of circ_VANGL1 expression on the prociferation of NCI-N87 and HGC-27 cells

细胞类型对照组Lenti-circ_VANGL1Lenti-circ_VANGL1-shRNANCI-N870.535±0.0050.746±0.009*0.221±0.004*HGC-270.56±0.0040.846±0.014*0.248±0.013*
与对照组相比,*P<0.05
2.3 circ_VANGL1表达水平对胃癌细胞凋亡的影响
经过慢病毒处理72h后,circ_VANGL1过表达组细胞凋亡比例与对照组相比(NIC-N87: 0.066±0.004 vs 0.065±0.012;HGC-27: 0.069±0.010 vs 0.07±0.012),差异无统计学意义;而circ_VANGL1表达下调组细胞凋亡比例显著增高(NIC-N87: 0.171±0.003;HGC-27: 0.213±0.002),差异有统计学意义(P<0.05),见图1。
2.4 circ_VANGL1表达水平对胃癌细胞线粒体势能的影响
线粒体膜电位流式细胞术检测结果显示,在对照组、Lenti-circ_VANGL1处理组中,NCI-N87(12.628±1.342 vs 12.725±1.393)和HGC-27(9.275±1.219 vs 9.392±1.067)细胞内线粒体维持较高的膜电位,红色荧光较强,绿色荧光非常弱;而Lenti-circ_VANGL1-shRNA处理组中红色荧光强度逐渐减弱,绿色荧光强度逐渐增强,说明线粒体膜电位下降(NIC-N87: 2.41±0.246;HGC-27: 1.41±0.246),与前两组相比,差异有统计学意义(P<0.05),见图2。
2.5 circ_VANGL1对凋亡相关蛋白表达的影响
circ_VANGL1表达下调后,NCI-N87和HGC-27细胞内bcl-2、线粒体细胞色素C蛋白表达水平下调,Fas、Fas相关死亡结构域(FADD)、Bax、胞质细胞色素C、Caspase-3活性片段蛋白表达水平上调,见图3。
2.6 circ_VANGL1与miRNAs表达水平相关性分析
通过miRDB软件对circ_VANGL1的靶miRNAs进行预测,结果显示miR-605-3p、miR-377-5p、miR-4468、miR-5008-5p、miR-6852-3p、miR-4749-3p、miR-6126、miR-4283、miR-6811-3p、miR-6850-5p、miR-4751、miR-4316等12个miRNAs与circ_VANGL1具有潜在结合位点(表3)。采用qRT-PCR检测发现circ_VANGL1表达下调后其中4条miRNAs包括miR-605-3p、miR-377-5p、miR-4468以及miR-5008-5p表达出现显著上调,见图4。
3 讨 论
非编码RNA与肿瘤之间的关系研究在过去的十年里主要聚焦于微小RNA(microRNA, miRNA)和长链非编码RNA(long non-coding RNA, lncRNA)。近年来,大量研究表明circRNAs在肿瘤发病中起重要作用,并在一定程度上对肿瘤的生物学行为以及发病机制研究提供了新的见解[8]。然而,circRNAs在胃癌的发生发展过程中的作用尚不清楚,阐明circRNAs功能的分子机制将促进胃癌circRNAs定向诊断和精准治疗的发展[9]。

图1 circ_VANGL1表达水平对胃癌细胞凋亡的影响
Fig.1 The effects of circ-VANGL1 on apoptosis of gastric cancer cells
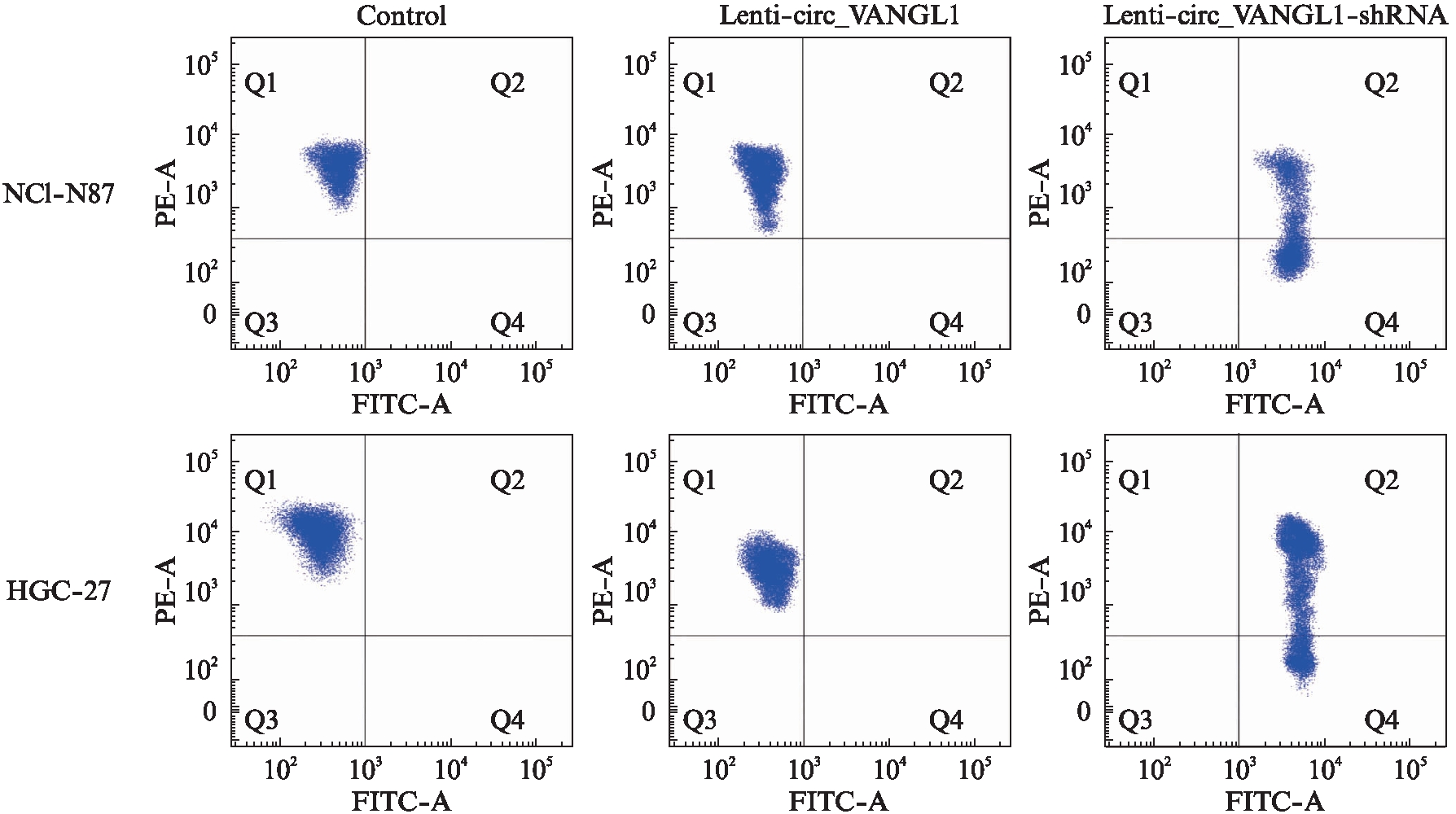
图2 circ_VANGL1表达对线粒体膜电位的影响
Fig.2 The effects of circ-VANGL1 on mitochondrial membrane potential of gastric cancer cells
线粒体膜JC-1荧光流式细胞术检测图;横坐标为JC-1单体(monomer),可产生绿色荧光,纵坐标为JC-1聚合物(J-aggregates),可产生红色荧光

图3 circ_VANGL1表达对凋亡相关蛋白表达的影响
Fig.3 The expression of circ-VANGL1 on apoptosis-related protein expression
A: 对照组;B: Lenti-circ_VANGL1; C: Lenti-circ_VANGL1-shRNA

图4 circ_VANGL1对各miRNA表达的影响
Fig.4 The effects of circ-VANGL1 expression on the expression of miRNAs in NCI-N87 cells
与对照组相比,*P<0.05
本研究对胃癌临床标本中circ_VANGL1表达水平进行了检测,结果显示circ_VANGL1在癌组织中的表达水平显著高于癌旁组织,并且其表达水平与肿瘤体积、TNM分期以及淋巴转移显著相关,但与年龄、性别和分型并不相关,说明circ_VANGL1对于胃癌的临床诊断和分期评估具有一定的参考价值。因其表达与肿瘤体积显著相关,因此,在功能学实验中检测了circ_VANGL1对胃癌细胞增殖和凋亡的影响。结果显示circ_VANGL1表达上调可以促进胃癌细胞增殖,而敲减其表达则能抑制细胞增殖。VANGL1在胃癌中发挥着促癌作用。凋亡是影响肿瘤生长的重要因素[10]。按凋亡信号来源可以将凋亡信号途径分为三条: 死亡受体途径、线粒体途径和内质网应激途径。这三条途径最后都需要Caspase参与,最终导致凋亡。死亡受体诱导的细胞凋亡是三条通路中研究较为成熟的信号转导途径,主要通过肿瘤坏死因子受体1(tumor necrosis factor receptor 1, TNFR1)、Fas、死亡受体3(death receptor 3, DR3)、死亡受体4(death receptor 4, DR4)以及死亡受体5(death receptor 5, DR5)介导[11]。其中Fas与其配体FasL结合后可以与细胞内的FADD相互作用,促进后者激活Caspase家族成员,诱导凋亡[12]。本研究Annexin Ⅴ/PI试验结果显示,circ_VANGL1表达下调可以促进细胞凋亡,并且Fas和FADD表达增高,说明Fas介导的死亡受体凋亡途径(又称外源性凋亡途径)被激活,提示circ_VANGL1参与调控胃癌细胞凋亡发生。但circ_VANGL1如何调控Fas/FADD仍有待进一步研究。临床病理因素相关性分析显示circ_VANGL1与淋巴转移呈正相关,但本研究中并未深入探索circ_VANGL1对胃癌细胞迁移和侵袭的影响,有待进一步揭示。
越来越多的报道表明,在真核动物的基因调控网络中存在包括ceRNAs在内的广泛的相互作用网,circRNAs可以通过与靶miRNA的潜在位点结合进而调控靶miRNA下游靶mRNA的表达[13-15]。已有研究报道circ_VANGL1也具有miRNA海绵作用。在膀胱癌中,circ_VANGL1可以作为miR-605-3p的海绵,促进miR-605-3p的靶基因VANGL1表达,从而发挥促进肿瘤细胞增殖的作用[7]。miRDB是常用的预测RNA与RNA相互结合、相互作用的重要软件[16-17]。本研究通过miRDB软件对circ_VANGL1可能的靶miRNAs进行了预测。共有12个靶miRNAs被发现,其中包括已经被证实的miR-605-3p。这在一定程度上说明了该预测结果的准确性。进一步通过qRT-PCR检测了circ_VANGL1表达下调后以上12个miRNAs在胃癌细胞中的表达水平,结果显示其中miR-605-3p、miR-377-5p、miR-4468以及miR-5008-5p表达出现显著上调,提示它们可能是circ_VANGL1的靶miRNAs。以上4个miRNAs除了miR-605-3p被证明与肿瘤相关之外,其它3个miRNAs的生物学功能至今未见报道。本课题组今后将通过荧光素酶报告基因实验检测circ_VANGL1与以上4个miRNAs是否存在直接结合,并分析其结合位点,由此可以进一步确认胃癌细胞中circ_VANGL1的靶miRNA。在明确miRNA之后可以进一步分析其靶mRNA,进而探讨circ_VANGL1调控胃癌细胞增殖和凋亡的分子机制。
综上所述,本研究发现circ_VANGL1在胃癌中表达异常增高,且其表达水平与肿瘤体积、TNM分期以及淋巴转移显著相关。提高其表达可以促进胃癌细胞增殖,下调其表达则能激活Fas/FADD死亡受体促进细胞凋亡。circ_VANGL1的促癌作用可能与其作为海绵竞争性结合靶miRNAs有关。
[1] TORREL A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2): 87-108.
[2] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2): 115-132.
[3] CONNS J, PILLMAN K A, TOUBIA J, et al. The RNA binding protein quaking regulates formation of circRNAs[J]. Cell, 2015,160(6): 1125-1134.
[4] LI Z Y, HUANG C, BAO C, et al. Exon-intron circular RNAs regulate transcription in the nucleus[J]. Nat Struct Mol Biol, 2015,22(3): 256-264.
[5] ZHOUL H, YANG Y C, ZHANG R Y, et al. CircRNA0023642 promotes migration and invasion of gastric cancer cells by regulating EMT[J]. Eur Rev Med Pharmacol Sci, 2018,22(8): 2297-2303.
[6] SUNH D, XU Z P, SUN Z Q, et al. Down-regulation of circPVRL3 promotes the proliferation and migration of gastric cancer cells[J]. Sci Rep, 2018,8(1): 10111.
[7] ZENG Z H, ZHOU W M, DUAN L X, et al. Circular RNA circ-VANGL1 as a competing endogenous RNA contributes to bladder cancer progression by regulating miR-605-3p/VANGL1 pathway[J]. J Cell Physiol, 2019,234(4): 3887-3896.
[8] HOUL D, ZHANG J. Circular RNAs: An emerging type of RNA in cancer[J]. Int J Immunopathol Pharmacol, 2017,30(1): 1-6.
[9] WANG D D, YANG S J, WANG H, et al. The progress of circular RNAs in various tumors[J]. Am J Transl Res, 2018,10(6): 1571-1582.
[10] FLORESE R. Commentary on “apoptosis, p53, and tumor cell sensitivity to anticancer agents”[J]. Cancer Res, 2016,76(23): 6763-6764.
[11] ELMORE S. Apoptosis: a review of programmed celldeath[J]. Toxicol Pathol, 2007,35(4): 495-516.
[12] STONEMAN V E, BENNETT M R. Role of Fas/Fas-L in vascular cell apoptosis[J]. J Cardiovasc Pharmacol, 2009,53(2): 100-108.
[13] MILITELLO G, WEIRICK T, JOHN D, et al. Screening and validation of lncRNAs and circRNAs as miRNA sponges[J]. Brief Bioinformatics, 2017,18(5): 780-788.
[14] XIE H J, REN X L, XIN S N, et al. Emerging roles of CircRNA001569 targeting miR-145 in the proliferation and invasion of colorectal cancer[J]. Oncotarget, 2016,7(18): 26680-26691.
[15] LI F, ZHANG L Y, LI W, et al. Circular RNA ITCH has inhibitory effect on ESCC by suppressing the Wnt/β-catenin pathway[J]. Oncotarget, 2015,6(8): 6001-6013.
[16] WONG N, WANG X W. MiRDB: an online resource for microRNA target prediction and functional annotations[J]. Nucleic Acids Res, 2015,43(Database issue): D146-D152.
[17] WANG X W. Improving microRNA target prediction by modeling with unambiguously identified microRNA-target pairs from CLIP-ligation studies[J]. Bioinformatics, 2016,32(9): 1316-1322.