神经干细胞(neural stem cells, NSCs)因具有自我更新和多向分化潜能而备受关注,以NSCs为基础的细胞替代治疗成为近年来的研究热点。很多研究证明NSCs移植治疗可以改善多种神经退行性疾病、外伤导致的神经细胞受损等疾病的症状[1-2]。研究者们通过使胚胎干细胞(embryonic stem cells, ESCs)体外分化获取NSCs[3]、体细胞经诱导转化为诱导型多能干细胞(induced pluripotent stem cells, iPSCs)[4]等方法完善细胞替代治疗。但上述两种方法均存在自身难以克服的弊端: 前者的获取无法通过伦理认证;后者存在明显的致瘤风险。2012年,Han等[5]成功将体细胞转化为诱导型NSCs(induced neural stem cells, iNSCs),iNSCs具有和NSCs相似的自我增殖能力和多向分化潜能,组织来源丰富,无致瘤性,无伦理限制,成为神经系统疾病细胞替代治疗的理想细胞。
很多研究表明转录因子Sox2是诱导转化过程中的关键诱导因子。RING等[6]通过单诱导因子Sox2成功将小鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)转化为iNSCs,并证明其他因子的添加并未提高转化的效率。2016年,Han等[7]采用丙戊酸(VPA)、Bix01294、RG108、PD0325901、CHIP99021、A83-01及维生素C(VC)等7种小分子物质成功将MEFs转化为iNSCs。目前的转化方法尚存在转化效率低的问题,无法满足iNSCs的基础研究和临床应用需求,本实验采用单独利用诱导因子Sox2,单独利用小分子物质,Sox2和小分子物质共同作用3种方法将MEFs转化诱导为iNSCs,比较3组的转化效率旨在探索小分子物质的添加是否可以提高单因子Sox2的诱导效率。
1 材料与方法
1.1 材料和试剂
孕14d C57小鼠购于上海南方模式生物有限公司;胎牛血清、DMEM高糖培养基、L-谷氨酰胺、N2添加物、B27添加物、含EDPA的胰酶、牛血清白蛋白(BSA)购于美国Gibco公司;NeuroCultTM细胞增殖试剂盒、D-PBS购于加拿大StemCell公司;碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)购于美国PeproTech公司;兔抗小鼠巢蛋白(nestin)、兔抗小鼠微管相关蛋白2(MAP2)、兔抗小鼠胶质细胞原纤维酸性蛋白(GFAP)、兔抗小鼠波形蛋白(vimentin)购于美国Abcam公司;VPA、Bix01294、RG108、PD0325901、CHIP99021、A83-01及VC等购于美国MCE公司。本实验所使用动物相关实验方法均依据国际实验动物使用及照顾相关方法,通过同济大学附属同济医院动物福利伦理委员会审查。
1.2 细胞培养基
MEFs培养基: DMEM高糖培养基、10%胎牛血清、1%青霉素/链霉素;NSCs和MEFs转化培养基: DMEM/F12、B27(50×)、EGF储存液(5000×)、bFGF储存液(5000×)、青霉素/链霉素(100×);NSCs分化培养基: DMEM/F12、5%胎牛血清、1%青霉素/链霉素和1μmol/L维甲酸(RA)。
1.3 MEFs和NSCs的提取
将孕14d的C57小鼠颈椎脱臼处死,乙醇消毒全身,取出胚胎置于4℃磷酸盐缓冲液(PBS)中,体视显微镜下去除内脏及四肢,保留头部并提取NSCs,从躯干部分提取MEFs。剥除胎鼠头颅皮肤、颅骨、脑膜,小心分离大脑皮层,置于4℃ PBS中用巴氏吸管反复吹打至均匀的悬液,250×g离心5min,PBS清洗2~3次,加入适量培养基重悬培养。将躯干部分组织剪碎,0.25%胰酶室温下消化20min,用巴氏吸管反复吹打至均匀悬液,加入等体积MEFs培养基终止消化,70μm筛过滤去除较大组织块,250×g离心5min,PBS清洗2~3次,培养于适量MEFs培养基中。
1.4 慢病毒表达载体的构建
本实验选择慢病毒表达载体pLenti6.3-MCS,排除Sox2基因自身的酶切位点,选择酶切位点Asc1和Pme1作为目的基因的插入位点。用293T细胞进行Sox2的过表达慢病毒包装。
1.5 将MEFs诱导转化为iNSCs
用多聚鸟氨酸/层粘连蛋白包被24孔板内的细胞爬片。将细胞分为5组: S组,单独使用诱导因子Sox2;M组,单独使用7种小分子物质;S+M组,使用诱导因子Sox2联合7种小分子物质;CT组,未转染的野生型MEFs;NC组,加入空白质粒。采用1/2小体积感染法,24h后换NSCs的完全培养基,隔天换液,共诱导7d,诱导开始后的第5天,免疫荧光显微镜下计数5个不同爬片nestin阳性细胞数目,以计算3组细胞向NSCs转化的转化效率。NSCs转化率=(nestin阳性细胞数/MEF起始细胞数)×100%。
1.6 iNSCs的诱导分化
为进一步比较3组所产生的iNSCs的分化能力,将iNSCs悬浮培养,7d聚集成球,消化后重悬,接种于Matrigel胶包被的24孔板的细胞爬片中。第2天换NSCs分化培养基,隔天换液,培养7~14d用免疫荧光法检测神经元、星形胶质细胞和少突胶质细胞。
1.7 免疫荧光染色
将细胞爬片用PBS漂洗5min,共3次;4%多聚甲醛固定20min;PBS清洗5min,共3次;1%曲拉通×100透膜30min;PBS清洗5min,共3次;免疫荧光封闭液封闭30min,PBS清洗5min,共3次;加入一抗4℃湿盒内孵育过夜,吸弃一抗溶液,PBS清洗5min,共3次;加入二抗溶液室温孵育2h,吸弃二抗溶液,PBS清洗5min,共3次;DAPI核染10min,吸弃核染溶液,PBS清洗5min,共3次;封片,免疫荧光显微镜下观察并计数荧光蛋白的表达量。其中一抗稀释比例1∶200,二抗稀释比例1∶500。
1.8 实时定量聚合酶链反应(q-PCR)
通过q-PCR检测3组所产生的iNSCs在NSC相关基因及多能性相关基因的表达水平。将3组诱导产生的iNSCs、MEFs及iPSCs用PBS冲洗3次,采用TRIzol法提取总RNA。使用TaKaRa反转录试剂盒将RNA反转录为cDNA,采用随机引物使用TaKaRa qPCR检测试剂盒对cDNA进行PCR扩增,各标记基因引物见表1。
表1 引物序列
Tab.1 The sequences of the primers for qPCR

引物序列(5'-3')Sox2 上游引物TATTCATGTATAACATGATGGAGACG-GAGG 下游引物AGTGCTCACATGTGCGACAGGGGCNestin 上游引物GCAGAGAAGACAGTGAGGCAGATG 下游引物GGAGGCAGGAGACTTCAGGTAGAGPax6 上游引物GTTGTGTGAGTAAAATTCTGGGC 下游引物GAGTCGCCACTCTTGGCTTAZbtbl6 上游引物CTGGGACTTTGTGCGATGTG 下游引物CGGTGGAAGAGGATCTCAAACAZfp42 上游引物CCGGGATGAAAGTGAGATTAGC 下游引物TCACCTCGTATGATGCACTCOct4 上游引物TCTTTCCACCAGGCCCCCGGCTC 下游引物TGCGGGCGGACATGGGGAGATCCNanog 上游引物CACAGTTTGCCTAGTTCTGAGG 下游引物GCAAGAATAGTTCTCGGGATGAA
1.9 统计学处理
用SPSS 22.0软件进行统计分析,MEFs向NSCs的转化率采用M(Q2,Q3)表示,余数据均采用![]() 表示。四组间的比较采用单因素方差检验分析。P<0.05为差异有统计学意义。
表示。四组间的比较采用单因素方差检验分析。P<0.05为差异有统计学意义。
2 结 果
2.1 MEFs及NSCs的鉴定结果
从胎鼠内提取的MEFs及NSCs传代培养至P3时基本纯化,生长状态良好,MEFs呈长梭形,免疫荧光的结果显示MEFs对成纤维细胞标记蛋白vimentin及α-SMA呈阳性,见图1。vimentin的阳性率为(97.2±1.5)%、α-SMA为(96.3±1.9)%。提取的原代细胞确定为成纤维细胞,且细胞的纯度较高。NSCs悬浮生长并可形成神经球,NSCs对NSCs标记蛋白Sox2和nestin呈阳性,见图2。Sox2的阳性率为(98.3±1.7)%,nestin为(98.9±1.6)%,提取的原代细胞确定为NSCs,且纯度较高。

图1 免疫荧光鉴定MEFs
Fig.1 Immunofluorescence staining of MEFs
A1~A3为光镜下MEFs的形态,B1~B3显示MEFs对α-SMA呈强阳性;C1~C3显示MEFs对vimentin呈强阳性
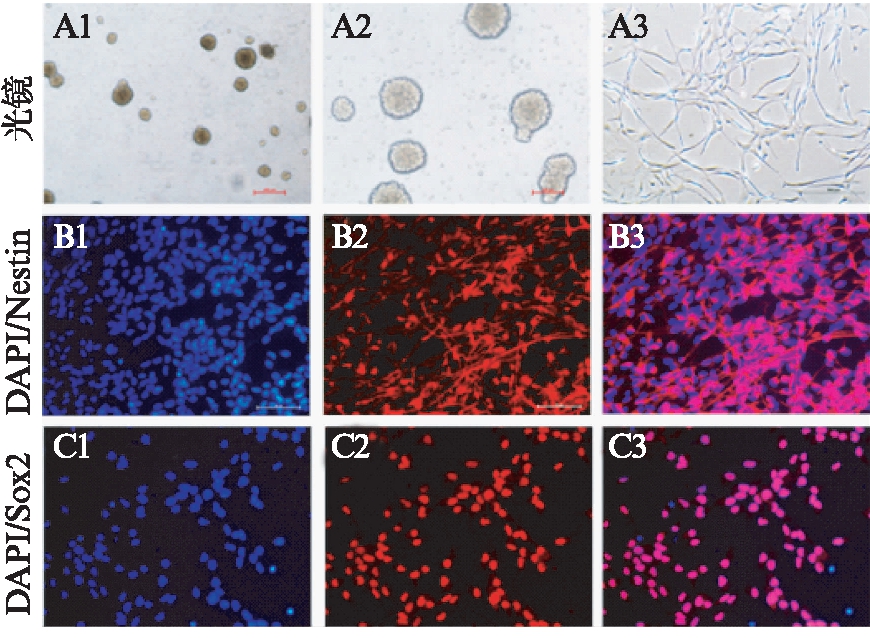
图2 免疫荧光鉴定NSCs
Fig.2 Immunofluorescence staining of NSCs
A1、A2为光镜下NSCs形成神经球的形态,A3为光镜下NSCs单层贴壁生长时细胞的形态;B1~B3显示NSCs对nestin呈强阳性;C1~C3显示NSCs对Sox2呈强阳性
2.2 将MEFs诱导转化为iNSCs
诱导开始后的4~6d,除了CT组和NC组,其他3组细胞的形态发生改变,细胞由梭形变得细长,相互之间连接成网状,并逐渐悬浮形成神经球的状态,见图3。免疫荧光染色结果显示部分细胞对nestin的染色呈强阳性,见图3。高倍显微镜下分类计数的结果显示: S组的转化率为1.32(1.27,1.47)%,M组的转化率为1.16(0.95,1.23)%,S+M组的转化率为2.53(2.17,2.60)%,CT组和NC组的转化率为0%。
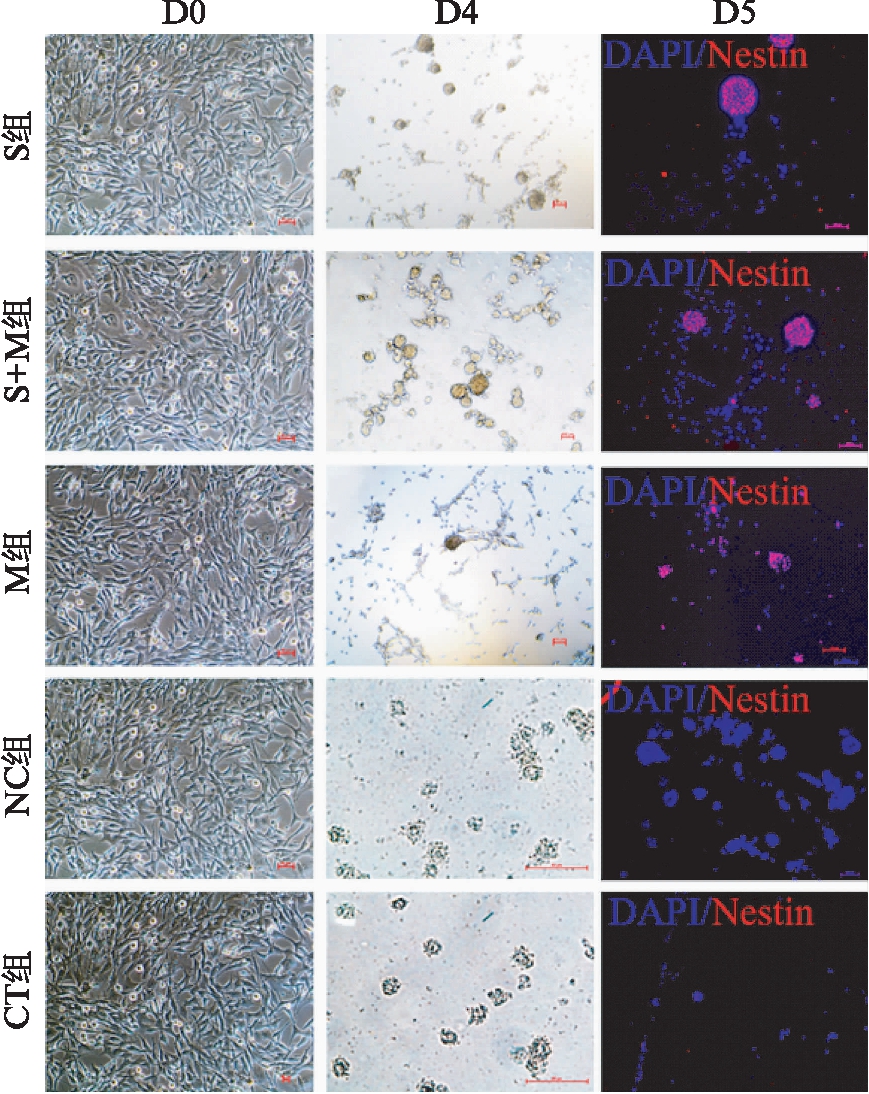
图3 MEFs在诱导过程中形态发生变化
Fig.3 Morphology changes of MEFs through the induction
在第5天,S组、S+M组及M组可观察到神经球的形成,免疫荧光检测结果证明iNSCs对Nestin/Sox2呈强阳性
诱导开始后的第8天,将细胞消化后置于低吸附培养瓶中,隔天换液。4~5d后,3组内皆可看到神经球形成,免疫荧光染色结果显示3组所形成的神经球均对nestin和Sox2呈强阳性,见图4。qPCR的结果显示3组所产生的iNSCs均表达多种NSC标志基因(Sox2、Pax6、Zbtb16),表达水平均较MEFs明显增高(P<0.05),但3组之间差异无统计学意义(P>0.05),见图5。3组的iNSCs不表达多潜能相关基因Oct4、Nanog、Zfp42,3组间差异性无统计学意义(P>0.05),见图6。
2.3 iNSCs具有自我更新能力和多向分化潜能
为了证明3种方法所形成的iNSCs具有多向分化的能力,将iNSCs置于多聚鸟氨酸/层粘连蛋白包被的6孔板中进行诱导分化,培养2周,荧光显微镜下可见成熟神经元(MAP2染色阳性),星形胶质细胞(GFAP染色阳性),少突胶质细胞(Olig2染色阳性)的形成,见图7。3组iNSCs具有多向分化的能力,且3组细胞之间不具有显著性差异。

图4 iNSCs神经球的形态及免疫荧光鉴定神经球
Fig.4 The morphology and immunofluorescence staining of neurospheres
光镜下见3组iNSCs形成神经球的形态;3组iNSCs对nestin呈阳性;3组iNSCs对Sox2呈阳性

图5 NSCs标记基因在各组中表达量的比较
Fig.5 The expression levels of NSCs marker genes in each group
CT组为MEFs

图6 多潜能性相关基因在各组中表达量的比较
Fig.6 The expression levels of pluripotency-related genes in each group
CT组为iPSCs
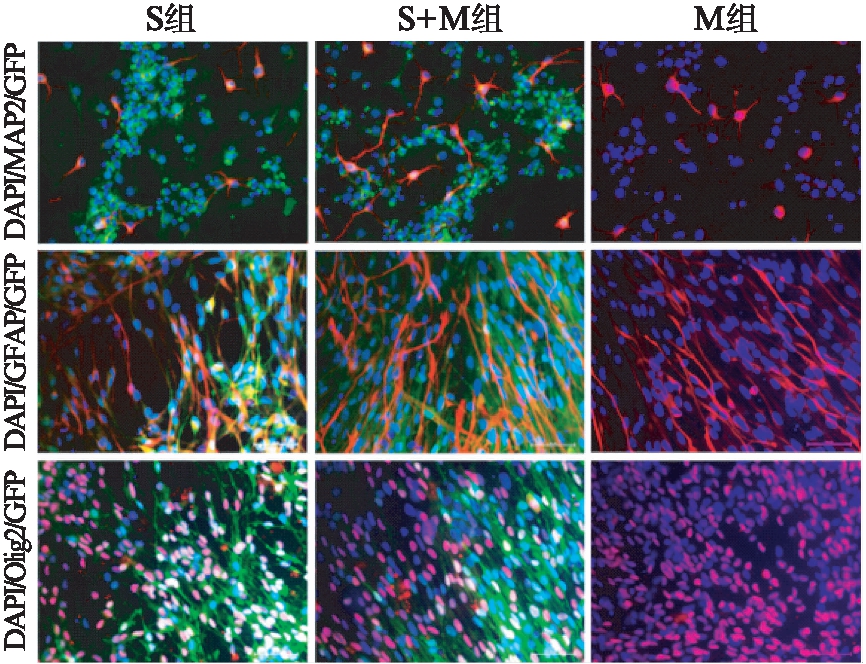
图7 免疫荧光鉴定3组iNSCs体外分化潜能
Fig.7 Immunofluorescence staining of differentiated iNSCs in vitro
免疫荧光显微镜下显示3组iNSCs能够分化为神经元(MAP2阳性),星形胶质细胞(GFAP阳性)和少突胶质细胞(Olig2阳性)
3 讨 论
NSCs因具有自我增殖和分化能力而对再生医学具有重大意义,它可以作为种子细胞用于治疗多种神经系统疾病,也可以用于药物筛选和毒性试验等[6,8]。基础实验研究和临床应用均要求获取足量的NSCs,但NSCs来源受限并受伦理约束。利用体细胞直接重编程为iNSCs则规避了上述方法的局限性。而且,将体细胞直接诱导转化为NSCs的方法组织来源丰富,可避免免疫排斥反应;另外,大量的研究表明iNSCs移植到小鼠脑内不存在致瘤性。因此,体细胞诱导产生的iNSCs为NSCs的研究提供了更好的选择[6]。
近年来,全球各个实验室通过不同的方法成功将体细胞直接转化为iNSCs,并证明iNSCs具有和野生型NSCs相似的功能。多数研究使用不同转录因子组合诱导体细胞向iNSCs转化[9-10],但是外源基因及细胞基因组的整合及病毒载体与细胞的整合都将带来一些难以预料的后果。所以减少外源基因的数量成为降低风险的一种方式。Ring等[6]成功利用单转录因子Sox2将MEFs转化为iNSCs,并证明此种转化方法可以激活内源性Sox2的表达,即转化诱导的细胞不需要外源性Sox2来维系NSCs功能状态,可以稳定传代40代以上。Han等[7]通过在培养基中添加7种小分子物质将MEFs转化为NSCs。VPA可通过抑制组蛋白去乙酰化酶而提高MEFs向iPSCs的转化效率[11];Bix01294是一种G9a HM色氨酸合成酶的抑制剂,可提高细胞重编程的效率[12];RG108是一种DNA甲基转移酶抑制剂,可以提高MEFs向iPSCs的转化效率[13];PD0325901可以抑制MAPK/ERK信号通路,提高ESCs自我更新能力[14];CHIP99021是一种糖原合成激酶3β的抑制剂,可以激活Wnt信号通路[14];A83-01通过抑制Smad2的磷酸化作用而抑制TGF-β介导的上皮细胞向间充质细胞的转化[15];VC是双加氧酶反应中的辅因子,可以提高iPSCs的产生[16]。此种方法转化效率可达2%,所形成的iNSCs具有稳定的自我增殖能力和多向分化潜能。但是,这两种方法的转化效率均较低。因此,本实验通过比较3种诱导方法的转化率证明两种方法的联合可以提高体细胞向iNSCs的转化效率,而不改变iNSCs的自我更新能力和多向分化潜能(如免疫荧光及PCR结果所示)。
本实验结果证明,转录因子和小分子物质具有协同作用,可以在提高MEFs向iNSCs转化效率的同时并不改变iNSCs的自我增殖能力及多向分化潜能。通过两种方法的组合提高转化效率可获得稳定的iNSCs。但本实验尚存在很多不足: (1) 为了提高转化的成功率,以便于转化效率的比较,本研究暂时只使用MEFs进行诱导转化;(2) 实验虽然证明两种方法的组合可以提高转化效率,但是具体的机制尚不明确,有待进一步研究;(3) 本实验暂时只停留在细胞水平,未进行动物实验以证明所转化的细胞可以在活体内存活、分化,对神经系统性疾病起治疗作用。
总之,本研究证明小分子物质与单因子Sox2的联合作用可以提高MEFs转化为iNSCs的效率,且并不影响所产生的iNSCs的自我增殖能力及多向分化能力,为投入大量iNSCs进行基础实验研究提供便捷,但具体的机制及各个小分子的作用值得进一步研究。
[1] SABELSTRÖM H, STENUDD M, FRISÉN J. Neural stem cells in the adult spinal cord[J]. Exp Neurol, 2014,260: 44-49.
[2] ZHANG W, GU G J, ZHANG Q, et al. NSCs promote hippocampal neurogenesis, metabolic changes and synaptogenesis in APP/PS1 transgenic mice[J]. Hippocampus, 2017,27(12): 1250-1263.
[3] PACHERN K J, ESNER M, BRYJA V, et al. Neural differentiation of mouse embryonic stem cells grown in monolayer[J]. Reprod Nutr Dev, 2002,42(4): 317-326.
K J, ESNER M, BRYJA V, et al. Neural differentiation of mouse embryonic stem cells grown in monolayer[J]. Reprod Nutr Dev, 2002,42(4): 317-326.
[4] TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006,126(4): 663-676.
[5] HAN D W, TAPIA N, HERMANN A, et al. Direct reprogramming of fibroblasts into neural stem cells by defined factors[J]. Cell Stem Cell, 2012,10(4): 465-472.
[6] RING K L, TONG L M, BALESTRA M E, et al. Direct reprogramming of mouse and human fibroblasts into multipotent neural stem cells with a single factor[J]. Cell Stem Cell, 2012,11(1): 100-109.
[7] HAN Y C, LIM Y, DUFFIELDL M D, et al. Direct reprogramming of mouse fibroblasts to neural stem cells by small molecules[J]. Stem Cells Int, 2016,2016: 4304916.
[8] 胡馨予,高正良,徐俊,等.2-DG对神经干细胞增殖和分化影响的研究[J].同济大学学报(医学版),2016,37(6): 35-40.
[9] KIM S M, KIM J W, KWAK T H, et al. Generation of integration-free induced neural stem cells from mouse fibroblasts[J]. J Biol Chem, 2016,291(27): 14199-14212.
[10] THIER M, WÖRSDÖRFER P, LAKES Y B, et al. Direct conversion of fibroblasts into stably expandable neural stem cells[J]. Cell Stem Cell, 2012,10(4): 473-479.
[11] HUANGFU D W, OSAFUNE K, MAEHR R, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J]. Nat Biotechnol, 2008,26(11): 1269-1275.
[12] SHI Y, DO J T, DESPONTS C, et al. A combined chemical and genetic approach for the generation of induced pluripotent stem cells[J]. Cell Stem Cell, 2008,2(6): 525-528.
[13] LEE J P, JEYAKUMAR M, GONZALEZ R, et al. Stem cells act through multiple mechanisms to benefit mice with neurodegenerative metabolic disease[J]. Nat Med, 2007,13(4): 439-447.
[14] YANG W F, WEI W, SHI C, et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains[J]. Stem Cells, 2009,27(2): 383-389.
[15] TOJO M, HAMASHIMA Y, HANYU A, et al. The ALK-5 inhibitor A-83-01 inhibits Smad signaling and epithelial-to-mesenchymal transition by transforming growth factor-beta[J]. Cancer Sci, 2005,96(11): 791-800.
[16] ESTEBAN M A, WANG T, QIN B M, et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells[J]. Cell Stem Cell, 2010,6(1): 71-79.