宫腔粘连(intrauterine adhesion, IUA),又称Asherman综合征(asherman syndrome, AS),1894年由Heinrich Fritsch首次报道,并于1950年由Joseph Asherman进一步命名[1],其在女性继发不孕中的发病率高达22%。宫腔粘连的发生机制目前还不是很清楚,但有研究认为创伤、感染和低雌激素状态是引起子宫内膜损伤后修复障碍、导致宫腔粘连发生的主要危险因素。据统计,92%的子宫内膜损伤继发于流产和产后进行的宫腔操作[1-3]。我国每年有600~1 300万人次行人工流产术,其中40%会继发不同程度的内膜损伤。
子宫内膜层主要由上皮细胞和间质细胞组成。组织学分为功能层和基底层。女性排卵周期中,子宫内膜功能层在激素作用下发生增生、分泌、脱落,而基底层可生成新的功能层,修复功能层脱落的创面。在排卵期,子宫内膜厚度至少达到7~8mm是保证胚胎正常植入的前提,低于6mm,则妊娠的可能性极低。流产、产后出血和刮宫术等宫腔操作常引起基底层的机械性损伤,若合并生殖道细菌逆行感染,常导致子宫内膜腺上皮细胞、间质细胞再生障碍,新生血管受损,子宫内膜活性丧失,肌层缺乏内膜覆盖,发生内膜纤维化和宫腔前后壁粘连,或是子宫内膜呈顽固性不再增生。宫腔镜下可见内膜厚度不均、局部变薄和粘连。组织病理学表现为宫腔内附着稠厚的纤维组织,纤维组织附着部位残留少量甚至完全缺乏正常的内膜组织,纤维附着部位的子宫内膜菲薄、腺体萎缩,缺乏有血管的间质,粘连局部处于低氧缺血的微环境。临床表现主要为月经紊乱、经量减少甚至闭经、导致胚胎难以着床造成不孕[1-4]。
目前对于宫腔粘连并无治疗指南。传统的治疗方案以手术和雌激素联合治疗为主。先行宫腔镜检查明确宫腔粘连及内膜的损伤程度,宫腔镜下行粘连松解术同时放置机械屏障如宫内节育器或球囊,术后予以口服雌激素促进子宫内膜再生。但目前文献显示这些方法效果均不佳,宫腔粘连患者的治愈率和妊娠率无明显改善,而且粘连复发率较高(轻度患者复发率超过30%,重度患者复发率超过60%),很多患者经过多次治疗后仍以失败告终。此外,大剂量雌激素的应用使得乳腺癌、卵巢癌等雌激素相关性肿瘤发病风险升高[5-6]。随着女性性生活年龄提前,婚前人工流产增加,宫腔粘连的发病率和检出率逐年上升,发病年龄呈年轻化趋势。宫腔操作继发宫腔粘连导致的不孕给婚姻和家庭带来巨大的负面影响,成为潜在的重大医疗和社会问题。探索新的有效防治子宫内膜损伤、治疗宫腔粘连的方法、恢复因宫腔粘连造成的不孕成为重大而紧迫的社会需求。
近年来,有学者提出导致宫腔粘连的子宫内膜修复障碍与局部干细胞损伤和缺失有关,认为子宫内膜的再生修复源自内膜中的干细胞。子宫内膜创伤和感染时内膜基底层损伤可能使位于此处的子宫内膜干细胞数量减少甚至缺失、功能受损,子宫内膜腺上皮不能完全再生,导致内膜疤痕性修复,最终引起内膜损伤[7-8]。这一理念的提出突破了传统的治疗手段,为子宫内膜损伤的治疗提供了新思路。
1 治疗子宫内膜损伤干细胞的种类及研发现状
干细胞被定义为可自我复制以及可分化成多种不同种类的细胞,并能够进一步产生至少一种高度分化后代的未分化细胞群体。人体内的多数器官和组织都含有干细胞群,在组织受到破坏或老化时提供替代细胞从而维持组织的内稳定。
干细胞具有自我复制和分化潜能,在一定的生理和病理诱导下,能够活化增殖,向同一或不同组织起源的细胞类型分化,维持机体和组织器官的功能、稳态和再生修复,在再生治疗中具有巨大的潜力,成为重大疾病防治的研究热点[9-10]。
2 子宫内膜干细胞
目前,许多实验团队都已证明子宫内膜中存在内膜干细胞,可能在每次月经周期中激活参与子宫内膜的重建。关于子宫内膜上皮干细胞的身份仍有待探究,目前主要认为它们存在于子宫腺基的基底层血管周围[11],包括以下类型。
子宫内膜类间充质干细胞(endometrial mese-nchymal stem-like cells, eMSCs)是集落形成基质细胞中的一个小细胞群,存在于基底层和功能层的血管周围,共同表达CD146+和血小板衍生生长因子受体β+(PDGF-βR+)。该实验团队也首次证实eMSCs可在体内再生形成子宫内膜基质[11-12]。
侧群细胞(side population cells, SP cells)因其表达多种内皮细胞标记而被认为是一种内皮干细胞。SP细胞集中于表达CD9-CD13-的子宫内膜部分。这些从子宫内膜中分离出来的SP细胞可产生类腺体(CD9+)或类基质(CD13+)细胞[11-13]。Masuda等[14]证明了SP细胞在特殊介质中可以增殖分化为多种类型的子宫内膜细胞,包括腺细胞、上皮细胞、基质细胞、内皮细胞。他们在动物实验中,将SP细胞植入免疫缺陷小鼠的肾包膜下,发现SP细胞可以生成含腺状结构、基质、血管和肌层的内膜组织,并随激素的变化而产生增生、分化、脱落的周期性改变。Cervelló等[15-16]亦证实了相同的结果,SP细胞可在小鼠体内产生类内膜样组织,同时该组织中的内膜腺体可表达孕激素并能够进一步分化形成蜕膜。
子宫内膜干细胞是具有自我更新、多向分化和高增殖潜能的成体干细胞,并且可以通过搔刮子宫内膜或月经血涂片等手段获得,操作简单、取材便利,或许能成为多能干细胞的一种新的潜在资源。2016年,Zhang等[17]将来源于月经血的eMSCs移植入子宫内膜受损的小鼠体内,发现内膜厚度及微血管密度增加,子宫内膜的损伤修复速度明显增加。此外,与内膜损伤的小鼠相比,治疗组的生育能力提高,具有较高的受孕率和较大的胚胎数。2018年,Domnina等[18]在宫腔粘连大鼠模型中植入月经血来源的eMSCs,大鼠的生育力显著提高,与接受骨髓干细胞移植的大鼠相比,其每胎分娩数量更多。
3 骨髓间充质干细胞
骨髓间充质干细胞(bone marrow derived stem cells, BMDSCs)因其可从骨髓中分离,较易在体外进行培养、诱导和扩增,是目前干细胞移植治疗领域应用最为广泛的一类种子细胞,具有分化为多种类型细胞的能力,可能对受损的组织有一定再生或修复作用,但相关具体机制仍需探究。
研究者发现接受过男性捐赠者骨髓进行移植的女性患者的子宫内膜细胞中有Y染色体的存在,由此推测BMDSCs也许能形成子宫内膜细胞,后续研究也进一步证实了移植于子宫内膜的BMDSCs具有分化成为上皮细胞和基质细胞的能力。有研究[19-21]在接受了雄性小鼠血液干细胞移植的雌性小鼠样本中发现所有受试雌性小鼠都含有捐赠者来源的子宫内膜干细胞,证明供体BMDSCs都可在受体体内分化成子宫内膜。Dimitrov等[22]也发现在人子宫内膜中含有少量具有子宫内膜基质干/原始细胞特征的细胞,该类细胞似乎属于MDSCs家族。然而,Cervelló等[23]开展的实验显示,BMDSCs可能只是一种激活子宫内膜细胞分化从而使子宫修复再生的限制性外生因子,而非循环的干细胞来源。Wang等[24]发现行BMDSCs治疗的大鼠模型中雌、孕激素受体均有显著的提高,提示BMDSCs移植可能是通过提高雌、孕激素受体的表达从而对受损的子宫内膜进行功能学修复[24]。此外,BMDSCs具有促进血管系统生成的作用[25]。研究[26]发现BMDSCs移植的大鼠模型与对照组相比,其子宫内膜组织可表达更高水平的成纤维细胞生长因子(fibroblast growth factors, FGF)、类胰岛素生长因子-1(insulin-like growth factor-1, IGF-1)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)和血管内皮生长因子(vascular endothelial growth factor, VEGF),这些因子都会提高子宫内膜细胞和子宫肌细胞的增殖能力,促进微血管重建,使子宫内膜恢复接受胚胎并支持其发育[26]。BMDSCs移植促进子宫内膜增殖,提高妊娠率的能力亦已在大鼠模型中得到验证[27-29]。一系列研究均证明BMDSCs可使传统宫腔粘连治疗无效的受损子宫内膜再生。
2011年,Nagori等[30]为1位重度宫腔粘连患者进行自体干细胞移植治疗并使患者成功妊娠。他们从患者的骨髓中分离出子宫内膜血管源干细胞,在对患者行刮宫术后于超声引导下将这些细胞置于子宫内膜腔,当子宫内膜达到合适的厚度后,该患者接受了体外受精并最终受孕。2015年,研究[31]进行了自体细胞疗法治疗难治性宫腔粘连和子宫内膜萎缩症的先导实验,受试患者接受了自体CD133+BMDSCs移植联合激素替代疗法,其中11名宫腔粘连患者均有月经情况改善,宫腔粘连程度降低同时子宫内膜厚度增加及血管生成,部分患者通过自然或人工方式相继受孕[31]。
子宫局部缺血/再灌注损伤可促进BMDSC向子宫内膜募集。BMDSCs可表达一种趋化因子受体CXCR4(C-X-C chemokine receptor type 4),CXCR4与其配体,即基质来源因子(C-X-C motif chemokine 12, CXCL12)在调节干细胞返回中发挥了重要作用。大鼠模型试验[32]证明,CSCL12在宫腔粘连的子宫内膜修复过程中促进了BMDSCs迁移至子宫内膜,同时可使宫腔粘连的大鼠更短时间受孕并且产胎更多。这些结果提示在BMDSCs移植前进行宫腔镜下粘连松解术,并在移植之后使用CXCL12或其他CXCR4受体激动剂可能提高宫腔粘连的治疗效果。
4 脂肪间充质干细胞
脂肪间充质干细胞(adipose mesen derived stem cells, AMDSCs)在细胞表型、分化能力等方面与BMDSCs相似,但其来源更丰富,取材创伤小,体外增殖速率快,易于大规模量产。
Kilic等[33]从雄鼠的脂肪组织中分离出干细胞并移植入宫腔粘连的雌鼠模型中,观察到移植后雌性大鼠的子宫内膜纤维化水平降低,且血管内皮生长因子、增殖细胞核抗原、细胞增殖相关核抗原Ki-67等多种细胞增殖标记物表达升高。同时,该试验还发现AMDSCs联合使用雌激素效果更佳,可有效促进子宫内膜细胞增殖。
AMDSCs作为一种更易获得的资源有望成为子宫内膜重建领域良好的细胞来源。但有研究发现,移植体内的AMDSCs存活时间较短,且对损伤发生部位的靶向性较差。祁旻龙等[34]考虑到人AMDSCs中缺乏炎症趋化因子受体2(chemokine receptor 2, CCR2),而已有证据表明CCR2可促进细胞的迁移和聚集、加快组织修复过程,因此通过慢病毒感染设计构建过表达CCR2的AMDSCs,并移植到创伤模型小鼠的创面4周,发现损伤部位的修复显著加快。该试验提示诱导CCR2过表达或可增强AMDSCs的靶向性。
5 人胚胎干细胞
人胚胎干细胞(humanEmbryonic stem cells, hESCs)来源于胚胎的内胚层,可在体外分化为3个胚层。多项研究显示hESCs在特定的培养介质中可以分化为各种细胞类型。
2015年,有研究[35]将hESCs与小鼠子宫内膜基质细胞共培养,诱导其分化为子宫内膜样上皮,其表面可表达雌、孕激素受体、细胞角蛋白、上皮细胞连接分子(epithelial cell adhesion molecule, EpCAM)、β-微管蛋白等,证实了hESCs可以向子宫内膜样细胞分化[35]。同年,有研究[36]将hESCs与子宫内膜基质细胞共同培养,诱导培养出子宫内膜样细胞,并将hESCs来源的细胞联合胶原支架移植入子宫被全层破坏的大鼠模型,12周后,该细胞存活下来,且其中一个子宫重度损伤大鼠模型子宫角的结构和功能得到恢复。
然而,使用胚胎以分离干细胞在伦理学上仍有争议。此外,临床试验发现经体外诱导的hESCs可能会成为肿瘤细胞的来源。
6 诱导多能干细胞
考虑到使用hESCs的限制性,诱导多能干细胞(induced pluripotent stem cells, iPSCs)为再生医学领域提供了一项新的工具。经过重新编程的iPSCs通常与hESCs有同样的自我复制和分化为3胚层的能力。iPSCs的优点包括可对患者体细胞中特定的转录因子进行异位表达而获得,从而避免了排异的可能性[37]。
研究[38]证明了iPSCs可从小鼠的胚胎成纤维细胞和成人成纤维细胞通过对4种转录因子,即Oct-3/4(octamer-binding transcription factor 3/4),Sox2(SRY(sex determining region Y)-box 2),c-Myc和Klf4(Kruppel-like factor 4)进行反转录病毒转染而获得。有实验[39]发现人子宫内膜成纤维细胞诱导获得的iPSCs有分化为中胚层和外胚层组织的能力。Park等[40]发现iPSCs也可从进行了Oct-4、Sox2、Klf4、Myc转换的子宫内膜细胞培养并重新编程得到。这些结果都证明了子宫内膜可以作为干细胞或成纤维细胞的来源以诱导iPSCs,该类型的iPSCs或可在将来成为干细胞治疗宫腔粘连的最佳选择。
7 展 望
干细胞现已成为一种恢复性细胞治疗的潜在资源而被广泛探索应用。对于接受传统激素联合手术及后续治疗的宫腔粘连患者,其子宫内膜的恢复情况并不十分理想,因此科学家们转而探索干细胞修复子宫内膜以作为宫腔粘连的一种新的治疗方式,但该项技术尚有许多问题亟待解决,如: 种细胞的选择,需要选取一种获取简便、性质稳定并且可以大量复制扩增的干细胞;以及干细胞的最佳定向诱导分化条件和效率;干细胞的移植时间、途径、剂量、复合作用机制问题;此外,需要寻找某种对患者伤害较小的方法严格监测移植至人体内的干细胞的安全性和质量,以上这些问题都有待于进一步研究,也是现在干细胞应用的主要探索方向。虽然迄今为止,对于利用干细胞修复子宫内膜的研究大多仍局限于动物模型或小样本量的临床试验,尚无大规模临床试验,但随着研究的进一步深入,相信干细胞移植治疗在未来一定能为众多宫腔粘连等子宫内膜再生障碍性疾病患者带来新的希望。
[1] MARCH C M. Management of Asherman’s syndrome[J]. Reprod Biomed Online, 2011,23(1): 63-76.
[2] 陶址,段华.宫腔镜粘连分离术后创面渗出液中粘连相关细胞因子浓度的动态分析[J].中华妇产科杂志,2012,47(10): 734-737.
[3] YU D, WONG Y M, CHEONG Y, et al. Asherman syndrome: one century later[J]. Fertil Steril, 2008,89(4): 759-779.
[4] CHEN Y Q, CHANG Y J, YAO S Z. Role of angiogenesis in endometrial repair of patients with severe intrauterine adhesion[J]. Int J Clin Exp Pathol, 2013,6(7): 1343-1350.
[5] YU D, LI T C, XIA E L, et al. Factors affecting reproductive outcome of hysteroscopic adhesiolysis for Asherman’s syndrome[J]. Fertil Steril, 2008,89(3): 715-722.
[6] KODAMAN P H, ARICI A. Intra-uterine adhesions and fertility outcome: how to optimize success?[J]. Curr Opin Obstet Gynecol, 2007,19(3): 207-214.
[7] KYO S, MAIDA Y, INOUE M. Stem cells in endometrium and endometrial cancer: accumulating evidence and unresolved questions[J]. Cancer Lett, 2011,308(2): 123-133.
[8] MARUYAMA T, MASUDA H, ONO M, et al. Human uterine stem/progenitor cells: their possible role in uterine physiology and pathology[J]. Reproduction, 2010,140(1): 11-22.
[9] DU H L, TAYLOR H S. Stem cells and reproduction[J]. Curr Opin Obstet Gynecol, 2010,22(3): 235-241.
[10] GARGETT C E, HEALY D L. Generating receptive endometrium in Asherman’s syndrome[J]. J Hum Reprod Sci, 2011,4(1): 49-52.
[11] GARGETT C E, MASUDA H. Adult stem cells in the endometrium[J]. Mol Hum Reprod, 2010,16(11): 818-834.
[12] MASUDA H, ANWAR S S, BÜHRING H J, et al. A novel marker of human endometrial mesenchymal stem-like cells[J]. Cell Transplant, 2012,21(10): 2201-2214.
[13] KATO K, YOSHIMOTO M, KATO K, et al. Characterization of side-population cells in human normal endometrium[J]. Hum Reprod, 2007,22(5): 1214-1223.
[14] MASUDA H, MATSUZAKI Y, HIRATSU E, et al. Stem cell-like properties of the endometrial side population: implication in endometrial regeneration[J]. PLoS One, 2010,5(4): e10387.
[15] CERVELL I, GIL-SANCHIS C, MAS A, et al. Human endometrial side population cells exhibit genotypic, phenotypic and functional features of somatic stem cells[J]. PLoS One, 2010,5(6): e10964.
I, GIL-SANCHIS C, MAS A, et al. Human endometrial side population cells exhibit genotypic, phenotypic and functional features of somatic stem cells[J]. PLoS One, 2010,5(6): e10964.
[16] CERVELL I, MAS A, GIL-SANCHIS C, et al. Reconstruction of endometrium from human endometrial side population cell lines[J]. PLoS One, 2011,6(6): e21221.
I, MAS A, GIL-SANCHIS C, et al. Reconstruction of endometrium from human endometrial side population cell lines[J]. PLoS One, 2011,6(6): e21221.
[17] ZHANG Y L, LIN X N, DAI Y D, et al. Endometrial stem cells repair injured endometrium and induce angiogenesis via AKT and ERK pathways[J]. Reproduction, 2016,152(5): 389-402.
[18] DOMNINA A, NOVIKOVA P, OBIDINA J, et al. Human mesenchymal stem cells in spheroids improve fertility in model animals with damaged endometrium[J]. Stem Cell Res Ther, 2018,9(1): 50.
[19] DU H L, TAYLOR H S. Contribution of bone marrow-derived stem cells to endometrium and endometriosis[J]. Stem Cells, 2007,25(8): 2082-2086.
[20] MINTS M, JANSSON M, SADEGHI B, et al. Endometrial endothelial cells are derived from donor stem cells in a bone marrow transplant recipient[J]. Hum Reprod, 2008,23(1): 139-143.
[21] IKOMA T, KYO S, MAIDA Y, et al. Bone marrow-derived cells from male donors can compose endometrial glands in female transplant recipients[J]. Am J Obstet Gynecol, 2009,201(6): 608.e1-e8.
[22] DIMITROV R, TIMEVA T, KYURKCHIEV D, et al. Characterization of clonogenic stromal cells isolated from human endometrium[J]. Reproduction, 2008,135(4): 551-558.
[23] CERVELL I, GIL-SANCHIS C, MAS A, et al. Bone marrow-derived cells from male donors do not contribute to the endometrial side population of the recipient[J]. PLoS One, 2012,7(1): e30260.
I, GIL-SANCHIS C, MAS A, et al. Bone marrow-derived cells from male donors do not contribute to the endometrial side population of the recipient[J]. PLoS One, 2012,7(1): e30260.
[24] WANG J M, JU B H, PAN C J, et al. Application of bone marrow-derived mesenchymal stem cells in the treatment of intrauterine adhesions in rats[J]. Cell Physiol Biochem, 2016,39(4): 1553-1560.
[25] MINTS M, JANSSON M, SADEGHI B, et al. Endometrial endothelial cells are derived from donor stem cells in a bone marrow transplant recipient[J]. Hum Reprod, 2008,23(1): 139-143.
[26] DING L J, LI X N, SUN H X, et al. Transplantation of bone marrow mesenchymal stem cells on collagen scaffolds for the functional regeneration of injured rat uterus[J]. Biomaterials, 2014,35(18): 4888-4900.
[27] ZHAO J, ZHANG Q, WANG Y G, et al. Rat bone marrow mesenchymal stem cells improve regeneration of thin endometrium in rat[J]. Fertil Steril, 2014,101(2): 587-594.
[28] CERVELL I, GIL-SANCHIS C, SANTAMAR
I, GIL-SANCHIS C, SANTAMAR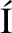 A X, et al. Human CD133+ bone marrow-derived stem cells promote endometrial proliferation in a murine model of Asherman syndrome[J]. Fertil Steril, 2015,104(6): 1552-1560.e1-3.
A X, et al. Human CD133+ bone marrow-derived stem cells promote endometrial proliferation in a murine model of Asherman syndrome[J]. Fertil Steril, 2015,104(6): 1552-1560.e1-3.
[29] ALAWADHI F, DU H L, CAKMAK H, et al. Bone Marrow-Derived Stem Cell (BMDSC) transplantation improves fertility in a murine model of Asherman’s syndrome[J]. PLoS One, 2014,9(5): e96662.
[30] NAGORI C B, PANCHAL S Y, PATEL H. Endometrial regeneration using autologous adult stem cells followed by conception by in vitro fertilization in a patient of severe Asherman’s syndrome[J]. J Hum Reprod Sci, 2011,4(1): 43-48..
[31] SANTAMARIA X, CABANILLAS S, CERVELL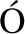 I, et al. Autologous cell therapy with CD133+bone marrow-derived stem cells for refractory Asherman’s syndrome and endometrial atrophy: A pilot cohort study[J]. Hum Reprod, 2016,31(5): 1087-1096.
I, et al. Autologous cell therapy with CD133+bone marrow-derived stem cells for refractory Asherman’s syndrome and endometrial atrophy: A pilot cohort study[J]. Hum Reprod, 2016,31(5): 1087-1096.
[32] SAHIN ERSOY G, ZOLBIN M M, COSAR E, et al. CXCL12 promotes stem cell recruitment and uterine repair after injury in asherman’s syndrome[J]. Mol Ther Methods Clin Dev, 2017,4: 169-177.
[33] KILIC S, YUKSEL B, PINARLI F, et al. Effect of stem cell application on Asherman syndrome, an experimental rat model[J]. J Assist Reprod Genet, 2014,31(8): 975-982.
[34] 祁旻龙,朱良,Yuri Ciervo,等.过表达趋化因子受体2促进脂肪间充质干细胞对皮肤损伤的修复[J].同济大学学报(医学版),2018,39(5): 23-27,33.
[35] YU W Z, NIU W B, WANG S N, et al. Co-culture with endometrial stromal cells enhances the differentiation of human embryonic stem cells into endometrium-like cells[J]. Exp Ther Med, 2015,10(1): 43-50.
[36] SONG T R, ZHAO X, SUN H X, et al. Regeneration of uterine horns in rats using collagen scaffolds loaded with human embryonic stem cell-derived endometrium-like cells[J]. Tissue Eng Part A, 2015,21(1/2): 353-361.
[37] DE L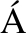 ZARO I, YILMAZER A, KOSTARELOS K. Induced pluripotent stem (iPS) cells: a new source for cell-based therapeutics?[J]. J Control Release, 2014,185: 37-44.
ZARO I, YILMAZER A, KOSTARELOS K. Induced pluripotent stem (iPS) cells: a new source for cell-based therapeutics?[J]. J Control Release, 2014,185: 37-44.
[38] TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006,126(4): 663-676.
[39] CHEN Y J, LIOU Y J, CHANG C M, et al. Reprogramming human endometrial fibroblast into induced pluripotent stem cells[J]. Taiwan J Obstet Gynecol, 2012,51(1): 35-42.
[40] PARK J H, DAHERON L, KANTARCI S, et al. Human endometrial cells express elevated levels of pluripotent factors and are more amenable to reprogramming into induced pluripotent stem cells[J]. Endocrinology, 2011,152(3): 1080-1089.