神经母细胞瘤(neuroblastoma, NB)是儿童最常见的颅外实体瘤,占所有儿童肿瘤的8%~10%,80%患儿发生在5岁以前。神经母细胞瘤具有生长迅速、早期转移、治疗效果不理想等特点。45%初发患儿为高危,由于他们在明确诊断时已经出现骨髓和骨质转移,即便经历清除手术、使用高强度化疗、放疗和干细胞移植,生存率仍然很低[1]。在前期研究中,发现高危组神经母细胞瘤儿童中出现骨质转移者生存率最低,2年总体生存率(overall survival, OS)为37.1%,2年无事件生存率(event free survival, EFS)仅为30.2%[2]。在中国,因为条件限制,缺乏神经母细胞瘤同位素治疗和GD2单抗治疗等新的措施;此外,在高危组治疗方案中有自体干细胞移植的阶段,很多患儿固不能承担其高昂费用而省略。因此,相比国外报道高危组NB患儿50%以上的5年生存率[3],目前国内同类数据明显降低。在神经母细胞瘤的动物模型中,唑来膦酸(zoledronic acid, ZA)可以抑制肿瘤的增殖[4-5];在患骨质转移的其他肿瘤儿童患者中,使用唑来膦酸初步研究显示出较好的耐受性[6]。近5年来,上海交通大学医学院附属新华医院收治的部分神经母细胞瘤伴骨质转移儿童中使用了唑来膦酸,现就其疗效进行回顾性分析总结。
1 资料与方法
1.1 一般资料
神经母细胞瘤患儿均来自上海交通大学医学院附属新华医院儿童血液肿瘤病区收治患者,诊断时间从2012年1月1日—2015年12月30日,随访截止为2018年10月30日,共36例,其中男29例,女7例,发病中位年龄21.6个月(10个月~13岁)。根据疾病诊断标准,病理加影像或者骨髓涂片流式细胞加影像确诊为神经母细胞瘤,通过骨髓涂片及流式细胞及影像学证实为Ⅳ期患者,最后使用骨扫描或PETCT评估确认存在骨质转移,明确诊断后纳入中国儿童神经母细胞瘤协作组高危组治疗方案,治疗后疾病进展的患者则进入个体化化疗方案。其中有13例在化疗后期加用唑来膦酸。使用唑来膦酸的方案获得上海交通大学医学院附属新华医院伦理委员会同意。唑来膦酸使用前征得患儿监护人和适龄儿童同意,并签署知情同意书。
1.2 使用方法
唑来膦酸注射液(商品名: 天晴依泰,中国正大天晴药业集团股份有限公司,国药准字H20041346,规格4mg/5mL)单次剂量2.3mg/m2,于化疗前1d 加入生理盐水100mL给予静脉滴注,随后静脉滴注500mL葡萄糖电解质液及0.1g/kg葡萄糖酸钙注射液(最大剂量为1g),间隔21~28d。对于结束强化疗的儿童,进入随访期后,唑来膦酸每2个月1次。
所有入组患儿记录其年龄、性别、身高、体质量等一般情况,诊断时间、疾病原发部位、转移部位、化疗疗程及剂量,放疗时间、手术时间、自体干细胞移植时间、Nmyc基因扩增程度、生化指标、严重事件发生时间,计算并比较唑来膦酸组及常规化疗患儿组之间的无事件生存时间及总体生存时间OS。
1.3 统计学处理
检验数据以![]() 表示,使用EXCEL、SPSS11.0软件及OpenEpi Version 2.3.1[7]对数据进行统计分析。计数资料使用χ2检验,计量成组资料使用独立t检验,化疗前后剂量数据比较使用配对t检验,组间比较使用ANOVA。生存分析使用SPSS软件。P<0.05为差异有统计学意义。
表示,使用EXCEL、SPSS11.0软件及OpenEpi Version 2.3.1[7]对数据进行统计分析。计数资料使用χ2检验,计量成组资料使用独立t检验,化疗前后剂量数据比较使用配对t检验,组间比较使用ANOVA。生存分析使用SPSS软件。P<0.05为差异有统计学意义。
2 结 果
2.1 骨质转移神经母细胞瘤儿童临床资料及生存状态
36例骨质转移神经母细胞瘤儿童情况如表1所示。91.6%接受了手术切除,22.2%接受了自体干细胞移植,随访时间8~72个月,中位生存时间为41.1个月;5年EFS为13.3%,OS为32.5%。唑来膦酸组和常规化疗组患者在性别方面存在差异,但在年龄、Nmyc基因扩增、放疗、手术、接受自体干细胞移植治疗方面无显著差异。唑来膦酸组患者中3例无瘤存活,7例带瘤存活,3例死亡;中位生存时间为61.4个月;5年EFS和OS分别是23.1%和65.9%。而23例传统化疗患者,4例无瘤存活,19例死亡;中位生存时间为30.0个月;5年EFS及OS分别为11.5%和13%。两组患者的OS存在显著性差异(P=0.001),见图1。
2.2 唑来膦酸在儿童中使用的不良反应
唑来膦酸组每年身高增长均值为3.69cm,体重增长均值为1.95kg,而常规化疗组患儿身高及体重增长均值分别是3.88cm(P=0.650)和2.1kg(P=0.711),提示两组患者在生长发育方面无显著性差异。唑来膦酸组患者使用唑来膦酸前后血清碱性磷酸酶的水平也无显著性差异[(193.0±65.9) vs (182.4±55.0) U/L,P=0.474]。唑来膦酸组患者在接受唑来膦酸治疗后出现轻微的副作用,如发热、骨痛和肝功能损害,未发现严重肾功能损害或者下颌骨坏死的病例,见表2。
表1 骨质转移神经母细胞瘤患儿的临床特征
Tab.1 Characteristics of bone metastatic neuroblastoma cases
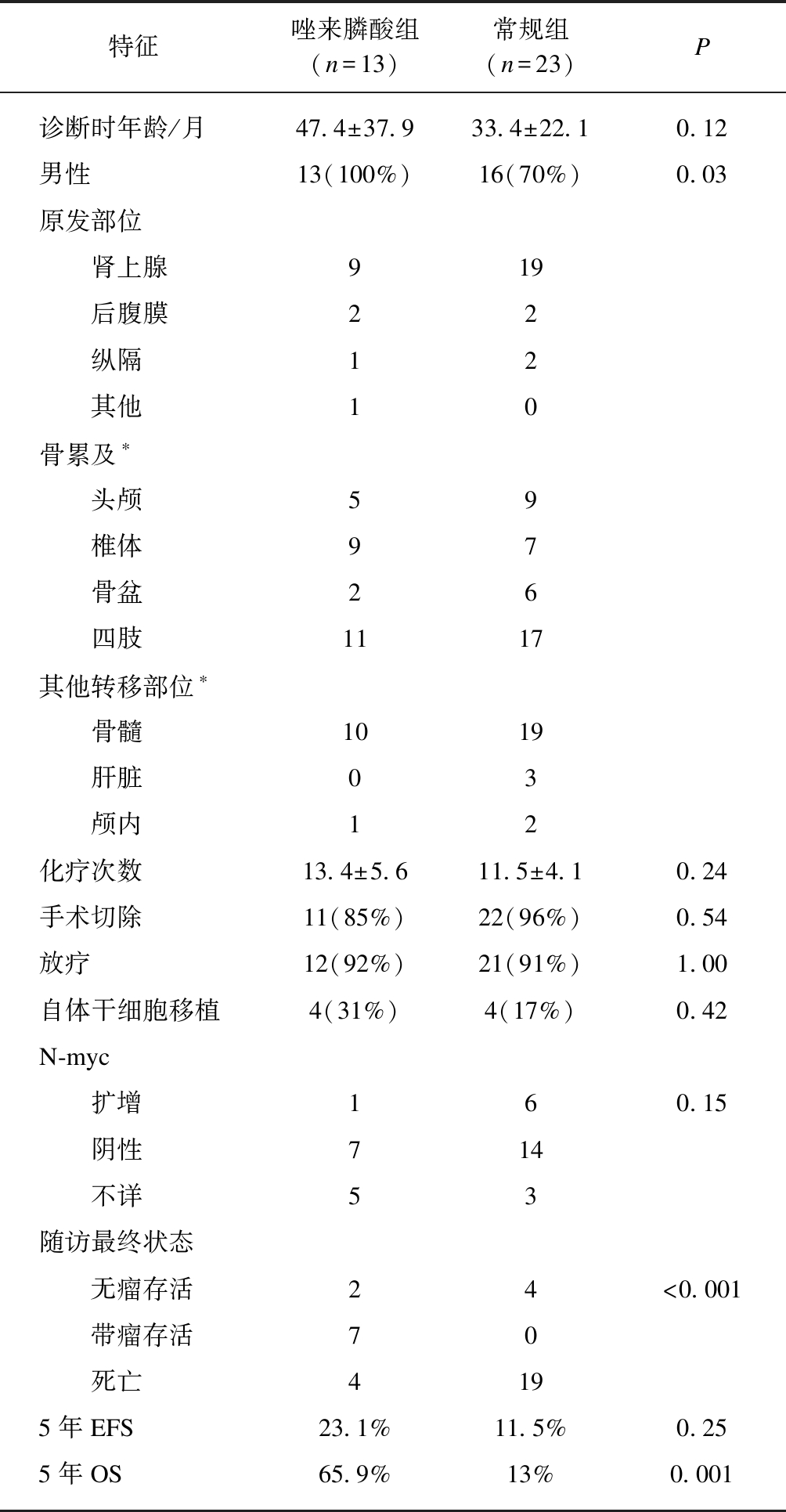
特征唑来膦酸组(n=13)常规组(n=23)P诊断时年龄/月47.4±37.933.4±22.10.12男性13(100%)16(70%)0.03原发部位 肾上腺919 后腹膜22 纵隔12 其他10骨累及 头颅59 椎体97 骨盆26 四肢1117其他转移部位 骨髓1019 肝脏03 颅内12化疗次数13.4±5.611.5±4.10.24手术切除11(85%)22(96%)0.54放疗12(92%)21(91%)1.00自体干细胞移植4(31%)4(17%)0.42N-myc 扩增160.15 阴性714 不详53随访最终状态 无瘤存活24<0.001 带瘤存活70 死亡4195年EFS23.1%11.5%0.255年OS65.9%13%0.001
*骨累及和其他转移计算时存在同一患儿多个部位同时侵犯,因此总数大于总人数
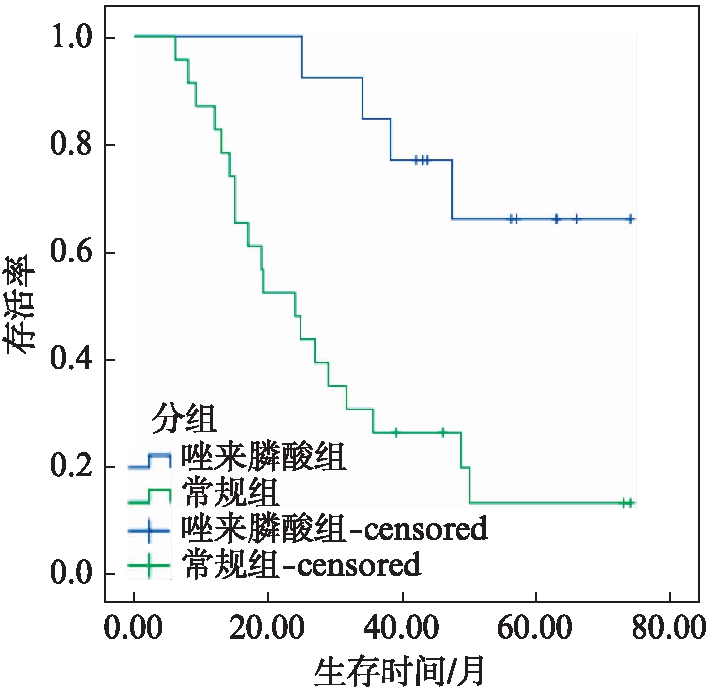
图1 骨质转移的神经母细胞瘤患儿生存曲线
Fig.1 Survival analysis in neuroblastoma patients with bone metastasis
表2 唑来膦酸的不良反应发生率
Tab.2 The incidence rate of adverse effects of Zoledronic acid
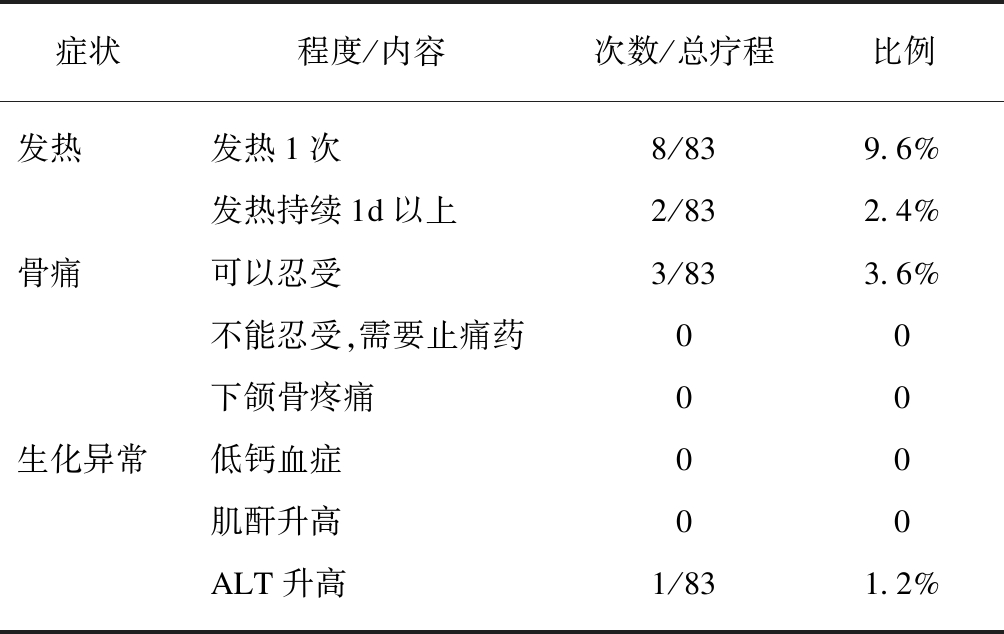
症状程度/内容次数/总疗程比例发热发热1次8/839.6%发热持续1d以上2/832.4%骨痛可以忍受3/833.6%不能忍受,需要止痛药00下颌骨疼痛00生化异常低钙血症00肌酐升高00ALT升高1/831.2%
3 讨 论
唑来膦酸是抗代谢性骨病的一类药物,主要作用是抑制因破骨细胞的活性增加而导致的骨吸收,用于治疗骨质疏松症、变形性骨炎、恶性肿瘤骨质转移相关的高钙血症和骨痛等。研究发现它不仅抑制破骨细胞,同时减少破骨细胞诱导的促有丝分裂因子如胰岛素样生长因子、TGFβ等分泌,从而延缓骨质内肿瘤细胞的增殖并促其凋亡[8]。进一步研究还发现唑来膦酸在抗肿瘤免疫中有一定作用: 肿瘤细胞内吞入唑来膦酸后形成ATP分解类似物,能促进T细胞增殖,驱使γδT细胞向癌细胞移动,继而抑制癌细胞的生长[9]。此外,发现唑来膦酸可以诱导乳腺癌患者肿瘤生长通路中很多相关microRNA的表达,从而抑制肿瘤的增殖[10]。唑来膦酸已经批准用于乳腺癌及前列腺癌骨质转移的患者,研究证实,在绝经后乳腺癌患者中早期使用双磷酸盐可以明显延长无事件生存期及总体生存期,甚至在无骨质转移的患者中使用也有益处[11]。
神经母细胞瘤在儿童中发病率高而且治疗效果比较差,早期就会发生骨髓及骨质转移。动物实验发现在骨质转移的神经母细胞瘤的动物中联合使用唑来膦酸和化疗药物可以抑制肿瘤的增殖和生存,效果比单纯使用化疗药物更显著[12]。因此,唑来膦酸在儿童神经母细胞瘤中应用也引起了研究者及临床医师的兴趣。虽然成人临床试验发现长期使用具备安全性[13],但是儿童中尚无唑来膦酸的使用说明。在本研究中,大部分病例是在化疗中或者化疗结束后出现疾病进展,明显骨痛或者骨扫描发现骨质病变加重,经监护人同意后,排除严重龋齿等口腔疾病,在化疗的同时加入唑来膦酸。还有部分儿童(4例)是由于初治时骨质病变显著,家长有强烈治疗愿望。唑来膦酸半衰期较长,达167h,主要通过肾脏排泄。而初发患儿肿瘤负荷较高,且化疗敏感。为减少对肝肾功能的影响,本研究选择在肿瘤负荷比较小的第5个化疗疗程开始给予唑来膦酸。
曾经有在儿童肿瘤患者使用唑来膦酸的初步实验,提示耐受剂量为2.3mg/m2[6],但也有建议可以用到4mg/m2[14]。本研究应用唑来膦酸2.3mg/m2每疗程,总唑来膦酸的疗程达4~11次。治疗过程中有较多的轻微发热和轻微骨痛,未见有下颌骨痛、电解质紊乱、肝肾功能受损的副反应。在本研究中,唑来膦酸组儿童平均年身高增长及体重增长与同期接受化疗的患儿相当;儿童一般因成骨活动活跃所以碱性磷酸酶比较高,唑来膦酸使用前后患儿的碱性磷酸酶没有差异,这些说明短期内唑来膦酸不影响儿童骨骼的生长发育。有报道唑来膦酸在儿童中主要副反应是导致骨髓抑制[14]。既往研究[15]发现神经母细胞瘤高危组儿童化疗后Ⅳ级骨髓抑制率已经超过90%,因此加用唑来膦酸无法进一步观察其骨髓抑制率。不过在强化疗结束后再单独应用唑来膦酸的病例中并未发现明显的骨髓抑制。
从临床治疗效果来看,唑来膦酸组的患者比同期常规化疗患者在总体生存率有显著性的提高,5年OS高达65.9%,说明唑来膦酸在体内环境中抑制神经母细胞瘤增殖、延缓病程方面有很明显的益处,与动物实验结果一致[5]。当然,目前研究的病例数较少,也非双盲对照,往往愿意使用唑来膦酸的患儿家长治疗意愿高且依从性高,可能也会导致两组OS出现差异。与此同时,本研究发现两组患者EFS不存在显著差异,一方面是由于唑来膦酸组的患者大部分是复发后加入治疗的,只有4例是未复发就开始治疗的,混杂因素多;另一方面体外实验发现唑来膦酸活化γδT淋巴细胞的同时也活化了抑制性T细胞,因此对神经母细胞的杀伤作用随时间延长有减弱[16],这也可以解释唑来膦酸组患者带瘤生存者较多。由于唑来膦酸本身非细胞毒性药物,因此主要作用是减少骨质内肿瘤细胞的增殖,还需要合理的合并用药或其他治疗措施来彻底杀伤肿瘤细胞,尤其是骨质外的病灶。
由于神经母细胞瘤的化疗周期长,且需要手术、放疗等综合治疗,使本病往往成为家庭沉重负担。同期患者中,有3例晚期患儿诊断明确后即放弃治疗(未纳入统计)。虽然自体干细胞移植对高危神经母细胞瘤患儿的长期生存有益,但是由于自体干细胞移植费用高达数十万人民币,本研究病例中接受自体干细胞移植的患者不到1/3。目前常用于成人肿瘤的靶向药物及小分子核酸药物[17]价格更加昂贵,且在儿童神经母细胞瘤中使用不成熟。而唑来膦酸的价格在中国和一般的化疗药相似,经济负担小。从目前的研究来看,在骨质转移的高危组神经母细胞瘤儿童中多次使用唑来膦酸能稳定骨质转移病灶、抑制肿瘤增殖,可能提高此类患儿的总体生存率;且中等剂量唑来膦酸在儿童中耐受度好,未见严重并发症。因此,可以认为唑来膦酸是儿童骨质转移神经母细胞瘤治疗中较有前景的一类药物。当然,唑来膦酸在骨质转移神经母儿童中的使用的方式、时机、剂量、次数及远期效果都是还待探讨的问题,值得进一步开展更大规模的前瞻性随机对照临床实验。
[1] MARIS J M, HOGARTY M D, BAGATELL R, et al. Neuroblastoma[J]. Lancet, 2007,369(9579): 2106-2120.
[2] 安霞, 袁晓军, 谈珍, 等.儿童神经母细胞瘤骨转移临床分析[J].新乡医学院学报, 2014,31(12): 994-998.
[3] COUGHLAN D, GIANFERANTE M, LYNCH C F, et al. Treatment and survival of childhood neuroblastoma: evidence from a population-based study in the United States[J]. Pediatr Hematol Oncol, 2017,34(5): 320-330.
[4] B CKMAN U, SVENSSON A, CHRISTOFFERSON R H, et al. The bisphosphonate, zoledronic acid reduces experimental neuroblastoma growth by interfering with tumor angiogenesis[J]. Anticancer Res, 2008,28(3A): 1551-1557.
CKMAN U, SVENSSON A, CHRISTOFFERSON R H, et al. The bisphosphonate, zoledronic acid reduces experimental neuroblastoma growth by interfering with tumor angiogenesis[J]. Anticancer Res, 2008,28(3A): 1551-1557.
[5] DICKSON P V, HAMNER J B, CAUTHEN L A, et al. Efficacy of zoledronate against neuroblastoma[J]. Surgery, 2006,140(2): 227-235.
[6] GOLDSBY R E, FAN T M, VILLALUNA D, et al. Feasibility and dose discovery analysis of zoledronic acid with concurrent chemotherapy in the treatment of newly diagnosed metastatic osteosarcoma: a report from the Children’s Oncology Group[J]. Eur J Cancer, 2013,49(10): 2384-2391.
[7] SULLIVAN K M, DEAN A, SOE M M. OpenEpi: a web-based epidemiologic and statistical calculator for public health[J]. Public Health Rep, 2009,124(3): 471-474.
[8] MUNDY G R, YONEDA T, HIRAGA T. Preclinical studies with zoledronic acid and other bisphosphonates: impact on the bone microenvironment[J]. Semin Oncol, 2001,28(2 Suppl 6): 35-44.
[9] NUSSBAUMER O, GRUENBACHER G, GANDER H, et al. Essential requirements of zoledronate-induced cytokine and γδ T cell proliferative responses[J]. J Immunol, 2013,191(3): 1346-1355.
[10] FANALE D, AMODEO V, BAZAN V, et al. Can the microRNA expression profile help to identify novel targets for zoledronic acid in breast cancer?[J]. Oncotarget, 2016,7(20): 29321-29332.
[11] HADJI P, COLEMAN R E, WILSON C, et al. Adjuvant bisphosphonates in early breast cancer: consensus guidance for clinical practice from a European Panel[J]. Ann Oncol, 2016,27(3): 379-390.
[12] PENG H J, SOHARA Y, MOATS R A, et al. The activity of zoledronic Acid on neuroblastoma bone metastasis involves inhibition of osteoclasts and tumor cell survival and proliferation[J]. Cancer Res, 2007,67(19): 9346-9355.
[13] HORTOBAGYI G N, ZHENG M, MOHANLAL R. Indirect evaluation of bone saturation with zoledronic acid after long-term dosing[J]. Oncologist, 2019,24(2): 178-184.
[14] RUSSELL H V, GROSHEN S G, ARA T, et al. A phase I study of zoledronic acid and low-dose cyclophosphamide in recurrent/refractory neuroblastoma: A new approaches to neuroblastoma therapy (NANT) study[J]. Pediatr Blood Cancer, 2011,57(2): 275-282.
[15] 谈珍,张勤,盛琦,等.神经母细胞瘤高危组患儿化学治疗后外周血细胞改变及严重感染相关因素的分析[J].上海交通大学学报(医学版),2017,37(3): 377-380.
[16] PRESSEY J G, ADAMS J, HARKINS L, et al. In vivo expansion and activation of γδ T cells as immunotherapy for refractory neuroblastoma: A phase 1 study[J]. Medicine (Baltimore), 2016,95(39): e4909.
[17] 洪雷鸣,秦环龙.小核酸药物抗肿瘤的研究进展[J].同济大学学报(医学版),2017,38(4): 123-127.