骨显像检查作为肿瘤患者随访肿瘤骨转移检查的常规项目。肿瘤患者除局部的骨解剖结构改变以外,由于内分泌系统的代谢改变及放化疗等因素使得骨质疏松的发生率远高于正常人群[1]。骨质疏松是一种以骨量减低、骨组织细微结构破坏为主要特征的全身性骨骼疾病,继而会增加脆性骨折的发生率[2]。肿瘤骨转移是乳腺肿瘤、前列腺肿瘤等常见的早期转移途径,且转移早期多无明显症状[3-4],SPECT/CT骨显像是探测早期骨转移较为灵敏的一项检查。肿瘤患者术后甚至是一些非肿瘤患者术后,因手术应激等原因也会引起相关骨代谢改变,增加骨质疏松的患病可能[5]。双光能X射线吸收法测量骨密度(bone mineral density, BMD)是现诊断骨质疏松的最佳定量指标[6],但其评价的部位、诊断的内容有限;而SPECT/CT骨显像在发现骨转移等局部病灶的同时,特征性部位的显像剂浓聚,可反映全身骨骼代谢情况[7]。本研究对SPECT/CT骨显像诊断骨质疏松的正确率、灵敏度进行分析,探讨SPECT/CT骨显像作为肿瘤患者随访检查的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析同济大学附属第十人民医院核医学科2018年5月—2018年10月,均已行骨密度测量和骨显像检查的研究对象104例。104例患者中,骨显像诊断为骨质疏松的患者80例,男9例,女71例,平均年龄(64.91±11.34)岁;诊断为骨质正常24例,男7例,女17例,平均年龄(55.04±15.69)岁。双光能X射线吸收法诊断为骨质疏松的患者56例,男5例,女51例,平均年龄(65.92±11.59)岁;诊断为骨质减低有23例,男5例,女18例,平均年龄(64.13±9.46)岁;诊断为骨质正常12例,男3例,女9例,平均年龄(50.75±11.59)岁。
1.2 检查方法
1.2.1 SPECT/CT骨显像检测方法 (1) 扫描仪器: 采用美国GE公司的Discovery NM/CT 670机型,该扫描仪同机CT为16排螺旋CT,对所选择的层面进行常规扫描可达到诊断级的要求。(2) 显像方法: 患者行全身骨显像和SPECT/CT局部断层融合显像检查时,经手背静脉注射99mTc-MDP(上海欣科医药有限公司),成人注射剂量为(7.4~9.25)×108Bq,3h排空膀胱后仰卧于扫描床上,以12~18cm/min的扫描速度从头到足一次性采集,常规采集获得前位和后位2幅图像。根据前后位图像中的有效信息选择进行断层扫描,以病灶或感兴趣部位为中心行SPECT/CT局部断层融合显像,首先行10min透射扫描,即CT采集,矩阵256×256,层厚5mm,扫描参数为120kV,200mA,得到约130个横断面,完成CT透射扫描后,探头自动复位,随后行16min发射扫描,即SPECT采集,360°采集,6°/帧,每帧25s,矩阵128×128,放大倍数1.28。(3) 图像重建和融合: SPECT图像采用迭代重建法,作衰减校正,层厚3.45mm,计算机图像重建处理后获得横断面、冠状面和矢状面,再利用软件自动实现SPECT/CT图像的同机融合,最终得到CT、SPECT和SPECT/CT融合图像。
1.2.2 双光能X射线骨密度测定检测方法 (1) 骨密度测定仪器: 采用美国GE公司的Discovery全身型双光能X线骨密度仪。(2) 检查方法: 测量前输入患者的身高、体质量、年龄、性别等基本信息,患者取仰卧曲膝固定位,应用骨密度仪对受试者的第1~4腰椎进行骨密度测量;再取右下肢内旋位,测量股骨上端包括股骨颈、大转子、股骨干部位的骨密度,计算出全髋骨密度。扫描时注意避开骨折、骨压缩变形、受损椎骨、椎体术后和人工髋关节置换术的部位。
1.3 诊断标准
1.3.1 双光能X射线骨密度测定诊断标准 临床上由于不同的骨密度检测仪的绝对值不同,通常使用T值作为骨质变化的评价标准[8],具体如下。正常: T值≥-1.0;骨量减少: -1.0 1.3.2 骨显像的骨质疏松诊断标准 由两位核医学科高年资医师共同阅片,对图像进行审阅,除图像资料外,患者的主诉、体征、相关辅助检查等临床资料均提供给医师参考。根据CT和SPECT融合图像中骨骼功能代谢和解剖结构的改变,并结合患者症状、病史、临床检查结果等作出诊断,若意见不一致时,由两位医师协商后确诊。 显像剂99mTc-MDP通过化学吸附,与骨骼结合可反映骨的代谢状况及新骨形成情况。全身骨显像显示: 颅骨放射性弥漫性增高呈“头盔样”;胸骨放射性增浓呈“领带样”;脊柱椎体显像剂放射性欠均匀分布,双侧肋骨放射性分布稀疏,双肾及膀胱显影浅淡等影像学特征;满足以上3项表现者即可诊断为骨质疏松。 1.3.3 肿瘤骨转移诊断标准 SPECT/CT诊断骨转移阳性病变标准: SPECT图像示左右不对称的不规则形状异常放射性浓聚或缺损灶,伴CT图像上相应部位见骨质破坏者诊断为骨转移阳性;无骨质破坏但患者有骨痛症状者被判为骨转移阳性。诊断骨转移可能的标准是: SPECT图像见放射性浓聚或缺损灶左右不对称、形状不规则,CT图像上未见骨质破坏、软组织肿块,患者未觉骨痛。诊断为良性病变标准: 放射性浓聚灶左右对称且位于腰骶关节、骶髂关节等处的代谢相关征象;或肋骨处的放射性浓聚灶呈类圆形,患者未觉骨痛,或有创伤、非病理性骨折史。所有影像诊断均经临床随访、或病理穿刺结果证实后,最终明确诊断。 采用SPSS 20.0进行相关的统计学分析,定量资料以 104例患者中,骨显像与骨密度皆诊断为骨质疏松的患者54例,同时诊断为骨质正常的患者9例;骨显像诊断正常而骨密度诊断为骨质疏松的患者有2例,骨显像诊断为骨质疏松而骨密度诊断为骨质正常的患者有3例,见表1。经SPSS 20.0软件对样本进行一致性检验分析,得Kappa系数为0.738,表示在测量腰椎和股骨骨质变化上,骨显像与骨密度测定法对于骨质疏松的诊断具有较好的一致性。 表1 两种检查方法诊断骨质变化的结果统计 Tab.1 Results of two examination methods for diagnosing bone changes 骨显像骨密度骨质疏松骨量减低骨质正常合计骨质疏松5423380骨质正常213924合计563612104 以骨密度测定结果结合患者体征、临床随访作为诊断骨质疏松的金标准,对表2中的两种方法检测出的骨质疏松和骨质正常患者人数进行分析,骨显像诊断骨质疏松的灵敏度为96%;特异度为75%;误诊率为25%;漏诊率为3%;正确率为92%。结果表明,SPECT骨显像诊断骨质疏松的准确度高,临床应用价值较好。 两种检测方法交叉诊断时会出现两种诊断结果不同步情况。图1A为SPECT骨显像诊断骨质疏松的真阳性情况下,同时骨密度检查为假阴性。该临床诊断为股骨头坏死、骨质疏松,但骨密度未诊断为骨质疏松,可能由于受骨密度诊断仅取局部骨密度测量的影响;此患者SPECT骨显像上“黑颅征”,“领带征”等骨质疏松征象明显,另髋部局部病灶高代谢,加做SPECT/CT融合显像示病灶局部结构清晰,图1B与图1A为同一患者。可见患者右侧股骨局部高代谢合并解剖结构破坏。图1C患者骨显像与骨密度诊断骨质疏松为阴性,骨显像上未见骨质疏松相关的征象,临床随访骨质疏松情况也为阴性。图1D患者骨密度诊断为骨量减低,SPECT图像上可见骨质疏松征象,诊断为骨质疏松。 图1 患者SPECT/CT骨显像图 104例患者中有55例肿瘤患者,其中47例乳腺癌患者,2例前列腺癌患者,其余肿瘤患者6例。55例肿瘤患者中,43例平扫后加做局部断层,其中22例诊断骨转移阳性,4例诊断为骨转移阳性可能。后期经病理或临床随访均证实22例骨转移阳性患者确诊肿瘤骨转移诊断。几种类型肿瘤中骨显像发现骨转移的检出率结果见表2。 表2 不同类型肿瘤骨转移的阳性率 Tab.2 Positive rate of bone metastases in different types of tumors 肿瘤类型检查量影像诊断骨转移阳性数确诊骨转移人数阳性率乳腺癌 47151531.9%前列腺癌 222100%胃癌 111100%子宫内膜癌1000%甲状腺癌 21150%肺癌 21150%合计 55202036.3% 选取研究对象中最好发骨转移的乳腺癌患者,初步分析乳腺癌患者骨质疏松的发病人数,47例乳腺癌患者中,骨质疏松22例,患病率为47%。 骨质疏松起病隐匿,潜在风险大,其早期诊断具有重要意义。在本研究中,骨显像诊断骨质疏松的灵敏度为96%,正确率为92%。骨密度诊断为骨量减低的36例患者中,23例经SPECT骨显像诊断为骨质疏松,主要原因考虑为骨质疏松形成早期,骨吸收与骨再建间的平衡失调及骨矿物质丢失,成骨活动增多从而骨显像剂摄取增多表现为特征部位的显像剂浓聚,但其骨量丢失的程度未达到骨密度测定诊断为骨质疏松的标准,SPECT骨显像的显像剂浓聚在骨密度改变之前,骨代谢活性的变化引起可见的放射性升高[9]。骨密度测定限于其检查部位仅为腰椎和髋关节,腰椎退行性变引起的脊柱部位骨钙沉积、腹主动脉钙化等改变都会影响其测量结果[10]。骨密度测定探测的只是腰椎和股骨的情况,而全身的骨质变化并不同步[11],颅骨、胸骨、腰椎早于肋骨、股骨发生骨质代谢改变[12]。 在本研究的55例肿瘤患者中,检出骨质疏松42例,骨转移阳性患者20例,骨转移阳性率为36.3%,体现了SPECT/CT骨显像作为肿瘤患者随访项目检测骨转移的必要性。SPECT/CT骨显像能够显示全身骨骼,反映骨骼的骨质变化及病灶、转移灶的具体部位,结合代谢情况,大多可以定性,作为骨质疏松的诊断或补充诊断,具有肯定的临床价值[13]。同时,SPECT/CT显像还可显示肿瘤的淋巴结浸润、转移情况[14-15]。乳腺癌患者47%的骨质疏松患病率,表明乳腺癌患者与继发骨质疏松具有较高的相关性,有进行随访的必要。 SPECT/CT骨显像不仅可以反映全身骨骼代谢改变情况,还有助于检出代谢性骨病相关的局部并发症,如椎体压缩性骨折、微小骨折、骨坏死等,克服了骨密度检查时测量结果受腰椎退行性变的影响[16]。SPECT/CT骨显像并非诊断骨质疏松症的金标准,但对于恶性肿瘤患者伴发骨质疏松症、骨质疏松伴骨折与骨转移瘤的鉴别诊断等方面可提供重要的临床参考意义[17]。SPECT/CT显像观测到的肿瘤转移情况可对肿瘤进行进一步精确的分级、分期,指导临床治疗[18]。对于骨质疏松患者常见的背痛表现,SPECT/CT显像可用于筛查病因,明确诊断[19]。 因SPECT/CT骨显像与骨密度测定对于诊断骨质疏松具有较好的相关性,SPECT/CT骨显像同时是乳腺癌、前列腺癌患者随访肿瘤转移情况的常规检查,所以在好发骨转移的肿瘤患者术后随访中,SPECT/CT骨显像可以替代骨密度测定诊断骨代谢疾病。 综上所述,SPECT/CT骨显像和骨密度测定诊断骨质疏松均较准确,两者间具有较好的一致性,同时SPECT/CT骨显像诊断骨质疏松具有更高的灵敏度。对于好发骨转移的肿瘤患者随访,SPECT/CT显像可替代骨密度测定诊断骨质疏松,能够减少患者的检查成本,降低患者受到的辐射损害。尽管如此,SPECT/CT骨显像仍具有一定局限性,有待下一步进行更深入的研究;同时,还存在当前的融合图像处理技术有伪影、本底显影较强等不足。相信随着医疗技术的发展及与相关技术理论的进一步融合,SPECT/CT骨显像在骨骼系统疾病的诊断中将发挥更大的作用。 [1] BODY J J, TERPOS E, TOMBAL B, et al. Bone health in the elderly cancer patient: A SIOG position paper[J]. Cancer Treat Rev, 2016,51: 46-53. [2] 张长青.股骨头缺血性坏死治疗及其争议[J].同济大学学报(医学版),2009,30(2): 1-5. [3] MAHALETCHUMY T, ABAZIZ A. Incremental value of single-photon emission computed tomography-computed tomography for characterization of skeletal lesions in breast cancer patients[J]. World J Nucl Med, 2017,16(4): 303-310. [4] COMPSTON J, COOPER A, COOPER C, et al. UK clinical guideline for the prevention and treatment of osteoporosis[J]. Arch Osteoporos, 2017,12(1): 43. [5] 张织茵,盛辉.代谢性手术对骨密度影响的研究进展[J].同济大学学报(医学版),2018,39(4): 124-128. [6] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011年)[J].2011,4(1): 2-17. [7] 戴生,冯坤,牛庆亮,等.SPECT骨显像评价骨质疏松的临床价值[J].中国骨质疏松杂志,2013,19(9): 938-940. [8] HOUGH S. The diagnosis of osteoporosis[J]. J Endocrinol Metab Diabet South Africa, 2012,17(2): 67-68. [9] SOININVAARA T, NIKOLA T, VANNINEN E, et al. Bone mineral density and single photon emission computed tomography changes after total knee arthroplasty: a 2-year follow-up study[J]. Clin Physiol Funct Imaging, 2008,28(2): 101-106. [10] ENSRUD K E, CRANDALL C J. Osteoporosis[J]. Ann Intern Med, 2017,167(3): ITC17-ITC32. [11] OSORIO J. Osteoporosis: not all BMD is created equal[J]. Nat Rev Rheumatol, 2016,12(4): 192. [12] PAPAIOANNOU A, KENNEDY C. Diagnostic criteria for osteoporosis should be expanded[J]. Lancet Diabetes Endocrinol, 2015,3(4): 234-236. [13] ZHAO Z, LI L, LI F L, et al. Single photon emission computed tomography/spiral computed tomography fusion imaging for the diagnosis of bone metastasis in patients with known cancer[J]. Skeletal Radiol, 2010,39(2): 147-153. [14] KRZHIVITSKII P I, NOVIKOV S N, KANAEV S V, et al. The use of single-photon emission computed tomography-computed tomography in detecting multiple metastatic lymph nodes in patients with breast cancer[J]. Nucl Med Commun, 2019,40(2): 169-174. [15] NOVIKOV S N, KRZHIVITSKII P I, KANAEV S V, et al. Axillary lymph node staging in breast cancer: clinical value of single photon emission computed tomography-computed tomography(SPECT-CT) with 99mTc-methoxyisobutylisonitrile[J]. Ann Nucl Med, 2015,29(2): 177-183. [16] LI Y B, ZHENG X, WANG R, et al. SPECT-CT versus MRI in localizing active lesions in patients with osteoporotic vertebral compression fractures[J]. Nucl Med Commun, 2018,39(7): 610-617. [17] 邱慧敏,蔡海东,陆思绮,等.骨密度测定对恶性肿瘤与骨质疏松的相关性评价[J].同济大学学报(医学版),2008,29(5): 132-134. [18] PALMEDO H, MARX C, EBERT A, et al. Whole-body SPECT/CT for bone scintigraphy: diagnostic value and effect on patient management in oncological patients[J]. Eur J Nucl Med Mol Imaging, 2014,41(1): 59-67. [19] COOK G J, HANNAFORD E, SEE M, et al. The value of bone scintigraphy in the evaluation of osteoporotic patients with back pain[J]. Scand J Rheumatol, 2002,31(4): 245-248.1.4 统计学处理
![]() 表示。应用配对四格表进行一致性检验分析,分析两种检查手段的特异度、灵敏度、假阳性率(误诊率)、假阴性率(漏诊率)、正确率。采用Kappa系数分析SPECT骨显像诊断结果与骨密度测定结果的一致性。
表示。应用配对四格表进行一致性检验分析,分析两种检查手段的特异度、灵敏度、假阳性率(误诊率)、假阴性率(漏诊率)、正确率。采用Kappa系数分析SPECT骨显像诊断结果与骨密度测定结果的一致性。2 结 果
2.1 SPECT骨显像与骨密度交叉诊断骨质疏松结果
2.2 SPECT骨显像诊断骨质疏松结果评价
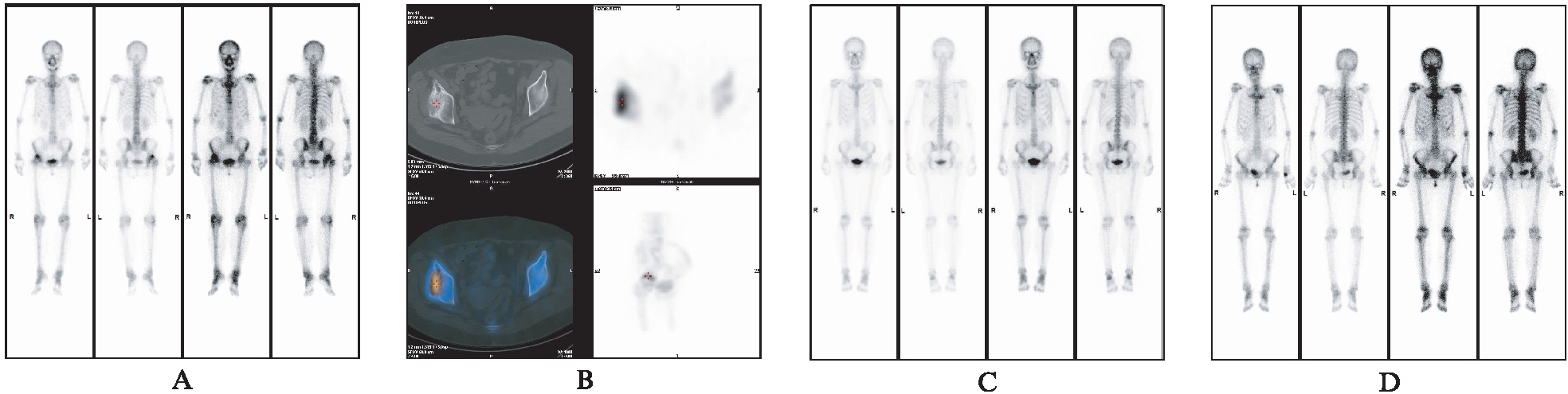
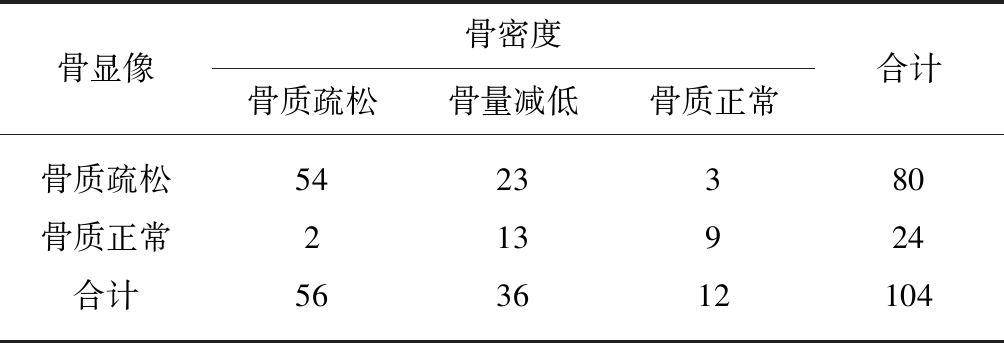
Fig.1 SPECT/CT bone imaging diagrams of patients
A: 骨质疏松合并股骨头坏死全身SPECT骨显像;B: 股骨头坏死局部SPECT/CT融合显像;C: 骨质疏松阴性患者SPECT骨显像;D: 骨质疏松阳性患者SPECT骨显像2.3 SPECT/CT骨显像发现肿瘤骨转移结果评价
2.4 乳腺癌患者骨质疏松的患病率
3 讨 论