现阶段,肺癌仍是世界上发病率和死亡率最高的恶性肿瘤。2004年,WHO根据组织形态学特性,将肺癌分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC)两大类,其中NSCLC占80%~85%[1-2]。正电子发射型电子计算机断层(positron emission computed tomography, PET)是一种功能代谢显像,可以从分子水平显示机体及病灶组织细胞的代谢、增殖、功能、血流和受体分布状况。PET/CT是将PET和CT融合为一体,由PET提供病灶详尽的功能与代谢等分子信息,而CT提供病灶精确的解剖定位,一次显像即可获得全身各方位的断层图像,应用于临床各种肿瘤的诊断,对于全身整体状况可一目了然[3]。
本研究收集在同济大学附属第十人民医院核医学中心行18F-FDG PET/CT显像且术后病理结果证实为初诊NSCLC患者的PET/CT影像,分析NSCLC的原发灶影像特征、肿瘤影消失率(tumor disappearance rate, TDR)和最大标准摄取值(maximum standard uptake value, SUVmax)与纵隔淋巴结转移、远处转移及肿瘤病理类型之间的关系,探讨18F-FDG PET/CT对NSCLC侵袭性的预测价值。
1 资料及方法
1.1 一般资料
回顾性分析2015年8月—2017年12月行18F-FDG PET/CT显像并经病理学检查确诊为NSCLC的患者122例(共122个病灶)。其中男性80例,女性42例;平均年龄(63.9±11.22)岁。患者其他一般资料见表1。根据转移情况将患者分为无转移组(n=34)、有转移组(n=88,有淋巴结转移或者远处转移),分别比较患者的年龄、性别、病灶位置、影像学分型、病理学分型差异是否存在统计学意义。
表1 患者一般资料
Tab.1 Patients’ general data

观察项目数值确诊肺癌方式 原发灶切除36 原发灶穿刺活检56 支气管镜活检22 转移灶穿刺活检并免疫组化8无转移∶有淋巴结或远处转移34∶88确诊转移方式 淋巴结手术切除病理8 淋巴结穿刺活检病理12 转移灶穿刺活检病理14 其他影像学亦发现转移特征50 随访病灶明显增多、变大4肿瘤影像学分型 周围型肺癌96 中央型肺癌26肿瘤组织学分型 非小细胞肺癌122 腺癌88 鳞癌26 腺鳞癌6 类癌2
1.2 检查方法
使用联影公司光导uMI 510 PET/CT,对患者行PET/CT+屏气状态下肺部薄层CT扫描。18F-FDG由上海原子科兴药业有限公司生产提供,药物放化纯度>95%。检查前患者禁食6h以上,控制血糖水平在显像药物注射前<11.0mmol/L,注射剂量为3.70~5.55MBq(0.10~0.15mCi)/kg,静脉注射18F-FDG后平静休息60min。扫描时患者一般采取仰卧位,扫描范围为颅底至股骨上1/3处。选择检查范围后进行螺旋CT扫描,条件为管电压140kV,管电流200~250mAs,层厚5.0mm。之后分4~5个床位采集全身PET图像,每床位采集时间为2~5min。PET图像重建参数常规使用OSEM,图像衰减校正采用CT扫描数据。CT重建采用标准重建法,重建层厚为5mm,将PET和CT图像传送到Ulead后处理工作站,进行帧对帧图像对位融合显示。
1.3 图像分析
病灶经两位有PET/CT诊断经验的高年资医师目测确认,在工作站上利用软件勾画感兴趣区(region of interest, ROI),自动计算ROI内像素的最大SUV作为肿瘤SUVmax。分别在CT肺窗和纵隔窗上测量横断面肿瘤原发灶最大长径及其短径,取肺窗最大长径作为肿瘤大小。取病灶70%勾画ROI测量原发灶密度。计算原发灶TDR,定义为: 1-纵隔窗长径×短径/肺窗长径×短径。
1.4 统计学处理
统计学处理采用SPSS17.0统计处理软件,正态分布计量数据以![]() 表示,非正态分布计量数据以中位数和四分位数表示,M(Q1~Q3)。数据符合正态分布时,两个独立样本检验用t检验,不符合正态性分布时则使用Mann-Whitney检验。NSCLC患者无转移组和有淋巴结转移或远处转移组原发灶的解剖部位、影像学分型和病理学分型的比较、性别等因素均进行χ2检验。以P<0.05为差异有统计学意义。
表示,非正态分布计量数据以中位数和四分位数表示,M(Q1~Q3)。数据符合正态分布时,两个独立样本检验用t检验,不符合正态性分布时则使用Mann-Whitney检验。NSCLC患者无转移组和有淋巴结转移或远处转移组原发灶的解剖部位、影像学分型和病理学分型的比较、性别等因素均进行χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 NSCLC原发灶与淋巴结转移或远处转移的关系
有转移组明显高于无转移组(P<0.01);男性患者发生淋巴结或远处转移者(62/80,78%)稍高于女性患者(26/42,62%),但差异无统计学意义(P>0.05)。位于右肺上叶、中叶、下叶及左肺上叶、下叶发生淋巴结或远处转移的原发灶分别有24(24/40,60%)、6(6/6,100%)、18(18/28,64%)、16(16/20,80%)、24(24/28,86%)个,位于不同肺叶的原发灶发生淋巴结或远处转移概率差异无统计学意义(P>0.05)。中央型肺癌、周围型肺癌原发病灶发生淋巴结或远处转移分别为26(26/26,100%)、62(62/96,65%)个,两者发生转移概率的差异有统计学意义(P<0.05)。原发灶病理类型为腺癌、鳞癌、腺鳞癌及类癌者发生淋巴结或远处转移分别为60、22、4、2个;因病例数所限,故只比较腺癌和鳞癌在无转移组和有转移组的分布,腺癌发生转移概率为68%(60/88),鳞癌发生转移概率为85%(22/26),两者差异无统计学意义(P>0.05),见表2。
表2 NSCLC原发灶与淋巴结或远处转移的关系
Tab.2 Relationship between primary NSCLC lesions and lymph node or distant metastasis

临床因素无转移组(n=34)有转移组(n=88)P年龄/岁54.8±6.867.4±5.4<0.01性别 男1862 女16260.067病灶位置 右肺上叶1624 右肺中叶06 右肺下叶1018 左肺上叶416 左肺下叶4240.672影像学分型 中央型026 周围型3462<0.05病理学分型 腺癌2860 鳞癌422 腺鳞癌24 类癌020.101
腺癌与鳞癌比较,*P=0.101
2.2 NSCLC原发灶PET/CT影像学特征与淋巴结或远处转移的关系
为了解肺癌是否发生淋巴结或远处转移与其PET/CT影像学特征之间的关系,将肺癌原发灶的大小、密度、TDR、SUVmax分别分层,并分别统计发生转移的情况。结果表明,随着原发灶增大、密度增大、TDR减小及SUVmax增大,发生区域淋巴结或远处转移的概率均增大,见表3。
无转移共34个病灶,有转移共88个病灶。无转移组和有转移组之间原发灶大小、密度、TDR、SUVmax分析表明: 有转移组原发灶较大、密度较大、TDR较小、SUVmax较大,两组间上述各指标差异均具有统计学意义(均P<0.01),见表4。
表3 NSCLC原发灶PET/CT影像学特征与 淋巴结或远处转移的关系
Tab.3 Relationship between PET/CT imaging features of primary NSCLC lesions and lymph nodes or distant metastasis

原发灶影像学特征n无转移∶有转移原发灶大小/cm ≤2.03220∶12 2.0~3.02610∶16 >3.0644∶60原发灶密度/HU ≤-10064∶2 -100~0106∶4 0~20124∶8 >209420∶74原发灶TDR ≤0.510220∶82 0.5~1106∶4 >110 8∶2原发灶SUVmax ≤2.51412∶2 2.5~5.086∶2 5.0~7.5102∶8 7.5~10162∶14 >107412∶62
表4 NSCLC原发灶大小、密度、TDR、SUVmax 在无转移组和有转移组间的统计检验结果
Tab.4 The size, density, TDR and SUVmax of NSCLC primary lesion between the non-metastatic group and the metastatic group
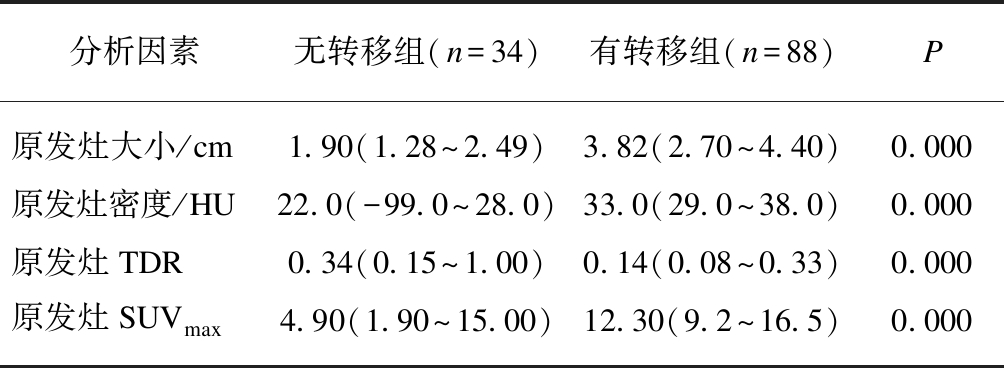
分析因素无转移组(n=34)有转移组(n=88)P原发灶大小/cm1.90(1.28~2.49)3.82(2.70~4.40)0.000原发灶密度/HU22.0(-99.0~28.0)33.0(29.0~38.0)0.000原发灶TDR0.34(0.15~1.00)0.14(0.08~0.33)0.000原发灶SUVmax4.90(1.90~15.00)12.30(9.2~16.5)0.000
注: 计量数据以中位数和四分位数表示,M(Q1~Q3)
3 讨 论
18F-FDG PET/CT作为多模态成像技术,除了提供精确的解剖信息和葡萄糖代谢分子信息外,还能够对全身的代谢负荷作出评估,目前在临床已较广泛应用于多种肿瘤的筛查与诊断评估[4]。
在本研究中,18F-FDG PET/CT对肺内病灶的综合诊断主要包括了反映肿瘤代谢程度的18F-FDG PET显像中的早期显像SUVmax和可反映病灶形态学特征的CT征象。在PET/CT诊断中,SUVmax可作为恶性肿瘤患者预后的一项预测因素[5]。肿瘤组织对18F-FDG的摄取,反映了肿瘤的代谢活性,是肿瘤的一个重要生物学特性。在初诊NSCLC患者中,原发肿瘤的SUVmax对病灶诊断具有较好作用[6-9],同时对患者治疗后疗效评估及生存预测等亦有较好的指导意义[10-12]。
多数学者主张以早期显像SUVmax≥2.5作为18F-FDG PET/CT诊断肺癌的依据之一,其灵敏性、特异性及准确性各家报道不同[13-14]。研究[15]报道,仅凭SUV值诊断恶性肺磨玻璃结节准确率较低,由于SUVmax可受多种因素影响,单纯以SUVmax判断病灶良恶性可出现假阳性或假阴性。如临床工作中常发现,在PET/CT检查无肺部肿瘤史或肺部疾病的患者时,纵隔亦多见淋巴结呈18F-FDG高摄取,此时则更需注重结合临床病史、症状、体征、肿瘤标记物和其他影像学等进行综合判断。
基于PET/CT可全身成像的优势,对于临床可疑肺癌患者,可通过一次显像同时了解肺部原发病灶与是否发生远处转移的关系。但18F-FDG并非肿瘤特异性显像剂,如何做到无创方式下确诊远处病灶即为肺癌转移灶,仍是目前18F-FDG PET/CT显像存在的极大挑战。
在18F-FDG显像定性困难时,选择非18F-FDG显像剂进行PET/CT显像,如核苷代谢显像剂18氟-3’-胸腺嘧啶核苷(18F-FLT)和胆碱代谢显像剂甲基-11C-胆碱(11C-choline,11C-胆碱)等,可利用其肿瘤显像的优势,弥补18F-FDG作为非肿瘤特异性显像剂的不足。研究[16]表明,18F-FLT摄取值高低可以反映肿瘤细胞的恶性程度。Buck等[17]也认为,18F-FLT为一种较为特异的新型肿瘤显像剂,可在18F-FDG浓聚的炎性病灶处不被摄取,较好地鉴别肺内恶性病变与炎症。华逢春等[18]对16例疑似肺肿瘤患者行18F-FDG PET/CT显像(注药1h后显像,2h后行延迟显像)、11C-胆碱PET显像(3d内,于注药10min后进行),以18F-FDG PET显像早期相SUVmax>2.5,11C-胆碱PET显像SUVmax>2.0为阳性,与病理结果对比,发现11C-胆碱和18F-FDG PET显像均能较好鉴别肺内良恶性肿瘤,但11C-胆碱和双时相18F-FDG PET显像优于18F-FDG PET常规显像,三者联合能提高对肺部病变及远处转移病灶的诊断效率。
本研究证实18F-FDG PET/CT显像中代谢参数SUVmax、TDR等能够更好对临床NSCLC患者进行危险分层,为评估NSCLC患者预后起到重要指导作用,18F-FDG PET/CT显像对评估NSCLC侵袭性有着重要的临床价值。
现阶段,研制针对NSCLC特异性更好的核素分子探针并加速其临床转化仍是PET/CT显像所面临的巨大挑战。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2): 69-90.
[2] PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005,55(2): 74-108.
[3] CHENG G, HUANG H. Prognostic value of 18F-fluorodeoxyglucose PET/computed tomography in non-small-cell lung cancer[J]. PET Clin, 2018,13(1): 59-72.
[4] SHARMA A, MOHAN A, BHALLA A S, et al. Role of various metabolic parameters derived from baseline 18F-FDG PET/CT as prognostic markers in non-small cell lung cancer patients undergoing platinum-based chemotherapy[J]. Clin Nucl Med, 2018,43(1): e8-e17.
[5] TAKEDA A, SANUKI N, FUJII H, et al. Maximum standardized uptake value on FDG-PET is a strong predictor of overall and disease-free survival for non-small-cell lung cancer patients after stereotactic body radiotherapy[J]. J Thorac Oncol, 2014,9(1): 65-73
[6] DOWNEY R J, AKHURST T, GONEN M, et al. Preoperative 18F fluorodeoxyglucose-positron emission tomography maximal standardized uptake value predicts survival after lung cancer resection[J]. J Clin Oncol, 2004,22(16): 3255-3260.
[7] SASAKI R, KOMAKI R, MACAPINLAC H, et al. [18F]fluorodeoxyglucose uptake by positron emission tomography predicts outcome of non-small-cell lung cancer[J]. J Clin Oncol, 2005,23(6): 1136-1143.
[8] CERFOLIO R J, BRYANT A S, OHJA B, et al. The maximum standardized uptake values on positron emission tomography of a non-small cell lung cancer predict stage, recurrence, and survival[J]. J Thorac Cardiovasc Surg, 2005,130(1): 151-159.
[9] ESCHMANN S M, FRIEDEL G, PAULSEN F, et al. Is standardised 18F-FDG uptake value an outcome predictor in patients with stage Ⅲ non-small cell lung cancer?[J]. Eur J Nucl Med Mol Imaging, 2006,33(3): 263-269.
[10] HELLWIG D, GRAETER T P, UKENA D, et al. Value of 18F-fluorodeoxyglucose positron emission tomography after induction therapy of locally advanced bronchogenic carcinoma[J]. J Thorac Cardiovasc Surg, 2004,128(6): 892-899.
[11] HOEKSTRA C J, STROOBANTS S G, SMIT E F, et al. Prognostic relevance of response evaluation using 18F-2-fluoro-2-deoxy-D-glucose positron emission tomography in patients with locally advanced non-small-cell lung cancer[J]. J Clin Oncol, 2005,23(33): 8362-8370.
[12] HELLWIG D, GRÖSCHEL A, GRAETER T P, et al. Diagnostic performance and prognostic impact of FDG-PET in suspected recurrence of surgically treated non-small cell lung cancer[J]. Eur J Nucl Med Mol Imaging, 2006,33(1): 13-21.
[13] 丁其勇,滑炎卿,管一晖,等.PET和PET/CT对孤立性肺结节的对照研究[J].中华核医学杂志,2005,25(5): 261-263
[14] 郑建国,屈婉莹,姚稚明,等.18F-FDG PET/CT在孤立性肺结节和肿块中误诊原因分析[J].中华核医学杂志,2007,27(3): 135-138.
[15] 高小月,周彩存,顾芬,等.初次确诊非小细胞肺癌患者首次化疗后骨髓抑制危险因素的前瞻性研究[J].同济大学学报(医学版),2018,39(6): 102-107.
[16] 谭业颖,田嘉禾,张锦明,等.18F-FLT PET显像诊断肺单发结节及评价细胞增殖的价值[J].中华核医学杂志,2007,27(2): 65-67.
[17] BUCK A K, SCHIRRMEISTER H, HETZEL M, et al. 3-deoxy-3-18F fluorothymidine-positron emission tomography for noninvasive assessment of proliferation in pulmonary nodules[J]. Cancer Res, 2002,62(12): 3331-3334.
[18] 华逢春,管一晖,张政伟,等.11C-胆碱与18F-FDG双时相PET显像在孤立性肺结节鉴别诊断中的应用[J].中华核医学杂志,2006,26(1): 15-18.