体外受精-胚胎移植(in vitro fertilization and embryo transfer, IVF-ET)是指不能自然受孕女性通过体外受精、移植胚胎的方式获得妊娠的技术。尽管近年来IVF-ET技术的不断改进与提高,但国内成功率仅为30%~40%,其影响治疗结局因素尚不明确。2017年的美国甲状腺协会(American Thyroid Association, ATA)指南指出女性在不孕症诊治中推荐评估血清TSH值;对不孕且伴有临床甲减者推荐使用LT4治疗;对于进行体外受精或卵泡浆内单精子注射的亚临床甲减女性,推荐进行LT4治疗以维持TSH水平在2.5mIU/L以下。然而,目前关于甲状腺功能及抗体对不孕症女性IVF-ET治疗结局影响的相关研究在国内外却少有报道。本研究收集在IVF-ET治疗前不孕症患者的临床资料,比较各因素对IVF-ET治疗结局的影响,并用ROC曲线分析各指标临床价值,现将研究报告如下。
1 资料与方法
1.1 一般资料
选取2016年3月—2017年3月在中国福利会国际和平妇幼保健院进行IVF-ET治疗的不孕症患者249例,其中成功病例101例,失败病例148例。按照《卫生部人类辅助生殖技术规范》纳入标准: (1) 具备完整的临床资料;(2) 明确诊断为不孕症并自愿接受IVF-ET治疗的患者,世界卫生组织(WTO)将不孕症定义为结婚后至少同居1年,有正常的性生活,且未有采取任何避孕措施而不能受孕;(3) 年龄20~40岁;(4) 不孕原因明确为输卵管不通。排除标准: (1) 有甲状腺疾病家族史、手术史、既往合并糖尿病、高血压、心脏瓣膜病、慢性肺病、传染性肝炎、慢性肾脏病、恶性肿瘤或其他自身免疫性疾病;(2) 排除因男方因素需要进行二代移植的患者;(3) 排除因基因问题需进行三代单囊胚移植及各种原因取消移植的患者;(4) 双胎或者多胎妊娠;(5) 多囊卵巢综合征患者、子宫肌腺症及不明原因不孕患者;(6) 孕前服用影响甲状腺功能的激素药物;(7)资料不全者。所有受试者自愿接受,并按流程上报经我院伦理委员会批准后进行,入组前都签署知情同意书。在IVF-ET治疗前,依据2017年的美国甲状腺协会(American Thyroid Association, ATA)指南推荐对伴有临床甲减及亚临床甲减的患者推荐左旋甲状腺素片治疗,控制TSH水平2.5mIU/L以下。
1.2 方法
1.2.1 一般资料的收集 在IVF-ET治疗前,收集目标人群的基本临床资料,包括姓名、性别、年龄、测量其身高(height, H)、体质量(weight, W)、收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP),计算体质量指数(body mass index, BMI)=体质量(kg)/身高2(m2)。
1.2.2 血常规及生化指标的诊断 血检测前一晚禁食8~10h,第2天清晨空腹抽静脉检查血常规: 白细胞(white blood cell, WBC)、红细胞(red blood cell, RBC)、血红蛋白(hemoglobin, HB);肝肾功能: 谷丙转氨酶(glutamic-pyruvic transaminase, ALT)、直接胆红素(direct Bilirubin, DBIL)、间接胆红素(indirect bilirubin, BIL-T)、尿素(urea, UR)、尿酸(uric acid, UA)、肌酐(creatinine, CREA);空腹血糖(fasting blood glucose, FBG)及血脂: 胆固醇(total cholesterol, TC)、总甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)等。血常规采用电阻检测法,仪器为日本希森美康Sysmex XN1000;糖化血红蛋白检测采用高效液相层析法,仪器为日本东曹株式会社G8;空腹血糖采用己糖激酶法检测,仪器为瑞士罗氏CobasC702;肝肾功能及血脂应用酶比色法测定,仪器为瑞士罗氏CobasC7。
1.2.3 各激素指标的诊断方法 禁食8~10h后第2天早晨抽静脉血10mL离心后取上清液,检测甲状腺功能: 游离甲状腺素(free thyroxin, FT4)、促甲状腺激(thyroid stimulating hormone, TSH)、过氧化物酶抗体(thyroid peroxidase autoantibody, TPOAb);性激素六项: 卵泡刺激素(follicle stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)、催乳素(prolactin, PRL)、孕酮(pregnendione, P)、雌二醇(estradiol, E)、Testo;抗穆勒管激素(anti-mullerian hormone, AMH)。甲状腺激素采用化学发光酶免疫分析法(Chemiluminescence Enzyme Immunoassay, CLEIA)检测,仪器为美国雅培Architect i2000,FT4、TSH、TPOAB试剂盒分别为7K66、7K62、2K47,三者的批内差异分别低于1.90%、1.60%、10%,三者的批间差分别低于4.01%、3.59%、10%。甲状腺功能参考值范围采用国际和平妇幼保健院课题组在2015年采用序贯方法建立的雅培试剂妊娠早期参考值范围: 孕前血清TSH正常范围值为0.06~2.81mIU/L,FT4正常范围值为12.85~18.55mIU/L,TPOAb正常范围值为水平<5.61IU/mL。性激素六项指标采用化学发光微粒免疫检测技术,仪器为德国贝克曼Beckman DXI8000。AMH检测用三步双抗体夹心法酶联免疫法检测,仪器为美国AYNEX公司的DS2,20~40岁正常参考范围0.24~11.78ng/mL。
1.2.4 IVF-ET操作流程 男性禁欲3~5d,手淫取精后进行精液量、精子浓度、精子形态及活力等指标检测,按照WHO第5版标准计数分析活力,经密度梯度离心及洗涤后,留取0.2mL上清液及高质量精子沉淀物为备用受精微滴[8-9]。女性患者垂体降调节和采用促性腺激素释放激素激动剂治降调节后进行控制性超促排卵方案,促性腺激素用果纳芬(雪兰诺,瑞士),B超监测到主导卵泡个3以上直径达到18mm时注射人绒毛膜促性腺激素(human chorionic gonadotropin, HCG) 4000~10000IU(2000IU/支,丽珠制药),36h后超声引导下取卵[10-12]培养4~6h,加入预先备用受精微滴进行体外受精,取卵后第3天移植细胞胚胎1~2枚,移植后给予黄体酮胶囊(安琪坦0.1g/粒,法国法杏制药)黄体支持治疗,0.2g,3次/d,阴道塞药,地屈孕酮片(达芙通10mg/片,荷兰苏威制药)10mg,2次/d,口服。2周后行血HCG检测,移植后4周行阴道超声见宫腔内单个孕囊及胎心搏动诊断为临床单胎妊娠,即IVF-ET治疗成功。
1.3 统计学处理
研究数据均采用SPSS19.0进行统计学分析处理,计量资料以![]() 表示,计数资料采取频数及百分数,采用Kolmogorov-Smirnov检验是否正态分布;正态分布的变量采用独立t检验比较两组差异,计数资料用卡方检验;非正态分布的计量资料采用Mann-Whitney U检验。影响因素分析采取logistic二元回归分析,有意义的指标使用ROC(receiver operating characteristic)曲线分析,计算比较曲线下面积(area under ROC curve, AUC),寻找最佳切点值,评价其临床效价。P<0.05为差异有统计学意义。
表示,计数资料采取频数及百分数,采用Kolmogorov-Smirnov检验是否正态分布;正态分布的变量采用独立t检验比较两组差异,计数资料用卡方检验;非正态分布的计量资料采用Mann-Whitney U检验。影响因素分析采取logistic二元回归分析,有意义的指标使用ROC(receiver operating characteristic)曲线分析,计算比较曲线下面积(area under ROC curve, AUC),寻找最佳切点值,评价其临床效价。P<0.05为差异有统计学意义。
2 结 果
2.1 两组病例的指标比较
收集病例总数249例,成功组101例,失败组148例,失败组年龄、TSH、TBIL、DBIL、ALT、UREA、UA、CREA、RBC、HB等指标高于成功组,差异有统计学意义(P<0.05);失败组FT4、TC、TG、WBC、SBP、DBP、HR等指标均低于成功组,差异有统计学意义(P<0.05);其余指标差异无统计学意义(P>0.05),见表1。
2.2 成功组及失败组的TPOAB阳性率比较
研究对象中TPOAB阳性患者总计47例,在IVF-ET成功组有14例(13.86%),而在IVF-ET失败组中TPOAB阳性患者比例达到22.30%,有33例,尽管两组比较差异无统计学意义(P=0.095)。
2.3 IVF-ET失败的相关因素分析
以IVF-ET是否成功作为因变量(0: 失败,1: 成功),以年龄、TSH、FT4、TBTL、DBIL、ALT、UREA、UA、CREA、三酰甘油、胆固醇、红细胞、血红蛋白、白细胞、中性比率、中性值、收缩压、舒张压、心率等多个变量为自变量进行多因素Logistic回归分析,研究结果显示年龄、年龄、TSH、DBIL、UA、CRE是危险因素,值越高导致IVF-ET失败可能性越大,FT4是保护因素,值越高成功的可能性越大,见表2。
表1 成功组及失败组病例临床指标比较
Tab.1 comparison of clinical indexes between the successful group and the failed group
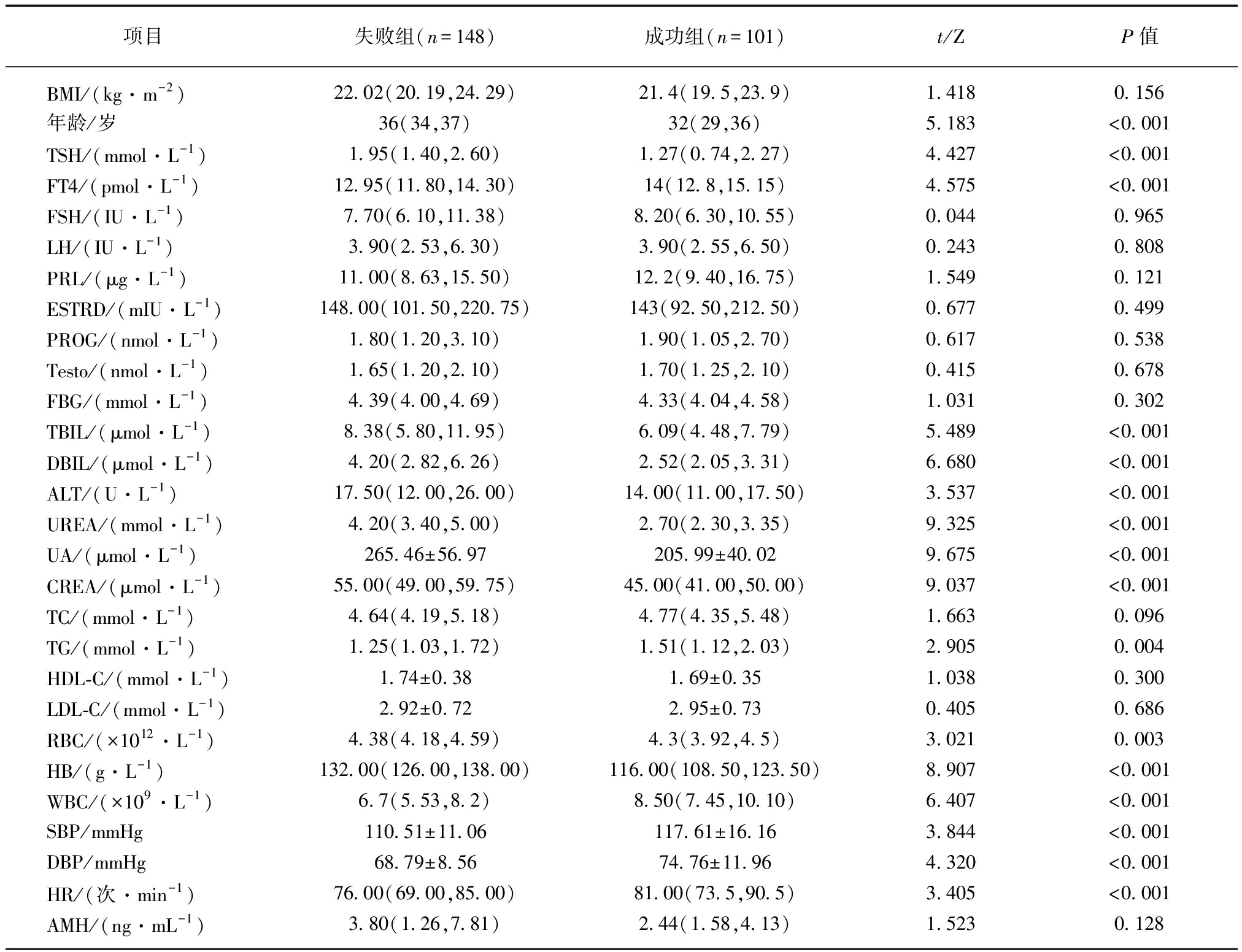
项目失败组(n=148)成功组(n=101)t/ZP值BMI/(kg·m-2)22.02(20.19,24.29)21.4(19.5,23.9)1.4180.156年龄/岁36(34,37)32(29,36)5.183<0.001TSH/(mmol·L-1)1.95(1.40,2.60)1.27(0.74,2.27)4.427<0.001FT4/(pmol·L-1)12.95(11.80,14.30)14(12.8,15.15)4.575<0.001FSH/(IU·L-1)7.70(6.10,11.38)8.20(6.30,10.55)0.0440.965LH/(IU·L-1)3.90(2.53,6.30)3.90(2.55,6.50)0.2430.808PRL/(μg·L-1)11.00(8.63,15.50)12.2(9.40,16.75)1.5490.121ESTRD/(mIU·L-1)148.00(101.50,220.75)143(92.50,212.50)0.6770.499PROG/(nmol·L-1)1.80(1.20,3.10)1.90(1.05,2.70)0.6170.538Testo/(nmol·L-1)1.65(1.20,2.10)1.70(1.25,2.10)0.4150.678FBG/(mmol·L-1)4.39(4.00,4.69)4.33(4.04,4.58)1.0310.302TBIL/(μmol·L-1)8.38(5.80,11.95)6.09(4.48,7.79)5.489<0.001DBIL/(μmol·L-1)4.20(2.82,6.26)2.52(2.05,3.31)6.680<0.001ALT/(U·L-1)17.50(12.00,26.00)14.00(11.00,17.50)3.537<0.001UREA/(mmol·L-1)4.20(3.40,5.00)2.70(2.30,3.35)9.325<0.001UA/(μmol·L-1)265.46±56.97205.99±40.029.675<0.001CREA/(μmol·L-1)55.00(49.00,59.75)45.00(41.00,50.00)9.037<0.001TC/(mmol·L-1)4.64(4.19,5.18)4.77(4.35,5.48)1.6630.096TG/(mmol·L-1)1.25(1.03,1.72)1.51(1.12,2.03)2.9050.004HDL-C/(mmol·L-1)1.74±0.381.69±0.351.0380.300LDL-C/(mmol·L-1)2.92±0.722.95±0.730.4050.686RBC/(×1012·L-1)4.38(4.18,4.59)4.3(3.92,4.5)3.0210.003HB/(g·L-1)132.00(126.00,138.00)116.00(108.50,123.50)8.907<0.001WBC/(×109·L-1)6.7(5.53,8.2)8.50(7.45,10.10)6.407<0.001SBP/mmHg110.51±11.06117.61±16.163.844<0.001DBP/mmHg68.79±8.5674.76±11.964.320<0.001HR/(次·min-1)76.00(69.00,85.00)81.00(73.5,90.5)3.405<0.001AMH/(ng·mL-1)3.80(1.26,7.81)2.44(1.58,4.13)1.5230.128
1mmHg=0.133kPa
表2 IVF-ET失败的相关因素logistic回归分析
Tab.2 Logistic regression analysis of factors
related to IVF-ET failure
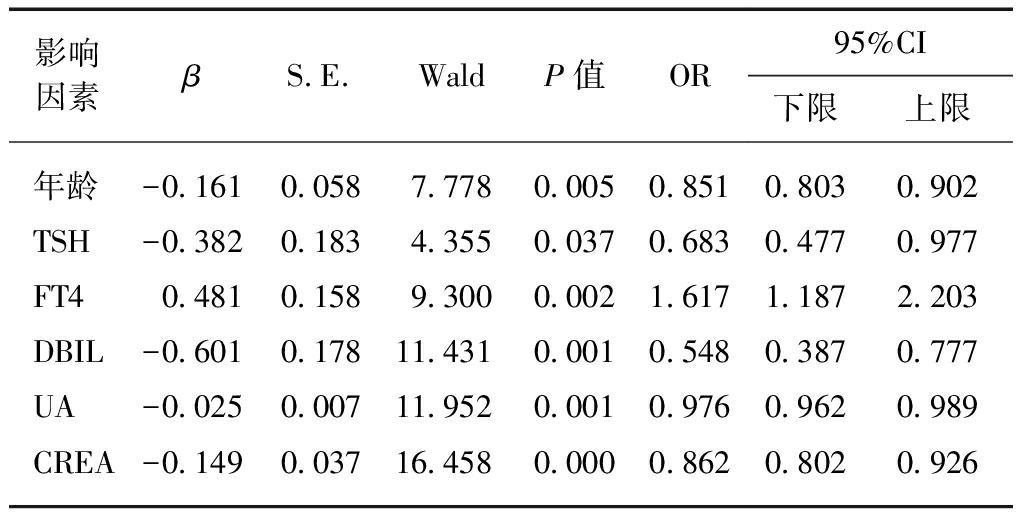
影响因素βS.E.WaldP值OR95%CI下限上限年龄-0.1610.0587.7780.0050.8510.8030.902TSH-0.3820.1834.3550.0370.6830.4770.977FT40.4810.1589.3000.0021.6171.1872.203DBIL-0.6010.17811.4310.0010.5480.3870.777UA-0.0250.00711.9520.0010.9760.9620.989CREA-0.1490.03716.4580.0000.8620.8020.926
2.4 ROC曲线对IVF-ET治疗的诊断分析
绘制TSH、FT4、DBIL、UA、CREA的ROC曲线,计算AUC,结果显示CREA的AUC最大为0.837,TSH的AUC最小为0.669,具有统计学意义(P<0.05);以最大约登指数所对应的值为最佳诊断切点,其对应的灵敏度依次为TSH(84.46%)>UA(72.97%)>CREA(70.27%)>FT4(62.16%)>DBIL(51.35%),特异度依次为DBIL(90.1%)>UA(82.18%)>CREA(80.20%)>FT4(64.36%)>TSH(51.49%),见图1、表3。
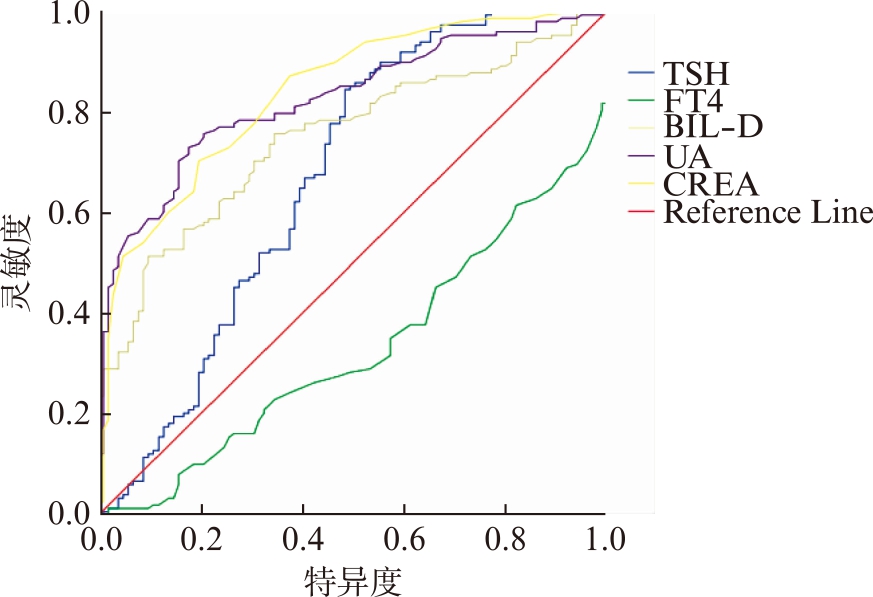
图1 影响IVF-ET妊娠结局母体血清因素的ROC分析结果
Fig.1 The ROC curve of maternal serum factors
affecting IVF-ET outcome
表3 各因素的ROC曲线
Tab.3 ROC curves of various factors
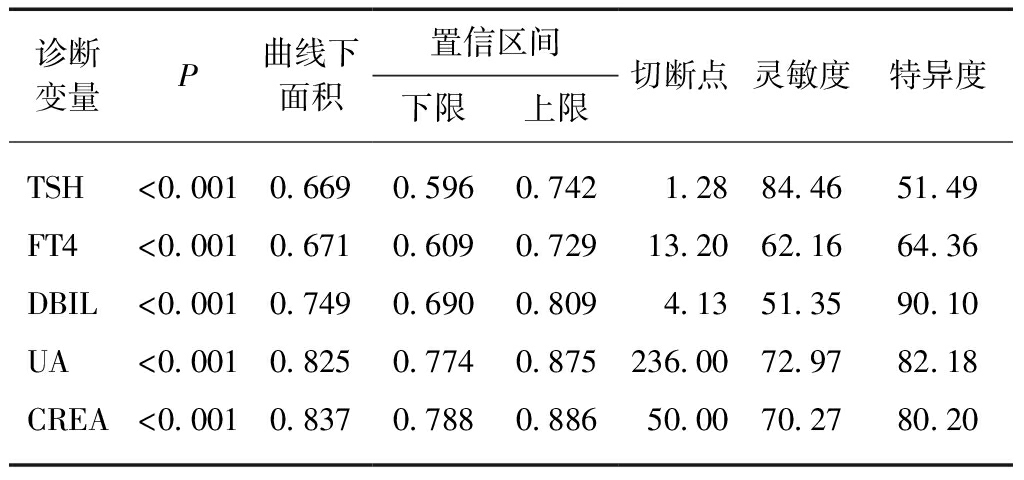
诊断变量P曲线下面积置信区间下限上限切断点灵敏度特异度TSH<0.0010.6690.5960.742 1.2884.4651.49FT4<0.0010.6710.6090.72913.2062.1664.36DBIL<0.0010.7490.6900.8094.1351.3590.10UA<0.0010.8250.7740.875236.0072.9782.18CREA<0.0010.8370.7880.88650.0070.2780.20
3 讨 论
IVF-ET是治疗不孕症的有效手段,根据临床研究,IVF-ET的成功与否是受多种因素影响,一方面在于IVF-ET术前的促排卵方案及IVF-ET术中的操作流程;另一方面在于胚胎质量;除此以外,母体是直接孕育胎儿的基础,对IVF-ET的治疗结局影响举足轻重。本研究着重分析母体血清检测的TPOAb及甲状腺功能对IVF-ET治疗结局影响。
TPOAb、TSH、FT4是甲状腺功能的关键指标,TPOAb阳性对IVF-ET的治疗结局是否有影响,吴晖南等[10]汇总分析显示,在甲状腺功能正常妇女中,甲状腺抗体阳性对IVF女性的临床妊娠率无明显影响,但是与自然流产风险增加相关;北京大学第三医院生殖中心厉晓帆等[11]研究490例经IVF-ET治疗后的多囊卵巢综合征患者妊娠结局,表明TPOAB阳性不是PCOS患者的IVF-ET治疗后不良妊娠结局的危险因素,TSH才是妊娠的危险因素,这与本研究的结果一致;而张思辰等[12]研究表明,妊娠期TPOAb阳性增加IVF-ET者的流产率,其OR值为2.14(95%CI: 1.43~3.21)。在IVF-ET治疗中TPOAB阳性与妊娠结局的相关机制不明确,推断机制如下: (1) TPOAb阳性者易并发亚临床甲减甚至甲减,主要是妊娠早期孕期激素波动;(2) TPOAb提示自身免疫功能受损,并非流产的导致因素;(3) TPOAb阳性因自身免疫使不孕时间增加,而流产率增加与年龄相关[13]。而FT4及TSH水平影响IVF-ET治疗结局的可能原因如下: (1) 促使多巴胺分泌减少,泌乳素PRL的分泌增加[14];(2) 低浓度的TSH负反馈垂体-甲状腺轴使促甲状腺素释放激素(TRH)升高,促进PRL分泌;高泌乳素血症可致排卵障碍、黄体功能不足;(3) 低TSH浓度使雌激素下降,性激素结合球蛋白减少,游离雌雄激素升高,最终雌酮、雄烯二酮代谢降低,加重黄体缺陷[15],卵泡发育不良、内膜变薄的结果使胚胎难于着床。在一项1500余例IVF-ET治疗队列研究中,按TSH值每增加0.5mIU/L进行分组,结果没有发现各组的流产率、植入率、生产率有统计学差异[16]。而在另一meta分析中,在接受IVF-ET治疗的亚临床甲状腺功能减退的患者中,予以左旋甲状腺素片治疗后明显增加了植入率和分娩率,并显著降低了流产率[17]。自然受孕人群中,降低TSH水平和改善妊娠结局存在线性关系[18],而IVF-ET治疗合并甲状腺功能减退或者亚临床功能患者中却未发现。依据本研究结果建议在IVF-ET治疗前,甲减及亚甲减的不孕者早期调节TSH值在1.28μmol/L以内,提高IVF-ET成功率。
IVF-ET的一个重要环节是需要归避系统损伤的风险,考虑到在接受IVF-ET治疗后的下一个周期开始前存在“基础风险”,对正在接受IVF-ET治疗的患者应进行基本的肝肾功能检测。本研究明确了DBIL、UA及CREA是影响IVF-ET失败的危险因素,DBIL是肝功能关键指标,UA、CREA是肾功能关键指标。目前,肝肾功能与IVF-ET的妊娠结局相关性尚不明确,可能机制如下: (1) 首次进行IVF-ET治疗者,肝内胆管障碍、自身免疫性肝病、肝细胞病毒感染、脂肪肝等多种原因致使肝细胞受损,非结合胆红素转化为结合胆红素受阻,DBIL升高;另肝内胆汁淤积症(intrahepatic cholestasis of pregnancy, ICP)与其相关,尽管ICP是遗传、激素水平等多因素相关性疾病[19],由于ICP肝内胆管胆酸盐沉积,胆红素排泄障碍使血清胆红素增高,胆红素细胞自身毒性增强胆汁酸的细胞毒作用,损害胎盘结构损害胎盘物质交换,胎盘血容量下降影响胚胎的发育[20];(2) 反复多次IVF-ET治疗易并发卵巢过度刺激综合征(ovarian hyper-stimulation syndrome, OHSS),而持续高水平雌、孕激素使胆管通透性增加、Na+-K+-ATP酶活性及肝细胞膜液态流动性降低,肝胆转运系统异常并发胆汁淤积[21];(3) 控制性超促排卵(controlled ovarian hyper-stimulation, COH)影响肝肾血流动力学变化[22],Giugliano等[23]的病例报道让人们提出了COH和肝功能衰竭的相关性假设,4次IVF-ET治疗后的肝功能衰竭患者并发严重的HELLP综合征,主要表现为肝酶水平升高、血小板减少、溶血,可能是由于血管紧张素和促炎细胞因子增加使得内皮功能障碍导致肝脏缺血[24]。
本研究表明TPOAB与IVF-ET成功失败的妊娠结局无相关,其影响尚缺乏依据。推测原因可能: (1) 本研究的入组对象涵盖的范围甚广,包括20~40岁不同年龄的患者;(2) 另外因为TPOAb阳性的样本例数少,未有分层分析;(3) 妊娠结局影响因素众多,在多种因素合并存在状态下,各因素间相互影响,有可能抵消其中某种因素对IVF-ET结局的影响,因此需要更多设计良好、样本量足够的研究来不断得到证实,来挖掘现象背后的本质。
[1] 莫美兰,黄春宇,许健,等.D-二聚体对反复种植失败患者妊娠结局的预测价值.生殖医学杂志,2017,26(11): 1127-1130.
[2] 刘翔华,王治鸿.体外受精——胚胎移植中受精障碍有关因素分析.世界最新医学信息文摘,2017,17(68): 74-76.
[3] ALEXANDER E K, PEARCE E N, BRENT G A, et al. 2017 guidelines of the American thyroid association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid, 2017,27(3): 315-389.
[4] Practice Committee of the American Society for Reproductive Medicine. Subclinical hypothyroidism in the infertile female population: a guideline. Fertil Steril, 2015,104(3): 545-553.
[5] MONTOYA J M, BEMAL A, BORRERO C. Diagnostics in assisted human reproduction. Reprod Biomed Online, 2002,5: 198-210.
[6] 许诗珺,范建霞,杨帅,等.不同促甲状腺激素/游离甲状腺素检测试剂对妊娠期甲状腺功能检测结果的影响.中华围产医学杂志,2015,18(2): 11-16.
[7] GLEICHER N, KUSHNIR V A, SEN A, et al. Definition by FSH, AMH and embryo numbers of good-, intermediate- and poor-prognosis patients suggests previously unknown IVF outcome-determining factor associated with AMH. J Translational Med, 2016,14(1): 172-183.
[8] 席军花.IVF-ET失败不孕妇女心理压力及生活质量.实用妇科内分泌杂志(电子版),2017,4(15): 89-90.
[9] 杨志勇,邢雅欣,杨艳楠,等.临床微量精子标本冷冻方法的研究.同济大学学报(医学版),2017,38(6): 41-45.
[10] 吴晖南,洪天配,高洪伟等.甲状腺抗体阳性对甲状腺功能正常女性辅助生殖妊娠结局影响的荟萃分析.中华医学杂志,2015,95(46): 3770-3774
[11] 厉晓帆,迟洪滨,乔杰等,自身免疫性甲状腺炎与多囊卵巢综合征患者体外受精一胚胎移植妊娠结局相关性的研究.中华医学杂志,2017,97(33): 2609-2613
[12] 张思辰,王少为,赵晓东,等.妊娠期单纯甲状腺过氧化物酶抗体阳性妇女的妊娠结局及干预措施对妊娠结局影响的荟萃分析.中华妇产科杂志,2016,51(4): 250-257.
[13] ABALOVICH M, AMINO N, BARBOUR L A, et al. Management of thyroid dysfunction during pregnancy and postpartum: all Endocrine Society Clinical Practice Guideline. Clinic Endocrinol Metab, 2007,92(8 Suppl): 2543-2565.
[14] 高敏芝,孙兆贵,赵晓明,等.卵泡液和血清EG-VEGF、VEGF和TGF-β_1水平与IVF妇女卵巢反应的关系及其对妊娠结局的预测价值.上海交通大学学报(医学版),2013,33(02): 184-190.
[15] MARTINS W P, NASTRI O, RIENZI L, et al. Blastocyst vs cleavage-stage embryo transfer: systematic review and meta-analysis of reproductive outcomes. Ultrasound Obstet Gynecol, 2017,49(5): 583-591.
[16] 叶红娟,陈秋菊,匡延平.多囊卵巢综合征患者在高孕激素超促排卵中LH与IVF/ICSI临床结局的相关性分析.生殖与避孕,2016,36(03): 177-184.
[17] VELKENIERS B, VAN M A, POPPE K, et al. Levothyroxine treatment and pregnancy outcome in women with subclinical hypothyroidism undergoing assisted reproduction technologies: systematic review and meta-analysis of RCTs. Hum Reprod Update, 2013,19: 251-258.
[18] BENHADI N, WIERSINGA W M, REITSMA J B, et al.Higher maternal TSH levels in pregnancy are associated with increased risk for miscarriage, fetal or neonatal death. Eur J Endocrinol, 2009,160(6): 985-991.
[19] FILIZ F BOLUKBAS, CENGIZ BOLUKBAS, HATICE Y BALABAN, et al. Intrahepatic cholestasis of pregnancy: spontaneous vs in vitro fertilization Euroasian J Hepato-gastroenterol, 2017,7(2): 126-129.
[20] 何惠,刘基铎,周迎春,等.ROC曲线评价AFU及AFP对原发性肝癌的诊断价值.国际检验医学杂志,2006,27(2): 118.
[21] SONG X, VASILENKO A, CHEN Y, et al. Transcriptional dynamic sofbile salt export pump during pregnancy; mechanisms and implications intrahepatic cholestasis of pregnancy. Hepatology, 2014,60: 1993-2007.
[22] ROMITO I, GULINO F A, LAGAN A S, et al. Renal and hepatic functions after A week of controlled ovarian hyperstimulation during in vitro fertilization cycles. J Fertil Steril, 2017,11(1): 15-19.
A S, et al. Renal and hepatic functions after A week of controlled ovarian hyperstimulation during in vitro fertilization cycles. J Fertil Steril, 2017,11(1): 15-19.
[23] GIUGLIANO E, CAGNAZZO E, PANSINI G, et al. Ovarian stimulation and liver dysfunction: is a clinical relationship possible. A case of hepatic failure after repeated cycles of ovarian stimulation. Clin Exp Reprod Med, 2013,40(1): 38-41.
[24] CHEN C D, WU M Y, CHEN H F, et al. Relationships of serum pro-inflammatory cytokines and vascular endothelial growth factor with liver dysfunction in severe ovarian hyper stimulation syndrome. Hum Re-prod, 2000,15(1): 66-71.