2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid, 2,4-D)是具有代表性的合成植物生长激素,已被确认有环境内分泌干扰作用。2,4-D是广谱的除草剂,广泛用于控制谷类作物、草坪、牧场、草原中阔叶杂草的生长。其过量残留会对蔬菜、人畜、环境产生威胁,在美国、意大利、以色列、西班牙、荷兰和中国等国家仍在喷洒2,4-D进行柑橘果实保鲜[6-7],美国环保署农药2,4-D参考剂量为0.21mg/(kg·d),相应的人体生物等效剂量成人为10.5mg/L、儿童为7mg/L。目前有关2,4-D的毒性作用主要集中在神经毒性、生殖发育毒性等方面,对其血液毒性作用机制尚不清楚。斑马鱼已经被证实是有效检测环境有毒物质的脊椎模式动物,82%的斑马鱼基因与人类同源,而且斑马鱼生命早期发育和疾病发生过程与人类相似,斑马鱼造血相关的转录调控因子和信号转导通路与人类的造血过程高度同源。因此,斑马鱼模型是研究心血管系统发育的良好模型,尤其适用于研究外源性化合物暴露对血液系统发育的影响。因此,本次研究利用斑马鱼模型研究2,4-D暴露后对造血干细胞发育的影响。
1 材料与方法
1.1 2,4-D溶解
2,4-D购自美国Sigma公司,纯度>97%,相对分子质量为221.04。称量5mg的2,4-D粉末,溶于50mL的去离子水中,制备100mg/L的母液,常温磁力搅拌12h,形成稳定的水溶液,于4℃冰箱保存备用。
1.2 斑马鱼受精卵的收集和培养
斑马鱼是一种性情温和、杂食性的热带淡水鱼,胚胎透明便于观察。水质要求: pH 7~8,水温28.5℃,溶解氧5.0mg/L以上。选取适量的雌鱼和雄鱼,按照1∶1的比例配对置于插有隔板的鱼缸内,次日清晨拔板收集受精卵;将受精卵置于48孔板中,每孔1个,每孔滴加不同浓度2,4-D,使2,4-D终浓度分别控制在0、5、10、20mg/L共4个浓度,每个浓度组12个复孔;置于28.5℃孵箱中孵化,24h为周期循环换液,培养并观察至斑马鱼出生后72h。
本研究所用斑马鱼品系包括野生型Tubingen品系和cmyb: eGFP转基因斑马鱼系(源自哈佛大学医学院)。
1.3 斑马鱼胚胎的急性毒性实验
野生型斑马鱼胚胎暴露于0、5、10、20mg/L的2,4-D水溶液,各组12个斑马鱼胚胎,于受精后72h(72hpf)记录死亡与形体畸形数目并拍照记录。cmyb: eGFP转基因斑马鱼胚胎暴露于2,4-D水溶液中,在胚胎48hpf用共聚焦显微镜(德国ZEISS公司LSM510型)拍摄荧光标记的造血干细胞。
1.4 血细胞基因表达的逆转录聚合酶链反应(RT-PCR)
收集48hpf各浓度组胚胎至无RNA酶的EP管中,利用TRIzol法抽提总RNA,再用美国Invitrogen公司SuperScriptTM Ⅳ反转录酶试剂盒反转录合成cDNA第一链,采用造血干细胞(cmyb)、红系(gata1)和粒-单核系细胞(l-plastin、pu.1)标记基因引物(引物序列见表1),进行荧光核染料SYBR Green的定量PCR反应,反应条件为: 95℃ 2min;95℃ 15s;60℃ 30s,40个循环;95℃ 15s;60℃ 15s;95℃ 15s。因此,检测实验组和对照组胚胎的造血干细胞(cmyb)、红系(gata1)和粒-单核系细胞(l-plastin、pu.1)的相对表达量。
表1 引物序列
Tab.1 Primer sequences(5′-3′)
基因上游引物下游引物pu.1CATCATCCCACCCCAGCAAACCCGAGAACCTCTCCACTGAACcmybTGGAAAGTCATCGCCAGCTTTAGGGTGTTTGTTGGCCCAGgata1CAGTCCAGTTCGCCAAGTCTGGTGGCACCACAATTCACACl-plastinGGAACGGTCACATCAGCACATCAGGGCCAGGTTCAAGTTC
造血干细胞: cmyb;红系: gata1;粒-单核系细胞: l-plastin、pu.1
1.5 造血干细胞的cmyb探针原位杂交
收集特定时相各浓度组斑马鱼胚胎,除去卵膜,4%多聚甲醛于4℃摇床上固定24h。100%含吐温-20的磷酸盐缓冲液(PBST)清洗后,双氧水去除色素。4%多聚甲醛置于室温下再次固定2~3h。100%PBST清洗后,25%、50%、75%PBST/甲醇溶液梯度脱水,-20℃冰箱保存。75%、50%、25%PBST/甲醇溶液梯度水化-20℃保存的胚胎。随后100%PBST溶液再次清洗。蛋白酶K消化。4%多聚甲醛置于室温下再次固定1h以上。100%PBST溶液清洗数次。用HYB(-)和HYB(+)预杂交溶液于70℃杂交炉中进行预杂交,然后加入0.1~1mg/L的Cmyb探针,于70℃杂交炉中过夜。洗涤后加入地高辛抗体,4℃过夜进行封闭和抗体孵育。再次洗涤后,用显色试剂NBT/BCIP碱性磷酸酶底物(美国VECTOR Laboratories公司)显色,在显微镜下观察并记录对照组和实验组胚胎中cmyb探针标记的蓝色点的变化情况,来反映cmyb表达量的变化。
1.6 统计学处理
实验数据结果以![]() 表示,采用SPSS19.0软件进行数据的单因素方差分析和t检验,并用probit法拟合求得半数致死剂量LC50,P<0.05为差异有统计学意义。
表示,采用SPSS19.0软件进行数据的单因素方差分析和t检验,并用probit法拟合求得半数致死剂量LC50,P<0.05为差异有统计学意义。
2 结 果
2.1 野生型斑马鱼胚胎急性毒性反应
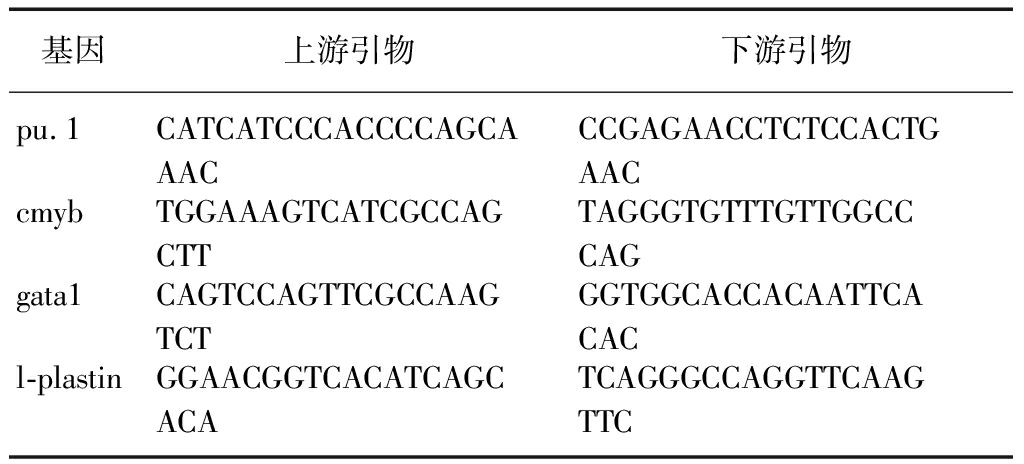
野生型斑马鱼胚胎暴露于0、5、10、20mg/L的2,4-D水溶液中,在72hpf时,胚胎LC50为16.3mg/L,95%的可信区间为13.2~21.3mg/L,见图1A。随着2,4-D的浓度增加,各浓度组的胚胎孵化率降低,在72hpf时5、10mg/L的2,4-D浓度组胚胎孵化率为91.7%,见图1B。5、10mg/L的2,4-D浓度组胚胎形态发育正常,而20mg/L的2,4-D浓度组胚胎出现明显的形态畸形,表现为小头、心包水肿、脊柱弯曲、卵黄囊畸形,见图2。
2.2 Cmyb: eGFP转基因鱼系荧光观察和原位杂交
用Cmyb探针标记造血干细胞,在30、48和72hpf,用10mg/L 2,4-D水溶液处理后,斑马鱼胚胎造血干细胞数量少于空白对照组,见图3。斑马鱼造血最早始于中间细胞群(intermediate cell mass, ICM)区,在30hpf 时10mg/L 2,4-D浓度组胚胎的ICM区域蓝色点少于对照组,见图3A~B。48hpf时10mg/L 2,4-D浓度组中cmyb探针标记的蓝色点明显少于对照组,见图3C~D,同时,在48hpf cmyb: eGFP转基因胚胎的激光共聚焦结果表明10mg/L 2,4-D浓度组胚胎的尾部区域蓝色荧光标记的造血干细胞数量亦少于对照组(t=13.11,P<0.001),见图3E~F。72hpf 整胚cmyb探针原位杂交实验中,10mg/L 2,4-D浓度组在尾部造血组织(caudal hematopoietic tissue, CHT)区域几乎未见蓝色点(图3G~H),同样72hpf cmyb: eGFP转基因胚胎的激光共聚焦中,10mg/L 2,4-D浓度组红色荧光标记的造血干细胞数量明显少于对照组(t=7.176,P<0.001),见图3I~J。

图1 不同浓度2,4-D组斑马鱼胚胎不同时间的
死亡率与孵化率
Fig.1 Mortality and hatching rate of zebrafish embryos
at different time in groups with different
concentrations of 2,4-D
A: 死亡率;B: 孵化率
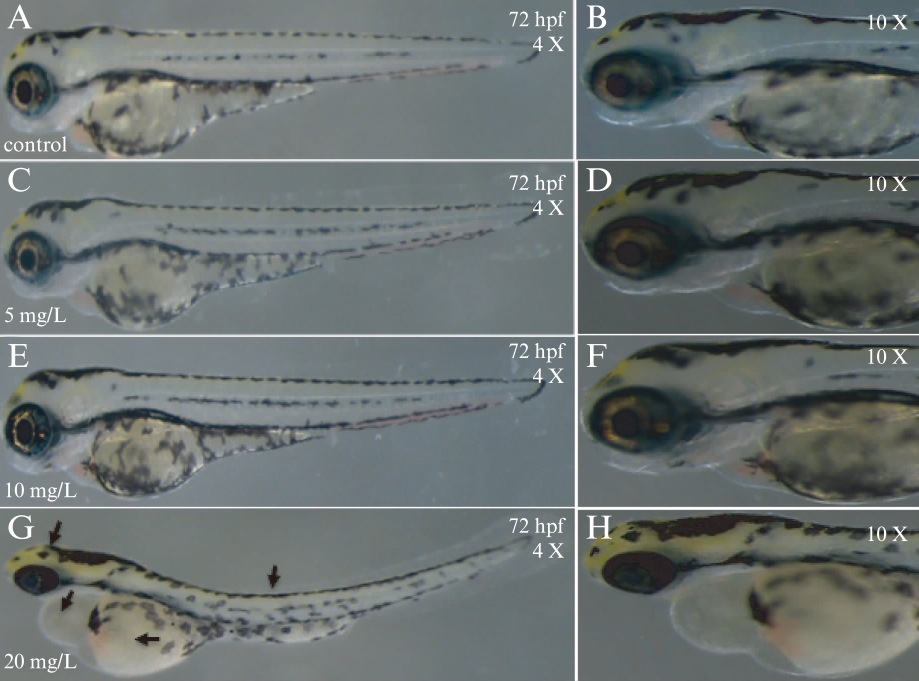
图2 不同浓度2,4-D组斑马鱼胚胎72bpf时发育情况
Fig.2 The development of zebrafish embryos with
different concentrations of 2,4-D at 72hpf
2.3 基因表达分析
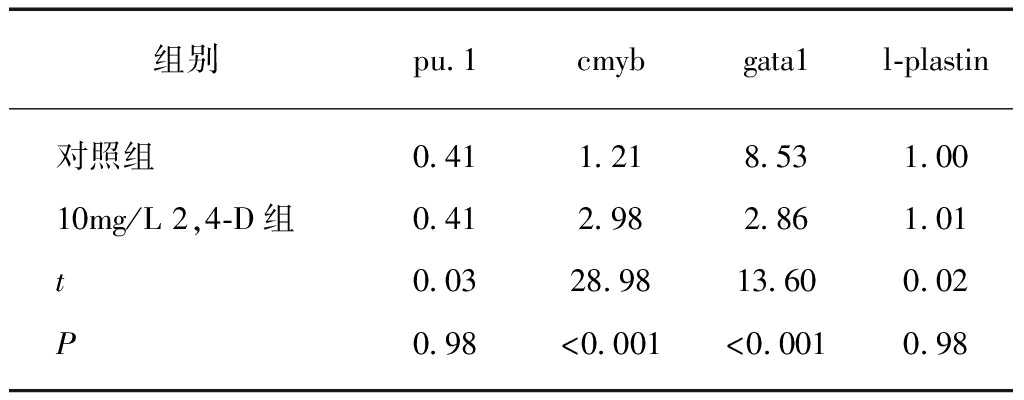
斑马鱼胚胎暴露于10mg/L 2,4-D水溶液48hpf 后,相比于对照组,造血干细胞标记基因cmyb(t=28.98,P<0.001)和原始红系祖细胞标记性基因gata1(t=7.176,P<0.001)表达量明显降低(P<0.001),粒一单核系细胞分化标记基因l-plastin(t=0.02,P=0.98)和pu.1(t=0.03,P=0.98)表达量并无明显改变,见表2。说明10mg/L 2,4-D水溶液暴露后对斑马鱼胚胎的造血干细胞标记基因cmyb和原始红系祖细胞标记基因gata1表达影响较大。
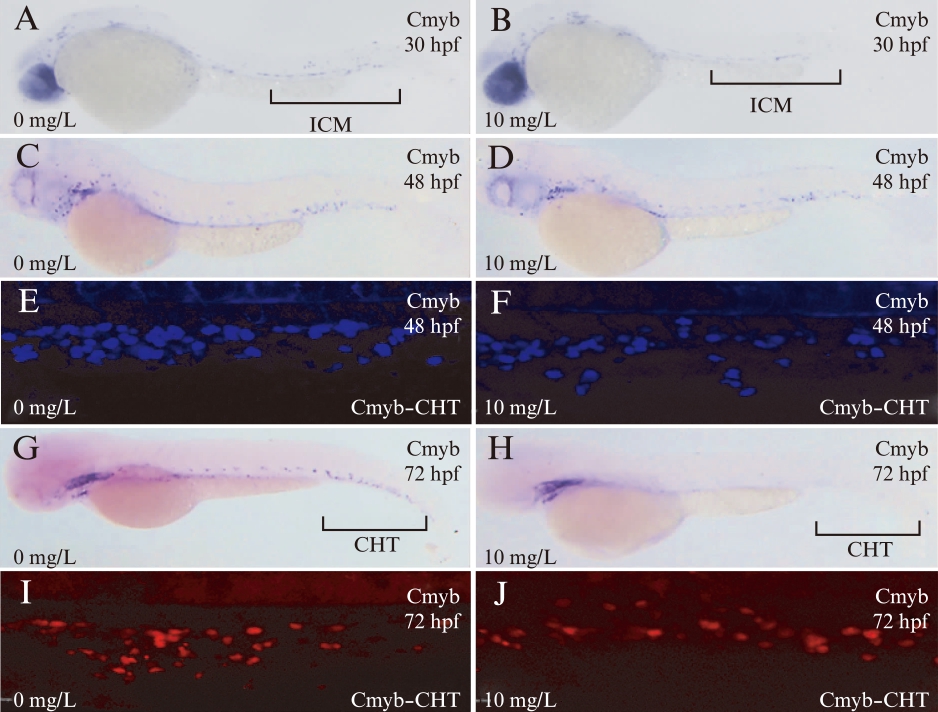
图3 10mg/L 2,4-D对斑马鱼胚胎干细胞分化的影响
Fig.3 Effect of 10mg/L 2,4-D on hematopoietic stem
cell differentiation in zebrafish embryos
表2 10mg/L 2,4-D对斑马鱼胚胎干细胞分化的影响
Fig.2 Effect of 10 mg/L 2,4-D on hematopoietic stem
cell differentiation in zebrafish embryos
组别pu.1cmybgata1l-plastin对照组0.411.218.531.0010mg/L 2,4-D组0.412.982.861.01t0.0328.9813.600.02P0.98<0.001<0.0010.98
3 讨 论
2,4-二氯苯氧乙酸(亦称2,4-D)已经使用超过60年,在进入市场销售的产品中超过600件商品检出2,4-D的残留,人类和生物体通过多种途径暴露于2,4-D。因此,2,4-D是一种潜在的生态风险因子,本研究利用良好的造血发育模型斑马鱼,观察急性毒性反应,检测血细胞发育相关基因的表达量变化和造血干细胞发育情况,以揭示2,4-D暴露后潜在的造血干细胞发育毒性及其机制。
造血干细胞是指具有自我更新能力并能分化为血细胞前体细胞,最终发育为成熟的血细胞,包括红细胞、白细胞和血小板。其自我更新和分化受到细胞内转录因子和信号网络的共同严密调控,任何自我更新和分化的调控异常都可能导致血液疾病发生[10]。Zhang等[11]研究发现抑制cmyb基因表达导致斑马鱼胚胎和成鱼造血干细胞迁移受阻,Mucenski等[12]敲除小鼠的cmyb基因,出现造血干细胞迁移和分化障碍,说明cmyb基因是造血干细胞维持正常功能的重要基因。Kubrak等[13]发现金鱼胚胎暴露于2,4-D水溶液后出现淋巴细胞数量减少。综合前人的研究成果,本研究假设2,4-D可能影响cmyb基因的表达导致造血干细胞发育毒性,并利用反转录聚合酶链反应检测造血发育基因表达,原位杂交观测cmyb基因的表达,然后在cmyb: eGFP转基因斑马鱼胚胎中进一步研究造血干细胞的发育情况。
本研究发现斑马鱼胚胎暴露于2,4-D水溶液中,出现造血干细胞毒性,表现为2,4-D暴露组cmyb基因表达量降低,同时cmyb荧光标记的造血干细胞数量减少。因此,斑马鱼胚胎暴露于2,4-D可能通过影响cmyb基因的表达导致造血干细胞发育毒性。但是,在本次研究中未能在cmyb基因蛋白水平和功能水平上,进一步阐述cmyb基因介导的2,4-D造血干细胞发育毒性。在未来的研究中,我们将着重于这两部分的研究,以期进一步了解2,4-D造血毒性的具体机制。
[1] MENEZES C, FONSECA M B, LEITEMPERGER J, et al. Commercial formulation containing 2,4-D affects biochemical parameters and morphological indices of silver catfish exposed for 90 days. Fish Physiol Biochem, 2015,41(2): 323-330.
[2] AYLWARD L L, HAYS S M. Interpreting biomonitoring data for 2,4-dichlorophenoxyacetic acid: update to Biomonitoring Equivalents and population biomonitoring data. Regul Toxicol Pharmacol, 2015,73(3): 765-769.
[3] GOODMAN J E, LOFTUS C T, ZU K. 2,4-Dichlorophenoxyacetic acid and non-Hodgkin’s lymphoma, gastric cancer, and prostate cancer: meta-analyses of the published literature. Ann Epidemiol, 2015,25(8): 626-636.
[4] THOMAS K W, DOSEMECI M, COBLE J B, et al. Assessment of a pesticide exposure intensity algorithm in the agricultural health study. J Expo Sci Environ Epidemiol, 2010,20(6): 559-569.
[5] AYLWARD L L, MORGAN M K, ARBUCKLE T E, et al. Biomonitoring data for 2,4-dichlorophenoxyacetic acid in the United States and Canada: interpretation in a public health risk assessment context using Biomonitoring Equivalents. Environ Health Perspect, 2010,118(2): 177-181.
[6] BURNS C J, SWAEN G M. Review of 2,4-dichlorophenoxyacetic acid(2,4-D) biomonitoring and epidemiology. Crit Rev Toxicol, 2012,42(9): 768-786.
[7] SANT K E, TIMME-LARAGY A R. Zebrafish as a model for toxicological perturbation of yolk and nutrition in the early embryo. Curr Environ Health Rep, 2018,5(1): 125-133.
[8] JAGANNATHAN-BOGDAN M, ZON L I. Hematopoiesis. Development, 2013,140(12): 2463-2467.
[9] PERLIN J R, ROBERTSON A L, ZON L I. Efforts to enhance blood stem cell engraftment: recent insights from zebrafish hematopoiesis. J Exp Med, 2017,214(10): 2817-2827.
[10] AYLWARD L L, HAYS S M. Biomonitoring Equivalents(BE) dossier for 2,4-dichlorophenoxyacetic acid(2,4-D). Regul Toxicol Pharmacol, 2008,51(3 Suppl): 37-48.
[11] 李亚梅,梁爱斌,汪俊帮,等.胎鼠不同造血部位的形态学和组织化学研究.同济大学学报(医学版),2016,37(3): 1-7.
[12] CALVI L M, LINK D C. The hematopoietic stem cell niche in homeostasis and disease. Blood, 2015,126(22): 2443-2451.
[13] ZHANG Y, JIN H, LI L, et al. cMyb regulates hematopoietic stem/progenitor cell mobilization during zebrafish hematopoiesis. Blood, 2011,118(15): 4093-4101.
[14] MUCENSKI M L, MCLAIN K, KIER A B, et al. A functional c-myb gene is required for normal murine fetal hepatic hematopoiesis. Cell, 1991,65(4): 677-689.
[15] KUBRAK O I, ATAMANIUK T M, STOREY K B, et al. Goldfish can recover after short-term exposure to 2,4-dichlorophenoxyacetate: use of blood parameters as vital biomarkers. Comp Biochem Physiol C Toxicol Pharmacol, 2013,157(3): 259-265.