泪道阻塞性疾病(larimal duct obstruction disease, LDOD)为临床常见眼科泪器疾病。LDOD主要临床表现为溢泪,可出现视物模糊、眼分泌物增加、鼻泪道周围皮肤不适等[1-2],有学者研究表示不可控制的溢泪严重影响患者生活质量及社交活动[3]。慢性LDOD本身虽非致盲性疾病,但若长时间未经治疗,可引起角膜病变等甚至失明。
目前LDOD治疗以泪道支架微创疗法为主,一般置入鼻泪道后2~3个月取出。传统泪道支架置入鼻泪道后,由于其本身无弹性舒缩功能,因此置入期间的整个泪道腔相对封闭,这与泪道腔的粘膜自身具备的舒缩功能不符。自制新型可舒缩泪道支架一定程度上保持泪道内壁固有的收缩弹性,且可清除泪道内炎性物质,从这点看应当具有广泛应用前景。对于其他如泪道损伤两步逆行封闭支架术等也同样适用。植入的支架产品能否数月存留体内并发挥功能,其材料组织相容性至关重要。本研究以临床传统泪道支架作对照,旨在评估自制新型可舒缩泪道支架组织相容性及应用安全性,为今后临床应用打下基础。
1 材料与方法
1.1 材料
健康清洁级新西兰大白兔(上海杰思捷实验动物有限公司提供)10只,13周龄,体质量2.0~2.5kg;健康SPF级昆明小鼠(上海杰思捷实验动物有限公司提供)78只,6~8周龄,体质量20~25g。新型可舒缩泪道支架购自天台康生医疗器械有限公司;泪道扩张引流管(ND-09B)购自杨中美迪硅胶医用制品有限公司;光学手术显微镜购自德国Leica DMR);苏木精-伊红(H-E)染液购自南京凯基生物科技发展有限公司;戊巴比妥钠购自美国Sigma公司;多聚甲醛购自微晶生物技术有限公司;电子天平购自深圳宇德立生物科技有限公司。
1.2 方法
1.2.1 毒性试验 60只昆明小鼠分7组,编号ABCDEFG组(前五组n=10,后两组n=5)。将可舒缩泪道支架和泪道扩张引流管各取长10mm,37℃无菌条件下用10mL NaCl浸提支架材料72h。将新型可舒缩泪道支架浸提液、泪道扩张引流管浸提液和生理盐水按20mL/kg、液体温度37℃±2℃分别对A、B、C组小鼠行腹腔注射,观察记录注射前及注射后14d各组有无异常反应及死亡情况。将新型可舒缩泪道支架浸提液、泪道扩张引流管浸提液分别滴于F、G组小鼠右眼,左眼均予生理盐水滴眼,每日1次,1滴/次,滴眼14d,观察滴眼前后两组小鼠眼表反应、饮食活动情况及死亡数量[8-11]。无菌条件下取新型可舒缩泪道支架材料和泪道扩张引流管材料各5mm分别植入D、E组小鼠腹腔内,观察植入后小鼠的生命活动和死亡情况。术前及术后2周测体质量,尾静脉取血测RBC、WBC。8周后处死小鼠,取心、肝、肾组织包埋切片H-E染色光镜检查。
1.2.2 肌肉刺激试验 4只新西兰大白兔,以30mg/kg剂量1.5%戊苯巴比妥钠耳缘静脉麻醉,无菌条件下取各支架材料10mm,观察材料表面条件、形状、尺寸、重量。常规动物手术操作将其分别植入脊柱两侧骶脊肌内(左侧: 新型可舒缩泪道支架,右侧: 泪道扩张引流管)。观察局部、全身情况和行为表现。若发现局部反应,则两试验材料不应放于同一试验动物上。术后4周、12周空气气栓各处死2只兔,肉眼观察植入处及周围反应,取出支架材料,观察支架材料表面条件、形状、尺寸、重量。取植入部位周围组织行H-E染色并进行组织病理学评价[12],参照医疗器械生物学评价ISO10993-6,具体分级如下: 0,0~2,9分无刺激;3,0~8,9分轻微刺激;9,0~15,0分中度刺激;>15,0分重度刺激。
1.2.3 过敏试验 18只昆明小鼠分3组(n=6)。按1.2.1所述制得浸提液。各组小鼠背部作6点对称的浸提液及生理盐水皮内注射,各点相距0.5cm。1周后观察有无过敏刺激反应。疑似有反应者或不明确者进行复试,最长观察时间可至21d[13]。
1.2.4 热原试验 6只新西兰大白兔分3组(n=2),实验前7d在同一环境条件下,体温均在正常范围(38.3℃~38.6℃)。按1.3.1所述制得浸提液。每次实验前30min内测兔体温,将浸提液及生理盐水自耳缘静脉注射(10mL/kg),注射后每小时测兔体温,共测3次,取体温最高一次减注射前体温,即为该兔体温升高度数。共做3次试验,每次实验至少隔4d[14]。
1.3 统计学处理
采用SPSS17.0对数据行统计学分析,计量数据均以![]() 表示,同一时间段两组计量资料比较使用独立样本t检验分析,不同时间点同组计量资料比较使用配对样本t检验分析,应用LSD-t检验进行组间多重比较,应用方差分析进行多组计量资料比较。P<0.05为差异具统计学意义。
表示,同一时间段两组计量资料比较使用独立样本t检验分析,不同时间点同组计量资料比较使用配对样本t检验分析,应用LSD-t检验进行组间多重比较,应用方差分析进行多组计量资料比较。P<0.05为差异具统计学意义。
2 结 果
2.1 传统泪道扩张引流管与新型可舒缩泪道支架一般情况比较
传统泪道扩张引流管与新型可舒缩泪道支架在长度上基本一样,其主要区别在于内部设计。传统泪道扩张引流管为单壁一体结构,具有固定粗细,不可调节,而新型可舒缩泪道支架设计有支架支撑内胆和外部扩张器两部分,其支撑内胆内径为4mm,由医用硅胶制成,见图1。外侧扩张管由聚丙烯(PP)、聚乙烯(PE)、聚酰胺(PA)及多种弹性材料制成,扩张管外侧含有微细小孔,通过注水孔注水及控制注水量可完成泪道支架管径大小的调节,见图2。

图1 传统泪道扩张引流管与新型可舒缩泪道支架的外观形态
Fig.1 The appearance of nasolacrimal duct expansion
drainage tube and novel dilatable lacrimal duct stent
A: 传统泪道扩张引流管;B: 新型可舒缩泪道支架
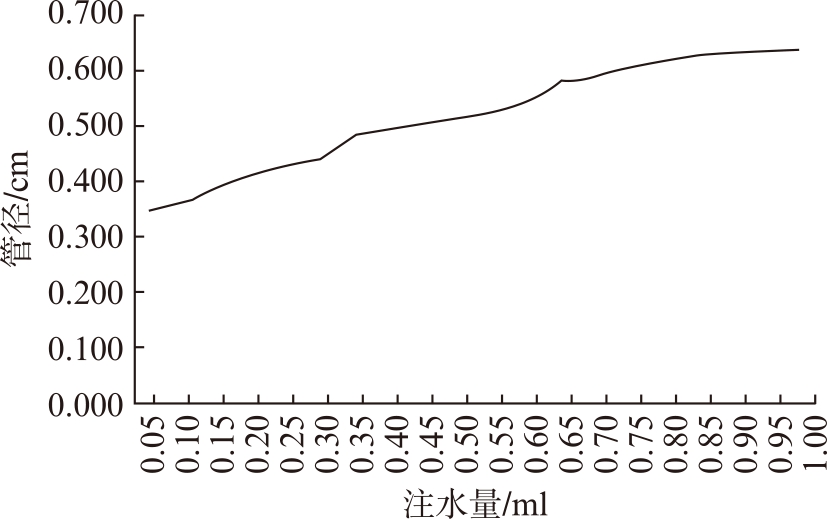
图2 新型可舒缩泪道支架球囊注水量与管径关系
Fig.2 The relationship between balloonwater injection
volume andpipe diameter of novel dilatable
lacrimal duct stent
2.2 毒性试验结果
A、B、C 3组小鼠腹腔注射后即出现精神萎靡、活动迟缓,2h内所有小鼠均恢复正常活动。注射后连续观察14d 3组小鼠生命活动正常,无中毒反应(抽搐、呼吸困难、尿失禁、大便失禁)及死亡现象。4个时间点(注射前、注射后24h、注射后7d、注射后14d)体质量情况示A、B、C组间均差异无统计学意义(P>0.05)。各组小鼠4个时间点体质量差异有统计学意义(P=0.000),但重复检测方差分析示组间无统计学意义(P=0.384)。F组小鼠浸提液滴眼后见流泪、结膜轻度充血现象,几次瞬目后恢复正常,未见角膜刺激症、角膜透明度改变、眼表炎症等明显炎症反应,与阴性对照组、G组无明显差别。D、E组小鼠术后3h内均恢复正常生命活动。两组小鼠平均体质量术前和术后2周差异无统计学意义(P=0.051;P=0.211),D组小鼠RBC、WBC术前及术后2周均在正常范围内无显著改变(P=0.399;P=0.431);E组RBC、WBC术前及术后2周均在正常范围内无显著变化(P=0.652;P=0.072)。术后8周取材,H-E染色结果示: 两组小鼠心、肝、肾细胞大致形态正常,组织轻微水肿,未见变性、坏死、空泡样变等异常。
2.3 肌肉刺激试验结果
仅2例植入新型可舒缩泪道管和1例植入泪道扩张引流管缝合口见轻微渗出,处理后愈合良好。肉眼未见兔局部或整体异常表现。术后4周,双侧植入部位及周围肌肉均未见明显充血积液、化脓及坏死等,支架材料形态、重量无变化。H-E染色见少量炎症细胞浸润,少量纤维、血管等结缔组织生长。新型可舒缩泪道支架组和泪道扩张引流管组评分分别为13,0分,12,0分,皆为中度刺激。术后12周,植入部位皮肤无异常,剖开后肉眼观未见明显充血、变性积液或坏死,材料清晰可见,表面可见纤维、毛细血管;H-E染色结果示新型可舒缩泪道支架组材料周围纤维结缔组织生长,肌纤维细胞核位于纤维周边部,组织结构清晰,无坏死、变性,未见明显炎症反应(图3A)。泪道扩张引流管组材料周围见纤维结缔组织增生,肌纤维未见明显病变,间质见少量炎症细胞浸润(图3B)。新型可舒缩泪道支架组和泪道扩张引流管组分别为5,0分,4,0分,皆属轻微刺激。
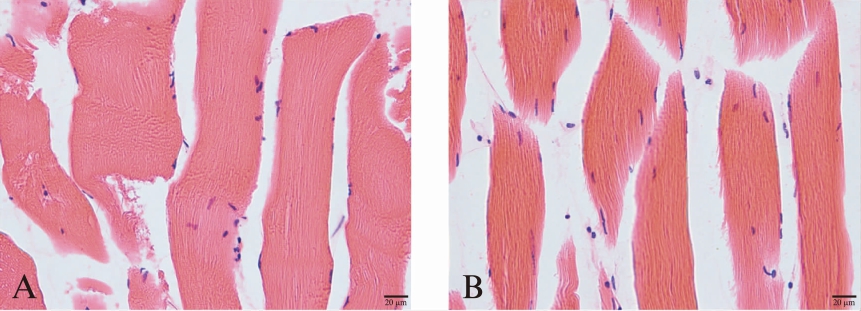
图3 肌肉刺激试验组织H-E染色
Fig.3 The histological view(H-E staining) of rabitt
muscle after stimulation test
A: 泪道扩张引流管支架材料置入兔骶脊肌12周后组织学切片,细胞核位于肌纤维周边部,结构清晰,未见明显炎症反应,见轻微结缔组织增生;B: 泪道扩张引流管支架材料置入兔骶脊肌12周后肌肉组织学切片,细胞核位于肌纤维周边部,结构清晰,少量炎细胞浸润
2.4 过敏试验结果
三组小鼠皮内注射1周后,均未见红斑、水肿、瘙痒等刺激反应。
2.5 热原试验结果
各组注射浸提液后体温变化见表1。两组体温升高均在0.4℃以内,且体温升高总度数在1.0℃以内。
3 讨 论
鼻泪管黏膜具有一定收缩功能,泪道扩张引流管的支撑对泪道有塑型作用,但管径大小固定的支架置于发生狭窄或阻塞的泪道2~3个月期间,易致泪道失去本身调节能力[15]且置管期间支架封闭泪道狭窄或阻塞处,易使原有慢性炎症加重而形成粘连或瘢痕,拔管后部分病例再次发生堵塞现象。而新型可舒缩泪道支架与传统泪道扩张引流管的不同在于其结构包括囊体和支架体且有间隙,可通过注水量的多少调节管径粗细,以实现支架的可舒缩。该优点一定程度上与泪道的收缩调节功能相适应。此外,充分扩张泪道后,缩小支架管径可以创造足够泪道空间以利于泪道冲洗,为泪道狭窄或阻塞的治疗提供良好的条件,因此具有很好的临床应用前景。
表1 支架浸提液兔耳缘静脉注射热原试验
Tab.1 The pyrogen test result of lacrimal stent extract
liquid injection (℃)
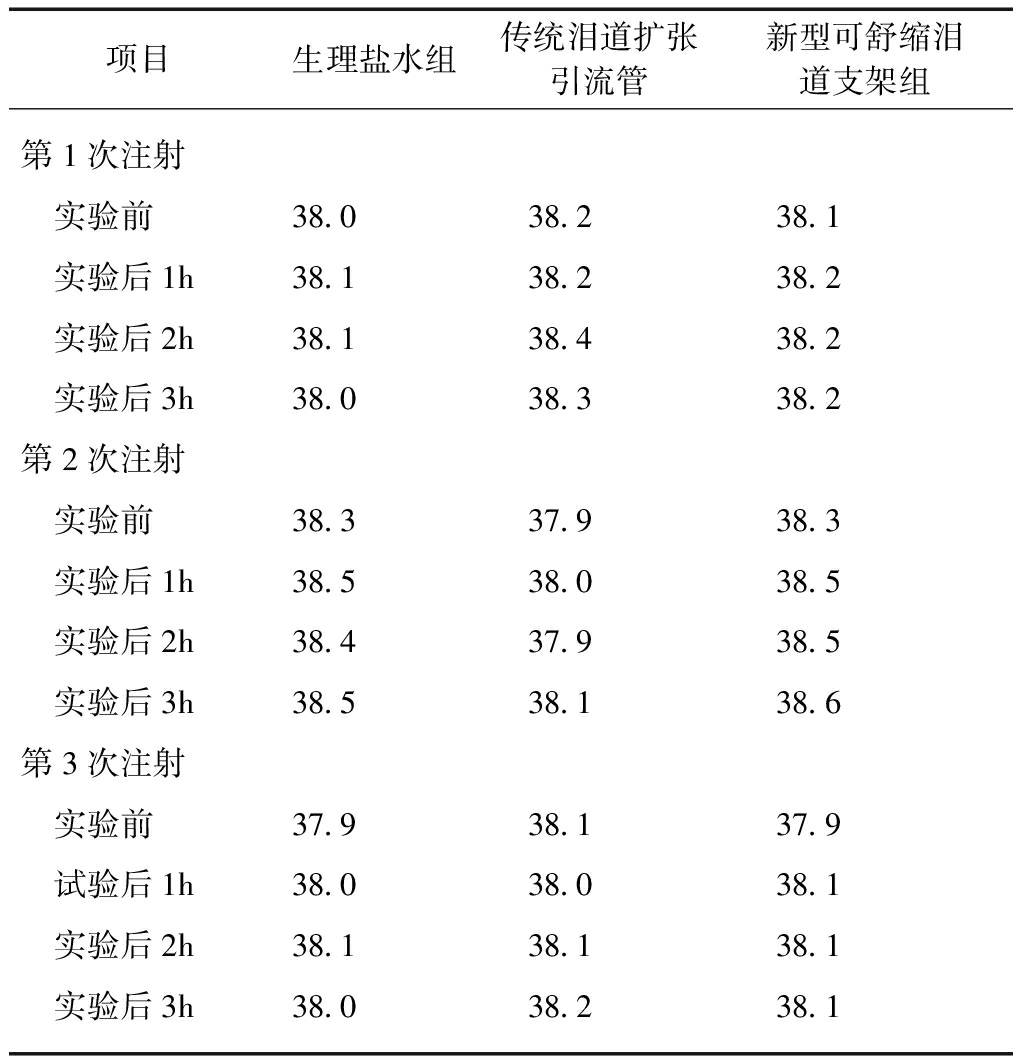
项目生理盐水组传统泪道扩张引流管新型可舒缩泪道支架组第1次注射 实验前38.038.238.1 实验后1h38.138.238.2 实验后2h38.138.438.2 实验后3h38.038.338.2第2次注射 实验前38.337.938.3 实验后1h38.538.038.5 实验后2h38.437.938.5 实验后3h38.538.138.6第3次注射 实验前37.938.137.9 试验后1h38.038.038.1 实验后2h38.138.138.1 实验后3h38.038.238.1
本新型可舒缩泪道支架主要由医用硅胶材料和RTV118胶水制成。加工制造过程中不可避免用到脱模剂、胶水等可能对机体产生刺激甚至损害。目前国际国内尚无对泪道支架组织相容性专门规章标准,因此参照国际医疗器械生物学评价ISO10993系列和国内医疗器械生物学评价GB/T 16886系列[16],以评估新型可舒缩泪道支架组织相容性。
毒性试验是研究组织相容性的重要部分,对于全身急性亚急性毒性试验若有两个或以上实验动物死亡、行为异常,或是3个或以上体质量变化超10%,则试验材料样品不符合医疗器械组织相容性评价。结果观察中小鼠腹腔注射随后精神萎靡、食欲不振,原因为小鼠腹腔注射后的急性反应。由于置管时材料与眼表直接接触,因此设计了局部急性亚急性毒性试验。因其术中与眼接触时间短,对内眼影响本实验未多加阐述。全身亚慢性毒性试验模拟了机体在反复或持续接触试验样品情况,可进一步佐证新型可舒缩泪道支架较好的组织相容性。
在体内,局部组织学反应被认为是评价支架生物相容性常规且重要的指标,因此本研究设计了肌肉刺激试验。支架材料植入兔肌肉后两周,实验动物的组织反应主要由手术创伤导致,同时手术技巧影响植入处的创伤反应,这段时间内难以与植入物造成变化相区别。但植入后4周及12周,两组肉眼及镜下观察结果均有相似的病理表现,提示自制新型可舒缩泪道支架组织相容性达到标准。我国医疗器械生物学评价GB/T 16886-4表示,异物植入肌肉和结缔组织,要到9~12周后其细胞群才可达到稳定状态[16]。本试验4周时,新型可舒缩泪道支架组和泪道扩张引流管组评分显示为中度刺激;12周时,新型可舒缩泪道支架组和泪道扩张引流管组评分提示轻微刺激。因此可推测,支架植入4周时周围组织炎症细胞浸润为机体应对异物的正常反应。植入物周围纤维包膜的形成被认为是材料与机体组织间的理想反应[11],且新型可舒缩泪道支架与泪道扩张引流管材料有相似的结果,提示前者有符合临床需求的局部组织学反应。
本研究证明了新型可舒缩泪道支架各项组织相容性指标均符合标准,与传统泪道扩张引流管具有相似的生物安全性。在制备过程中虽然使用了脱模剂、118胶水等,但经长时间真空抽滤干燥后,已在材料空隙中消失,不对生物体造成损害。
本研究仍存在一定不足。对于动物实验,直接将两组支架置于兔泪道内所得结果可能会更直观,但由于该新型可舒缩泪道支架是为人而设计,未单独针对兔的泪道解剖而设计模型,在后续研究中需进一步完善;此外,由于应用材料的生物安全性与其血液相容性也有一定关系[17],本研究未涉及相关研究,今后应努力完善。
[1] FU J M, OGIONK, MATSUYAMA H, et al. Success rates of daryoendoscopy guided probing forrealcitrant congenital nasolacrimal duct obstruction. Jpn Ophthalmol, 2016,60(4): 274-279.
[2] RAJAB M T, ZAVARZADEH N, MAHMOUDI A, et al. Biocanalicular versus monocanalicular intubation after failed probing in congenital nasilacrimal duct obstruction.Int J Ophthalmol, 2016,9(10): 1466-1470.
[3] OH J R, CHANG J H, YOON J S, et al. Change in qualify of life of patients undergoing silicone stent intubation for nasolacrimal duct stenosis combined with dry eye syndrome. Br J Ophthalmol, 2015,99(11): 1519-1522.
[4] 左志夏,夏智,刘亚会,等.逆行泪道置管术治疗鼻泪管阻塞疗效.国际眼科杂志, 2014,14(1): 167-68.
[5] 张敬先,邓宏伟,叶琳.泪道置管技术.中华眼科杂志, 2011,47(8): 765-767.
[6] BI Y, SUI G, ZHOU Q, et al. Two-step retrograde closed stenting: a novel method for treating canalicular lacerations in Chinese patients. Eye (Lond), 2013,27(11): 1275-1280.
[7] ZHANG S J, PEI Q G, PANK F, et al. Study on bio-compatibility of PLGA/HA in vivo. Chin J Dent Reser, 2007,17(1): 40-45.
[8] 国家质量监督检验检疫总局.GB/T 16886.11-2011.医疗器械生物学评价第11部分: 全身毒性试验.北京: 中国标准出版社,2011.
[9] 彭晔.多孔纳米钙磷陶瓷支架材料生物相容性分析.医学信息, 2015,28(44): 381-382.
[10] ZHANG S J, PEI Q G, PANK F, et al. Study on bio-compatibility of PLGA/HA in vivo. Chin J Dent Reser, 2007,17(1): 40-45.
[11] ASSAD M, CHERNYSHOVA, LEROUXMA, et al. A new porous titanium-alloy: part 2. sensitization, irritation and acute systemic toxicity evaluation. Biomed Mater Eng, 2002,12(4): 339-346.
[12] BOGUSLAWA Z, MARIA S, DANUTABRYLA, et al. Histology Evaluation of the local soft tissue reaction after implanting resorbable and non-resorbable monofilament fibers. Pollm Med, 2016,46(2): 135-143.
[13] ISO10993-10-2002. Biological evaluation of medical devices-Part 10: Test for irritation and delayed-type sensitivity.
[14] ZHANG S J, PEI Q G, PANK F, et al. Study on bio-compatibility of PLGA/HA in vivo. Chin J Dent Reser, 2007,17(1): 40-45.
[15] 刘振兴,周祁,陈冉冉,等.白内障超声乳化术后早期区域性角膜水肿的临床研究.同济大学学报(医学版),2016,37(1): 42-45.
[16] 国家质量监督检验检疫总局.GB/T 16886.6-2017.医疗器械生物学评价第6部分: 植入后局部反应试验.北京: 中国标准出版社,2017.