近年来,侵袭性真菌感染的发病率和死亡率增加,其中以念珠菌感染最常见[2]。念珠菌感染中白念珠菌占90%以上,然而随着广谱抗真菌药物的广泛使用,非白念珠菌发病率也逐渐上升[3]。研究表明,持续感染的真菌病灶中大多存在生物膜,生物膜是微生物群落为了自我保护而产生的黏附在非生物或生物材料表面的细胞外聚合物基质(ECM)包裹菌细胞群落的一种形态。念珠菌生物膜形成后,感染菌株的侵袭力和耐药性增加。两性霉素B(amphotericin B, AMB)为一种广谱杀真菌药物,临床使用较广,常用以治疗复杂真菌感染。而该药因肾毒性较大限制了其在临床上的应用。研究表明,人参茎叶皂苷(Ginseng stem-leaf saponins,GSLS)具有一定的抗真菌作用,与氟康唑联合使用时可以增加其对念珠菌的抗菌活性。本研究将人参茎叶皂苷与两性霉素B联合应用于念珠菌生物膜,观察二者是否具有协同作用,为临床治疗提供新思路。
1 材料与方法
1.1 菌种来源
白念珠菌90028由复旦大学附属华山医院真菌室馈赠;白念珠菌SC5134、ATCC22086由同济大学姜远英教授实验室馈赠;近平滑念珠菌ATCC22019由同济大学附属同济医院皮肤科真菌室提供。临床分离株: 15株由海军医科大学附属长征医院真菌分子生物学重点实验室馈赠;13株由同济大学附属同济医院检验科及真菌室提供;3株由宁波市鄞州区人民医院检验科提供。它们分别来自血液、脑脊液、腹腔引流液等体液。
1.2 抗真菌药物和试剂
两性霉素B购自美国Sigma公司;人参茎叶皂苷购自中国药品生物制品检定所;二甲基亚砜(DMSO)、甲基四氮盐(XTT)、VitK3、1640培养液购自美国Sigma公司;PBS购自上海捷瑞生物工程有限公司;结晶紫粉末购自Biosharp公司。
1.3 菌株鉴定
将分离纯化的菌株接种于SDA培养基,按照之前的方法对所有菌株提取DNA并进行ITS基因扩增测序及β-tubulin基因扩增测序,对其进行分子鉴定。
1.4 生物膜的制备
将分离纯化的菌株接种到YPD液体培养基中,37℃摇床培养18~36h,采集对数期的细胞。用YPD培养液调整密度至1×107/mL,除第1列(阴性对照),96孔培养板各孔均加入100μL标准菌液,37℃孵育90min。弃悬浮液,PBS缓冲溶液(pH7.2)清洗3遍。去悬浮细胞,加入200μL的1640培养液,37℃培养48h。弃悬浮液,PBS(pH7.2)冲洗3次(动作轻柔,切勿破坏生物膜)。
1.5 体外药敏及生物膜活力测定[8-9]
参照M38-A2方案,用二甲亚砜将两性霉素B及人参茎叶皂苷粉末分别配置成浓度为1600μg/mL及5120μg/mL母液(-80℃遮光保存)。随后用1640培养液将两性霉素B母液倍比稀释成0.25~128μg/mL 10个浓度梯度,人参茎叶皂苷倍比稀释成0.5~256μg/mL。甲基四氮盐用PBS配制成浓度为0.5mg/mL溶液,VitK3用100%丙酮配制成浓度为10mmol/L溶液,过滤除菌后分装保存在-70℃。采用棋盘稀释法(8×12)进行联合药敏试验。第1列(阴性对照)仅加入1640培养液。2~11列按照浓度由高到低依次加入100μl的AMB溶液,96孔板A~G行按浓度由高到低依次加入100μL GSLS。第12列仅加入GSLS,第H行仅加入AMB的作为单药对照。置37℃培养箱48h。弃悬浮液,PBS轻柔(pH7.2)清洗3次后每孔加入100μL XTT/VitK3溶液,以XTT法测定生物膜活性。所有试验重复3次。
1.6 AMB与GSLS作用形式评价
用部分抑制浓度指数(fractional inhibitory concentration index, FICI)评价AMB与GSLS的作用形式。FICI的计算方法为: FICI=(MICAMB联用/MICAMB单用)+(MICGSLS联用/MICGSLS单用)。其中,FICI≥4表现为拮抗作用,1≤FICI<4表现为无关作用,0.5 将96孔板培养好的生物膜置室温2h后每孔加入150μL 99%的甲醇固定,室温作用20min后弃甲醇,过夜干燥。向各孔中加入150μL 0.5%结晶紫溶液,室温作用15min后以双蒸水清洗止无色素洗脱为止。每孔加入100μL 95%乙醇洗脱生物膜中的结晶紫,室温静置约30min后取各孔75μL有色上清液置于新的96孔板中,酶标仪(美国Thermo公司)测定570nm波长的吸光度(A570)。所有试验重复3次。 数据统计采用SPSS 20.0统计学软件,医院分离株对药物的敏感性差异比较采用Kruslal-Wallis秩和检验法。P<0.05为差异有统计学意义。 31株念珠菌中,其中白念珠菌16株、近平滑念珠菌6株、热带念珠菌8株,季也蒙念珠菌1株。 对于标准菌株,药物单用时,可观察到AMB具有强耐药性,(sessile minimal inhibition concentration, sMIC90)为8~64μg/mL;GSLS的sMIC90>256μg/mL;两药联用时,AMB和GSLS对受试菌株的sMIC90分别减少了3/4~15/16和7/8,见表1。 表1 AMB联合GSLS体外抗白念珠菌、近平滑念珠菌 Tab.1 Interaction of amphotericin B and ginseng 菌系sMIC90/(μg·mL-1)单用联合AMBGSLSAMBGSLSFICI结果9002864>2564160.125协同ATCC220868>2562160.273协同SC513416>2564320.375协同ATCC2201964>2564320.187协同 sMIC为菌株处于生物膜状态下的最低抑菌浓度 16株临床白念珠菌药敏。结果显示,药物单用时,AMB和GSLS的sMIC90分别为16~128μg/mL、>256μg/mL;两药联用时,AMB和GSLS对受试菌株的sMIC90分别减少了3/4~15/16和7/8。FICI指数显示,在所有的菌株联合用药显示出协同抗真菌作用,见表2。 表2 AMB联合GSLS体外抗临床白念珠菌生物膜药敏结果 Tab.2 Interaction of amphotericin B and ginseng 菌株药名sMIC90/(μg·mL-1)单独联合FICI结果1AMB6440.094协同GSLS>25682AMB1680.128协同GSLS>256163AMB3280.312协同GSLS>25684AMB6440.187协同GSLS>256325AMB1640.281协同GSLS>25686AMB3240.187协同GSLS>256167AMB6440.125协同GSLS>256168AMB64160.312协同GSLS>256169AMB12880.093协同GSLS>256810AMB128160.250协同GSLS>2563211AMB1640.312协同GSLS>2561612AMB12880.125协同GSLS>2561613AMB3280.375协同GSLS>2563214AMB128160.250协同GSLS>2563215AMB64160.281协同GSLS>256816AMB12880.187协同GSLS>25632 临床分离株近平滑念珠菌、热带念珠菌、季也蒙念珠菌实验结果显示,当药物单用时,AMB和GSLS的48h的sMIC90分别为16~128μg/mL、>256μg/mL;当两药联用时,AMB和GSLS的48h sMIC90分别减少了3/4~31/32和7/8。所用菌株FICI值均≤0.5,显示出协同抗真菌作用,差异有统计学意义(P<0.05),见表3、4。 表3 AMB联合GSLS体外抗近平滑念珠菌生物膜药敏结果 Tab.3 Interaction of Aamphotericin B and ginseng 菌株药名sMIC90/(μg·mL-1)单独联合FICI结果1AMB3240.187协同GSLS>256162AMB128160.250协同GSLS>256323AMB128160.250协同GSLS>256324AMB128320.375协同GSLS>256325AMB128160.250协同GSLS>256326AMB64160.375协同GSLS>25632 表4 AMB联合GSLS体外抗热带念珠菌生物膜药敏结果 Tab.4 Interaction of amphotericin B and ginseng 菌株药名sMIC90/(μg·mL-1)单独联合FICI结果1AMB1610.187协同GSLS>256322AMB6440.187协同GSLS>256323AMB3280.375协同GSLS>256324AMB64160.265协同GSLS>256325AMB6420.046协同GSLS>25646AMB12820.046协同GSLS>25687AMB128320.375协同GSLS>256328AMB64160.312协同GSLS>25616 上述的XTT法只能检测有活性的细胞,而结晶紫法可以检测活细胞、死细胞及生物膜中细胞外基质。与单独运用AMB和GSLS相比,将AMB与GSLS联合作用于白念珠菌、近平滑念珠菌、热带念珠菌、季也蒙念珠菌4种菌株时,生物膜的生成量均明显减少(P<0.05),与XTT减低法测定的结果相同,见表5。 表5 结晶紫染色减低法测定生物膜结果 Fig.5 The biofilm total of Candida by the crystal 组别白念珠菌近平滑念珠菌热带念珠菌季也蒙念珠菌N0.2550.3610.3600.263AMB0.2120.1520.1530.124A+G0.1320.3000.3080.211GSLS0.2500.3600.3620.256 真菌感染,特别是侵袭性真菌感染的发病率、致死率呈逐年上升的趋势,以白念珠菌为代表的念珠菌感染率与病死率逐年增长。在念珠菌致病过程中,生物膜的形成发挥了重要的作用。念珠菌生物膜形成后,感染菌株的侵袭力和耐药性增加。研究表明,在体外,生物膜几乎对目前所有已知的抗真菌药物均显示出明显的耐药性。 本实验采用FICI评价AMB与GSLS的作用形式,用XTT法直观反映活菌数的百分比,XTT在有甲萘醒(电子转移剂)存在时,在活细胞内被还原成可溶性的棕色产物,用酶标仪测定溶液值,来判断细胞的生长活性[11]。用XTT法测试结果显示,AMB单用时不能显著抑制白念珠菌生物膜中菌株的生长,而加入GSLS时,所有试验菌株的FICI值均在0.5以下,也就是都体现出协同作用。说明AMB单用时不能显著抑制白念珠菌生物膜中菌株的生长,而加入GSLS时,AMB的抗真菌作用显著增强,表明GSLS能增强其体外抗生物膜活性。虽然在过去的几十年中,白念珠菌在院内真菌感染中是最主要的致病真菌,但非白念珠菌感染的病例也在不断上升[12]。本研究应用同样的方法评估了AMB和GSLS对近平滑念珠菌标准株及临床株、热带念珠菌临床分离株、季也蒙念珠菌临床分离株生物膜的联合作用效果,结果显示均具有协同抑制作用。 用结晶紫定量法(CV)对念珠菌生物膜进行测定试验中,尽管CV法不能够很好的区分生物膜中的死细胞、活细胞和生物膜基质,但是它能够较好地测定生物膜生成量在药物作用下的变化。本研究发现GSLS联合AMB与GSLS、AMB单用相比,能明显减少念珠菌生物膜的产生(P<0.5)。AMB联合GSLS能够明显增加成熟念珠菌生物膜药物的敏感性。 本研究通过XTT减低法和CV法对念珠菌生物膜在抗真菌药物敏感性试验中的结果基本一致,研究结果显示: GSLS与AMB联用对白念珠菌、近平滑念珠菌、热带念珠菌、季也蒙念珠菌生物膜均具有较强的协同抑制作用。尽管目前GSLS的药理作用还未得到证实,但是研究人员认为GSLS可能是通过结合真菌细胞膜的甾醇类而使真菌细胞破裂,从而达到杀菌的效果;当两药联用时,GSLS可能是非特异性地改变生物膜中细胞外基质成分和破坏生物膜的完整性,使得AMB容易到达真菌细胞内,从而加强AMB的杀菌作用,因此两者出现较强的协同作用。研究表明,生物膜形成是真菌感染引起的许多疾病的发病机制,也使疾病进展变得越来越复杂[15]。随着对真菌生物膜的形成机制和耐药机制研究的深入,以及单一药物效果有限、副作用严重、对药物产生耐药性这些都限制了单一抗真菌药物的使用,因此,需要研究者不断发现新的抗真菌药物和治疗方案。本研究发现GSLS能够显著增强AMB抗念珠菌生物膜的作用,为体外或者原位生物膜依赖性的真菌感染,特别是为深部真菌感染的防治带来了希望,但有关机制需要进一步深入研究。 [1] SILVA N C, NERY J M, DIAS A L T. Aspartic proteinases of Candida, spp.: role in pathogenicity and antifungal resistance. Mycoses, 2014,57(1): 1-11. [2] SILVA S, NEGRI M, HENRIQUES M, et al. Candida glabrata, Candida parapsilosis and Candida tropicalis: biology, epidemiology, pathogenicity and antifungal resistance. FEMS Microbiol Rev, 2012,36(2): 288-305. [3] 邓琳,孔庆涛,陈军,等.1135株临床念珠菌分布特征和药敏结果分析.中国真菌学杂志,2016,11(3): 160-165. [4] MITCHELL K F, ZARNOWSKI R, ANDES D R. Fungal super glue: the biofilm matrix and its composition, assembly, and functions. PLoS Pathog, 2016,12(9): e1005828. [5] VEDIYAPPAN G, ROSSIGNOL T, D’ENFERT C. Interaction of Candida albicans biofilms with antifungals: transcriptional response and binding of antifungals to beta-glucans. Antimicrob Agents Chemother, 2010,54(5): 2096. [6] FERN [7] KIM M N, SHIN J H, SUNG H, et al. Candida haemulonii and closely related species at 5 university hospitals in Korea: identification, antifungal susceptibility, and clinical features. Clin Infect Dis, 2009,48: e57-61. [8] SIMITSOPOULOU M, CHATZIMOSCHOU A, ROILIDES E. Biofilms and Antifungal Susceptibility Testing . Methods Mol Biol, 2016,1356: 183-197. [9] 方甜甜,宋沧桑,李兴德,等.阿司匹林与两性霉素B对白色念珠菌生物膜的体外联合作用研究.中国药物评价,2014,31(4): 202-204. [10] SIMITSOPOULOU M, CHATZIMOSCHOU A, ROILIDES E. Biofilms and antifungal susceptibility testing. Methods Mol Biol, 2016,1356: 183-197. [11] 周亚滨.阿司匹林与两性霉素B联合应用抑制念珠菌生物被膜效应的研究.济南: 山东大学,2013. [12] GUO F, YANG Y, KANG Y, et al. Invasive candidiasis in intensive care units in China: a multicentre prospective observational study. J Antimicrobial Chemoth, 2013,68(7): 1660-1668. [13] 冀燕芬,张莉莉,邓淑文,等.烟曲霉临床菌株对体外抗真菌药物的敏感性研究.同济大学学报(医学版),2017,38(1): 74-79.1.7 结晶紫分光光度法测定生物膜量[10]
1.8 统计学处理
2 结 果
2.1 菌种的鉴定结果
2.2 两性霉素B联合人参茎叶皂苷抗念珠菌生物膜药敏结果
标准株生物膜药敏结果
stem-leaf saponins against standard strains of Candida
albicans, Candida parapsilosis biofilm in vitro by
microdilution assay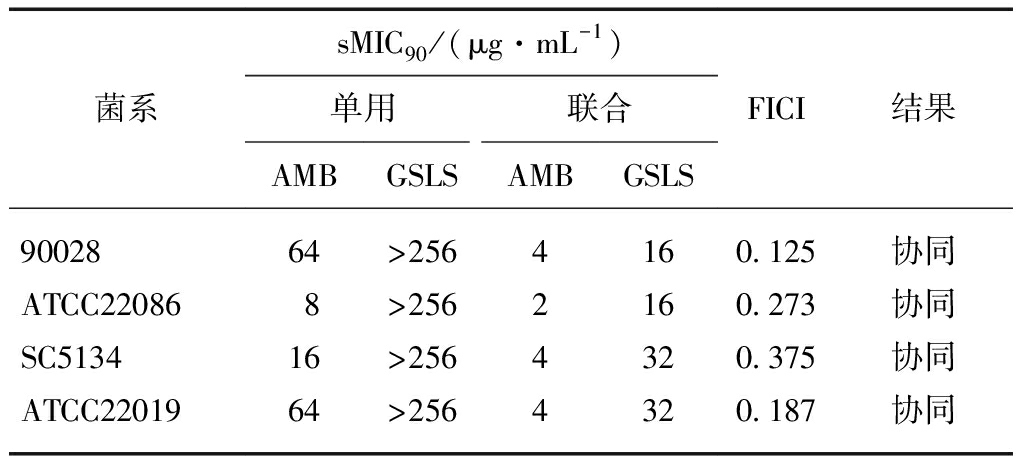
stem-leaf saponins against clinical Candida albicans
isolates biofilm in vitro by microdilution assay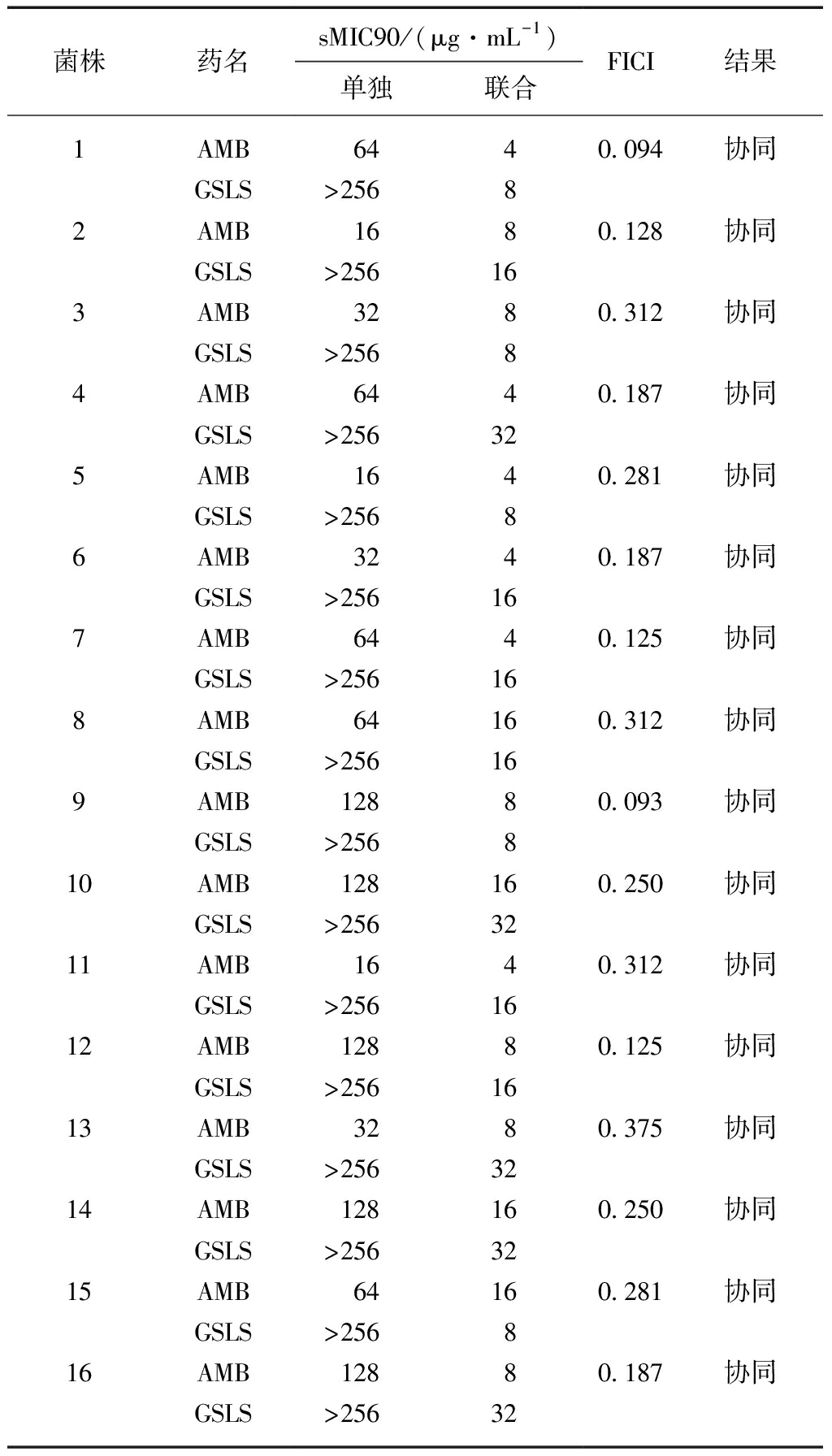
stem-leaf saponins against clinical Candida parapsilosis
isolates biofilm by microdilution assay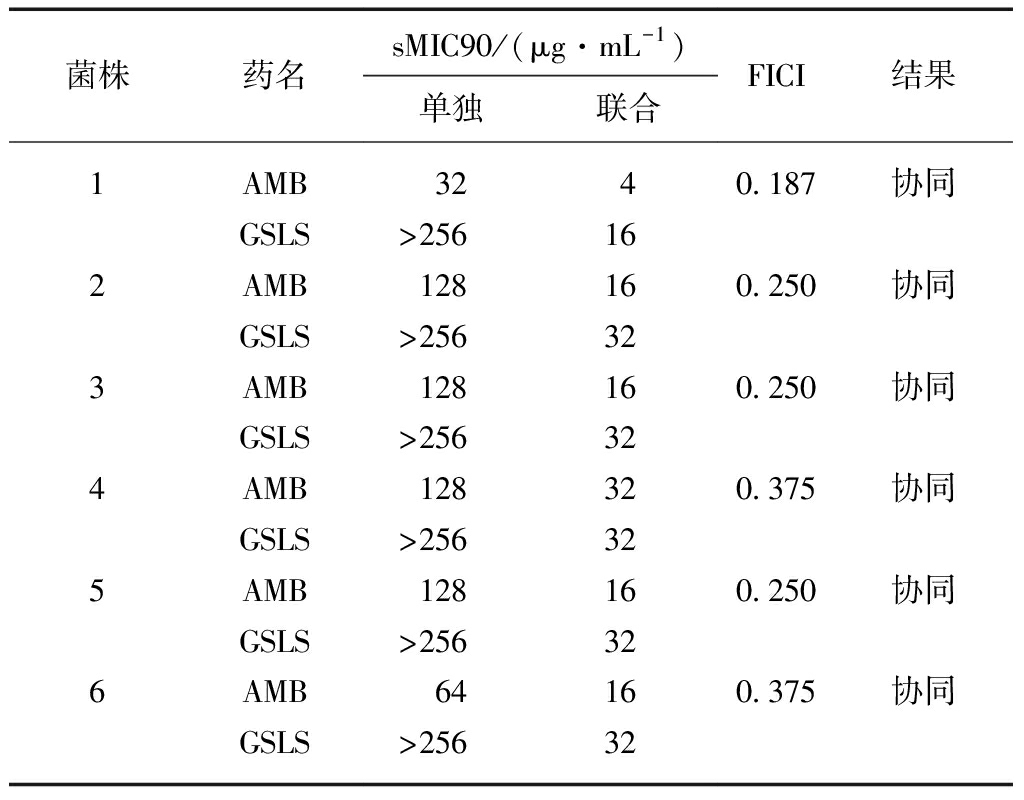
stem-leaf saponins against clinical Candida tropicalis
isolates by microdilution assay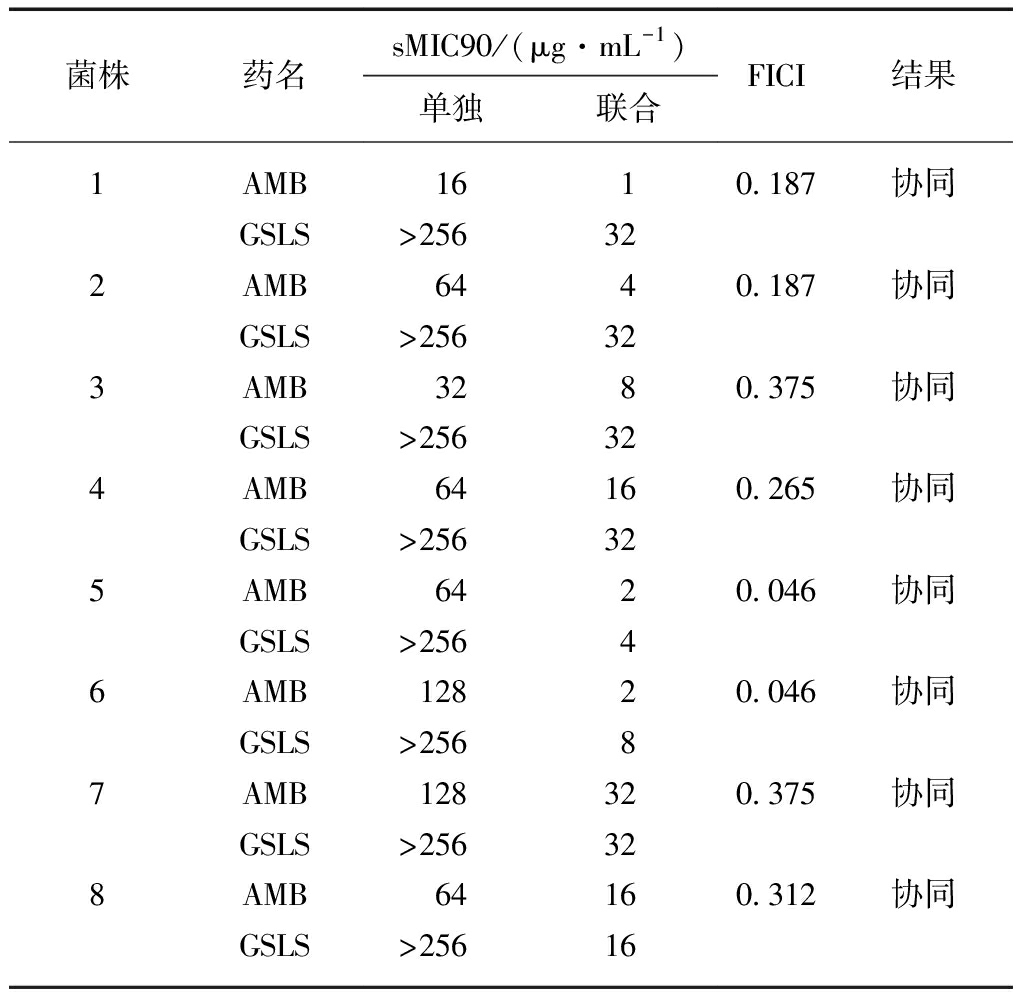
2.3 结晶紫定量生物膜的量
violet spectrophotometry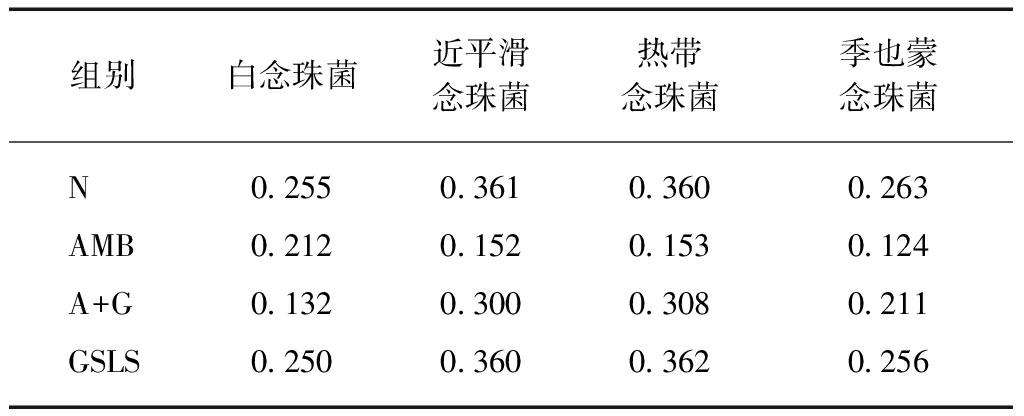
3 讨 论
 N R, DE P E, BALLESTEROS M P, ET AL. Unmet clinical needs in the treatment of systemic fungal infections: The role of amphotericin B and drug targeting. Int J Pharm, 2017,525(1): 139-148.
N R, DE P E, BALLESTEROS M P, ET AL. Unmet clinical needs in the treatment of systemic fungal infections: The role of amphotericin B and drug targeting. Int J Pharm, 2017,525(1): 139-148.