CBD的氨基酸序列TKKTLRT是胶原酶酶解Ⅰ型胶原蛋白的识别序列,能特异性地与Ⅰ型胶原上的α2链结合。Ⅰ型胶原蛋白是目前最广泛使用的天然植入材料之一,通过将CBD序列重组到蛋白类药物上,使重组药物可以吸附在Ⅰ型胶原蛋白上,形成药物缓释系统,将蛋白类药物缓慢释放到局部环境中[2-4]。因为Ⅰ型胶原蛋白是哺乳动物体内含量最高的蛋白,也有报道直接将重组蛋白直接注射到组织内,依靠自体胶原蛋白达到缓释的效果[3,6]。
IL-4是20世纪80年代发现的一类多功能多效应细胞因子,一直以来都是研究的热点。它由激活的T细胞、肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞产生,并对感染性疾病、自身免疫性疾病、神经系统疾病和肿瘤等疾病发挥积极的治疗作用。IL-4还可以激活巨噬细胞朝着M2的方向分化,而M2巨噬细胞具有降低局部炎症,促进组织修复的功能[9-10]。本研究构建了pET-30a-IL-4-CBD-His Tag质粒载体,并通过组氨酸标签纯化了IL-4-CBD-His Tag蛋白,经与天然的IL-4对比,证实其具有正常的细胞活性,并具有胶原依赖的缓释功能。
1 材料与方法
1.1 材料
质粒pET-30a(+)为实验室自有;大肠杆菌BL21购自天根生化科技有限公司(货号: CB105);限制性核酸内切酶NdeⅠ和EcorⅠ从New England Biolabs公司购买获得;同源重组试剂盒HieffCloneTM Plus One Step Cloning Kit购自上海翊圣生物科技有限公司(货号: 10911);质粒提取试剂盒、DNA凝胶回收试剂盒、DNA片段纯化试剂和蛋白分子量标准Marker均购自宝日医生物技术(北京)有限公司。His60镍柱购自GE医疗集团;qPCRmix购自Roche公司;Ⅰ型胶原蛋白溶液购自索莱宝科技有限公司(货号: C8062);Ⅰ型胶原蛋白膜购自贝迪生物工程股份有限公司;商业化的IL-4购自R&D Systems公司(货号: 404-ML)
1.2 方法
1.2.1 克隆载体的构建 按照大肠杆菌密码子的偏爱性,在不改变IL-4氨基酸序列的前提下,对GenBank中的小鼠IL-4核苷酸序列(NM_021283)进行密码子优化,然后委托苏州金唯智生物科技有限公司合成核苷酸序列。
依次以F1和R1、F1和R2、F1和R3为引物对进行三轮PCR扩增,获得具有pET-30a(+)同源序列的IL-4-CBD-His Tag扩增产物,引物序列如下。F1: 5′-AGAAGGAGATATACATATGCATATTCATGGCTG-CGATAAAAACC-3′;R1: 5′-GGTACGCAGGGTT-TTTTTGGTGTGATGGCTATAATCCATCTGCATA-ATGCT-3′;R2: 5′-TCATTAGTGATGGTGATGGT-GGTGGGTACGCAGGGTTTTTTTGGTGTG-3′;R3: 5′-ACGGAGCTCGAATTCGTCATTAGTGATGGTG-ATGGTGGTGG-3′。
同时,依次以F1和R4、F1和R3为引物对进行两轮PCR扩增,获得带有pET-30a(+)同源序列的IL-4-His Tag扩增产物,以其作为无CBD序列的对照组。R4的引物序列为5′-TCATTAGTGATGGTGAT-GGTGGTGGCTATAATCCATCTGCATAATGCT-3′。
采用TaKaRa片段回收试剂盒分别对IL-4-CBD-His Tag和IL-4-His Tag扩增产物进行纯化,采用限制性核酸内切酶NdeⅠ和EcoRⅠ对原核表达载体pET-30a(+)进行双酶切,采用DNA凝胶回收试剂盒对双酶切载体进行电泳分离和切胶回收纯化。分别将IL-4-CBD-His Tag和IL-4-His Tag与双酶切载体进行同源重组,构建分别表达IL-4-CBD-His Tag和IL-4-His Tag的重组载体。随后,经转化、挑取单克隆、测序等步骤,验证重组载体是否克隆正确。
1.2.2 重组蛋白的表达与纯化 将测序验证正确的载体转化进大肠杆菌BL21进行表达。挑取单克隆,接种到2mL LB培养基,37℃培养12h后将细菌转移到新的200mL LB液体培养基中继续培养,待吸光度值达到约0.6,加入终浓度为0.8mmol/L的IPTG(异丙基-β-D-硫代吡喃半乳糖苷),诱导12h后,8000r/min,离心半径10cm,4℃离心15min,收集菌体。40mL含终浓度0.5% Triton×100和1mmol/L PMSF的预冷PBS重悬菌体,超声碎菌后,8000r/min 4℃离心15min,收集沉淀,加入镍柱纯化的binding buffer(20mmol/L Na3PO4、500mmol/L NaCl、10mmol/L 咪唑、6mol/L盐酸胍pH 8.0)5mL重悬沉淀,室温孵育30min,8000r/min,4℃离心15min,收集上清液,进行镍柱纯化操作,所使用的washing buffer成分为20mmol/L Na3PO4、500mmol/L NaCl、20mmol/L咪唑和6mol/L盐酸胍,Elution buffer成分为20mmol/L Na3PO4、500mmol/L NaCl、500mmol/L咪唑和6mol/L盐酸胍。将洗脱下来的目的蛋白装在截留分子质量8000的透析袋中进行透析。透析液为含有1mmol/L GSH、0.1mmol/L GSSH和4mol/L盐酸胍的PBS缓冲液,逐渐降低盐酸胍的浓度进行梯度复性,最后的透析液换成PBS。复性后,2000r/min 4℃离心15min去除未复性成功的沉淀物,上清中即是目的蛋白。
1.2.3 IL-4的生物活性检测 使用预冷的含2%胎牛血清(FBS)的PBS从C57小鼠的股骨和胫骨中冲出骨髓细胞,红细胞裂解液去除红细胞,以每孔1×106细胞的量接种在6孔板中,所用培养基为Iscove’s Modified Dulbecco’s Medium(IMDM)+10% FBS+1%双抗(青霉素链霉素混合液)+15% L-929细胞上清(含有巨噬细胞集落因子MCSF),第4天换液去除未贴壁细胞,第7天获得成熟的巨噬细胞。将培养板分成3组分别加入终浓度20pmol/L IL-4-CBD-His Tag、IL-4-His Tag和商业化IL-4。24h后收集细胞,提取RNA,采用qPCR实验检测M2巨噬细胞ArgI、Egr2和CD38基因的表达。同时收集细胞上清,检测M2巨噬细胞IL-10的分泌量。
1.2.4 胶原蛋白对CBD-IL-4的吸附实验 在IL-4的吸附效果分析实验中,对夹心法ELISA进行了改进。首先,将Ⅰ型胶原蛋白铺在96孔板中,使其在孔底形成一层薄膜,重组蛋白在与胶原膜孵育后,被吸附在胶原膜上的IL-4能够与生物素化的IL-4抗体结合,经过酶联反应,吸附的IL-4的信号被放大,通过酶标仪在450nm波长处检测吸光度。根据吸光度值可间接确定吸附在胶原膜上的IL-4的量。
具体步骤为: 将0.01mg/mL鼠尾Ⅰ型胶原蛋白溶液以每孔100μL的量加入96孔板中,放置过夜后倒出溶液,PBS洗3次后,每孔加入含3%FBS的PBS,37℃孵育1h,随后加入梯度稀释的CBD-IL-4-His Tag、IL-4-His Tag和CBD-His Tag 100μL,37℃孵育1h后,倒掉溶液并用PBS洗5次,随后采用小鼠IL-4 ELISA检测试剂盒检测IL-4的含量。
1.2.5 IL-4-CBD-His Tag缓释实验 首先对胶原蛋白膜进行交联以增加其韧性和硬度,避免在长期浸入到水中时发生溶胀。将胶原蛋白膜剪成0.4cm×0.4cm的方形,浸到4mL含有1mg/mL 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和0.6mg/mL N-羟基丁二酰亚胺的MES(pH 6.5)缓冲液中进行交联,37℃孵育4h后,使用4mol/L NaCl和去离子水洗涤1h,随后在冻干机中冻干。将10μL 5μmol/L的CBD-IL-4-His Tag和IL-4-His Tag分别滴到胶原蛋白膜上,37℃静置30min让溶液完全吸收,加入1mL PBS,放置于转速为100r/min、37℃摇床中,每隔12h更换一次PBS,最后ELISA检测每次更换下来的PBS中含有的IL-4的量。
1.3 统计学处理
所有数据处理通过GraphPad Prism完成,采用t检验分析差异。P<0.05为差异有统计意义。
2 结 果
2.1 载体构建与重组蛋白表达纯化
通过在PCR引物上引入pET-30a(+)同源序列和CBD-His Tag或His Tag,分别获得了具有pET-30a(+)同源臂的IL-4-CBD-His Tag及IL-4-His Tag片段,在同源重组酶的作用下,顺利重组到pET-30a(+)载体上,测序验证重组载体构建成功。结构示意见图1。
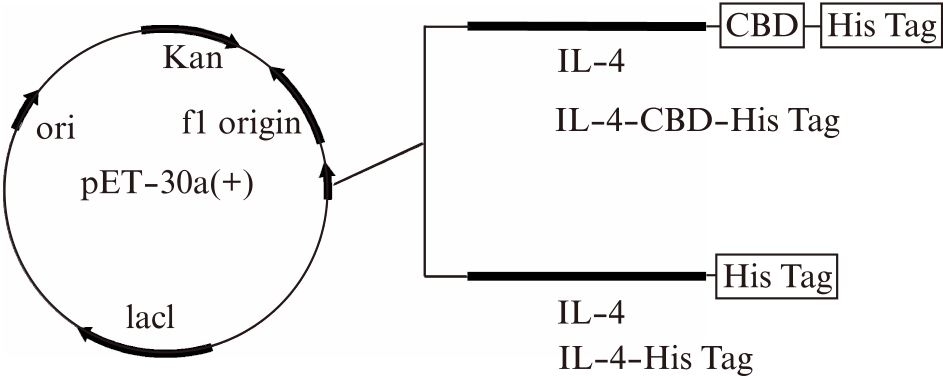
图1 质粒结构示意图
Fig.1 Schematic representation of the expression plasmid
在蛋白表达阶段,根据已有的文献数据[13-14],IL-4将在大肠杆菌中以包涵体的形式表达,所以我们使用盐酸胍将包涵体变性,并在变性状态下过镍柱对目的蛋白进行纯化,随后梯度降低盐酸胍的浓度,在4℃环境中缓慢使用蛋白恢复活性。同时,1mmol/L GSH、0.1mmol/L GSSH也被加入到透析液中以促进IL-4恢复到正常的构象,最后用PBS对目的蛋白进行透析。纯化的IL-4-CBD-His Tag和IL-4-His Tag蛋白样品经过SDS-PAGE凝胶电泳后,通过考马斯亮蓝G-250染色,结果显示,纯化的蛋白为一条带,见图2。

图2 重组蛋白的表达与纯化
Fig.2 Recombinant protein expression and purification
M: 蛋白分子量标准Marker;1,4: 大肠杆菌总蛋白;2,5: 经IPTG诱导后大肠杆菌总蛋白;3,6: 纯化后的蛋白条带;实心箭头和空心箭头分别指IL-4-His Tag和IL-4-CBD-His Tag
2.2 IL-4重组蛋白活性分析
qPCR数据表明,IL-4-CBD-His Tag、IL-4-His Tag能显著提高ArgI基因、Egr2基因的表达量,同时下调CD38基因的表达量。另外,在CBD-IL-4-His Tag、IL-4-His Tag的诱导下,巨噬细胞分泌的IL10显著提高,见图3。同时加入商业化的IL-4作为阳性对照,结果表明通过大肠杆菌重组表达纯化的IL-4-CBD-His Tag和IL-4-His Tag与商业化的IL-4具有相似的生物活性。
2.3 IL-4吸附与缓释效果分析
随着IL-4-CBD-His Tag浓度的增加,吸光度逐渐增加,并在60nmol/L时达到饱和。与之对比,不带有CBD序列的IL-4-His Tag虽然也会随着浓度的增加吸光度也会增加,但增加的值要显著低于IL-4-CBD-His Tag,见图4。因为吸光度能间接表明吸附在Ⅰ型胶原蛋白膜上IL-4的量,所以结果表明CBD序列能显著提高Ⅰ型胶原蛋白对IL-4的吸附水平。以CBD-His Tag为对照,CBD序列及His Tag序列不会对吸光度产生干扰。
缓释试验中,IL-4-His Tag因为没有CBD对胶原蛋白的锚定,在短期内大量释放到PBS中,而可以吸附在Ⅰ型胶原蛋白上的IL-4-CBD-His Tag则可以缓慢释放,见图5。
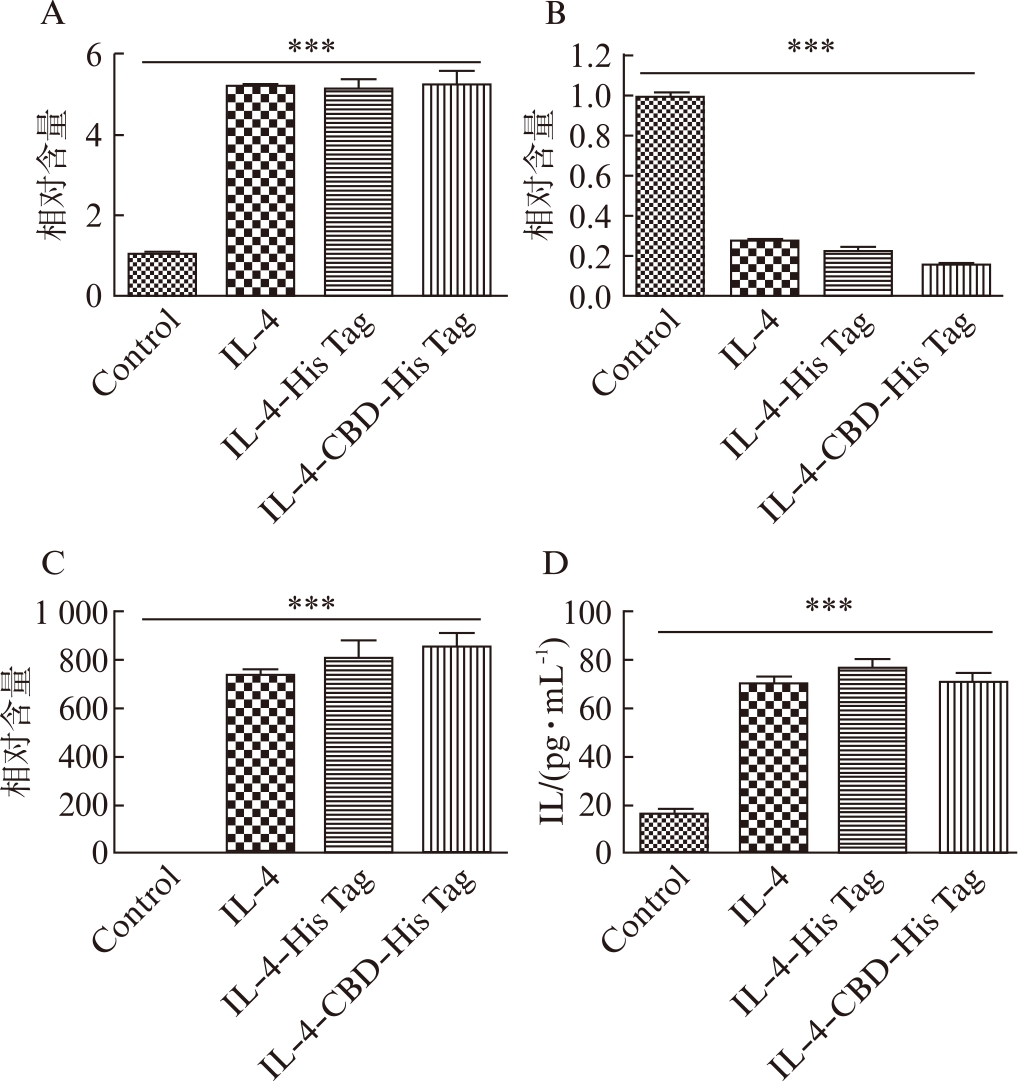
图3 IL-4-CBD-His Tag活性测定
Fig.3 Test of IL-4-CBD-His Tag bioactivity
A-C: qPCR检测Egr2基因、CD38基因、ArgI基因的相对表达量;D: 细胞上清液中IL10的分泌量测定
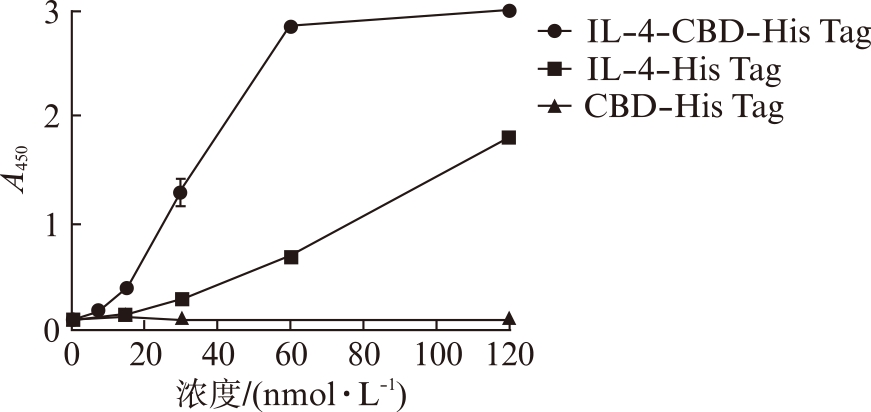
图4 Ⅰ型胶原蛋白对IL-4的吸附实验
Fig.4 Type I Collagen-binding assay
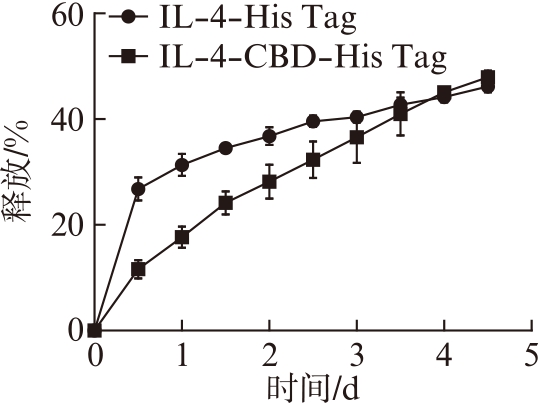
图5 缓释实验
Fig.5 Sustained release assay
3 讨 论
在IL-4的表达阶段,尽管我们尝试改变诱导剂IPTG的浓度和降低诱导温度,最终IL-4依然是以包涵体的形式表达出来。参阅相关的文献[11-12],本研究采用在变性的条件下使用镍柱纯化目标蛋白,再通过梯度降低变性剂盐酸胍的浓度,缓慢让IL-4复性,同时加入GSH和GSSH以提高IL-4的复性效率。在检测IL-4的细胞活性方面,利用了IL-4能诱导M0巨噬细胞分化为M2巨噬细胞的原理,检测了M2巨噬细胞相关基因的表达量以及能分泌IL-10的特点,结果表明经复性得到的IL-4诱导后的巨噬细胞表现出Egr2基因和ArgI基因的表达量上调、CD38基因的表达量下调、对IL-10的分泌增加的特点,这些特点与文献中M2巨噬细胞的特点相符。另外,M0巨噬细胞除了分化为M2细胞外还可能分化为M1巨噬细胞,本研究结果表明经IL-4诱导后的巨噬细胞的Egr2基因上调、CD38基因下调,而这两个基因在M1巨噬细胞中呈相反的表达趋势[13],进一步证实最后经IL-4诱导的M0巨噬细胞只分化为M2巨噬细胞。吸附和缓释实验结果也证明了通过大肠杆菌表达纯化的IL-4恢复成了正确的分子构象。
虽然IL-4的表达纯化技术已经很成熟,也已经有了商业化的IL-4,但本研究创新性的通过基因重组的方法将胶原吸附序列CBD与IL-4整合在一起,使IL-4具有了缓释的功能。缓释功能的存在可以克服生物体内液体环境的流动性,避免局部药物浓度随着体液的流动快速下降,同时可以避免药物崩解带来的局部刺激等不良反应。
目前药物缓释技术多是通过将药物包埋或吸附在纳米微球上,随着微球的降解,药物被缓慢释放到局部环境中。微球的来源主要分为两类: 天然来源(如壳聚糖、淀粉、海藻酸盐等)和人工合成(如聚酯、聚酰胺、聚磷酸脂等),这些材料因为生物相容性不高往往会引起炎症反应。而本研究中药物缓释依赖的材料为Ⅰ型胶原蛋。Ⅰ型胶原蛋白因为其低致敏性和生物可降解性,已经广泛应用到止血海绵、人工硬脊膜、脊髓支架材料和骨修复材料等领域。而且,Ⅰ型胶原蛋白具有其独特的生物学优点,比如信号中继、引导组织生成、止血、组织修复等,相信随着Ⅰ型胶原蛋白研究的深入,越来越多的Ⅰ型胶原蛋白材料会应用到生物体内,这些研究大大提高了本研究的适用范畴。
IL-4作为一类多效应的免疫抑制因子,通常以JAK-STAT、Ras-ERK、PI3K-PKB这3种信号通路发挥其生物学效应。近年来,其越来越多新的生物学功能被发掘出来比如介导脂类和糖代谢、皮肤修复、抗击肠道寄生虫、控制肠道感染等。另外,文献报道IL-4在脑出血和脊髓损伤等神经系统损伤中,也具有积极的治疗效果[14-15]。但是,由于血-脑屏障的存在[16],静脉或口服给药很难在脑或者脊髓中达到有效浓度。颅内或者髓鞘直接给药,不仅可能造成二次损伤,而且因为脑脊液的流动性,局部药物浓度很难维持。本研究通过基因工程方法重组的可缓释IL-4-CBD-His Tag,有望克服上述难题。另外,在慢性炎症控制、组织修复领域,本研究也有潜在的应用价值。
[1] LEE C H, SINGLA A, LEE Y. Biomedical applications of collagen. Int J Pharm, 2001,221(1-2): 1-22
[2] LI X, HAN J, ZHAO Y, et al. Functionalized collagen scaffold neutralizing the myelin-inhibitory molecules promoted neurites outgrowth in vitro and facilitated spinal cord regeneration in vivo. ACS Appl Mater Interfaces,2015,7(25): 13960-13971.
[3] ADDI C, MURSCHEL F, DE CRESCENZO G. Design and use of chimeric proteins containing a collagen-binding domain for wound healing and bone regeneration. Tissue Eng Part B Rev, 2017,23(2): 163-182
[4] SUN W, LIN H, CHEN B et al. Promotion of peripheral nerve growth by collagen scaffolds loaded with collagen-targeting human nerve growth factor-beta. J Biom Mater Res Part A, 2007,83(4): 1054-1061
[5] DI LULLO GA, SWEENEY SM, KORKKO J et al. Mapping the ligand-binding sites and disease-associated mutations on the most abundant protein in the human, type I collagen. J Biol Chem, 2002,277(6): 4223-4231.
[6] SUN W, SUN C, LIN H, et al. The effect of collagen-binding NGF-beta on the promotion of sciatic nerve regeneration in a rat sciatic nerve crush injury model. Biomaterials, 2009,30(27): 4649-4656.
[7] SMITH N, TIERNEY R, WEI W, et al. Induction of interferon-stimulated genes on the IL-4 response axis by Epstein-Barr virus infected human b cells; relevance to cellular transformation. PLoS One, 2013,8(5): e64868.
[8] YING W, CHERUKU P S, BAZER F W, et al. Investigation of macrophage polarization using bone marrow derived macrophages. J Vis Exp, 2013(76).doi: 10.3791/50323.
[9] SHIN T, AHN M, MOON C, et al. Alternatively activated macrophages in spinal cord injury and remission: another mechanism for repair?. Mol Neurobiol, 2013,47(3): 1011-1019.
[10] ROSZER T. Understanding the mysterious M2 macrophage through activation markers and effector mechanisms. Mediators Inflamm, 2015,2015: 816460.
[11] QIU Y, SUN J R, HUANG Y B, et al. Expression and purification of recombinant human interleukin 4 in Escherichia coli. Sheng Wu Gong Cheng Xue Bao, 2006,22(6): 962-967.
[12] VAN KIMMENADE A, BOND M W, SCHUMACHER J H, et al. Expression, renaturation and purification of recombinant human interleukin 4 from Escherichia coli. Euro J Biochem, 1988,173(1): 109-114.
[13] JABLONSKI K A, AMICI S A, WEBB L M, et al. Novel markers to delineate murine M1 and M2 macrophages. PLoS One, 2015,10(12): e0145342.
[14] FRANCOS-QUIJORNA I, AMO-APARICIO J, MARTINEZ-MURIANA A, et al. IL-4 drives microglia and macrophages toward a phenotype conducive for tissue repair and functional recovery after spinal cord injury. Glia, 2016,64(12): 2079-2092.
[15] YANG J, DING S, HUANG W, et al. Interleukin-4 ameliorates the functional recovery of intracerebral hemorrhage through the alternative activation of microglia/macrophage. Front Neurosci, 2016,10: 61
[16] 李俊雯,杨红彦,靳令经,等.低灌注时水通道蛋白-4在血脑屏障通透性升高中的作用.同济大学学报(医学版),2016,37(5): 14-19.