特发性肺动脉高压(idiopathic pulmonary arte-rial hypertension, IPAH)是环境、遗传、内分泌或者药物等因素损伤肺血管,导致心肺功能受损的一类非常复杂的临床综合征[1]。评估IPAH患者心肺功能的重要无创方法之一是通过心肺运动试验(cardiopulmonary exercise testing, CPET)检测运动状态下患者的运动耐力、机体代谢和气体交换异常等方面以综合反映患者的状态及预后[2]。既往文献报道IPAH患者中女性患者发病率高,但男性患者预后更差: 包括伴有更高的平均肺动脉压(mean pulmonary arterial pressure, mPAP)、平均右心房压 (mean right atrial pressure, mRAP)和较低的心排出量(cardiac output, CO)[3-4]。性别差异广泛存在于IPAH的发病率、诊断、治疗和预后等各个方面[5-7],本课题组研究[8-9]发现,IPAH患者的CPET参数具有显著的性别差异及其对血流动力学有不同预测价值,但是未探讨CPET参数对生存率的预测是否也受性别影响。故本研究旨在前期研究基础上深入分析具有性别差异的CPET参数对IPAH患者无事件生存率的预测价值。
1 资料与方法
1.1 研究对象
选择从2010年5月至2016年4月期间于同济大学附属肺科医院首次住院的IPAH患者,共56例(男性21例,女性35例)。不同性别患者再按照有无恶化事件分为两个亚组: 有恶化事件组(event组)和无恶化事件组(event-free组),其中男性患者两亚组分别为9例和12例,女性患者分别为15例和20例。所有患者均经右心导管检查明确诊断。入选标准根据最新NICE分类[15]: 静息状态下,平均肺动脉压(mean pulmonary arterial pressure, mPAP)≥25mmHg(1mmHg=0.133kPa),平均肺小动脉楔压(mean pulmonary arterial wedge pressure, mPAWP)≤15mmHg。排除标准: 排除其他类型的肺动脉高压;排除合并有肺部疾病(根据患者的临床表现、CT及肺功能结果进行鉴别);排除影响激素代谢的慢性或急性疾病;排除正在使用或既往使用过激素药物及影响激素的药物;排除不能配合CPET的神经-骨骼-肌肉性、精神性疾病的患者[8]。
1.2 方法
1.2.1 一般资料 记录患者的年龄、性别、身高、体质量,并计算体质量指数(body mass index, BMI),同时收集患者的相关临床参数,包括: 6min步行距离(6min walk distance, 6MWD)、氨基末端脑利钠肽前体(n-terminal natriuretic peptide type-B, NT-proBNP)、世界卫生组织肺动脉功能分级(World Health Organization functional class, WHO-FC)及临床恶化事件(包括死亡,因心肺功能恶化的靶向药物治疗加量、口服用药改为注射用药或病情加重再次入院)等。
1.2.2 主要检测参数 (1) 右心导管参数包括: mRAP、mPAP、mPAWP、肺血管阻力(pulmonary vascular resistance, PVR)、 CO、 混合静脉血氧饱和度(oxygen saturation of mixed venose blood, SvO2)等。(2) CPET主要的参数有: 运动负荷(workload)、心率(heart rate, HR)、氧脉搏(O2 pulse)、摄氧量(oxygen uptake, VO2)、二氧化碳排出量(carbon dioxide output,VCO2)、分钟通气量(minute ventilation, VE)、呼气末氧气分压(end-tidal PO2, PETO2)、呼气末二氧化碳分压(end-tidal PCO2, PETCO2)等。无氧阈用AT表示,峰值期用peak表示。采用V-slop法确定AT点。VE/VCO2 slope为从运动开始到通气补偿点间的VE/VCO2斜率[11]。OUES是通过对VE进行对数转换后与VO2的线性关系得出,公式VO2=OUES×lgVE+b(b为常数);OUEP采用连续90s的VO2/VE的最大平均值[12]。
1.2.3 研究终点和随访 入选的研究对象中有恶化事件发生的患者研究终点是恶化事件的发生,无恶化事件发生患者的研究终点是随访结束时间即2016年4月。患者随访通过门诊随访和电话随访。
1.3 统计学处理
采用SPSS 19.0软件进行数据分析。符合正态分布的连续变量用![]() 表示,组间比较用独立样本t检验;不符合正态分布的计量资料用中位数(四分位数间距)表示,组间比较采用Mann-Whitney U检验;分类变量采用构成比表示,组间比较用χ2检验。采用正向单因素或多因素Cox比例风险分析预测特发性肺动脉高压患者无临床恶化事件生存率即无事件生存率(event-free survival)的性别差异指标;受试者工作特征曲线(receiver-operating characteristic, ROC)及曲线下面积(area under curve, AUC)用于评价独立预后因素的灵敏度和特异度;计算约登指数[灵敏度-(1-特异度)]的最大值确定Cut-off值;最后利用各组不同独立预后因素的Cut-off值重新分组并用Kaplan-Meier进行生存分析验证其预测价值。P<0.05表示差异有统计学意义。
表示,组间比较用独立样本t检验;不符合正态分布的计量资料用中位数(四分位数间距)表示,组间比较采用Mann-Whitney U检验;分类变量采用构成比表示,组间比较用χ2检验。采用正向单因素或多因素Cox比例风险分析预测特发性肺动脉高压患者无临床恶化事件生存率即无事件生存率(event-free survival)的性别差异指标;受试者工作特征曲线(receiver-operating characteristic, ROC)及曲线下面积(area under curve, AUC)用于评价独立预后因素的灵敏度和特异度;计算约登指数[灵敏度-(1-特异度)]的最大值确定Cut-off值;最后利用各组不同独立预后因素的Cut-off值重新分组并用Kaplan-Meier进行生存分析验证其预测价值。P<0.05表示差异有统计学意义。
2 结 果
2.1 一般资料
IPAH患者的临床资料及血流动力学资料见表1。共24例患者发生临床恶化事件(event),其中包括4例死亡患者,其余为因心肺功能恶化的靶向药物治疗加量、口服用药改为注射用药或病情加重再次入院。平均年龄为(38.3±16.1)岁,包括9例男性,平均年龄(43.9±22.0)岁;15例女性,平均年龄(34.9±10.8)岁。各组间BMI、6MWD、NT-pro BNP和WHO-FC的差异无统计学意义。
血流动力学参数mRAP、mPAP、PAWP、PVR和SvO2在各组间差异无统计学意义,仅CO在女性event组中较event-free组降低(P<0.05),见表1。
表1 患者基线资料
Tab.1 Baseline data of patients![]()
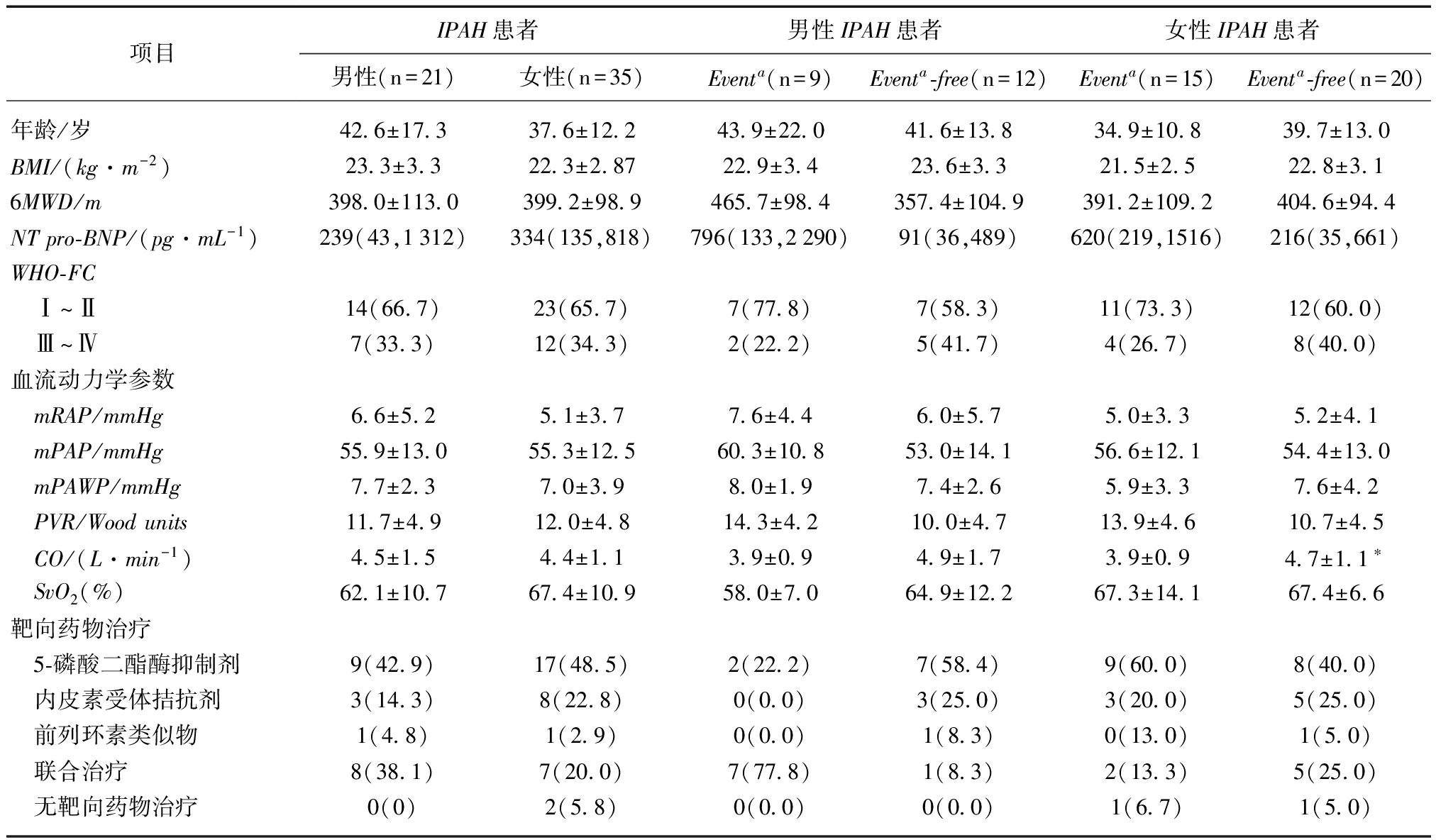
项目IPAH患者男性IPAH患者女性IPAH患者男性(n=21)女性(n=35)Eventa(n=9)Eventa⁃free(n=12)Eventa(n=15)Eventa⁃free(n=20)年龄/岁42 6±17 337 6±12 243 9±22 041 6±13 834 9±10 839 7±13 0BMI/(kg·m-2)23 3±3 322 3±2 8722 9±3 423 6±3 321 5±2 522 8±3 16MWD/m398 0±113 0399 2±98 9465 7±98 4357 4±104 9391 2±109 2404 6±94 4NTpro⁃BNP/(pg·mL-1)239(43,1312)334(135,818)796(133,2290)91(36,489)620(219,1516)216(35,661)WHO⁃FC Ⅰ~Ⅱ14(66 7)23(65 7)7(77 8)7(58 3)11(73 3)12(60 0) Ⅲ~Ⅳ7(33 3)12(34 3)2(22 2)5(41 7)4(26 7)8(40 0)血流动力学参数 mRAP/mmHg6 6±5 25 1±3 77 6±4 46 0±5 75 0±3 35 2±4 1 mPAP/mmHg55 9±13 055 3±12 560 3±10 853 0±14 156 6±12 154 4±13 0 mPAWP/mmHg7 7±2 37 0±3 98 0±1 97 4±2 65 9±3 37 6±4 2 PVR/Woodunits11 7±4 912 0±4 814 3±4 210 0±4 713 9±4 610 7±4 5 CO/(L·min-1)4 5±1 54 4±1 13 9±0 94 9±1 73 9±0 94 7±1 1∗ SvO2(%)62 1±10 767 4±10 958 0±7 064 9±12 267 3±14 167 4±6 6靶向药物治疗 5⁃磷酸二酯酶抑制剂9(42 9)17(48 5)2(22 2)7(58 4)9(60 0)8(40 0) 内皮素受体拮抗剂3(14 3)8(22 8)0(0 0)3(25 0)3(20 0)5(25 0) 前列环素类似物1(4 8)1(2 9)0(0 0)1(8 3)0(13 0)1(5 0) 联合治疗8(38 1)7(20 0)7(77 8)1(8 3)2(13 3)5(25 0) 无靶向药物治疗0(0)2(5 8)0(0 0)0(0 0)1(6 7)1(5 0)
aEvent: 包括死亡,因心肺功能恶化的靶向药物治疗加量、口服用药改为注射用药或病情加重再次入院;Event与Event-free患者对比,*P<0.05
2.2 CPET参数
IPAH患者的CPET参数见表2。与女性患者相比,男性患者具有较高的peak VE,PETO2 at AT,peak PETO2以及较低的peak VO2/VE及PETCO2 at AT。亚组分析中,男性event组的运动耐力参数peak workload显著低于event-free组;而反映心血管参数的peak O2 pulse则在女性患者event组中降低;相较于女性event组,男性event组显示出较高的peak VE,Nadir VE/VCO2,PETO2 at AT和peak PETO2,而peak VO2/VE,PETCO2 at AT和peak PETCO2则相对降低;这些差异有统计学意义(P<0.05)。
2.3 CPET参数预测无事件生存率
在校正了年龄、BMI及WHO-FC后,男性患者的peak PETCO2显示出其作为无事件生存率独立预后因素的较高预测价值(P=0.015,95%CI: 0.816~0.978);而女性患者的peak O2 pulse则是无事件生存率的独立预后因素(P=0.044,95%CI: 0.313~0.985),见表3。
表2 IPAH患者心肺运动试验参数比较
Tab.2 Comparison of CPET parameters in IPAH patients
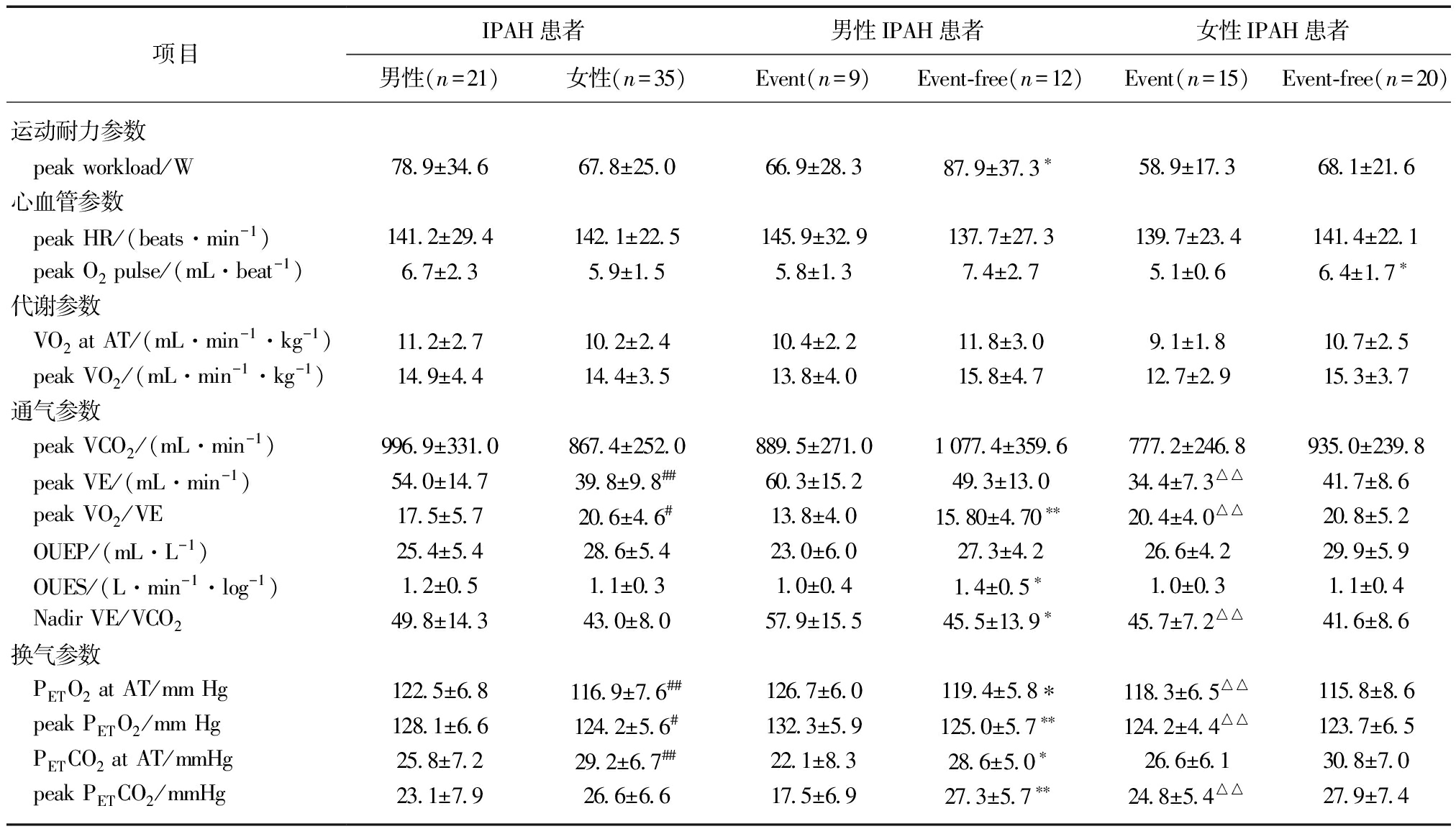
项目IPAH患者男性IPAH患者女性IPAH患者男性(n=21)女性(n=35)Event(n=9)Event⁃free(n=12)Event(n=15)Event⁃free(n=20)运动耐力参数 peakworkload/W78 9±34 667 8±25 066 9±28 387 9±37 3∗58 9±17 368 1±21 6心血管参数 peakHR/(beats·min-1)141 2±29 4142 1±22 5145 9±32 9137 7±27 3139 7±23 4141 4±22 1 peakO2pulse/(mL·beat-1)6 7±2 35 9±1 55 8±1 37 4±2 75 1±0 66 4±1 7∗代谢参数 VO2atAT/(mL·min-1·kg-1)11 2±2 710 2±2 410 4±2 211 8±3 09 1±1 810 7±2 5 peakVO2/(mL·min-1·kg-1)14 9±4 414 4±3 513 8±4 015 8±4 712 7±2 915 3±3 7通气参数 peakVCO2/(mL·min-1)996 9±331 0867 4±252 0889 5±271 01077 4±359 6777 2±246 8935 0±239 8 peakVE/(mL·min-1)54 0±14 739 8±9 8##60 3±15 249 3±13 034 4±7 3△△41 7±8 6 peakVO2/VE17 5±5 720 6±4 6#13 8±4 015 80±4 70∗∗20 4±4 0△△20 8±5 2 OUEP/(mL·L-1)25 4±5 428 6±5 423 0±6 027 3±4 226 6±4 229 9±5 9 OUES/(L·min-1·log-1)1 2±0 51 1±0 31 0±0 41 4±0 5∗1 0±0 31 1±0 4 NadirVE/VCO249 8±14 343 0±8 057 9±15 545 5±13 9∗45 7±7 2△△41 6±8 6换气参数 PETO2atAT/mmHg122 5±6 8116 9±7 6##126 7±6 0119 4±5 8∗118 3±6 5△△115 8±8 6 peakPETO2/mmHg128 1±6 6124 2±5 6#132 3±5 9125 0±5 7∗∗124 2±4 4△△123 7±6 5 PETCO2atAT/mmHg25 8±7 229 2±6 7##22 1±8 328 6±5 0∗26 6±6 130 8±7 0 peakPETCO2/mmHg23 1±7 926 6±6 617 5±6 927 3±5 7∗∗24 8±5 4△△27 9±7 4
与男性患者对比,#P<0.05或##P<0.01;与Event患者对比,*P<0.05或**P<0.01;与Event男性对比,△△P<0.01;AT表示无氧阈值,peak表示峰值
表3 多因素Cox比例风险分析预测特发性肺动脉高压预后的指标
Tab.3 Parameters predicting event-free survival in multivariate Cox-proportional hazards analysis
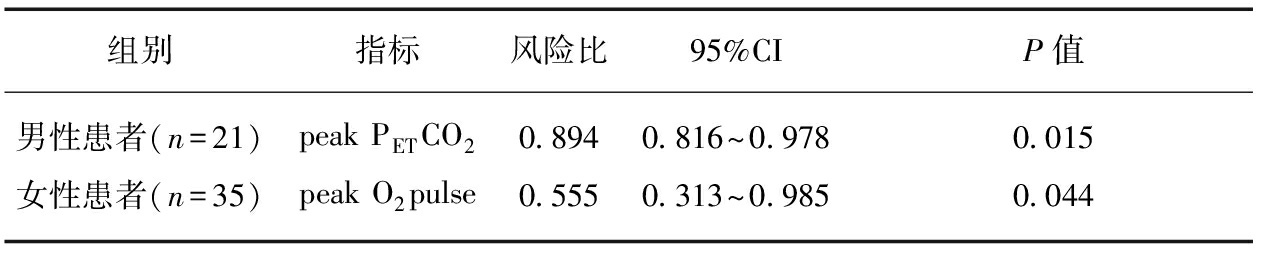
组别指标风险比95%CIP值男性患者(n=21)peakPETCO20 8940 816~0 9780 015女性患者(n=35)peakO2pulse0 5550 313~0 9850 044
多因素Cox比例风险模型采用年龄、BMI和WHO-FC校正
2.4 ROC曲线及Kaplan-Miere生存曲线
本研究将上述各组的独立预后因素做ROC曲线,分别求得曲线下面积(area under the cure, AUC)和Cut-off值,男性患者中,ROC曲线下面积0.870,peak PETCO2的Cut-off值为20.50mmHg;女性患者中,ROC曲线下面积0.720,peak O2 pulse的Cut-off值为6.25mL/beat,见表4。
最后利用各独立预后因素的Cut-off值重新分组并用Kaplan-Meier进行生存分析,见图1,并直观地与男女患者的生存率和无事件生存率作比较,见图1A和B。IPAH患者的生存率和无事件生存率未见性别差异。但是按照Cut-off进行的亚组分析中,peak PETCO2<20.50mmHg的男性患者无事件生存率更差(P=0.0015),见图1C;peak O2 pulse的小于6.25mL/beat的女性患者无事件生存率更差(P=0.0425),见图1D。
表4 受试者工作特征曲线
Tab.4 Receiver operating characteristics curve
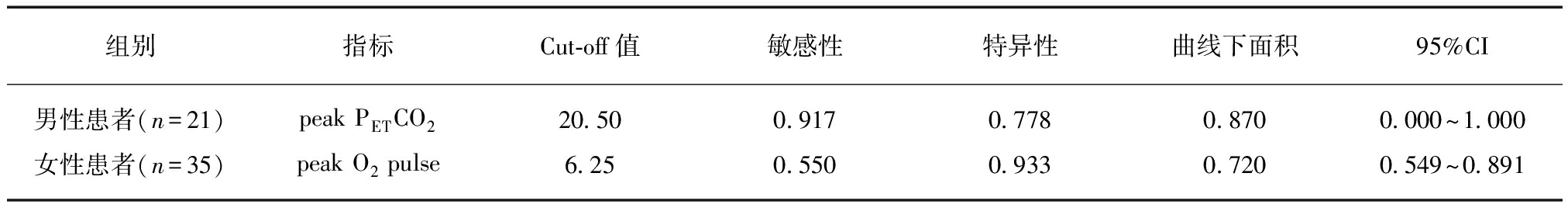
组别指标Cut⁃off值敏感性特异性曲线下面积95%CI男性患者(n=21)peakPETCO220 500 9170 7780 8700 000~1 000女性患者(n=35)peakO2pulse6 250 5500 9330 7200 549~0 891
O2 pulse: 氧脉搏;PETCO2: 呼气末二氧化碳分压
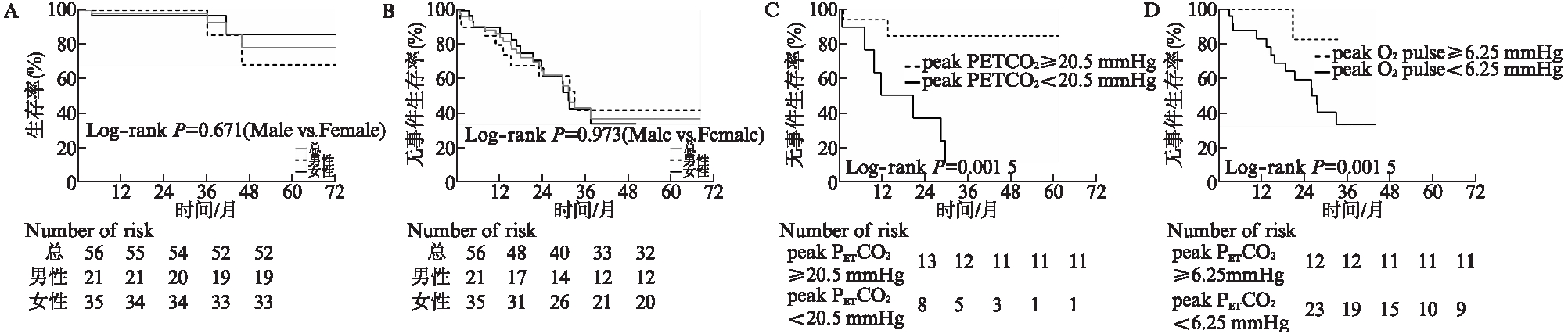
图1 IPAH患者Kaplan-Meier生存分析
Fig.1 Kaplan-Meier cumulative survival curves in IPAH patients
A: IPAH患者全因死亡率的性别差异;B: IPAH患者无事件生存率的性别差异;C: 男性IPAH患者peak PETCO2<20.50mmHg与≥20.50mmHg时的无事件生存率;D: 女性IPAH患者peak O2 pulse<6.25mL/beat与≥6.25mL/beat时的无事件生存率
3 讨 论
CPET作为一项综合检测心肺循环、呼吸系统功能的技术,能够全面、客观地评价运动耐力和心肺储备功能,逐渐成为评价IPAH药物疗效及预后的一项可靠检查手段。本研究证实了不同状态的IPAH患者CPET参数均具有显著的性别差异;虽然这组样本中IPAH患者的生存率和无事件生存率未见性别差异,但是仍然观察到不同的CPET参数分别预测各组患者的临床预后。
RHC是确诊IPAH的金标准,除此之外,其多项血流动力学指标如mRAP、mPAP、PAWP、PVR及CO与其他临床指标如6MWD、NT-pro BNP均是良好的预后指标。既往有研究报道男性PAH患者的mRAP、mPAP、6MWD明显高于女性,这与此次研究结果并不完全一致[4],而本研究暂未发现6MWD、NT-pro BNP、WHO-FC、血流动力学指标及靶向药物治疗在之间存在性别差异,但是男性患者的mRAP、mPAP、PAWP和PVR也有高于女性患者的趋势。原因之一可能是由于本次研究样本量较小,国外的研究纳入了2696例的患者[4],而本研究仅有56例患者;另一个原因可能是本研究只纳入了IPAH患者,而国外的研究纳入其他类型PAH,例如家族性肺动脉高压(FPAH),结缔组织病相关性肺动脉高压(CTD-PAH)等,并且CTD-PAH中又纳入了许多亚组分类。此外,与本次的研究结果一致的结果还有血流动力学参数中的CO在女性event组中较event-free组降低,CO的降低与IPAH患者发生临床恶化事件具有一定的相关性[9],而男性患者中未见此结果,这可能意味着女性患者一旦出现临床恶化事件,心脏损伤可能更严重。
在CPET参数的差异方面,本研究发现男性event组患者较event-free组在呼吸储量和气体交换效率上有更严重的供求失衡,表现为在运动耐力和通、换气等指标上的局限性,例如较低的peak workload,peak VO2/VE,OUES,PETCO2 at AT和peak PETCO2以及较高的Nadir VE/VCO2,PETO2 at AT和peak PETO2;而女性event组则主要表现为较差的peak O2 pulse。以上结果提示在通气有效性和心肺循环系统的结构重构及功能改变上的性别差异有助于进一步分析临床预后的独立因素[13]。
Jarvis等[14]研究发现不同性别正常人的肌肉重量、肌纤维类型及释放能量的地方是不同的。在本研究中男性患者反映机体运动耐力和心功能的CPET参数高于女性患者,这或许是因为男性患者的肌肉比重更大,从而使其运动耐力及心功能更好。另一方面,雌二醇的代谢也可能会影响心血管系统中的信号转导和表观遗传学从而导致CPET心血管参数上的两性差异[15]。
本次研究发现,总患者中只有3例患者死亡,1例是女性,2例是男性,可能因为全因死亡的患者样本量少所以并未检测出生存率的性别差异,因此后续没有观察CPET参数对生存率的影响,而是观察对无事件生存率的影响。本研究发现peak PETCO2和peak O2 pulse可分别作为两性别的临床无事件生存率的预测因素,得到这一结果的原因可能正是因为男性IPAH患者在通气有效性的显著病理生理改变,包括乳酸酸中毒、低氧血症等均可刺激通气增加导致PETCO2下降[16];而peak O2 pulse可以作为反映心功能的一个良好参数,O2 pulse(每搏量×动脉-静脉血氧含量)差,混合静脉血氧含量又取决于外周组织对氧的摄取利用,而本研究不存在外周组织氧利用障碍的情况,故O2 pulse主要反映患者的每搏量情况[11],提示女性IPAH患者心血管系统的功能受损更为严重,因而发现peak O2 pulse<6.25mL/beat的女性患者无事件生存率更差。前期已有研究提示当PETCO2<20mmHg时发生IPAH的可能性增高,具体机制尚不明确[16]。本次研究结果表明当peak PETCO2<20.50mmHg时男性患者的无事件生存率更差,与前期结果保持了良好的一致性;另有研究[17]证实患有心力衰竭的成年女性患者较男性预后更佳,其心脏适应性和后负荷也优于男性[5,18-19]。最后,性别差异产生不同结果的机制是否与性激素有关也有待进一步考证。
综上所述,虽然本研究结果受制于样本量的限制,但仍发掘出peak PETCO2和peak O2 pulse分别在两性别IPAH患者中作为预测疾病预后独立预测因素的价值。peak PETCO2的降低可以用于预测男性IPAH患者无事件生存率更差的临床结局;而peak O2 pulse的下降能够作为预测女性IPAH患者无不良事件生存率的独立指标。为将来进一步探索IPAH患者在发病机制、个体化治疗及预测临床结局上的性别差异提供了新的思路。
【参考文献】
[1] FREEMAN M L, LANDOLFO C, SAFFORD R E, et al. Noninvasive assessment of right heart function and hemodynamics during exercise in patients with pulmonary arterial hypertension[J]. South Med J, 2013,106(2): 141-146.
[2] BADESCH D B, RASKOB G E, ELLIOTT C G, et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry[J]. Chest, 2010,137(2): 376-387.
[3] MATHAI S C, HASSOUN P M, PUHAN M A, et al. Sex differences in response to tadalafil in pulmonary arterial hypertension[J]. Chest, 2015,147(1): 188-197.
[4] SHAPIRO S, TRAIQER G L, TURNER M, et al. Gender difference in the diagnosis, treatment, and outcome of patients with pulmonary arterial hypertension enrolled in the Registry to Evaluate Early and Long-term PAH Disease Management (REVEAL)[J]. Chest, 2012,141(2): 363-373.
[5] Swift A J, Capener D, Hammerton C, et al. Right ventricular sex differences in patients with idiopathic pulmonary arterial hypertension characterised by magnetic resonance imaging: pair-matched case controlled study[J]. PLoS One, 2015,10(5): e0127415.
[6] LAHM T, TUDER R M, PETRACHE I. Progress in solving the sex hormone paradox in pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2014,307(1): L7-26.
[7] MARTIN Y N, PABELICK C M. Sex differences in the pulmonary circulation: implications for pulmonary hypertension[J]. Am J Physiol Heart Circ Physiol, 2014,306(9): H1253-1264.
[8] YUAN P, CHEN T X, PUDASAINI B, et al. Sex-specific cardiopulmonary exercise testing indices related to hemodynamics in idiopathic pulmonary arterial hypertension[J]. Ther Adv Respir Dis, 2017,11(3): 135-145.
[9] YUAN P, NI H J, CHEN T X, et al. Sex-specific cardiopulmonary exercise testing parameters as predictors in patients with idiopathic pulmonary arterial hypertension[J]. Hypertens Res, 2017,40(10): 868-875.
[10] HOEPER M M, BOGAARD H J, CONDLIFFE R, et al. Definitions and diagnosis of pulmonary hypertension[J]. J Am Coll Cardiol, 2013,62(25 Suppl): D42-50.
[11] SUN X G, HANSEN J E, OUDIZ R J, et al. Exercise pathophysiology in patients with primary pulmonary hypertension[J]. Circulation, 2001,104(4): 429-435.
[12] SUN X G, HANSEN J E, STRINGER W W. Oxygen uptake efficiency plateau: physiology and reference values[J]. Eur J Appl Physiol, 2012,112(3): 919-928.
[13] MENDES P R, KIYOTA T A, CIPOLLI J A, et al. Gender influence the relationship between lung function and cardiac remodeling in hypertensive subjects[J]. Hypertens Res, 2015,38(4): 264-268.
[14] JARVIS S S, VAN GUNDY T B, GALBREATH M M, et al. Sex differences in the modulation of vasomotor sympathetic outflow during static handgrip exercise in healthy young humans[J]. Am J Physiol Regul Integr Comp Physiol, 2011,301(1): R193-200.
[15] LAHM T, PATEL K M, CRISOSTOMO P R, et al. Endogenous estrogen attenuates pulmonary artery vasoreactivity and acute hypoxic pulmonary vasoconstriction: the effects of sex and menstrual cycle[J]. Am J Physiol Endocrinol Metab, 2007,293(3): E865-871.
[16] YASUNOBU Y, OUDIZ R J, SUN X G, et al. End-tidal PCO2 abnormality and exercise limitation in patients with primary pulmonary hypertension[J]. Chest, 2005,127(5): 1637-1646.
[17] DENT M R, TAPPIA P S, DHALLA N S. Gender differences in cardiac dysfunction and remodeling due to volume overload[J]. J Card Fail, 2010,16(5): 439-449.
[18] JIANG R, WANG L, ZHU CT, et al. Comparative effectiveness of sildenafil for pulmonary hypertension due to left heart disease with HFrEF[J]. Hypertens Res, 2015,38(12): 829-839.
[19] 杨国玲,袁平,郭健,等.心肺运动试验参数预测特发性肺动脉高压患者肺血管阻力升高的性别差异[J].同济大学学报(医学版), 2018,39(1): 64-69.