淫羊藿苷(icariin, ICA)是补肾中药淫羊藿的主要有效成分,现代研究表明其对骨骼系统、神经系统、内分泌系统、心血管系统等均能发挥药理作用[1-3],然而淫羊藿苷对骨骼系统影响的研究主要集中在其调节成骨/破骨平衡进而防治骨质疏松等方面,有关淫羊藿苷影响软骨细胞代谢的研究尚少,仍然不清楚淫羊藿苷对骨关节炎软骨退变作用效果和机制。本课题组前期通过关节炎的动物模型论证了淫羊藿苷对骨免疫的调节作用[4-5],并通过体外培养关节炎患者来源滑膜成纤维细胞证实淫羊藿苷可以抑制滑膜细胞分泌炎性因子TNF-α,进而推测其具有调控炎症介导的软骨损伤和退变的潜能[6]。本研究通过IL-1β刺激软骨细胞,模拟软骨细胞炎性损伤和退变的病理,观察不同浓度淫羊藿苷对软骨细胞退变的干预作用。
1 材料与方法
1.1 主要试剂与仪器
胎牛血清双抗、Hanks液购自美国Gibco公司;RPMI-1640培养基、胰酶购自美国Hyclone公司;TRIzol、Ⅱ型胶原酶(collagen Ⅱ, Col-Ⅱ)购自美国Invitrogen公司;大鼠IL-1β购自美国PeproTech公司;MTT购自上海鼎国生物科技有限公司;SYBR@Premix Ex TaqTM(TliRNaseH Plus)、PrimeScriptTM RT reagent Kit with gDNA eraser(Perfect Real Time)购自日本TaKaRa公司;氯仿、异丙醇购自国药集团,引物由上海英俊生物技术有限公司合成;大鼠Col-ⅡELISA试剂盒购自武汉华美生物有限公司。
超净台(VCM-620)购自珠海市再鑫仪器有限公司,Thermo 311 CO2培养箱购自Thermo公司,5417R高速冷冻离心机购自Eppendorf公司,CKX41荧光倒置相差显微镜购自OLYMPUS公司,DW-25L262低温冰箱购自海尔医疗科技有限公司,SIM-F124制冰机购自SANYO公司,高压蒸汽消毒器购自上海医用核子仪器厂,ELX800酶标仪购自Bio-Tek,7500fast实时荧光定量PCR仪购自ABI公司。
1.2 关节软骨细胞的分离、培养
参照以往研究中软骨细胞分离步骤[7]: 无菌条件下剥离大鼠胎鼠四肢长骨,Hanks液清洗2遍,剔除肉眼可见软组织,眼科剪分离骨骺端透明软骨,手术刀片切成<1mm3的碎屑,于15mL无菌离心管中,用10倍体积含0.25%EDTA的胰酶于37℃水浴锅消化40min,离心半径15cm,2000r/min,离心5min,弃上清液,加入约10倍体积终浓度为0.5g/L的Ⅱ型胶原酶,置37℃水浴锅继续消化2h,加入等体积培养液终止消化,收集上清液,200目筛网过滤收集滤液,离心半径15cm,1500r/min离心5min,弃上清液;加入适量含终浓度为1%双抗和10%FBS的RPMI-1640培养液(不含额外添加的生长因子等)重悬细胞,接种于10cm培养皿,记为P0代,常规培养传代。
1.3 MTT法测定不同浓度淫羊藿苷对软骨细胞增殖的效果
取P1代软骨细胞,以4×103/孔接种于96孔板,设置空白对照组(常规培养: 10% FBS+1%双抗+89%RPMI-1640培养基,不含额外添加的生长因子)、淫羊藿苷不同剂量组(常规培养基础上加入不同浓度ICA干预,终浓度分别为1×10-7、1×10-6和 1×10-5 mol/L),每组4个复孔。细胞贴壁6h 后更换新的培养液并弃去未贴壁细胞,继续培养12h后加入淫羊藿苷进行干预,分别于不同时间点(12、24、36、48、60、72h)以MTT法检测细胞增殖情况。
1.4 IL-1刺激软骨细胞炎症损伤和退变及淫羊藿苷的干预作用
取P1代软骨细胞,以1.2×105/孔密度接种于6孔板,设置空白对照组(N组)、炎症刺激组(M组)和淫羊藿苷低、高剂量组(ICA-L、ICA-H组,终浓度分别为1×10-7、1×10-6 mol/L),每组3个复孔。细胞贴壁6h后更换新的培养液并弃去未贴壁细胞,除N组外,M组、ICA-L组和ICA-H组均加入终浓度为10ng/mL的IL-1β诱导软骨细胞炎症和损伤,12h后ICA-L组和ICA-H组分别加入相应浓度淫羊藿进行干预,连续干预72h。收集细胞并提取RNA,RT-PCR法检测。引物序列如下。Col-Ⅱ上游引物: 5′-GAGGGCAACAGCAGGTTCAC-3′,下游引物: 5′-GCCCTATGTCCACACCAAATTC-3′;Acan上游引物: 5′-TGGCATTGAGGACAGCGAAG-3′,下游引物: 5′-TCCAGTGTGTAGCGTGTGGAAAT-AG-3′;MMP13上游引物: 5′-GATGATGAAACCTGGACA-AGCA-3′,下游引物: 5′-GAACGTCATCATCTGG-GAGCA-3′;Sox9上游引物: 5′-GAAAGACCACCC-CGATTACAAG-3′,下游引物: 5′-AAGATGGCGT-TAGGAGAGATGTG-3′。反转录cDNA:取2μg总RNA,加入4μL的5×RT master mix,加RNase-free H2O至20μL,混匀离心。PCR扩增:10μL SYBR Green, 上、下游引物各1μL,0.4μL RoxDye(Ⅱ),2μL反转录产物,5.6μL RNase-free H2O,共20μL。预变性95℃ 30s;变性95℃ 3s,退火、延伸60℃ 30s,共40个循环。根据所测Ct值,用2-ΔΔCt法计算出各个mRNA的相对表达量。细胞培养上清液,用ELISA法检测Col-Ⅱ和GAG含量。
1.5 统计学处理
采用SPSS 18.0统计软件进行统计分析。计量资料以![]() 表示,组间比较,数据服从正态分布采用独立样本t检验,否则采用秩和检验,以P<0.05为差异具有统计学意义。
表示,组间比较,数据服从正态分布采用独立样本t检验,否则采用秩和检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 淫羊藿苷对软骨细胞增殖的影响
MTT法显示,1×10-5 mol/L淫羊藿苷干预72h后促进软骨细胞增殖(P<0.01),但在早期(24h)表现为抑制软骨细胞增殖(P<0.01),在干预48h和60h后对软骨细胞增殖无明显作用。1×10-6 mol/L浓度ICA干预软骨细胞36h后,与空白对照组相比差异均具有统计学意义(P<0.05);干预36h后,1×10-7 mol/L淫羊藿苷除60h时间点外,其余时间点与空白对照组比较,差异均具有统计学差异(P<0.05)。干预72h后,1×10-7 mol/L淫羊藿苷促进软骨细胞增殖作用最为明显,见表1。
表1 不同浓度ICA对软骨细胞增殖的作用
Tab.1 Effects of ICA on chondrocytes proliferation![]()
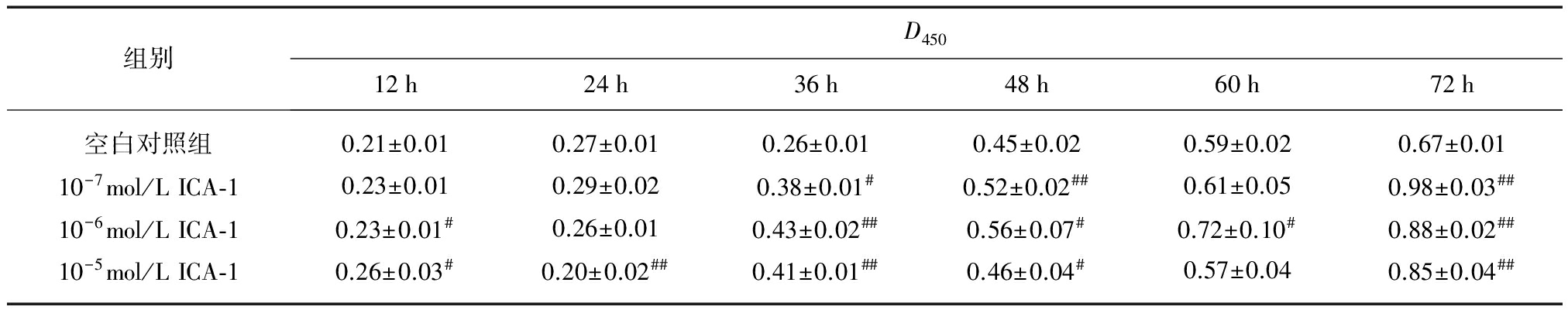
组别D45012h24h36h48h60h72h空白对照组0.21±0.010.27±0.010.26±0.010.45±0.020.59±0.020.67±0.0110-7mol/LICA⁃10.23±0.010.29±0.020.38±0.01#0.52±0.02##0.61±0.050.98±0.03##10-6mol/LICA⁃10.23±0.01#0.26±0.010.43±0.02##0.56±0.07#0.72±0.10#0.88±0.02##10-5mol/LICA⁃10.26±0.03#0.20±0.02##0.41±0.01##0.46±0.04#0.57±0.040.85±0.04##
与空白对照组比较,#P<0.05,##P<0.01
2.2 淫羊藿苷对IL-1β刺激软骨细胞分泌Col-Ⅱ和GAG的影响
M组上清液中分泌性蛋白Col-Ⅱ较N组降低但差异无统计学意义(P=0.11);ICA-L组、ICA-H组Col-Ⅱ浓度与M组相比差异没有统计学意义(P=0.19,P=0.31)。M组上清中GAG含量较N组显著下降,差异具有统计学意义(P=0.01),淫羊藿苷干预后,ICA-L组和ICA-H组上清液中GAG含量均显著提高(均为P=0.00),见图1。
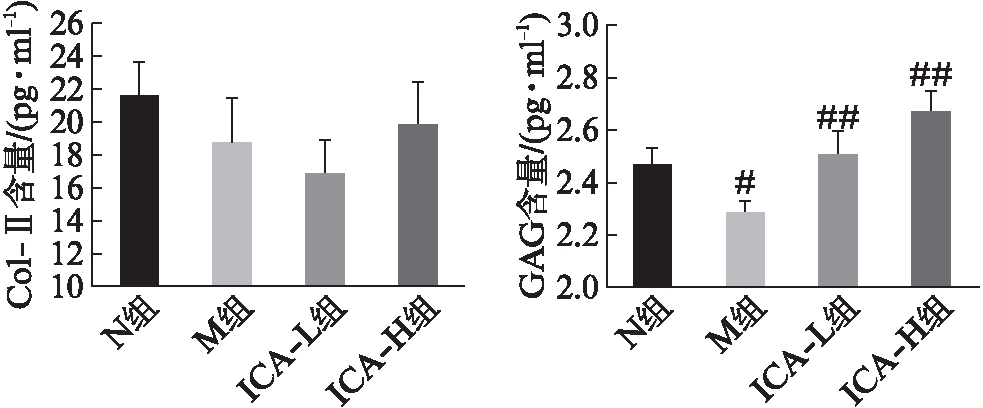
图1 淫羊藿苷对IL-1β刺激下软骨细胞分泌Col-Ⅱ和GAG的影响
Fig.1 Effects of ICA on Col-Ⅱand GAG secretion in chondrocytes stimulated by IL-1β
与N组比较,#P<0.05;##P<0.01
2.3 淫羊藿苷对IL-1β刺激软骨细胞Col-Ⅱ、MMP13、Acan和Sox9 mRNA表达的影响
RT-PCR结果显示,IL-1β炎性因子刺激软骨细胞3d后,与N组比较,M组Acan mRNA水平降低(P<0.05)、MMP13 mRNA水平升高(P<0.01),差异均具有统计学意义;Col-Ⅱ mRNA水平几乎没有变化,Sox9 mRNA水平虽然降低但差异无统计学意义(均为P>0.05)。与M组比较,ICA-L组Acan和Sox-9 mRNA表达升高(均为P<0.01),Col-Ⅱ mRNA、MMP13 mRNA表达差异无统计学意义(均为P>0.05);而高剂量淫羊藿苷能显著提高Col-Ⅱ mRNA水平,并抑制MMP13 mRNA表达(均为P<0.01),但对Sox9/Acan mRNA表达没有明显影响(均为P>0.05),见图2。
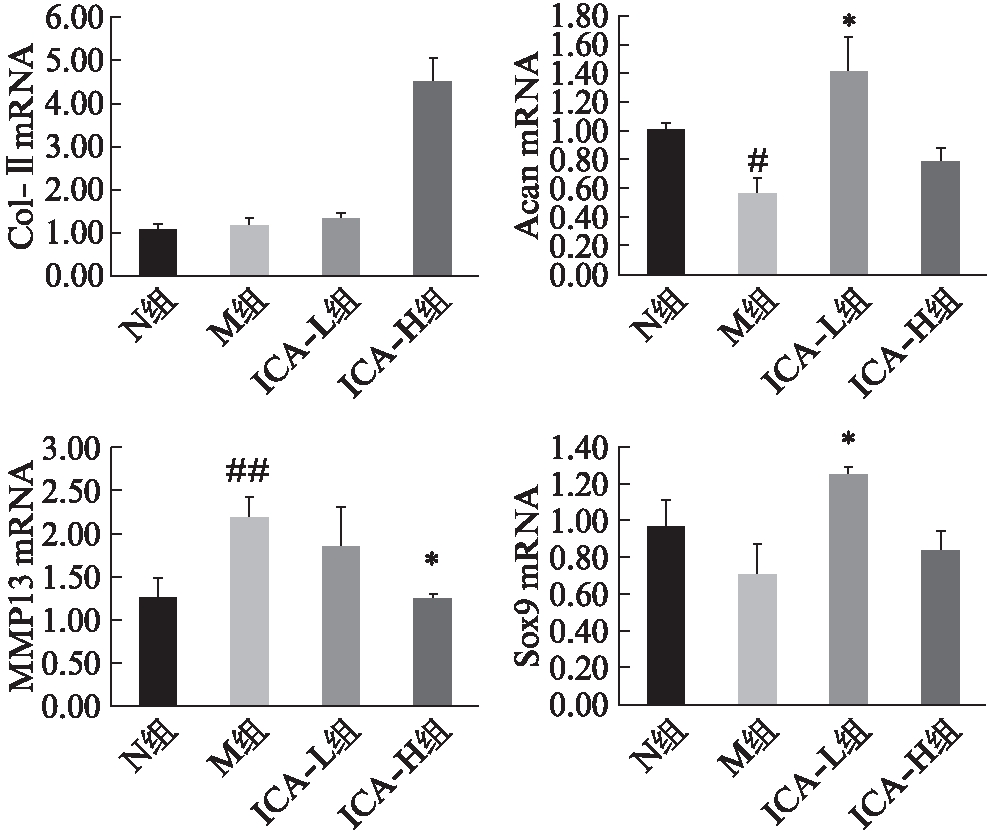
图2 淫羊藿苷对软骨细胞Col-Ⅱ/Acan/MMP13/Sox9 mRNA表达情况
Fig.2 Effects of ICA on Col-Ⅱ/Acan/MMP13/Sox9 mRNA expression in chondrocytes stimulated by IL-1β
与N组比较,#P<0.05,##P<0.01;与M组比较,*P<0.01
3 讨 论
关节软骨退变是骨关节炎形成与发展的核心环节,如何延缓软骨退变亦是骨关节炎防治的重点和难点。临床应用含有淫羊藿等滋补肝肾、活血通络类中药治疗骨关节炎取得一定疗效[8-9],进一步的动物实验采用单药淫羊藿治疗膝骨关节炎,结果表明单药淫羊藿能缓解木瓜蛋白酶诱导的早期兔膝骨关节炎软骨退变[10-11]。淫羊藿的主要有效成分为淫羊藿苷,有研究已经证实淫羊藿苷能影响软骨细胞增殖,然而其作用效果与ICA浓度和干预时间的关系仍未明确。
王鹏珍团队的研究[12]结果显示,1×10-6 mol/L ICA促进软骨细胞增殖作用明显,而1×10-5 mol/L ICA始终(连续5d)未明显促进软骨细胞增殖,甚至在第3天表现为抑制增殖作用,但继续干预7d和14d后所有浓度均明显促进软骨细胞分泌蛋白聚糖。Zhang等[13]观察5×10-5、1×10-5、5×10-6、1×10-6、1×10-7mol/L浓度ICA对软骨细胞的作用效果,干预5d后MTT增殖实验和激光共聚焦显微镜观察结果均显示,1×10-5 mol/L对软骨细胞增殖有抑制趋势,更高浓度(5×10-5 mol/L)则表现为明显抑制作用,表现为融合区域大幅度减少;随着干预时间延长(至7~14d后),所有浓度均表现为促进软骨细胞基质合成作用,且呈现剂量依赖趋势。因此,淫羊藿苷对软骨细胞的长期(>7d)效果可能表现为促进软骨细胞增殖,而短期(<7d)效果似乎与ICA药物剂量有关。
本研究中观察了1×10-7、1×10-6和1×10-5 mol/L浓度的ICA对软骨细胞干预12~72h的作用效果,结果显示高剂量淫羊藿苷干预早期(24h内)抑制软骨细胞增殖的趋势,随着干预时间的延长(特别是干预36h后),各浓度淫羊藿苷组促进软骨细胞增殖的趋势愈加明显;干预72h后,1×10-7 mol/L淫羊藿苷促进软骨细胞增殖作用最为明显。值得注意的是Liu等[14]的研究结果显示,在10-10、10-9、10-8、10-7 mol/L几个剂量中,更低剂量(10-9 mol/L)ICA促进软骨细胞增殖作用最为明显,且该浓度拮抗LPS引起的软骨细胞增殖抑制的效果最佳,随着时间延长这一效应更加明显。与Liu等的研究结论不同,本研究结果提示在1×10-7 mol/L和1×10-6 mol/L两个浓度中,更高剂量(1×10-6 mol/L)似乎更能拮抗IL-1β引起的软骨细胞分泌Col-Ⅱ和GAG含量降低,缓解炎症因子引起的软骨细胞退变,促进Col-ⅡmRNA表达,降低MMP13 mRNA的表达;而低剂量(1×10-7 mol/L)对Acan和Sox9 mRNA的表达更为敏感。
综上,此次研究结果表明淫羊藿苷具有促进软骨细胞增殖的作用,能影响软骨细胞外基质环境,调节软骨细胞表型特异基因的表达水平,拮抗IL-1β诱导的软骨细胞退变。然而淫羊藿苷影响软骨细胞代谢的量效关系和作用机制,仍有待进一步观察和探索,特别是淫羊藿苷“长期”和“短期”效应的差异、“短期”是否存在双向调节机制等。
【参考文献】
[1] 张立国,倪力军,赵丽丽,等.5种黄酮有效部位的不同组方的细胞抗炎、免疫与骨细胞修复活性的比较[J].中国实验方剂学杂志,2015(18): 149-154.
[2] 钱力,翁文杰,李成荫,等.淫羊藿黄酮类化合物对骨及软骨细胞作用研究进展[J].中国中医基础医学杂志,2012(3): 347-348.
[3] 李东晓,吴瑕,张磊,等.淫羊藿对骨骼系统的药理作用研究进展[J].中药药理与临床,2009(1): 74-79.
[4] 刘益杰,朱鸿飞,冯伟,等.淫羊藿苷对牛Ⅱ型胶原诱导型关节炎小鼠IL-17/RANKL轴的影响[J].时珍国医国药,2012,23(11): 2776-2778.
[5] 刘益杰,冯伟,何东仪,等.淫羊藿苷对Ⅱ型胶原诱导型关节炎大鼠骨破坏及血清RANKL/OPG的干预作用[J].中国中西医结合杂志,2013,33(9): 1221-1225.
[6] 刘益杰,冯伟,褚立希,等.淫羊藿苷对IL-1β刺激RA滑膜成纤维细胞增殖及TNF-α和RANKL分泌的影响[J].上海中医药杂志,2012(3): 77-80.
[7] 刘益杰,冯伟,杨松滨,等.不同循环静压力对兔软骨细胞整合素α1β1的影响[J].上海中医药杂志,2012(7): 13-15.
[8] 杜义斌,朱丽文.金乌骨通胶囊治疗膝骨关节炎60例疗效观察[J].中国药物与临床,2005,5(8): 625-626.
[9] 陈赛红.新癀片与仙灵骨葆合用治疗中老年骨关节退行性变的临床观察[J].中国中西医结合杂志,2002,22(8): 586-586.
[10] 黄少君,孙升云,徐梅,等.淫羊藿对早期兔膝骨性关节炎软骨的影响[J].暨南大学学报(自然科学与医学版),2014,35(3): 273-278.
[11] 张景,张水花,沈思,等.T1ρ成像技术监测淫羊藿治疗早期兔膝软骨退变[J].实用放射学杂志,2016,32(10): 1609-1613.
[12] 王鹏珍,万超.淫羊藿苷促进软骨细胞体外3-D培养下生成软骨[J].中国老年学杂志,2015(10): 2597-2600.
[13] ZHANG L, ZHANG X, LI K F, et al. Icariin promotes extracellular matrix synthesis and gene expression of chondrocytes in vitro[J]. Phytother Res, 2012,26(9): 1385-1392.
[14] LIU M H, SUN J S, TSAI S W, et al. Icariin protects murine chondrocytes from lipopolysaccharide-induced inflammatory responses and extracellular matrix degradation[J]. Nutr Res, 2010,30(1): 57-65.