卵巢癌是全世界范围内妇科恶性肿瘤患者的主要致死原因。卵巢癌被确诊时通常已处于晚期阶段,导致生存率较差[1],患者的5年生存率仅有5%~30%[2]。不同的卵巢癌中存在广泛的细胞遗传学和分子差异[3]。目前的研究仅限于卵巢上皮细胞生长失控和肿瘤侵袭、转移行为发生的基本分子机制[4]。
TMEM45A(也称为DERP7、DNAPTP7、FLJ10134)属于跨膜蛋白基因家族编码蛋白,近期少数学者开始关注TMEM45A在肿瘤中的表达和作用[6-7]。TMEM45A在MCF-7乳腺癌中表现为表观调控基因[6];在缺氧情况下,TMEM45A的过表达可以支持肝癌和乳腺癌细胞的化疗抵抗[5];过表达的TMEM45A与乳腺癌[5]、膀胱癌[7]和卵巢癌[8]的预后差有关。
本研究探讨了TMEM45A在卵巢癌细胞生物学方面的作用,并研究了其可能的作用机制,为卵巢癌精准治疗靶点提供了理论依据。。
1 材料与方法
1.1 生物信息学分析
对TCGA数据库进行挖掘性分析,寻找到目标基因TMEME45A,发现其在卵巢癌灶及正常组织存在差异表达。并采用GSEA软件对该基因进行富集分析。在所有188个预定义的“KEGG途径”基因组中,TGF-β信号传导途径和粘着斑途径(focal adhesion pathway)被鉴定与TMEM45A的高表达具有显著相关性。选择上述可能相关信号通路中的关键基因: TGF-β1、TGF-β2、RhoA和ROCK2进行检测。
1.2 试剂和样本
TRIzol试剂购自美国Invitrogen公司;OVCAR3、A2780、HO-8910、CAOV3、SKOV3和HEK293T细胞系购自美国模式培养物保藏中心;TMEM45A、TGFβ1、TGFβ2、RhoA和ROCK2抗体购自Abcam公司;GAPDH抗体购自Cell Signaling Technology公司。肿瘤组织和配对的非肿瘤组织收集于2015—2017年共25例上皮性卵巢浆液性腺癌患者,所有患者与同济大学附属杨浦医院签署知情同意书。该项研究已获得同济大学附属杨浦医院伦理委员会的许可。
1.3 细胞培养
OVCAR3、A2780和HO-8910采用RPMI-1640培养液培养;CAOV3、SK-OV-3和HEK293T采用DMEM培养液培养。完全培养液主要包含10%胎牛血清(FBS)、100mg/mL青霉素G、50μg/mL链霉素。以上这些细胞均置于37℃、5% CO2培养箱中进行培养。
1.4 RNA提取和RT-PCR
按试剂说明书,TRIzol法提取总RNA,根据cDNA合成工具操作说明,对提取的mRNA进行反转录获得cDNA。以RT-PCR检测指定基因的mRNA水平。GAPDH作为内参。以ABI 7300 RT-PCR仪为反应仪器,扩增程序如下: 95℃ 10min, 95℃ 15s, 60℃ 45s,共40个循环。以ΔΔCt表示TMEM45A mRNA的相对表达量。实验重复3次,RT-PCR引物见表1。
1.5 Western印迹法
使用放射免疫沉淀法缓冲液溶解细胞,进行BCA蛋白定量测定;制备SDS-PAGE凝胶;随后电印迹到硝酸纤维素膜上。用适当的一级抗体和辣根过氧化物酶缀合的二级抗体进行Western印迹法。
表1 RT-PCR引物
Tab.1 RT-PCR Primers

目的基因引物列表TMEM45A上游:5′⁃ACCAAGTTGGATCATGGGGA⁃3′下游:5′⁃AGCCATGCCAGTTAAAGCCA⁃3′GAPDH上游:5′⁃AATCCCATCACCATCTTC⁃3′下游:5′⁃AGGCTGTTGTCATACTTC⁃3′TGF⁃β1上游:5′⁃GACTACTACGCCAAGGAGGTC⁃3′下游:5′⁃GAGAGCAACACGGGTTCAG⁃3′TGF⁃β2上游:5′⁃AGAGCAGAAGGCGAATGG⁃3′下游:5′⁃AAAGTGCAGCAGGGACAG⁃3′RhoA上游:5′⁃TAGTCCACGGTCTGGTCTTC⁃3′下游:5′⁃CTTTCCACAGGCTCCATCAC⁃3′ROCK2上游:5′⁃CAGCAATGGTAAGCGTAAAG⁃3′下游:5′⁃GTAGAGACGGAGTTTCACTATG⁃3′
1.6 RNA干扰和稳定细胞系的构建
检索美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库(https:∥www.ncbi.nlm.nih.gov/gene/55076)获得人TMEM45A基因全序列(Gene ID: 55076),设计并合成3条特异性针对TMEM45A基因的shRNA(序列如下表)。将3条shRNA分别插入慢病毒载体PLKO.1中。同时设计一条随机序列作为阴性对照-shRNA(scrambleshRNA, scr-shRNA),见表2。并将构建体转染到具有慢病毒包装载体的HEK293T细胞中。转染后48h后,收集慢病毒颗粒,用于感染选定细胞。使用Western印迹和RT-PCR检测TMEM45A-RNAi病毒的沉默效应。选择最有效的shRNA,用于后续实验。
表2 人TMEM45A mRNA shRNA目标靶位及
对照shRNA序列
Tab.2 human TMEM45A mRNA targeting position and scramble shRNA sequence

TMEM45A⁃Ri⁃1713~733(GAGGCCTTTATCTTCTACAAC)TMEM45A⁃Ri⁃2821~841(GAGTTCCTTGTTCGGAACAAT)TMEM45A⁃Ri⁃31248~1268(TAAGTGTACTGTTTGCATTTC)干扰shRNACCTAAGGTTAAGTCGCCCTCG
1.7 细胞实验
1.7.1 细胞增殖实验 将3×103/孔细胞接种在96孔板中,正常条件下培养24h,使用TMEM45A-shRNA病毒(实验组)/阴性对照组病毒(对照组)感染。在指定的时间点,将CCK-8溶液加入到每个孔中并温育1h,通过酶标仪测量波长450nm处的吸光度值(D450)。
1.7.2 细胞周期分析 将细胞接种在6孔板中,并在正常条件下培养24h,然后进行病毒感染,随后在-20℃下固定于70%乙醇中。然后将细胞在磷酸盐缓冲盐水(PBS)中洗涤并重悬于含有20μg/mL PI和200μg/mL核糖核酸酶A的染色溶液中。实验进行3次重复,每个样品分析3×104个细胞。使用Cell Quest软件和手动闸对G1、S和G2 / M级进行定量。
1.7.3 细胞黏附实验 室温下用1mL纤连蛋白(5μg/mL)预包被2h,慢病毒颗粒感染细胞48h后进行测定。将细胞以105/孔细胞的密度接种到包被的平板中,在37℃下附着1h。用PBS洗除非黏附细胞,将平板固定在4%多聚甲醛中并用吉姆萨溶液染色,测定黏附细胞的数量。
1.7.4 体外侵袭实验 在37℃、5% CO2培养箱中用基质胶包被Transwell上孔1h。将指定的细胞血清饥饿24h,上室小层中接种500μL(含有105/ mL细胞)细胞悬浮液,下室中加入750μL(含10%FBS)培养基,培养48h。培养结束后,用棉签轻轻擦拭微孔膜上层细胞。使用PBS洗涤迁移到下层孔中的细胞,固定在4%多聚甲醛中并用0.2%结晶紫染色。在光学显微镜(×100倍)下计数入侵细胞,实验重复3次。
1.8 统计学处理
采用SPSS 17.0统计软件进行,计量资料以![]() 表示,两组间比较采用t检验,多组间检验采用单因素方差分析。P<0.05为差异有统计学意义。
表示,两组间比较采用t检验,多组间检验采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 TMEM45A在卵巢癌组织中过表达
来自TCGA的卵巢癌高通量RNA测序数据显示,TMEM45A在卵巢癌组织中的表达显著高于癌灶相邻组织(P<0.005),这表明TMEM45A可能是卵巢癌的致癌基因,见图1。RT-PCR结果显示TMEM45A在84%(21/25)的测试卵巢癌组织中过表达,其mRNA水平在卵巢肿瘤和正常组织之间有显著差异(P<0.001),见图2。
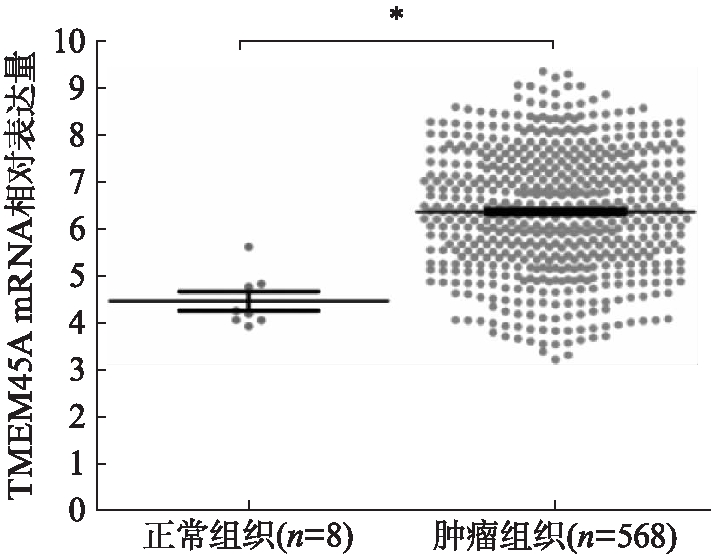
图1 卵巢癌组织RNA测序结果
Fig.1 Ovarian cancer tissue RNA sequencing results
与正常组织相比,*P<0.005
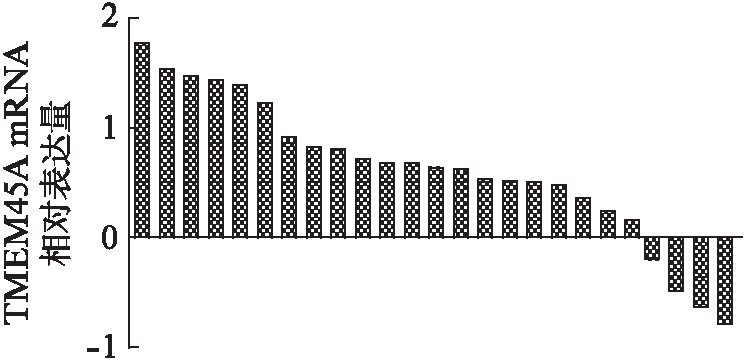
图2 TMEM45A 在卵巢癌组织中的表达情况
Fig.2 TMEM45A expression in ovarian cancer tissues
2.2 RNA干扰下调TMEM45A表达
RT-PCR和Westren印迹法结果显示,TMEM45A在HO-8910和A2780细胞系中的相对的表达量(0.021%+0.1%、0.046%+0.3%)明显高于其余3种细胞系中的表达量(0.007%+0.05%、0.003%+0.03%、0.08%+0.14%)(均P<0.05)。TMEM45A-Ri-3可以明显下调TMEM45A的mRNA和蛋白表达水平,见图3。
2.3 TMEM45A敲降对细胞增殖的影响
2.3.1 抑制卵巢癌细胞增殖 CCK-8结果显示,与空白组和对照组细胞相比,TMEM45A-Ri-3病毒感染的细胞生长明显受到抑制(P<0.05),见图4。
2.3.2 诱导卵巢癌细胞周期停滞 与空白组细胞(45.1±1.1)%和对照组细胞(45.9±1.1)%相比,在TMEM45A shRNA病毒感染的细胞中观察到G1期的HO-8910细胞数(70.8±1.9)%更高,在A2780细胞系中也观察到类似的结果,表明TMEM45A的促进增殖功能很可能是通过促进卵巢癌细胞停留于G1/S细胞周期来实现的,见图5。
2.4 TMEM45A敲降表达对细胞黏附、侵袭的影响
2.4.1 抑制卵巢癌细胞黏附 细胞黏附测定显示,TMEM45A基因敲降使卵巢细胞对纤连蛋白的附着能力被显著抑制。在HO-8910细胞系中,TMEM45A-Ri-3干扰的细胞黏附数目(9.33±0.94)仅占对照组细胞的数目(26.67±1.89)的37%,在A2780细胞系中(29.99±3.68、66.67±5.44)也获得了类似的结果(P<0.05),表明TMEM45A可以调节卵巢癌细胞黏附,见图6。
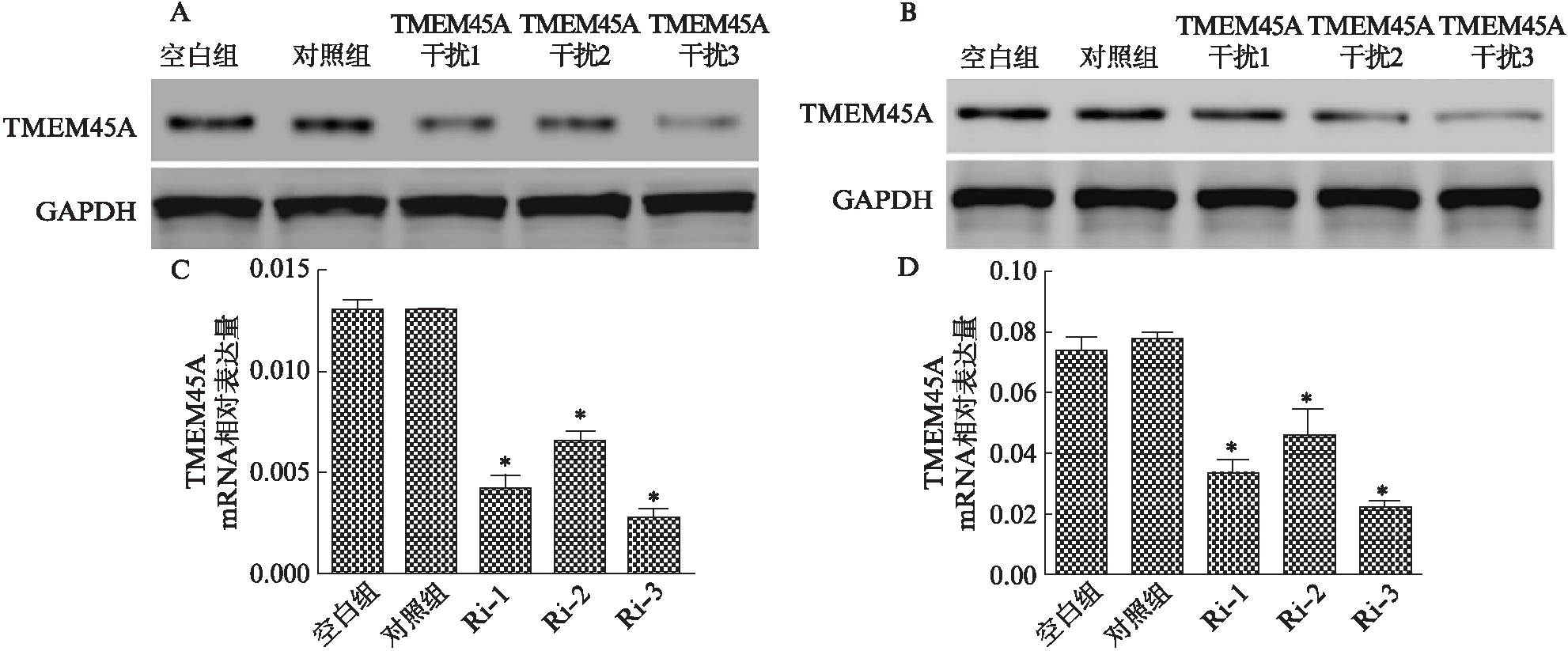
图3 TMEM45A在卵巢癌细胞系中表达情况及基因干扰效果鉴定
Fig.3 TMEM45A expression in ovarian cancer cell lines and identification of gene interference
A:A2780细胞;B: HO-8910细胞;A、B、C、D分别显示了敲降A2780、HO-8910细胞系中TMEM45A基因的效果;Ri-1、Ri-2、Ri-3: TMEM45A-shRNA-1、-2、-3病毒干扰细胞;*P<0.05

图4 CCK-8检测TMEM45A-Ri-3基因敲降影响卵巢癌细胞增殖情况
Fig.4 TMEM45A knockdown impairs cell proliferation in the HO-8910 and A2780 cells
A: A2780细胞系;B: HO-8910细胞系;*P<0.05
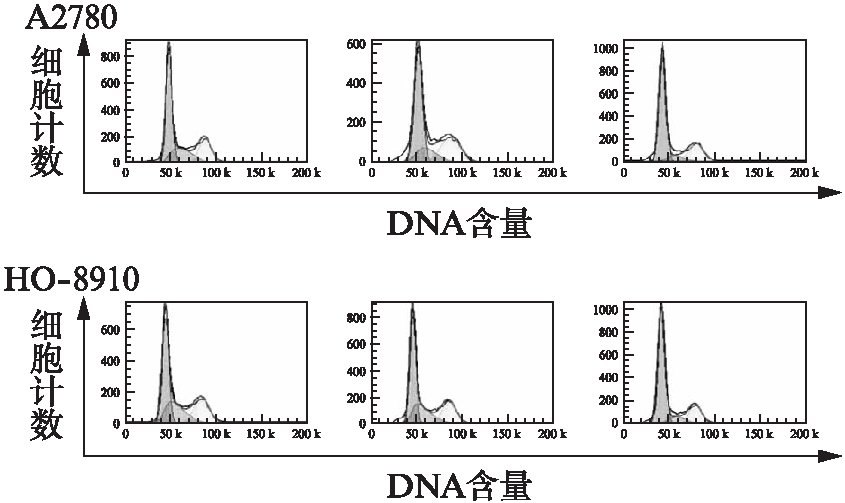
图5 TMEM45A-Ri-3基因影响卵巢癌细胞系周期分布
Fig.5 TMEM45A knockdown impairs cell cycle progression in the HO-8910 and A2780 cells
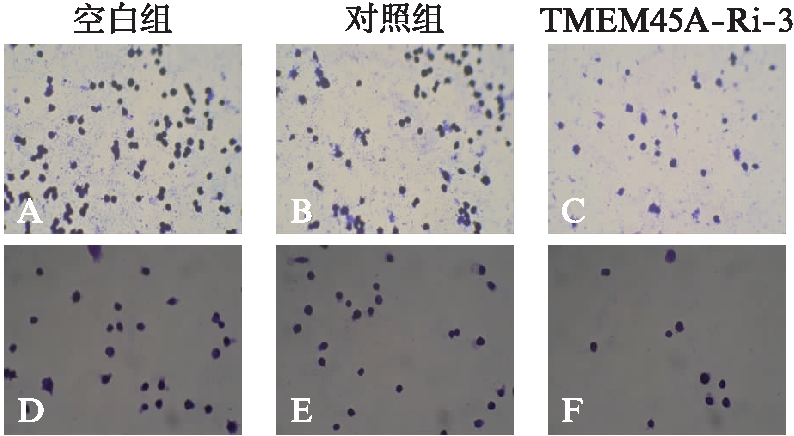
图6 TMEM45A-Ri-3基因干扰抑制卵巢癌细胞黏附
Fig.6 TMEM45A knockdown inhibits cell adhesion
A、B、C: A2780细胞系,D、E、F: HO-8910细胞系
2.4.2 抑制卵巢癌细胞侵袭 基质胶涂层膜室侵袭测定结果显示,TMEM45A敲降细胞与对照组细胞相比,其侵袭能力大大降低。在HO-8910细胞系中,侵入的TMEM45A-Ri-3细胞数目(53.67±10.53)降低到对照组细胞(108±12.25)的38%,在A2780细胞系中(29.99±3.68、66.67±5.44))也获得了类似的结果(P<0.05),见图7。
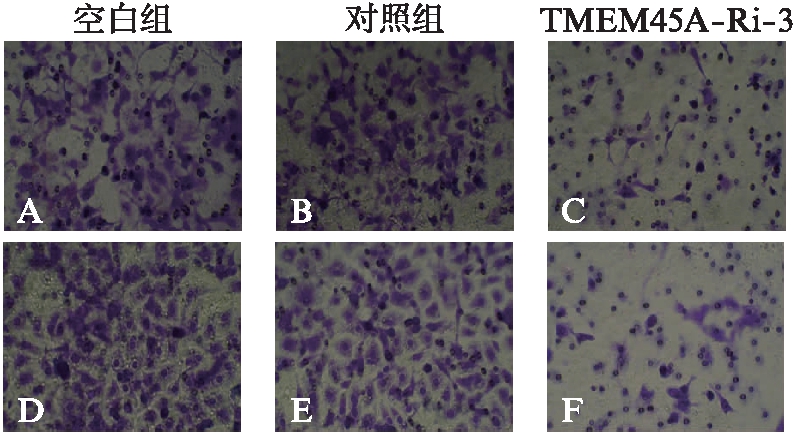
图7 TMEM45A-Ri-3基因干扰抑制卵巢癌细胞侵袭
Fig.7 TMEM45A knockdown inhibits cell invasion
A、B、C: A2780细胞系;D、E、F: HO-8910细胞系
2.5 生物学途径和过程相关基因信号检测
在HO-8910和A2780细胞系中,TMEM45A-Ri-3和对照组细胞中TGF-β信号通路重要调节因子和细胞黏附分子的表达结果显示,随着TMEM45A的下调,TGF-β1、TGF-β2、RhoA、ROCK2的mRNA和蛋白水平均也显著降低(P<0.05),见图8。
3 讨 论
目前,TMEM45A在癌症中的表达和功能已有报道。研究[9-10]显示,TMEM45A有利于肝癌细胞化疗抵抗,同时,敲降TMEM45A基因可以抑制神经胶质瘤细胞的增殖、侵袭和转移。本研究通过分析TCGA高通量RNA测序数据,证明TMEM45A在卵巢癌中的表达高于正常组织。通过RT-PCR对25对卵巢肿瘤和正常组织中TMEM45A的mRNA水平进行分析,发现TMEM45A在84%(21/25)的测试卵巢癌组织中过表达。
为了进一步分析MEM45A在卵巢癌中的功能,本研究通过RNA干扰抑制HO-8910和A2780两种卵巢细胞系中TMEM45A的表达,数据显示抑制TMEM45A的表达显著抑制了卵巢癌细胞增殖。在大多数常见的恶性肿瘤中,经常可以观察到细胞周期的异常调节导致细胞异常增殖[11-12]。在本研究中,RNA干扰导致TMEM45A的沉默效应显著刺激细胞周期停滞于G1期,表明TMEM45A可以通过促进卵巢癌细胞中的G1/S细胞周期转换来促进细胞增殖。这些数据明确了TMEM45A在卵巢细胞癌发生中的作用。
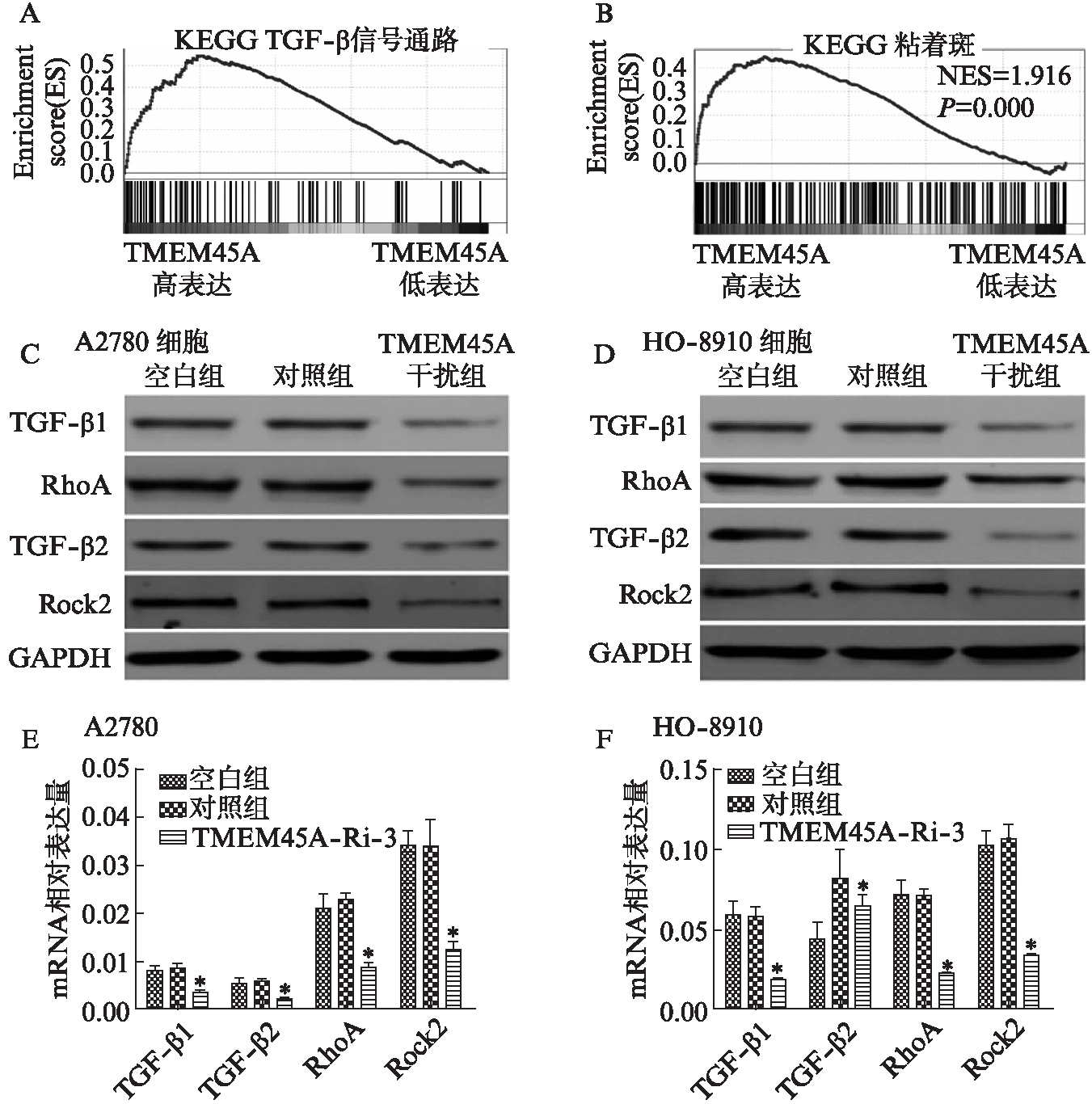
图8 TMEM45A高表达组中相关过表达基因与TMEM45A低表达组中相关低表达基因
Fig.8 Gene set enrichment analysis of genes overexpressed in TMEM45A-higher expression patients relative to TMEM45A-lower expression patients from the TCGA ovarian cancer dataset
A、B: KEGG TGF-β信号通路和粘着斑相关基因与TMEM45A表达正相关;C、E、D、F显示TGF-β1、TGF-β2、RhoA、ROCK2的蛋白和RNA表达被TMEM45A-Ri明显抑制;*P<0.05
TMEM45调节卵巢癌的确切途径仍不清楚。本次实验GSEA数据表明TMEM45A过表达与TGF-β信号通路正相关。TGF-β信号传导参与多种细胞过程,包括细胞分化、增殖、凋亡等,其也被认为可以促进肿瘤进展和侵袭[13]。TGF-β表达升高,肿瘤细胞迁移和侵袭性增强[14]。TMEM45A敲降可以显著降低TGF-β1和TGF-β2的表达,这表明TMEM45A的功能与TGF-β信号转导的调节在卵巢癌细胞中存在关联。
此外,GSEA结果还表明TMEM45A过表达和粘着斑基因之间存在正相关,形成和维持粘着斑需要Rho。研究[15]显示,Rho亚家族的成员RhoA在调节细胞存活、运动、凋亡和侵袭中起重要作用。据报道,RhoA在多种肿瘤中表达明显升高,表明RhoA的表达水平可能与这些肿瘤的进展正相关,在肿瘤发生和进展中起重要作用[16]。通过抑制RhoA表达,可以逆转胃癌[17]和乳腺癌[18]细胞的恶性表型。而抑制ROCK2的表达则减弱了非小细胞肺癌的贴壁依赖性生长和侵袭[19]。本研究发现TMEM45A敲降显著降低了RhoA和ROCK2的mRNA和蛋白水平,RhoA和ROCK2的下调可能与TMEM45A RNAi细胞的黏附和侵袭能力受损有关。
虽然本研究初步验证了TMEM45A对卵巢癌增殖、侵袭的作用,但是TMEM45A作为跨膜蛋白,其胞内上游调节信号途径仍不明确,其激活与抑制途径依然有待研究。TMEM45A要作为卵巢癌靶向治疗的目的基因,其与卵巢癌患者临床预后的关系同样有待进一步研究。
【参考文献】
[1] JEMAL A, SIEGEL R, XU J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010,60(5): 277-300.
[2] CANNISTRA S A. Cancer of the ovary[J]. N Engl J Med, 1993,329(21): 1550-1559.
[3] GURUNG A, HUNG T, MORIN J, et al. Molecular abnormalities in ovarian carcinoma: clinical, morphological and therapeutic correlates[J]. Histopathology, 2013,62(1): 59-70.
[4] 彭书敏,王凯,詹光熙,等.MTA3通过β-hCG调控上皮性卵巢癌侵袭转移的机制研究[J].同济大学学报(医学版),2017,38(4): 1-5.
[5] SUN W, QIU G, ZOU Y, et al. Knockdown of TMEM45A inhibits the proliferation, migration and invasion of glioma cells[J]. Int J Clin Exp Pathol, 2015,8(10): 12657-12667.
[6] FLAMANT L, ROEGIERS E, PIERRE M, et al. TMEM45A is essential for hypoxia-induced chemoresistance in breast and liver cancer cells[J]. BMC Cancer, 2012,12(1): 391.
[7] HSIEH T C, WU J M. Differential control of growth, cell cycle progression, and gene expression in human estrogen receptor positive MCF-7 breast cancer cells by extracts derived from polysaccharopeptide I’m-Yunity and Danshen and their combination[J]. Int J Oncol, 2006,29(5): 1215-1222.
[8] URQUIDI V, GOODISON S, CAI Y, et al. A candidate molecular biomarker panel for the detection of bladder cancer[J]. Cancer Epidemiol Biomarkers Prev, 2012,21(12): 2149-2158.
[9] CRIJNS A P, FEHRMANN R S, DE J S, et al. Survival-related profile, pathways, and transcription factors in ovarian cancer[J]. PLoS Med, 2009,6(2): e24.
[10] FLAMANT L, ROEGIERS E, PIERRE M, et al. TMEM45A is essential for hypoxia-induced chemoresistance in breast and liver cancer cells[J]. BMC Cancer, 2012, 12(1): 1-16.
[11] EVAN G I, VOUSDEN K H. Proliferation, cell cycle and apoptosis in cancer[J]. Nature, 2001,411(6835): 342-348.
[12] MOLINARI M. Cell cycle checkpoints and their inactivation in human cancer[J]. Cell Prolif, 2000,33(5): 261-274.
[13] LI Z, DONG M, FAN D, et al. LncRNA ANCR down-regulation promotes TGF-β-induced EMT and metastasis in breast cancer[J]. Oncotarget, 2017,8(40): 67329-67343.
[14] WAKEFIELD L M, ROBERTS A B. TGF-beta signaling: positive and negative effects on tumorigenesis[J]. Curr Opin Genet Dev, 2002,12(1): 22-29.
[15] SCHMITZ A A, GOVEK E E, BÖTTNER B, et al. Rho GTPases: signaling, migration, and invasion[J]. Exp Cell Res, 2000,261(1): 1-12.
[16] MATSUOKA T, YASHIRO M. Rho/ROCK signaling in motility and metastasis of gastric cancer[J]. World J Gastroenterol, 2014,20(38): 13756-13766.
[17] LIU N, BI F, PAN Y, et al. Reversal of the malignant phenotype of gastric cancer cells by inhibition of RhoA expression and activity[J]. Clin Cancer Res, 2004,10(18 Pt 1): 6239-6247.
[18] PILLÉ J Y, DENOYELLE C, VARET J, et al. Anti-RhoA and Anti-RhoC siRNAs Inhibit the Proliferation and Invasiveness of MDA-MB-231 Breast Cancer Cells in Vitro and in Vivo[J]. Mol Ther, 2005,11(2): 267-274.
[19] VIGIL D, KIM T Y, PLACHCO A, et al. ROCK1 and ROCK2 are required for non-small cell lung cancer anchorage-independent growth and invasion[J]. Cancer Res, 2012,72(20): 5338-5347.