内皮前体细胞(endothelial progenitor cells, EPCs)具有诱导血管新生,重建缺血区域微循环功能的作用,在治疗下肢缺血的临床研究中已经取得了明确的疗效[1-2]。糖尿病患者自体EPCs在高糖导致的氧化应激下出现功能障碍,需要进行干预调控才能有效提高其促糖尿病足微循环血管新生的疗效。碱性成纤维细胞生长因子-2(FGF-2)是一种能调节细胞分裂、增殖、迁移及分化的多效活性肽,可以促进血管生成、伤口愈合、胚胎发育和器官分化[3],然而FGF2对高糖下EPCs功能障碍的修复作用尚未有人研究。因此,本研究主要探讨外源FGF2对体外高糖条件下受损EPCs功能的影响。
1 材料与方法
1.1 实验材料
8周龄健康雄性C57BL/6J小鼠26只,每只体质量约25g,购自上海斯莱克实验动物有限公司,饲养在SPF级、12h昼夜循环的动物房,所有动物实验均经过上海实验动物伦理委员会批准。
EGM2培养液购自Cloneties公司;胎牛血清购自美国Gibco公司;胰蛋白酶-EDTA购自北京雷根生物有限公司;FGF-2购自R&D公司;TUNEL工作液购自Roche公司;基质胶购自Becton Dickson公司;单克隆抗体CD31、CD144、CD45、KDR及兔抗小鼠active β-catenin、β-catenin多克隆抗体购自Abcam公司;FITC标记荆豆凝集素I(FITC-UEA-I)购自Sigma公司;DiI标记的乙酰化低密度脂蛋白(Dil-ac-LDL)购自Molecular Probes公司;0.25%胰酶购自美国Invitrogen公司;多聚甲醛、RIPA裂解液购自生工生物工程(上海)股份有限公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;IgG山羊抗兔二抗购自武汉博士德生物工程有限公司;ECL荧光显示剂购自Pirece公司;其余为市售试剂(级别: AR)。
仪器24孔板、Transwell小室购自美国Corning公司;流式细胞仪购自美国BD公司;荧光倒置显微镜购自日本Olympus;凝胶图像分析软件购自上海天能科技有限公司;电泳槽、电转仪和酶标仪购自美国Bio-Rad公司;CO2细胞培养箱购自美国Thremo公司;激光多普勒血流仪购自美国Devon公司。
1.2 EPCs的分离培养与鉴定
小鼠使用巴比妥酸麻醉后断颈处死,无菌条件下从股骨和胫骨取骨髓组织,分离单核细胞。使用EGM2培养液补充VEGF等生长因子和5%胎牛血清培养,取贴壁细胞继续于37℃、5%CO2条件下培养,每3天换液1次。流式细胞仪分析EPCs细胞表型以及Dil-ac-LDL和FITC-UEA-I双荧光染色鉴定EPCs。
1.3 EPCs分组及处理
EPCs培养7d后,以0.25%胰酶消化,细胞悬液以1×106/mL接种,分为正常对照组、高糖组、高糖+FGF-2处理组,培养48h后,进行细胞功能检测。正常对照组采用EGM2培养液+5%胎牛血清培养,高糖组采用EGM2培养液+5%胎牛血清+高糖(30mmol/L)培养,高糖+FGF-2处理组采用EGM2培养液+5%胎牛血清+高糖(30mmol/L)+FGF-2(0、30、50、100、150、300ng/mL)。
1.4 EPCs凋亡检测
按TUNEL法标准程序进行。细胞用4%多聚甲醛固定,蒸馏水洗后,按照试剂盒说明进行,避光条件下DAB显色,用苏木精复染、中性树胶封片,高倍显微镜下随机选取5个视野计数。
1.5 EPCs迁移能力
采用Transwell小室评价EPCs的迁移能力。将同步化后的EPCs用2.5g/L胰酶消化,用无血清的M199培养基重悬后,以2×104/孔的密度重新种植于24孔板Transwell的上室,下室加入含50μg/L VEGF的培养基,将FGF2加于上室。CO2孵箱孵育24h,多聚甲醛固定,结晶紫染色,在高倍显微镜下计数6个随机视野的EPCs数量。
1.6 EPCs成管能力检测
将稀释的基质胶按200μL/孔接种到预冷的24孔板中,置于37℃ 40min,使基质胶凝固。消化收集细胞,用EGM-2悬浮,每孔按2×104/500μL加入24孔板中,37℃ 5%CO2孵育24h。倒置显微镜下观察并计数小管样结构。
1.7 Western印迹法检测活化β-catenin和总β-catenin的表达
EPCs细胞培养7d后,以0.25%胰酶消化,细胞悬液以1×106/mL接种,各处理条件下培养48h后胰蛋白酶消化收集细胞,提取总蛋白,BCA法测定蛋白浓度。每组取20μg蛋白,SDS-PAGE分离蛋白,电转至PVDF膜,使用相应抗体孵育后,化学发光法ECL显影。应用Image-Pro Plus 6.0软件对各特异性条带进行累计吸光密度分析。
1.8 体内验证实验
用8周龄健康雄性C57BL/6J小鼠构建后肢缺血模型,步骤如下: 适量戊巴比妥钠(50mg/kg)腹腔麻醉,脱毛剂脱除小鼠双下肢全部毛发。仰卧位固定于手术台上,消毒,铺巾,从腹股沟到膝关节处沿着血管走向用眼科剪剪开一纵形切口,暴露股动脉全长,上端结扎股动脉出腹股沟处并切断,向下逐一结扎切断分支动脉至股动脉分支为腘动脉和股浅动脉处,取出股动脉,逐层缝合皮肤。丁丙诺啡(0.04mg/kg SC)被用来术后镇痛。将后肢缺血小鼠随机分为4组,每组6只。收集正常组、高糖组、高糖+FGF2(150ng/mL)组EPCs,在后肢缺血模型建立后48h,通过小鼠尾静脉注射1×107个各处理下EPCs,其中1组注射无细胞的培养基作为空白对照。EPCs注射4周后,利用激光多普勒血流仪测量小鼠后肢血液灌注情况。红色区域为血液灌注丰富的区域。
1.9 统计学处理
应用SPSS 17.0软件对实验数据进行统计分析,计量资料以![]() 表示,两组间均数比较采用t检验、多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
表示,两组间均数比较采用t检验、多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 EPCs培养与鉴定
EPCs传代培养后细胞形态稳定,呈卵圆形生长,见图1A、图1B。激光共聚焦显微镜观察贴壁细胞,在激发光549nm,发射光565nm波长时,DiI-Ac-LDL吞噬功能呈阳性,细胞胞质呈红色,见图1C;在激发光488nm,发射光520nm波长下细胞与FITC-UEA-1结合,连接呈阳性,呈现绿色荧光,见图1D。流式细胞仪分析结果显示,EPCs相关的表面抗原标记KDR、CD31、CD144阳性率分别为(95.2±4.1)%、(84.1±6.8)%和(77.5±7.8)%;不表达造血干细胞系表面抗原标记CD45,其阳性率仅为(4.9±1.2)%,见图1E。
2.2 FGF2对高糖下EPCs凋亡的影响
Tunel细胞凋亡检测显示,EPCs与高糖共同孵育48h后,细胞凋亡率显著高于正常对照组(P<0.01);不同浓度外源性FGF-2处理下的EPCs,细胞凋亡率较高糖组明显降低,且凋亡率随FGF2浓度的升高逐渐降低,150ng/mL FGF2处理组凋亡率降低最为明显(P<0.05,P<0.01),见图2。

图1 流式细胞仪与激光共聚焦显微镜对EPCs鉴定结果(×200,n=3)
Fig.1 Identification of EPCs by flow cytometry and confocal laser scanning microscopy(×200,n=3)
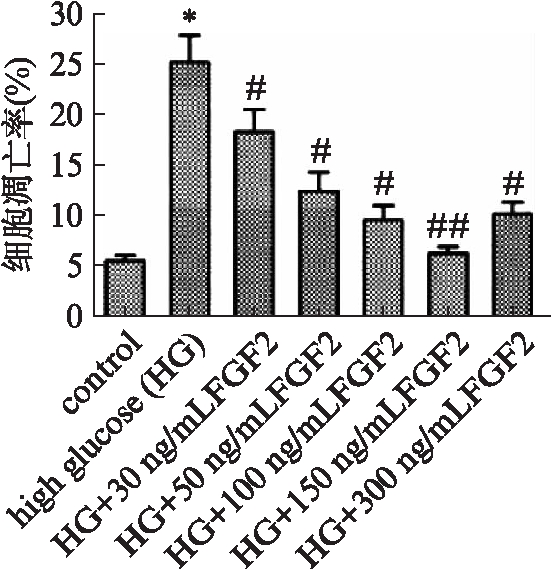
图2 Tunel检测EPCs凋亡率
Fig.2 Apoptosis rate of EPCs
与对照组相比,*P<0.01;与高糖组相比,#P<0.05,##P<0.01;n=3
2.3 FGF2对高糖下EPCs迁移的影响
Tranwell小室检测结果显示,高糖组EPCs迁移数显著低于对照组(P<0.01);不同浓度外源性FGF-2处理的高糖损伤后EPCs,细胞迁移数均显著高于高糖组(P<0.05),且细胞迁移数随FGF2浓度的升高依次增多,150ng/mL FGF2处理组细胞迁移数增加最为显著(P<0.01),见图3。
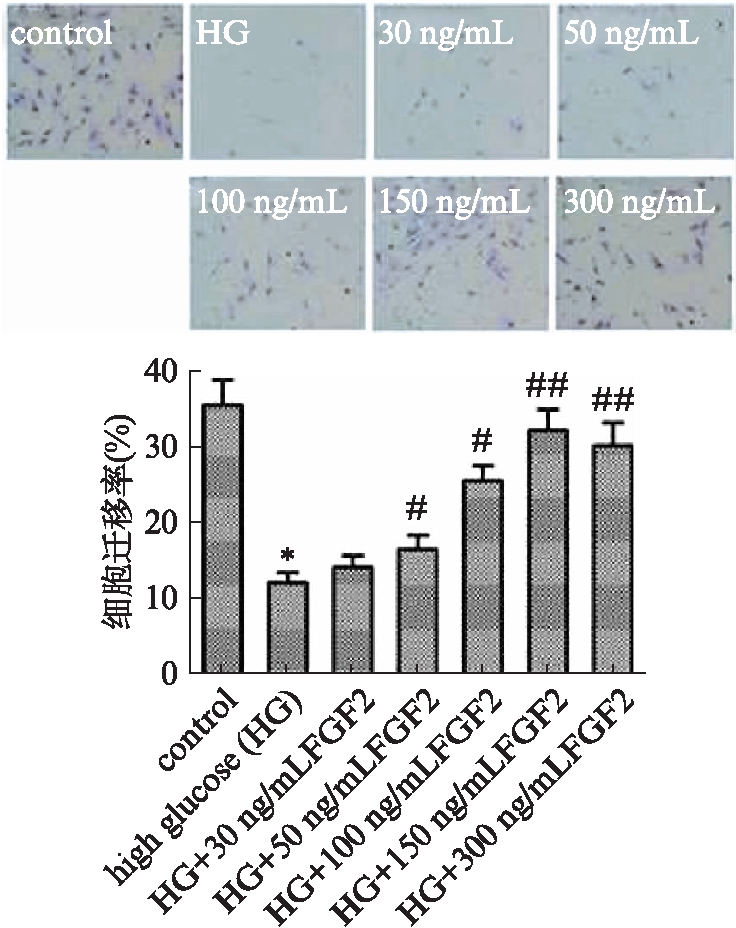
图3 Transwell检测EPCs迁移图像及迁移率(×200)
Fig.3 EPCs cell migration in Transwell chamber(×200)
与对照组相比,*P<0.01;与高糖组相比,#P<0.05,##P<0.01;n=3
2.4 FGF2对高糖下EPCs成管能力的影响
细胞成管检测结果显示,高糖组EPCs成管腔数目较正常对照组显著降低(P<0.01),外源性FGF-2的加入显著提高了细胞成管能力(P<0.05),且随FGF2浓度的升高细胞成管腔数目依次增多,加入150ng/mL FGF2处理细胞时,细胞成管能力最强(P<0.05,P<0.01),见图4。
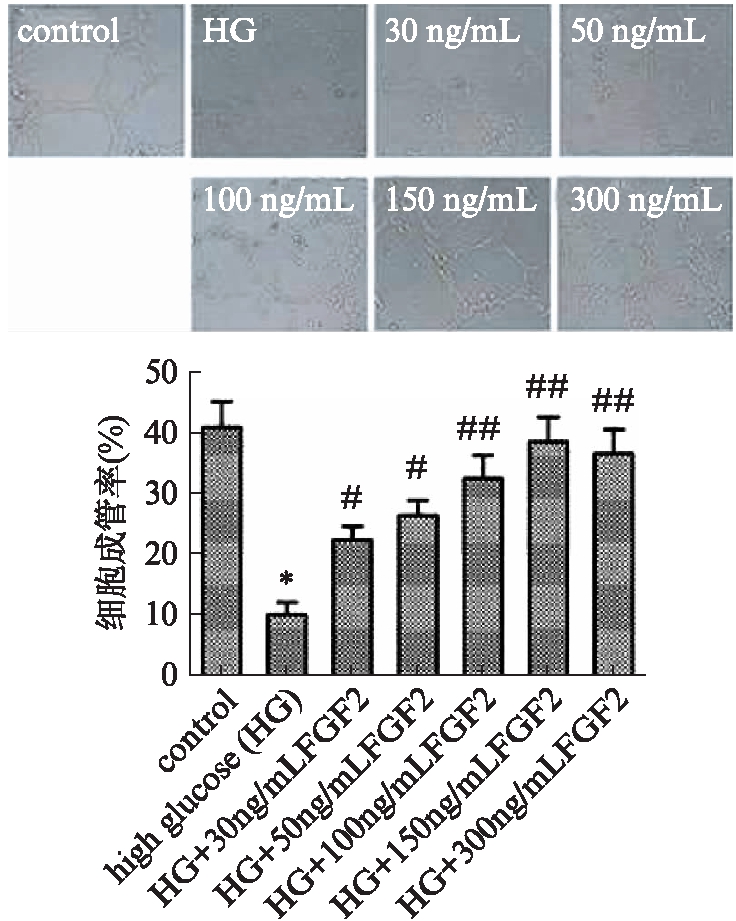
图4 EPCs的Matrigel成管图像及成管率(×200)
Fig.4 Tube formation of EPCs in Matrigel(×200)
与对照组相比,*P<0.01;与高糖组相比,#P<0.05,##P<0.01;n=3
2.5 FGF2对高糖下EPCs Wnt/β-catenin通路活化的影响
Western印迹法结果表明,高糖组EPCs中活性β-catenin的比例较对照组显著降低(P<0.05),外源性FGF-2的加入显著提高了活性β-catenin的比例(P<0.05),且随FGF2浓度的升高逐渐增加,150ng/mL浓度下β-catenin活性最强(P<0.01),见图5。
2.6 体内验证FGF2对高糖下EPCs功能的影响
激光多普勒血流仪测量结果显示,4周后,注射正常EPCs的小鼠缺血后肢血流量显著增加,注射高糖处理EPCs的小鼠缺血后肢血流量较正常EPCs组显著降低,而高糖+FGF2组小鼠缺血后肢血流量较高糖EPCs组显著升高,见图5。
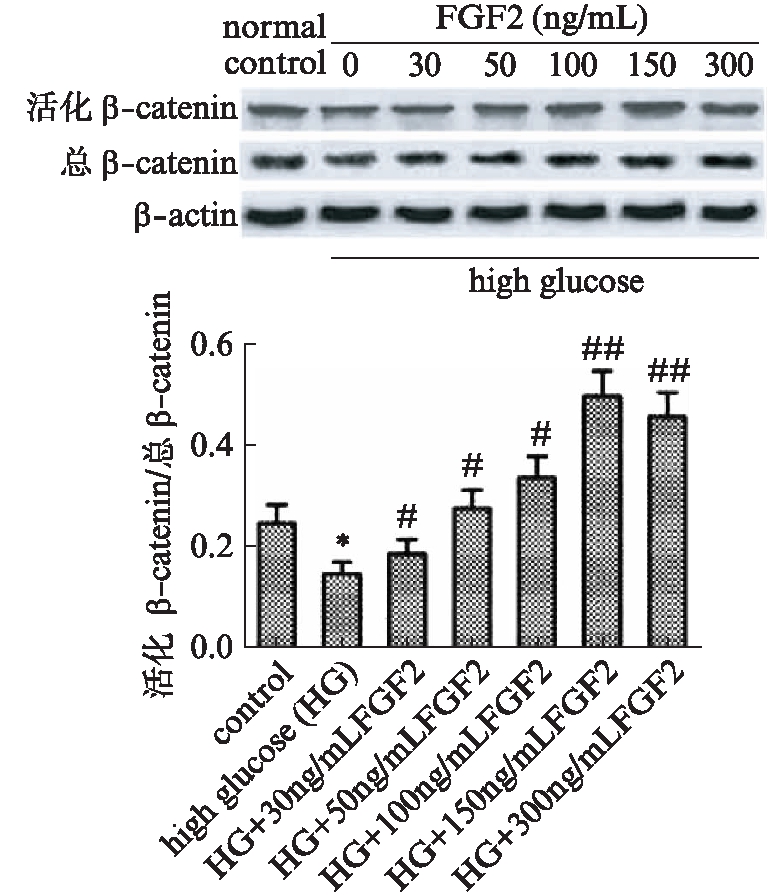
图5 EPCs中Wnt/β-catenin通路信号分子的表达
Fig.5 Expression of Wnt/β-catenin signaling molecules in EPCs
与对照组相比,*P<0.01;与高糖组相比,#P<0.05,##P<0.01;n=3
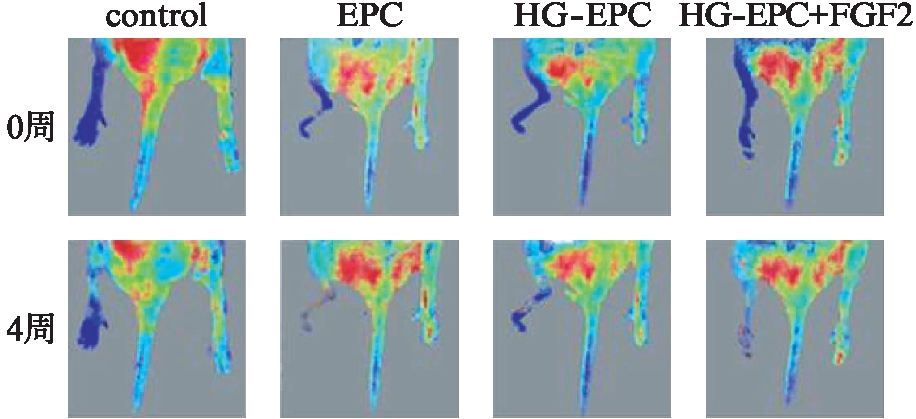
图6 激光多普勒血流仪测量各组小鼠缺血后肢血流量(n=6)
Fig.6 Blood flow of mouse ischemic hindlimb measured by laser Doppler flowmetry(n=6)
3 讨 论
糖尿病可引发多种并发症[4]。糖尿病足是指糖尿病患者因合并神经病变和末梢血管病变(下肢动脉供血不足)而引起下肢皮肤溃疡、感染和(或)深部组织破坏等病变,许多患者因此截肢致残[5]。微循环障碍是糖尿病足的重要病理基础,它在糖尿病患者血管内皮功能障碍及植物神经调节功能障碍的共同长期作用下形成,导致组织缺血[6]。缺血组织释放的因子能动员并招募干细胞、前体细胞至损伤部位并替换修复损伤组织[7]。
血管生成是一个多阶段的过程,涉及多种生长因子、细胞因子以及细胞的参与[8]。EPCs具有增殖、黏附、迁移并形成特定血管结构的能力[9]。利用EPCs能够移行至血管受损部位进行修复的特点[10],将EPCs移植到缺血组织可以作为治疗血管相关疾病的一种很有前途的方法[11]。自体EPCs移植有患者痛苦小、采集的干细胞数量多、移植后恢复快等优点[12],然而,在糖尿病患者体内的高糖环境下,自体EPCs移植因为EPCs功能障碍而收效甚微,对其进行人工干预有望改善自体EPCs功能。
EPCs最早从人的外周血液中分离获得,细胞表面抗原CD34+和KDR+为标志。在缺血动物模型中发现其能在组织水平上整合到新生毛细血管,从而提示EPCs能增进缺血组织的血管侧支生长[13-14]。EPCs共表达两种表面标志物,即造血干细胞的表面标志物(CD34和CD133)和内皮细胞的表面标志物(VEGF-R2,亦称KDR)[15]。早期EPCs生长速度较快,具有高血管生成能力,但增殖能力较低,表达髓系[16]。晚期EPCs生长速度较慢,是高度增殖非髓样细胞,形成内皮细胞[17-18]。在一些CD分子的表达上,Late EPCs几乎不表达CD133,KDR和CD34表达量不高[19],几乎100%表达CD31、CD144、CD146、CD105、vWF和Enos。流式细胞分析发现,本研究分离的EPCs表达与内皮祖细胞系相关的表面抗原标记KDR、CD31、CD144,而不表达造血干细胞系表面抗原标记CD45。培养至第7天,贴壁的梭形细胞从细胞团边缘出芽生长,表达EPCs特异性抗原标志,可特异性摄取FITC-UEA-I并内吞Dil-ac-LDL,确定细胞为晚期内皮组细胞。
EPCs能分泌包括VEGF、HGF、MCP-1、IL-1β、IL-8等多种生长因子,但EPCs自分泌或者旁分泌的FGF-2数量极低。高糖会导致EPCs的这种旁分泌与自分泌功能异常。研究发现,糖尿病患者EPCs分泌的干细胞因子、生长因子和促血小板生成素减少,而IL-1β、TNF-α增加,低氧环境不能上调其HIF-1α表达。高糖诱导氧化应激反应是导致糖尿病患者EPCs功能障碍的主要原因[20],氧化应激可促进EPCs凋亡[21],并引起EPCs活性降低,迁移、成管等功能下降[22]。因此,氧化应激可能是预防糖尿病血管稳态受损的重要治疗靶点。本研究通过在体外模拟糖尿病体内高糖环境,结果表明30mmol/L高糖培养条件下EPCs凋亡增加,迁移和成管能力明显下降,说明高糖导致了EPCs功能障碍。FGF2在血管生成过程中发挥重要作用,通过刺激蛋白酶合成金属蛋白酶和尿激酶型纤溶酶原激活剂,降解基底膜,有助于细胞迁移形成新血管[23];参与细胞外基质的合成,促进新生血管的成熟[24];可刺激血管内皮生长因子VEGF的合成[25],这些都表明FGF-2具有促血管生成特性。体内FGF2参与增殖、分化、血管生成、创伤愈合、胚胎发育与分化为多器官等重要生理过程。本研究通过加入外源FGF-2,研究其对EPCs功能障碍的修复作用。实验发现加入外源性FGF-2可显著抑制高糖引起的EPCs凋亡,迁移和成管能力也明显增强,浓度为150ng/mL时效果最好;体内实验中,FGF-2处理过的高糖-EPCs对缺血修复作用也显著提高,进一步表明FGF-2可以明显改善高糖引起的EPCs功能障碍。Wnt信号是已知的调节血管生成和调整EPCs动员的关键。有研究[26]表明,Wnt/β-catenin信号通路在血管生物学中起关键的作用,激活Wnt信号通路能促进肢体缺血损伤后的血管再生,而抑制Wnt信号通路则起相反作用。FGF-2是否通过Wnt/β-catenin信号通路调节EPCs的功能有待研究,本研究发现FGF-2加入后Wnt/β-catenin通路活化,表明,FGF2是通过激活Wnt/β-catenin通路促进受损EPCs功能恢复。
分离糖尿病患者EPCs,在体外用高水平的FGF-2处理改善其功能,再用于自体EPCs移植,有利于提高自体细胞移植疗效,使其更加有效地促进血管发生、参与伤口愈合。因此,注射外源性FGF-2处理的自体EPCs有可能提高EPCs治疗的受益程度和预防截肢。但目前EPCs治疗尚未形成一套标准的表型和功能分析,亦未对细胞体内环外境的综合评价标准化,在EPCs生物学的研究中仍然存在的争议很多。
【参考文献】
[1] 鲁俊.内皮前体细胞移植在糖尿病足治疗中的作用[J].同济大学学报(医学版),2016,37(2): 110-117.
[2] SHEU J J, LIN P Y, SUNG P H, et al. Levels and values of lipoprotein-associated phospholipase A2, galectin-3, RhoA/ROCK, and endothelial progenitor cells in critical limb ischemia: pharmaco-therapeutic role of cilostazol and clopidogrel combination therapy[J]. J Transl Med, 2014,12(1): 101.
[3] LITWIN M, RADWA![]() SKA A, PAPROCKA M, et al. The role of FGF2 in migration and tubulogenesis of endothelial progenitor cells in relation to pro-angiogenic growth factor production[J]. Mol Cell Biochem, 2015,410(1-2): 131-142.
SKA A, PAPROCKA M, et al. The role of FGF2 in migration and tubulogenesis of endothelial progenitor cells in relation to pro-angiogenic growth factor production[J]. Mol Cell Biochem, 2015,410(1-2): 131-142.
[4] VLADU M, CLENCIU D, EFREM I C, et al. Insulin resistance and chronic kidney disease in patients with type 1 diabetes mellitus[J]. J Nutr Metab, 2017,2017: 6425359.
[5] AHMAD J. The diabetic foot[J]. Diabetes Metab Syndr, 2016,10(1): 48-60.
[6] KABBANI M, ROTTER R, BUSCHE M, et al. Impact of diabetes and peripheral arterial occlusivedisease on the functional microcirculation at the plantar foot[J]. Plast Reconstr Surg Glob Open, 2013,1(7): e48.
[7] CHEN H, WANG S, ZHANG J, et al. A novel molecule Me6TREN promotes angiogenesis via enhancing endothelial progenitor cell mobilization and recruitment[J]. Sci Rep, 2014,4: 6222.
[8] KOTA S K, MEHER L K,JAMMULA S, et al. Abberant angiogenesis: The gateway to diabetic complications[J]. Indian J Endocrinol Metab, 2012,16(6): 918-930.
[9] NGUYEN M P, LEE D, LEE S H, et al. Deguelin inhibits vasculogenic function of endothelial progenitor cells in tumor progression and metastasis via suppression of focal adhesion[J]. Oncotarget, 2015,6(18): 16588-16600.
[10] PRISCO A R, HOFFMANN B R, KACZOROWSKI C C, et al. Tumor necrosis factor α regulates endothelial progenitor cell migration via CADM1 and NF-κB[J]. Stem Cells, 2016,34(7): 1922-1933.
[11] COBELLIS G, BOTTI C, TADDEO A, et al. Successful bone marrow transplantation reveals the lack of endothelial progenitor cells mobilization in a patient with critical limb ischemia: a case report[J]. Transplant Proc, 2010,42(7): 2816-2820.
[12] SMADJA D M, DUONG-VAN-HUYEN J P, DAL CORTIVO L, et al. Early endothelial progenitor cells in bone marrow are a biomarker of cell therapy success in patients with critical limb ischemia[J]. Cytotherapy, 2012,14(2): 232-239.
[13] ZHOU W, ZHOU W, ZENG Q, et al. MicroRNA-138 inhibits hypoxia-induced proliferation of endothelial progenitor cells via inhibition of HIF-1α-mediated MAPK and AKT signaling[J].Exp Ther Med, 2017,13(3): 1017-1024.
[14] COLLET G, SZADE K, NOWAK W, et al. Endothelial precursor cell-based therapy to target the pathologic angiogenesis and compensate tumor hypoxia[J]. Cancer Lett, 2016,370(2): 345-357.
[15] LI T, WANG G D,TAN Y Z, et al. Inhibition of lymphangiogenesis of endothelial progenitor cells with VEGFR-3 siRNA delivered with PEI-alginate nanoparticles[J]. Int J Biol Sci, 2014,10(2): 160-170.
[16] WILS J, FAVRE J, BELLIEN J. Modulating putative endothelial progenitor cells for the treatment of endothelial dysfunction and cardiovascular complications in diabetes[J]. Pharmacol Ther, 2017,170: 98-115.
[17] CRITSER P J, YODER M C. Endothelial colony-forming cell role in neoangiogenesis and tissue repair[J]. Curr Opin Organ Transplant, 2010,15(1): 68-72.
[18] FERNANDEZ C E, OBI-ONUOHA I C, WALLACE C S, et al. Late-outgrowth endothelial progenitors from patients with coronary artery disease: endothelialization of confluent stromal cell layers[J]. Acta Biomater, 2014,10(2): 893-900.
[19] URBICH C, DIMMELER S. Endothelial progenitor cells: characterization and role in vascular biology[J]. Circ Res, 2004,95(4): 343-353.
[20] WU H, LI R, WEI Z H, et al. Diabetes-Induced Oxidative Stress in Endothelial Progenitor Cells May Be Sustained by a Positive Feedback Loop Involving High Mobility Group Box-1[J]. Oxid Med Cell Longev, 2016,2016: 1943918.
[21] WANG F, WANG Y Q, CAO Q, et al. Hydrogen peroxide induced impairment of endothelial progenitor cell viability is mediated through a FoxO3a dependant mechanism[J]. Microvasc Res, 2013,90(6): 48-54.
[22] LU C, ZHANG X, ZHANG D, et al. Short time tripterine treatment enhances endothelial progenitor cell function via heat shock protein 32[J]. J Cell Physiol, 2015,230(5): 1139-1147.
[23] ELKIN M, MIAO H Q, NAGLER A, et al. Halofuginone: a potent inhibitor of critical steps in angiogenesis progression[J]. FASEB J, 2000,14(15): 2477-2485.
[24] DAVIS G E, KIM D J, MENG C X, et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes[J].Methods Mol Biol, 2013,1066: 17-28.
[25] GUI C, LI S, NONG Q L, et al. Changes of serum angiogenic factors concentrations in patients with diabetes and unstable angina pectoris[J].Cardiovasc Diabetol, 2013,12: 34.
[26] JIANG L, YIN M, WEI X, et al. Bach1 Represses Wnt/β-Catenin Signaling and Angiogenesis[J]. Circ Res, 2015,117(4): 364-375.