脊髓损伤(spinal cord injury, SCI)通常会造成永久性感觉及运动功能障碍,难以治愈。天冬酰胺内肽酶(asparagine endopeptidase, AEP) 与年龄密切相关,在衰老大脑中表达上调并被活化。在酸性缓冲液中可剪切β淀粉样蛋白前体蛋白(amyloid β precursor protein, APP)以及Tau蛋白[1],因而影响认知功能。而敲除了AEP基因的老年小鼠则不能剪切APP。最近,Emory大学Zhang等[2](KeqiangYe团队)通过小分子药物高通量筛选,找到AEP特异性小分子抑制剂,暂时命名为compound#11,4-(哌啶-1-取代)苯胺基团是其关键药效基团。其能与AEP结合,在初级神经元中阻断APP和Tau蛋白的剪切[2]。脊髓损伤部位的炎性微环境中,由于K+大量外流[3]导致损伤部位细胞的胞内基质的pH值比正常组织略低,而且会大量表达某些种类的蛋白酶[4]。其中,损伤部位的AEP表达量上调,推测其活性也会升高。但是其是否有助于SCI小鼠脊髓组织结构及功能的恢复尚不明确。所以,本研究观察腹腔注射compound#11对SCI小鼠脊髓组织结构及运动功能的影响。
1 材料与方法
1.1 材料
健康成年雌性C57BL/6小鼠28只,8~10周龄,体质量(20±1.0)g,购于斯莱克动物实验公司,由同济大学动物实验中心饲养,SPF级别。温度(20±3)℃,湿度(50±20)%,每日光照12h,全营养鼠粮及适当饮食用水;compound#11由Keqiang Ye教授实验室提供;丙戊酸(VPA)购于Sigma公司;解剖显微镜购于Olympus公司;Rotarod转棒仪购于济南益延科技公司;肌电诱发电位仪购于丹麦丹迪公司;显微镜和数码摄像显微图像系统购于Leica公司;改造动脉夹,维持前端压力恒定为60g。
1.2 实验方法
1.2.1 动物分组、模型制作及给药 (1) 动物分组。将28只C57BL/6小鼠随机分为compound#11干预组、VPA干预组、生理盐水对照组、假手术组,每组7只。(2) 小鼠脊髓损伤模型的构建。采用腹腔注射5%戊巴比妥钠麻醉小鼠,背部去毛,将小鼠固定于手术台上。除假手术组以外的3组小鼠,在外科显微镜下,纵行切开皮肤去除T9椎板,充分暴露T9脊髓节段后采用改造后的动脉夹钳夹脊髓3s造成急性脊髓损伤模型。假手术组只行椎板切除术,未进行脊髓钳夹。逐层缝合肌肉、皮肤,将术后小鼠安置于体温维持垫上苏醒;术后辅助小鼠排尿每日2次,每次排尿后使用碘伏消毒尿道。(3) 给药方法。术后苏醒30min给药。compound#11干预组腹腔注射compound#11 10mg/kg,每日1次,连续28d;VPA干预组腹腔注射VPA 200mg/kg,每日1次,连续7d;生理盐水对照组在每日相同时间点,腹腔注射等量生理盐水,连续28d。
1.2.2 运动功能评价方法 术后7、14、21、28d,进行BMS评分、Rotarod检测,对小鼠后肢运动功能进行评价。所有的行为学评价采用双盲方法。BMS评分: 内容包括后肢各关节活动度、后肢步态和协调性、运动时爪子的精细运动,主评分满分9分,副评分满分11分。Rotarod检测: 依据小鼠在固定转速下所能承受的最长时间,来比较组间差异。规定最长时间不超过60s。
1.2.3 电生理 采用运动诱发电位(motor evoked potentials, MEP)评价SCI后脊髓传导功能完整性。评价指标包MEP的潜伏期、波幅。小鼠经盐酸氯胺酮注射液麻醉,测试均重复2次,确保结果的准确性。
1.2.4 组织形态观察方法 H-E染色: 术后28d小鼠处死,取脊髓组织在4%多聚甲醛中固定,用石蜡包埋,连续切片,进行H-E染色,显微镜下观察并拍照。免疫组化: 术后28d对小鼠进行在体灌注,分离出来的脊髓组织置于OCT中,并在液氮中冰冻OCT完全变成固体后,-80℃冰箱过夜。冰冻切片机切片后,滴加一抗、二抗进行免疫荧光染色,激光共聚焦显微镜下观察并拍照。
1.3 统计学处理
使用GraphPad Prism软件,数据以![]() 表示,所有实验数据均采用t检验分析差异。P<0.05为差异有统计学意义。
表示,所有实验数据均采用t检验分析差异。P<0.05为差异有统计学意义。
2 结 果
2.1 行为学评价
损伤后不同时间点各组小鼠BMS双盲法评分见表1。28d后,compound#11干预组、VPA干预组、生理盐水对照组BMS评分与假手术组相比,差异具有统计学意义(P<0.05)。虽然compound#11干预组、VPA干预组与生理盐水对照组相比无明显统计学差异(P>0.05),但两给药组BMS评分在每一个时间点都高于生理盐水对照组,评分呈总体升高的趋势,见图1。
表1 不同时间点各组BMS评分统计
Tab.1 BMS score at different time points after SCI

组别7d14d21d28dcompound#11干预组02±041065±074136±074164±084VPA干预组022±040072±04611±05618±063生理盐水对照组017±038060±05109±05614±051假手术组88±049±09±09±0
在5r/min条件下,compound#11干预组、VPA干预组、生理盐水对照组能够承受最长时间分别为(18.9±0.75)、(18.7±0.85)、(16.5±1.07)s,均显著低于假手术组[(60±0.00)s,P均<0.05];compound#11干预组、VPA干预组高于生理盐水对照组(P<0.05)。
虽然compound#11干预组、VPA干预组与生理盐水对照组BMS评分无明显差异,但在耐力实验中,Rotarod能检测到其差异性存在,见图1~2。由此可知,损伤后需采用不同的敏感检测方式全方面的评估功能恢复才能获得更为完善、可靠的实验数据。
2.2 组织学分析
损伤后28d,钳夹损伤区轴突脱髓鞘明显,神经元减少,角质细胞增生发生改变,受损部位的下行神经元凋亡,胶质瘢痕形成;生理盐水组与compound#11干预组、VPA干预组相比,呈现出更加活跃的胶质细胞增生以及更大的空洞面积,神经元凋亡程度也稍重于其他给药两组,但是给药组与对照组相比,差异无统计学意义(P>0.05),见图3~4。

图1 BMS评分
Fig.1 BMS behavioral score
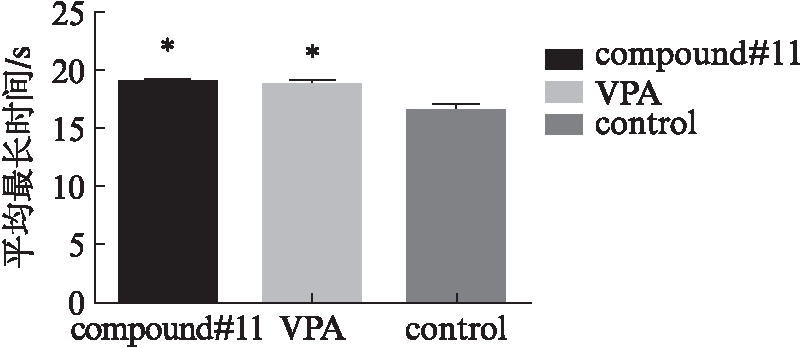
图2 Rotarod检测结果
Fig.2 Results of Rotarod behavioral
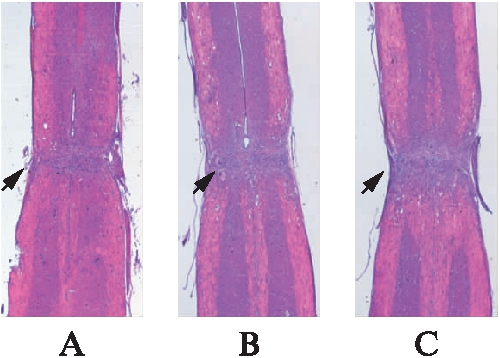
图3 术后28 d各组H-E染色结果
Fig.3 H-E staining results of compound #11 group, VPA group, saline control group
A: compound#11干预组;B: VPA干预组;C: 生理盐水组
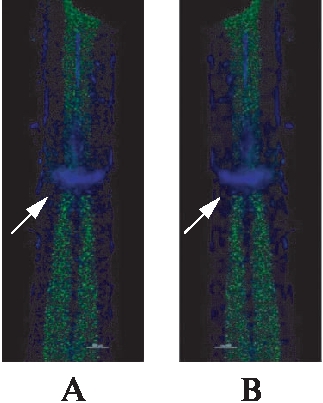
图4 术后28d两组NeuN(b)染色结果
Fig.4 NeuN staining results of compound #11 group, saline control group
A: compound#11干预组;B: 生理盐水组
2.3 电生理检测结果
MEP潜伏期的长短主要由脊髓的破坏程度来决定,从而反映神经传导速度。MEP波幅则一般反映刺激后,引起同步放电神经元数量的多少。采用MEP来检测损伤脊髓运动传导功能,不同时间点各组小鼠神经电生理检查延长期结果见表2、潜伏期结果见表3。随着手术后时间的延长,compound#11干预组、VPA干预组、生理盐水组3组延长期波幅逐渐增加;compound#11干预组、VPA干预组、生理盐水组3组潜伏期开始缩短。compound#11干预组、VPA干预组无论是延长期波幅还是延长期时间都比对照组的变化趋势更好一些,但是3组间差异无统计学意义(P>0.05)。
表2 不同时间点各组神经电生理检查延长期
Tab.2 The amplitude of electrophysiologic examination at different time points (μv)
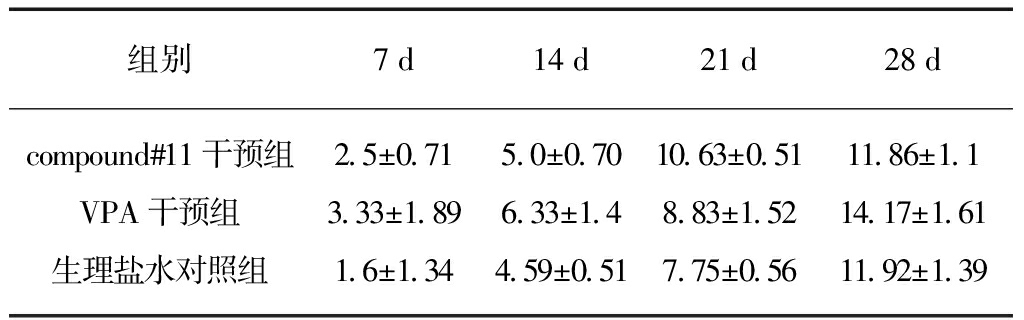
组别7d14d21d28dcompound#11干预组25±07150±0701063±0511186±11VPA干预组333±189633±14883±1521417±161生理盐水对照组16±134459±051775±0561192±139
表3 不同时间点各组神经电生理检查潜伏期
Tab.3 The latency of electrophysiologic examination at different time points (ms)
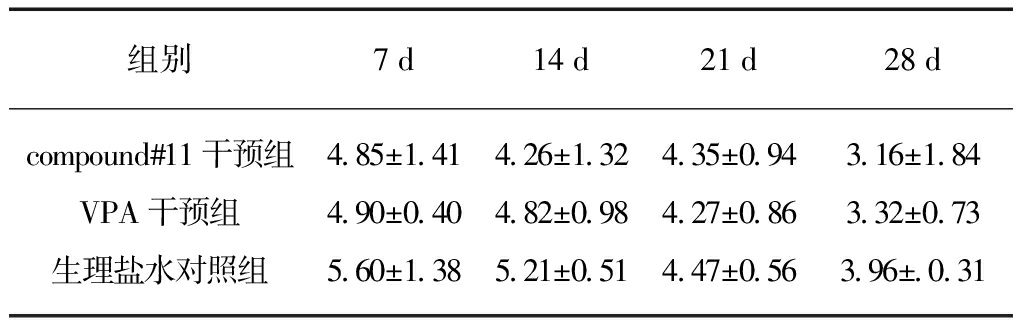
组别7d14d21d28dcompound#11干预组485±141426±132435±094316±184VPA干预组490±040482±098427±086332±073生理盐水对照组560±138521±051447±056396±031
3 讨 论
脊髓是中枢神经系统中重要组成部分,脊髓损伤容易造成肢体瘫痪,如何提高神经再生能力、促进神经环路重建是脊髓损伤治疗所面临的重要科学问题。小分子药物(small molecule drugs)是指一类可以影响信号转导过程的小分子物质,它们通过作用细胞中某些关键的信号通路,使其调控的下游信号通路得以抑制或激活[5],具有神经再生、保护作用和免疫调节作用,在维护内源性神经干细胞微环境方面具有广阔的应用前景[6-9]。比如雷帕霉素是治疗脊髓损伤是比较常用的一种小分子免疫抑制剂,减缓炎症反应,提高神经元的存活率[10]。本研究选择VPA作为阳性对照组。VPA具有促进移植神经干细胞修复脊髓损伤功能的作用,可以提高脊髓损伤后运动功能。但是单独使用VPA给药处理的小鼠与未处理的小鼠相比,并没有显著性改善,猜测VPA很可能是影响了移植细胞的功能[11]。
AEP是溶酶体产生的一种半胱氨酸蛋白酶,它可以在天冬氨酸残基之后剪切蛋白质。AEP在衰老大脑中表达上调并被活化,并能同时剪切APP和Tau蛋白[2],从而影响认知功能,并发现敲除AEP基因的老年小鼠不能再剪切APP。最近,Zhang等[2](Keqiang Ye团队)通过小分子药物的高通量筛选,找到了AEP特异性小分子抑制剂compound#11,它能够与AEP结合,在初级神经元中阻断对APP和Tau蛋白的剪切。通过对AD模型鼠给予compound#11,发现它具有明显的认知及运动功能修复[12]。在脊髓损伤部位的炎性微环境中,由于K+大量外流[3]导致损伤部位细胞的胞内基质的pH值比正常组织略低,而且会大量表达某些种类的蛋白酶[4]。其中,损伤部位的AEP表达量上调。因此,推测其活性也会升高。并且,Zhang等[2](Keqiang Ye团队)现已经在周围神经损伤疾病模型上证实,compound#11也具有一定的神经保护作用。但是compound#11在脊髓损伤部位是否会抑制AEP,阻断其对APP和Tau蛋白的剪切,从而有助于SCI小鼠脊髓组织结构及功能的恢复尚未有相关研究和文献报道。本研究通过对脊髓损伤小鼠腹腔注射compound#11,观察其对SCI小鼠脊髓组织结构及运动功能的影响。
对于诸多行为学评价方法,哪种更加客观,能够反应真实情况目前并无一致结论。本实验采用BMS评及Rotarod综合评价,和单独使用BMS评分法相比,更进一步细致、全面的评估小鼠后肢恢复过程中的行为学变化,并且与损伤程度有较高的契合度,结合评价可以判断细小动作恢复情况。本研究结果提示,两组给药组与生理盐水对照BMS评分无统计学差异,但是Rotarod测试证实小鼠行为学之间有明显统计学差异。这些行为学评价方法虽便于推广,但标准复杂,观察人员须要有一定经验,并且至少两名观察者分别计分,以减少主观因素影响。
随着医学电生理学的快速发展,人们逐渐认识到了诱发电位在疗效评估和功能评定方面的重要性。其良好的客观性与敏感性,已经越来越多的运用于临床SCI评价。MEP是继SEP后检测运动神经系统设计的另一种神经电生理检查方法,提供了更加客观、定量的依据。MEP潜伏期的长短主要由脊髓的破坏程度来决定,从而反映神经传导速度[13]。MEP波幅则一般反映刺激后,引起同步放电神经元数量的多少。本研究采用MEP来检测损伤脊髓运动传导功能,发现随着手术后时间的延长,compound#11干预组、VPA干预组、生理盐水组3组延长期波幅逐渐增加,潜伏期开始缩短。但组间并无显著性差异。
结合行为学,组织学以及电生理结果来看,compound#11干预SCI小鼠后与生理盐水对照组相比,修复作用并没有明显统计学差异的原因可能是compound#11类似VPA,具有促进移植神经干细胞修复脊髓损伤功能的作用,需要与移植干细胞或者其他治疗方法协同治疗脊髓损伤。
综上所述,在脊髓损伤小鼠模型中,单独使用compound#11修复脊髓损伤,具有一定改善作用,但其临床药用价值有待进一步探索。基于本文数据我们推测,联合使用compound#11与干细胞移植或者其他治疗方法协同治疗,进而共同促进脊髓损伤的修复方式可能更为可行。
【参考文献】
[1] ZHANG Z, SONG M, LIU X, et al. Cleavage of tau by asparagine endopeptidase mediates the neurofibrillary pathology in Alzheimer’s disease[J]. Nat Med, 2014,20(11): 1254-1262.
[2] ZHANG Z, SONG M, LIU X, et al. Delta-secretase cleaves amyloid precursor protein and regulates the pathogenesis in Alzheimer’s disease[J]. Nat Commun, 2015,6: 8762.
[3] TATOR C H, FEHLINGS M G. Review of the secondary injury theory of acute spinal cord trauma with emphasis on vascular mechanisms[J]. J Neurosurg, 1991,75(1): 15-26.
[4] BAREYRE F M, SCHWAB M E. Inflammation, degeneration and regeneration in the injured spinal cord: insights from DNA microarrays[J]. Trends Neurosci, 2003,26(10): 555-563.
[5] LU B, ATALA A. Small molecules and small molecule drugs in regenerative medicine[J]. Drug Discov Today, 2014,19(6): 801-808.
[6] HUBBARD S R. Protein tyrosine kinases: autoregulation and small-molecule inhibition[J]. Curr Opin Struct Biol, 2002,12(6): 735-741.
[7] KHALILI J S, YU X, WANG J, et al. Combination small molecule MEK and PI3K inhibition enhances uveal melanoma cell death in a mutant GNAQ and GNA11 dependent manner[J]. Clin Cancer Res, 18(16): 4345-4355.
[8] SPIEGEL J, CROMM P M, ZIMMERMANN G, et al. Small-molecule modulation of Ras signaling[J]. Nat Chem Biol, 2014,10(8): 613-622
[9] MANANDHAR S P, HILDEBRANDT E R, SCHMIDT W K. Small-Molecule Inhibitors of the Rce1p CaaX Protease[J]. J Biomol Screen, 2007,12(7): 983-993.
[10] LIU D, MCILVAIN H B, FENNELL M, et al. Screening of immunophilin ligands by quantitative analysis of neurofilament expression and neurite outgrowth in cultured neurons and cells[J]. J Neurosci Methods, 2007,163(2): 310-320.
[11] LV L, HAN X, SUN Y, et al. Valproic acid improves locomotion in vivo after SCI and axonal growth of neurons in vitro[J]. Exp Neurol, 2012,233(2): 783-790.
[12] ZHANG Z, SONG M, LIU X, et al. Delta-secretase cleaves amyloid precursor protein and regulates the pathogenesis in Alzheimer’s disease[J]. Nat Commun, 2015,6(59): 8762.
[13] GUHA A, TATOR C H, ROCHON J. Spinal cord blood flow and systemic blood pressure after experimental spinal cord injury in rats[J]. Stroke, 1989,20(3): 372-377.