盆腔内囊性为主占位病变(main cystic occupying lesions, MCOLs)是最常见的成年女性盆腔内占位病变,其大多来源于卵巢及附件结构,少部分来自输卵管以及邻近其它组织器官结构。病变被发现时往往体积偏大,影像学定位及定性诊断方面常有一定偏差。磁共振成像及动脉增强扫描(DCE-MRI)对女性盆腔内占位病变的组成构成分辨率高,强化特征显示敏感等均有利于卵巢附件区MCOLs的诊断和鉴别诊断,且能避免放射性损伤,是目前女性盆腔占位病变腹腔镜术前定位及定性诊断较为倚重的影像检查技术之一[1-3]。但DCE-MRI对女性盆腔占位性病变,尤其是MCOLs的定位及定性诊断误诊时有发生,大多受对MRI影像特征认识不足及技术检查不到位的影响。正确认识女性盆腔内囊性为主占位病变的MRI影像特征及应用磁共振新技术,有利于提高MCOLs的诊断准确度,对指导腹腔镜手术具有重要意义。
本研究收集同济大学附属第十人民医院45例DCE-MRI误诊的成年女性盆腔附件区MCOLs的临床资料及影像资料,对比手术及病理,探讨MRI误诊的原因及可能的MRI鉴别征象,以提高DCE-MRI对盆腔内MCOLs的影像诊断水平。
1 资料与方法
1.1 临床资料
搜集2013年1月至2016年5月间经手术病理证实的成年女性盆腔内MCOLs病例共256例,其中MRI诊断与病理诊断不一致的共45例(17.6%),年龄21~79岁,平均年龄(51.1±13.1)岁。部分患者(42.2%,19/45)为超声体检发现,部分表现为腹部包块或下腹部坠痛就诊,部分伴有月经量过多、不规则月经或痛经。
1.2 检查仪器与成像方法
所有患者均行3.0T MRI平扫及DCE检查。MRI检查采用德国西门子公司产Magnetom Verio 3.0T磁共振,腹部相控阵表面线圈。检查者采用仰卧位,检查前给予患者呼吸与屏气训练,以减少呼吸运动伪影。MRI平扫包括TSE T1WI、T2WI 、DWI横断位或矢状位、T2WI冠状位,T2WI抑脂(T2WI/FS)矢状位。动态MRI增强检查(DCE-MRI)采用快速梯度同波(TFE)T1WI抑脂增强扫描: 行增强前TFE T1WI/FS,增强后多期横断位、延迟增强扫描采用冠状位及矢状位扫描VIBE T1WI/FS。Gd-DTPA对比剂经肘静脉注射,注射速度2.5ml/s。DCE-MRI扫描序列及参数见表1。
表1 女性盆腔肿块MRI扫描检查序列及参数
Tab.1 MRI scan sequence and parameters of female pelvic mass
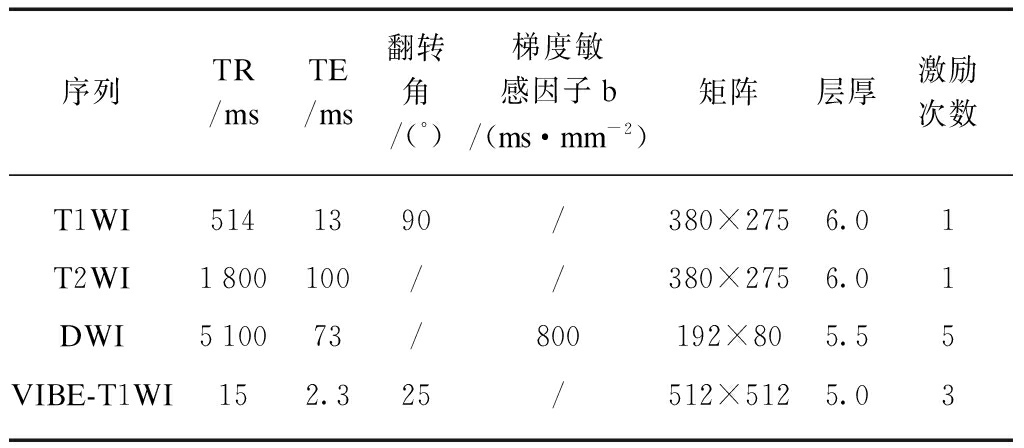
序列TR/msTE/ms翻转角/(°)梯度敏感因子b/(ms·mm-2)矩阵层厚激励次数T1WI5141390/380×2756.01T2WI1800100//380×2756.01DWI510073/800192×805.55VIBE-T1WI152.325/512×5125.03
2 结 果
2.1 MRI误诊病例与病理对照
MRI诊断与病理诊断不一致的成年女性盆腔内MCOLs共45例。其中定位错误引起的错误诊断7例(15.6%,7/45);定位准确,但对病变磁共振征象认识不足引起的错误诊断38例(84.4%,38/45)。肿瘤性与非肿瘤性MCOLs错误诊断28例(62.2%),包括肿瘤性MCOLs诊断为非肿瘤MCOLs 11例(39.3%),而非肿瘤MCOLs诊断为肿瘤性MCOLs 17例(60.7%)。肿瘤定性方面MRI良恶性诊断与病理不完全一致的8例(17.8%),包括4例良性肿瘤MRI诊断为恶性肿瘤3例,交界性肿瘤1例;而2例恶性肿瘤MRI诊断为良性肿瘤1例,交界性肿瘤1例;2例交界性肿瘤MRI诊断为良性肿瘤,见表2。本组45例误诊病例病变体积多较大,最大径3.1~23.0cm,平均(8.3±3.3)cm,与卵巢及附件区关系密切。病变内囊性液体信号复杂,分隔厚薄及强化特点各异。
2.2 DCE-MRI误诊病例不同病变特点及MRI影像学特征
MRI误诊病例附件区占位病变体积多较大,平均8.5cm,见表3。
表2 45例成年女性盆腔内囊性及囊性成份为主占位性病变MRI误诊病例及病理对照
Tab.2 Comparison of MRI misdiagnosis and pathological diagnosis
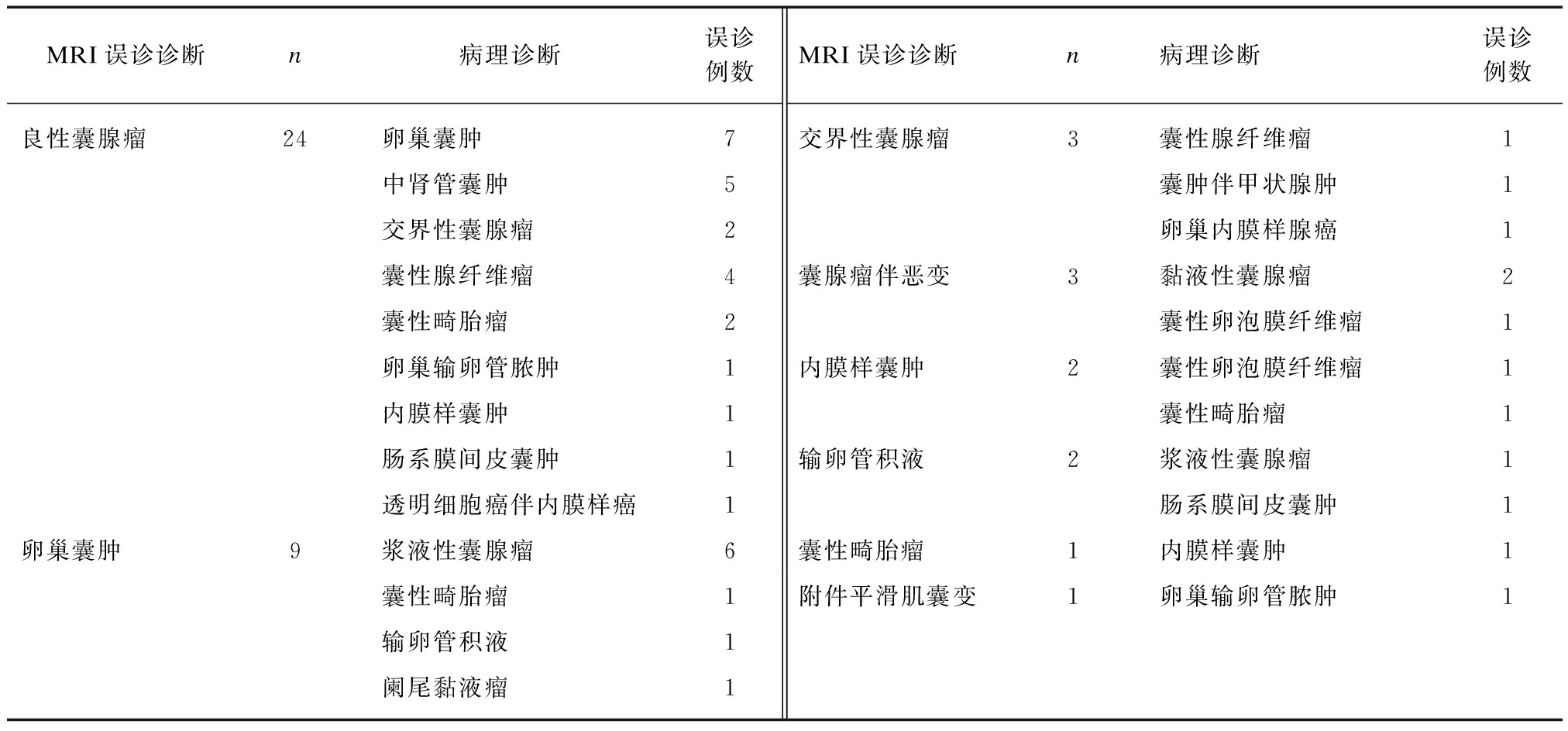
MRI误诊诊断n病理诊断误诊例数MRI误诊诊断n病理诊断误诊例数良性囊腺瘤24卵巢囊肿7中肾管囊肿5交界性囊腺瘤2囊性腺纤维瘤4囊性畸胎瘤2卵巢输卵管脓肿1内膜样囊肿1肠系膜间皮囊肿1透明细胞癌伴内膜样癌1卵巢囊肿9浆液性囊腺瘤6囊性畸胎瘤1输卵管积液1阑尾黏液瘤1交界性囊腺瘤3囊性腺纤维瘤1囊肿伴甲状腺肿1卵巢内膜样腺癌1囊腺瘤伴恶变3黏液性囊腺瘤2囊性卵泡膜纤维瘤1内膜样囊肿2囊性卵泡膜纤维瘤1囊性畸胎瘤1输卵管积液2浆液性囊腺瘤1肠系膜间皮囊肿1囊性畸胎瘤1内膜样囊肿1附件平滑肌囊变1卵巢输卵管脓肿1
表3 45例MRI误诊病例不同病变特点及影像学特征
Tab.3 The imaging characteristics of 45 MRI misdiagnosed cases
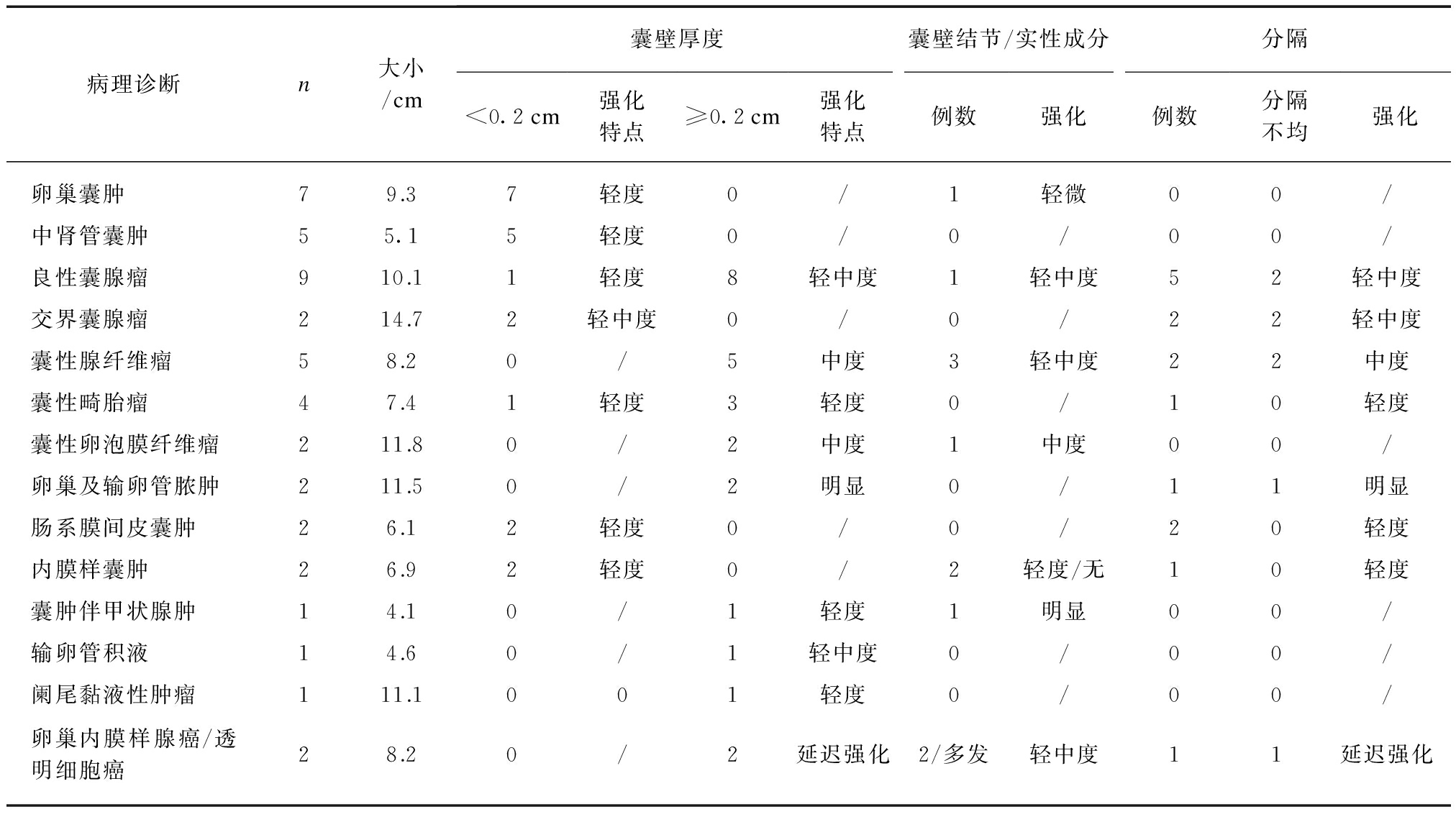
病理诊断n大小/cm囊壁厚度囊壁结节/实性成分分隔<0.2cm强化特点≥0.2cm强化特点例数强化例数分隔不均强化卵巢囊肿79.37轻度0/1轻微00/中肾管囊肿55.15轻度0/0/00/良性囊腺瘤910.11轻度8轻中度1轻中度52轻中度交界囊腺瘤214.72轻中度0/0/22轻中度囊性腺纤维瘤58.20/5中度3轻中度22中度囊性畸胎瘤47.41轻度3轻度0/10轻度囊性卵泡膜纤维瘤211.80/2中度1中度00/卵巢及输卵管脓肿211.50/2明显0/11明显肠系膜间皮囊肿26.12轻度0/0/20轻度内膜样囊肿26.92轻度0/2轻度/无10轻度囊肿伴甲状腺肿14.10/1轻度1明显00/输卵管积液14.60/1轻中度0/00/阑尾黏液性肿瘤111.1001轻度0/00/卵巢内膜样腺癌/透明细胞癌28.20/2延迟强化2/多发轻中度11延迟强化
肿瘤性MCOLs与囊肿性MCOLs的壁的厚度不同,肿瘤性病变囊壁多超过0.2cm(占84.0%),而良性囊肿性病变囊壁菲薄,多数<0.2cm。恶性囊性病变与炎性病变壁厚且伴有较明显强化,壁厚薄不一见于恶性肿瘤、囊性腺纤维瘤和囊性纤维瘤,见图1。
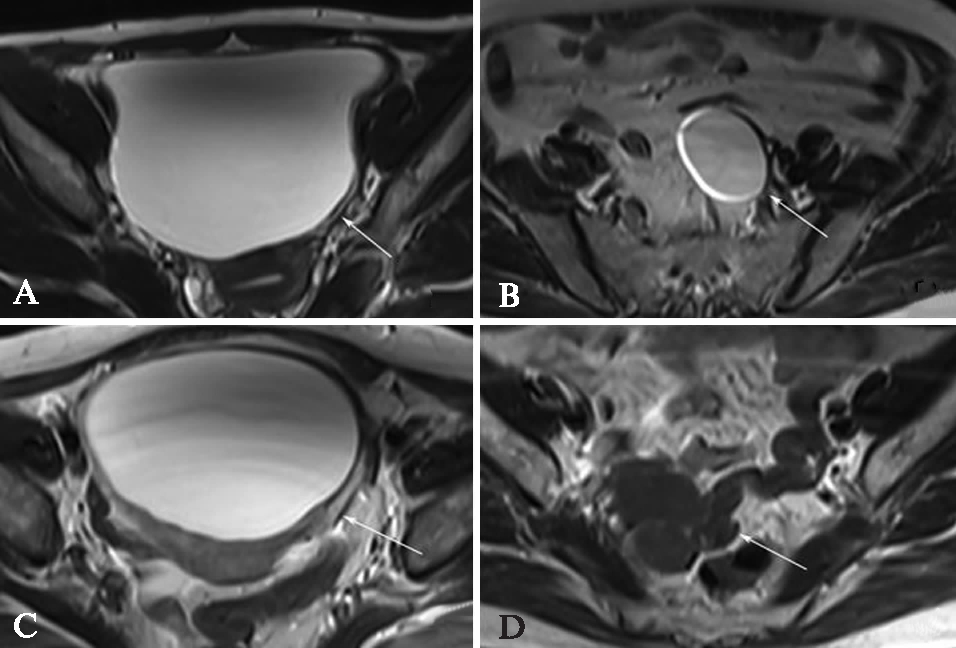
图1 四种不同病变的囊壁厚度比较
Fig.1 Comparison of the wall thickness in four different lesions
A: 卵巢囊肿,囊壁菲薄、均一(<0.2cm),张力较低;B: 浆液性囊腺瘤,囊壁张力较高,较厚(≥0.2cm),但厚度均匀;C: 卵泡膜纤维瘤,显示下方囊壁粗厚,且不规则,结合T1WI考虑纤维成份,术后病理显示为卵泡膜纤维瘤的纤维成份;D: 内膜样癌,囊壁厚薄不一且有分隔,局部可见壁结节
囊性腺纤维瘤、囊性为主卵泡膜纤维瘤、透明细胞或内膜样样癌等肿瘤性病变瘤壁更厚且厚薄不均,且其强化程度高于囊腺瘤和囊肿性病变。卵巢脓肿性病变的壁也显示较厚,但延迟强化更明显,高于肿瘤性病变的瘤壁强化,见图2。
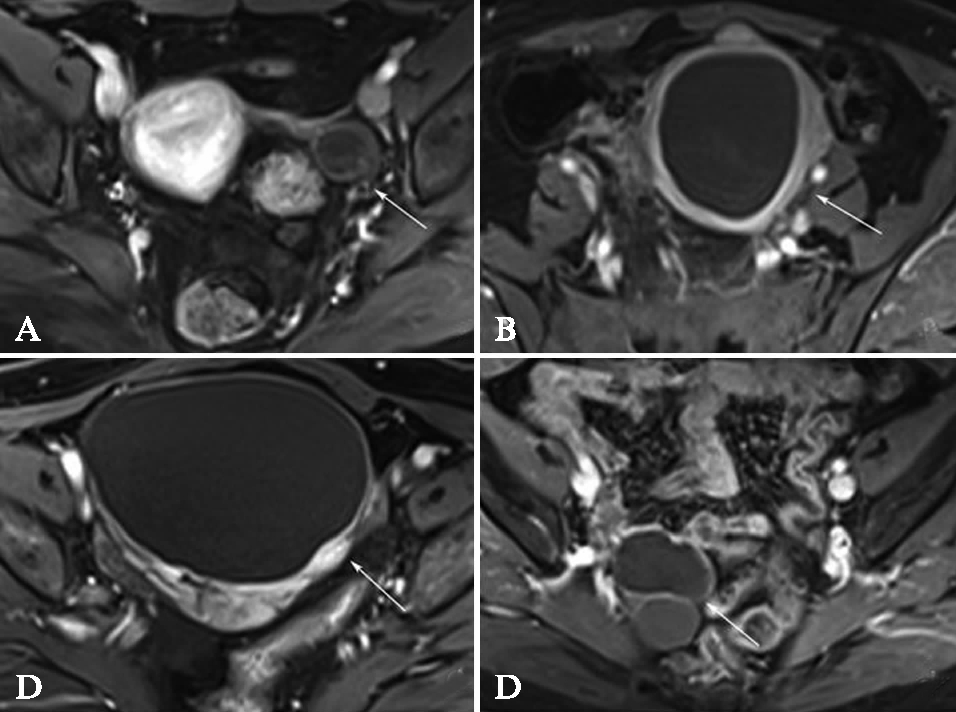
图2 四种不同病变的强化特征(均为延迟期)比较
Fig.2 Comparison of four different lesions’s enhancement characteristics
A: 囊性畸胎瘤,可见囊壁轻度强化,内见少许斑片状轻度强化;B: 附件区脓肿,囊壁较厚,延迟强化更明显,高于肿瘤性病变的瘤壁强化;C: 卵泡膜纤维瘤,可见局部纤维成份强化;D: 内膜样癌,可见不均匀厚薄的囊壁及壁结节在延迟期明显强化。
部分内膜样囊肿可见囊性成份呈T1WI等低或稍高信号,T2WI高信号改变,与典型的内膜样囊肿T1WI高信号、T2WI等低信号不同,见图3,此信号改变亦见于卵巢附件区畸胎瘤和脓肿性病变。
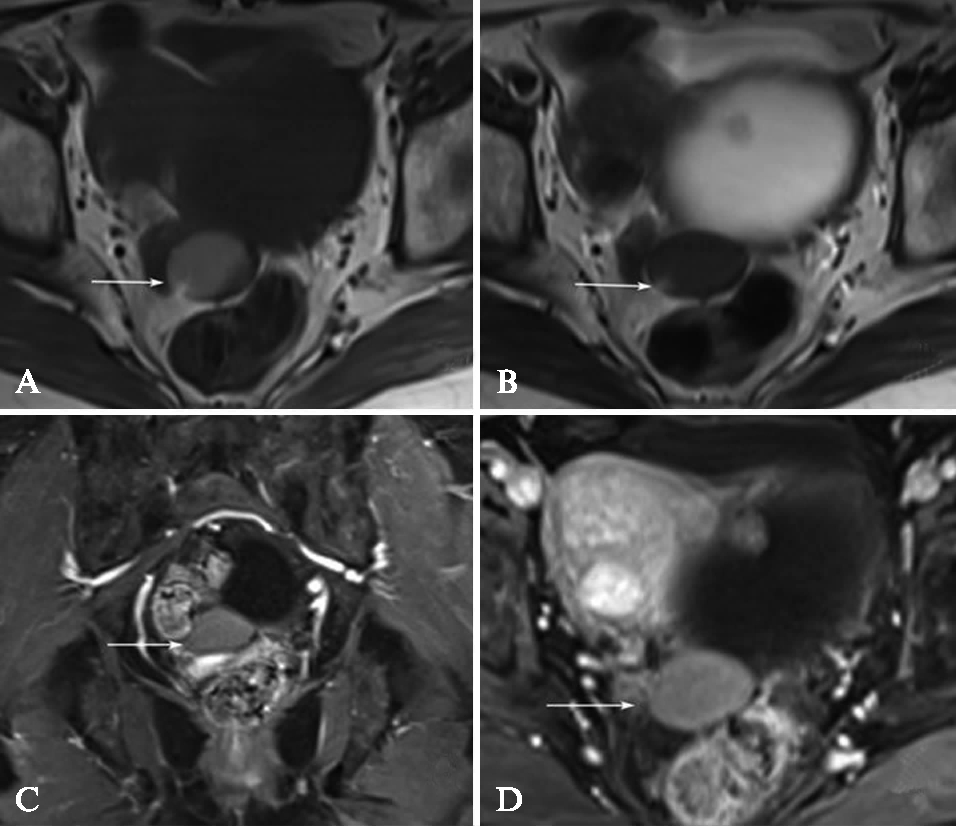
图3 内膜样囊肿
Fig.3 Endometrial cysts
A: T1WI上表现为稍高信号;B: T2WI信号较低,且靠近囊壁外下方可见在T1WI及T2WI均表现为高信号的出血成份,提示囊内成份不一;C: T1压脂像;D:增强显示病变未见明显强化
磁共振显示,囊性畸胎瘤T1WI信号稍高于纯液性信号,T2WI液性信号内见淡片状T2WI略低信号,类似漂浮物样改变,或T1WI压脂像较T1WI略低等改变,见图4。
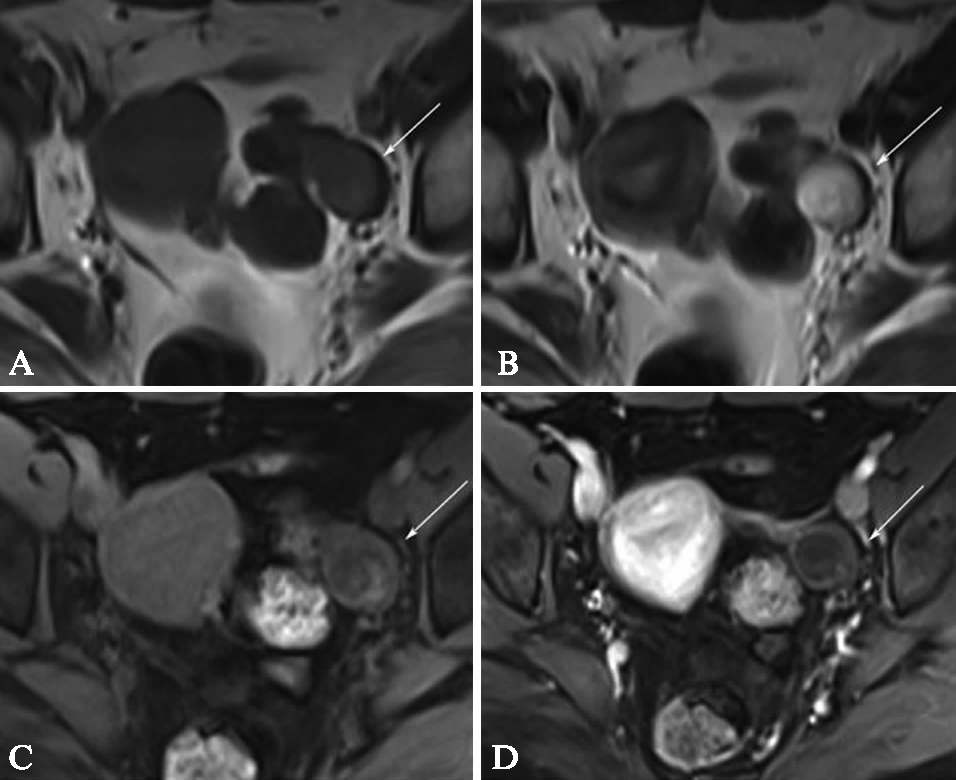
图4 囊性畸胎瘤
Fig.4 Cystic teratoma
A: T1WI见囊内少量稍高于纯液性信号的成份;B: T2WI液性信号内见淡片状T2WI略低信号,类似漂浮物样改变; C: T1WI压脂像较T1WI未见信号减低表现;D: DCE-MRI扫描囊内未显示任何异常强化,类似囊性征象,这种不典型表现容易降低肿瘤的定性诊断
3 讨 论
成年女性盆腔内MCOLs病变体积较大时,MRI对卵巢结构的识别困难,又容易影响病变的定位诊断,MRI需要依靠病变的影像特点及病变周围的解剖关系来推断占位病变的来源。本组MRI误诊病例分析显示盆腔附件区占位病变体积多较大,部分引起定于困难,因定位错误引起的错误诊断占15.6%(7/45)。正确认识病变的形态、分布和特征性变化有助于附件来源囊性为主病变与非附件来源病变的鉴别。如肠系膜间皮囊肿病变,MRI显示除囊壁菲薄外(<0.2cm),其形态呈匍匐状,张力较低,内见较多或密集纤细分隔,增强扫描见分隔强化轻微,边界不清晰,与邻近肠系膜分界不清,为病变特征性征象,与卵巢囊腺瘤及输卵管积液张力较高、分隔或壁较厚(1~3mm)不同。而阑尾黏液性肿瘤或黏液性囊肿的病理基础是黏液积聚导致的阑尾腔扩张,典型形态表现为长管状或葫芦状,病灶形态上呈长管状,上下走行为主,其囊壁较厚2~3mm,外缘光整,与输卵管积液的边缘及走行方向均有不同[4-5]。而输卵管积液扩张较为复杂,呈囊性信号改变外,形态呈葫芦状或长管状典型改变易于与卵巢囊肿或囊腺瘤鉴别,输卵管积液除独特的形态改变外,常伴有输卵管周围的慢性炎症改变,亦是鉴别的主要征象之一[6-7]。3.0T DCE-MRI多序列、多方位成像优势能很好显示病灶的形态特点,有助于提高磁共振定位诊断准确率[8]。
在卵巢附件囊肿性病变诊断方面,其一,无分隔囊肿大小能明显影响卵巢及附件区囊肿与良性囊腺瘤的鉴别诊断。本组有12例卵巢囊肿DCE-MRI误诊为良性囊腺瘤病变,其中6例显示未见明显分隔,但囊肿较大,均>5cm,平均9.2cm;有6例良性囊腺瘤DCE-MRI误诊为卵巢囊肿,有2例囊腺瘤内无明显分隔且壁较菲薄(<0.2cm),最大径均超过4cm,显示少数良性囊腺瘤与卵巢囊肿形态学上有重叠,DCE-MRI不容易仅依靠病变大小及囊壁厚薄完全区分。其二,良性囊肿病变常与囊肿旁的内膜样囊肿混合存在,或囊肿旁伴有生理性或黄体囊肿时,DCE-MRI显示多囊性或分隔样征象,或囊肿壁旁结节样改变等假象,易将较大囊肿(≥5cm)误诊为囊腺瘤病变。卵巢囊肿与邻近正常组织分界不清或局部炎性病变存在等亦能影响MRI诊断诊断的准确性。其三,囊壁的特征对DCE-MRI区分良性囊肿与肿瘤性MCOLs有重要价值。如(图3)所示,良性囊肿均见囊壁菲薄,均小于0.2cm,而肿瘤性MCOLs囊壁多超过0.2cm(84.0%)。有文献亦认为囊壁0.3cm以上时不考虑囊肿性诊断[9]。本组研究亦显示,囊性腺纤维瘤、囊性为主卵泡膜纤维瘤、透明细胞或内膜样样癌等肿瘤性MCOLs病变虽然囊性成分较多,但瘤壁常较厚,常在3mm或以上,较良性囊腺瘤囊壁厚度大且不均一,分隔常较厚且欠均匀,与良性囊腺瘤不同。
除MCOLs的形态学变化可以引起不同的误诊外,不典型的MRI信号变化和强化特点也能引起不同的误诊。部分内膜样囊肿、囊性畸胎瘤甚至脓肿性病变、囊性变阔韧带肌瘤等均可显示类似的T1WI/T2WI信号变化,以T1WI、T2WI等序列为基础分析MRI征象,推断MCOLs的组织构成时会引起一定的误诊分析。
部分内膜样囊肿可显示囊壁下异常强化的蜕膜组织,亦容易误诊为囊腺瘤病变甚至交界性囊性病变。有文献认为病变内T2WI点状较低信号灶(点状黑影)多见于慢性出血时含铁血黄素沉积,对内膜样囊肿的诊断有重要价值,但T2WI点状较低信号灶亦见于其他卵巢附件区出血性病变(如出血性囊肿、肿瘤性出血后等),并不是内膜样囊肿的特征性MRI征象[10-11]。少数内膜样囊肿MRI显示病变呈多囊样或分隔改变,且囊性成份信号不一致,其与少分隔黏液性囊腺瘤或囊性畸胎瘤不容易区分,本组研究显示,除分析MRI信号不同变化外,DCE-MRI囊壁菲薄且分隔强化均一对内膜样囊肿与囊腺瘤的鉴别价值较大。由于DCE-MRI扫描囊内未显示任何异常强化,常误以为病变T2WI序列内淡薄低信号与T2WI效应有关,导致误诊。少部分囊性畸胎瘤VIBE/T1WI压脂序列囊性病变信号没有明显减低,磁共振不显示脂肪组织的存在,DCE-MRI呈囊性征象且囊壁较薄,常引起错误的诊断[12]。
本组显示分隔稀少的囊腺瘤容易与囊肿性病变混淆,而分隔不均匀的囊腺瘤容易与交界性囊腺瘤或囊腺癌混淆。除了良性囊肿性病变与肿瘤性MCOLs囊壁的差异外,囊壁的均匀与否、分隔、结节及数量、强化程度等均有助于肿瘤性MCOLs的鉴别。其中内膜囊肿内沉积血块、内膜异位结节及卵巢白体等结构的存在易导致误诊为肿瘤性病变[13]。囊性腺纤维瘤T2WI信号见囊壁或实性成分纤维结构信号,而卵泡膜纤维瘤显示T2WI纤维信号与独特的云雾状卵泡膜成分共存亦具有特征性,其结节常较大[14-15],囊性腺纤维瘤和囊性卵泡膜纤维瘤的误诊大多是对其独特的磁共振征象认识不足所致,其T1WI/T2WI信号的变化及DCE强化特征有助于诊断。而透明细胞癌或内膜样癌囊性成分为主,DCE-MRI扫描见结节多发,强化明显,沿囊壁内分布[16-17],本组病例MRI征象与文献报道一致;不同于囊腺癌或囊腺瘤恶变显示的厚薄不均分隔、不规则结节及囊壁外浸润性侵蚀改变。而单房囊性、明显强化的壁结节,壁结节旁局限性细微的囊壁不规则或囊壁超过3mm等征象,要考虑内膜样癌的可能性存在[18]。本组研究显示,在所有强化结节中,恶性肿瘤结节多而且强化程度高于良性病变结节,而卵巢甲状腺肿结节强化程度最高,类似甲状腺组织或血管样早期强化。卵巢甲状腺肿结节周围可以合并有囊性成份,类似囊腺癌或内膜样癌征象,但结节的多期强化特点与恶性肿瘤结节的中度程度强化不同,有重要的影像诊断价值[19]。亦有文献报道磁共振弥散成像(DWI)有助于内膜样囊肿和内膜样癌的鉴别诊断[20]。
总之,DCE-MRI诊断成年女性盆腔附件区MCOLs,误诊的原因复杂,其中病变的大小、T1WI/T2WI信号变化、囊壁及实性结构的形态及强化特点等均能影响病变的定位、肿瘤性与非肿瘤性以及良恶性的鉴别等。且卵巢附件区部分囊性病变成份复杂,又可以合并有不同的原发病变(如畸胎瘤合并囊腺瘤,囊腺瘤合并内膜样小囊肿等),病变周围组织如卵巢组织、生理性囊肿、子宫内膜异位及卵巢输卵管周围的慢性炎症等均能引起DCE-MRI对MCOLs的错误判断。而提高对病变形态、MRI不同信号变化和强化特征的正确认识,能明显提高诊断准确率,减少误诊,有利于腹腔镜手术的合理应用与手术的顺利完成。
【参考文献】
[1] TAMAI K, KOYAMA T, SAGA T, et al. MR features of physiologic and benign conditions of the ovary[J]. Eur Radiol, 2006,16(12): 2700-2711.
[2] BEKIESI SKA-FIGATOWSKA M, JURKIEWICZ E, IWANOWSKA B, et al. Magnetic resonance imaging as a diagnostic tool for ovarian masses in girls and young women[J]. Med Sci Monit, 2007,13(Suppl 1): 116-120.
SKA-FIGATOWSKA M, JURKIEWICZ E, IWANOWSKA B, et al. Magnetic resonance imaging as a diagnostic tool for ovarian masses in girls and young women[J]. Med Sci Monit, 2007,13(Suppl 1): 116-120.
[3] FOTI PV, ATTIN G, SPADOLA S, et al. MR imaging of ovarian masses: classification and differential diagnosis[J]. Insights Imaging, 2016,7(1): 21-41.
G, SPADOLA S, et al. MR imaging of ovarian masses: classification and differential diagnosis[J]. Insights Imaging, 2016,7(1): 21-41.
[4] PERSAUD T, SWAN N, TORREGGIANI W C. Giant mucinous cystadenoma of the appendix[J]. Radiographics, 2007,27(2): 553-557.
[5] OKUDA I, MATSUDA M, NOGUCHI H. Massive mucinous cystadenoma of the appendix with intussusception in an adult: usefulness of reconstructed computed tomography images[J]. Radiat Med, 2008,26(2): 88-91.
[6] 陈曌,郑晓林,郭友,等.盆腔良性多囊性病变的CT、MRI诊断[J]. 中国CT和MRI杂志,2014,12(4): 45- 47.
[7] 蔺鸿儒,李玉智,韩建秀,等.输卵管积液的MRI诊断[J].实用放射学杂志,2014,30(11): 1858-1860.
[8] THAWAIT S K, BATRA K, JOHNSON S I, et al. Magnetic resonance imaging evaluation of non ovarian adnexal lesions[J]. Clin Imaging, 2016,40(1): 33- 45.
[9] 张大千,强金伟,蔡宋琪,等.MRI鉴别卵巢冠囊肿与卵巢囊肿及囊腺瘤[J].实用放射学杂志,2015,31(2): 265-268.
[10] MORISAWA N, KIDO A, KATAOKA M, et al. Magnetic resonance imaging manifestations of decidualized endometriotic cysts: comparative study with ovarian cancers associated with endometriotic cysts[J]. J Comput Assist Tomogr, 2014,38(6): 879-884.
[11] CORWIN M T, GERSCOVICH E O, LAMBA R, et al. Differentiation of ovarian endometriomas from hemorrhagic cysts at MR imaging: utility of the T2 dark spot sign[J]. Radiology, 2014,271: 126-132.
[12] 蔡宋琪,强金伟,赵书会,等.卵巢畸胎瘤的不典型MRI表现[J].中国医学计算机成像杂志,2014,20(4): 348-352.
[13] 乔敏霞,时惠平,秦丹,等.卵巢囊腺瘤的MRI诊断及鉴别诊断[J].中国CT和MRI杂志,2014,12(4): 29-31.
[14] 石双任,陈宏伟,鲍健.卵巢囊性腺纤维瘤CT及MRI表现[J].放射学实践,2012,27(10): 1113-1116.
[15] JUNG D C, KIM S H, KIM S H. MR imaging findings of ovarian cystadenofibroma and cystadenocarcinofibroma: clues for the differential diagnosis[J]. Korean J Radiol, 2006,7(3): 199-204.
[16] SUZUKI A, SHIOZAWA T, MORI A, et al. Cystic clear cell tumor of borderline malignancy of the ovary lacking fibromatous components: Report of two cases and a possible new histological subtype[J]. Gynecol Oncol, 2006,101(3): 540-544.
[17] YAMAMOTO Y, WAKIKAWA A, UENO A, et al. Comparison of endometriotic cysts and ovarian cancer in association with endometriotic cysts[J]. Cancer Treat Res Commun, 2016, doi: 10.1016/ j.ctarc. 2017.11.002.
[18] KITAJIM K, KAJI Y, KUWATA Y, et al. Magnetic resonance imaging findings of endometrioid adenocarcinoma of the ovary[J]. Radiat Med, 2007,25(7): 346-354.
[19] 张田荪,沈比先,李元歌,等.卵巢甲状腺肿MR诊断与病理分析[J].医学影像学杂志,2011,21(11): 1711-1713.
[20] LEE N K, KIM S, KIM K H, et al. Diffusion-weighted magnetic resonance imaging in the differentiation of endometriomas from hemorrhagic cysts in the ovary[J]. Acta Radiol, 2016,57(8): 998-1005.