β-arrestins是在提纯肾上腺素受体激酶的过程中发现的一种重要的接头蛋白和信号转导调控蛋白,在人体许多组织中广泛表达,包括肺组织[1],并对绝大多数由G蛋白偶联受体(G protein-coupled receptors, GPCRs)介导的信号通路有负调控作用[2],还在GPCRs的脱敏、内化、复敏以及细胞增殖反应和基因转录中起重要作用[3- 4]。本研究通过利用慢病毒转染技术,将体外合成的靶向β-arrestin 2的短发夹RNA(short hairpin RNA, shRNA)导入人非小细胞肺癌细胞系A549中,筛选出沉默β-arrestin 2基因(基因名ARRB2)效果最好的一组,为进一步探讨肺癌中β-arrestin 2的调控机制打下基础。
1 材料与方法
1.1 材料
质粒pSicoR-GFP及辅助质粒VSVG、RSV-REV和RRE,293T和A549细胞由中国科学院生物物理研究所提供,胎牛血清,DMEM培养基,青霉素、链霉素双抗溶液,胰蛋白酶购自Gibco公司,Lipofectamine 2000购自Invitrogen公司,SuperReal PreMix Plus qPCR buffer、RNA提取试剂盒购自天根生化科技有限公司,2×Taq PCR StarMix with Loading Dye购自GenStar公司,PCR仪购自Bio-Rad公司,高速低温离心机购自Gene公司,倒置荧光显微镜购自Nikon公司。
1.2 方法
1.2.1 慢病毒载体的线性化 慢病毒载体采用pSicoR-GFP,使用限制性内切酶HpaⅠ和XhoⅠ进行酶切消化,过夜后进行琼脂糖凝胶电泳,找出最亮条带然后切下,使用天根公司的DNA回收试剂盒提取回收载体。
1.2.2 设计shRNA引物 根据β-arrestin 2的全基因序列查找文献并设计4个相应的靶序列,见表1。
根据设计好的siRNA及酶切位点设计shRNA合成引物,由上海生工生物技术有限公司合成。
上游引物: 5′-T siRNA-F TTCAAGAGA siRNA-R TTTTTTC-3′;
下游引物: 5′-TCGAGAAAAAA siRNA-F TCTC-TTGAA siRNA-R A-3′。
表1 设计靶向β-arrestin 2的siRNA序列
Tab.1 Design of siRNA sequence aiming at β-arrestin 2

序列标号引物序列(5'→3')siRNA-1 上游引物5'-CCAACCTCATTGAATTTGA-3' 下游引物5'-TCAAATTCAGAATGGTTGG-3'siRNA-2 上游引物5'-CTCGAACAAGATGACCAGG-3' 下游引物5'-CCTGGTCATCTTGTTCGAG-3'siRNA-3 上游引物5'-TCGAACAAGATGACCAGGT-3' 下游引物5'-ACCTGGTCATCTTGTTCGA-3'siRNA-4 上游引物5'-GGACCGCAAAGTGTTTGTG-3' 下游引物5'-CACAAACACTTTGCGGTCC-3'
1.2.3 连接 将合成引物稀释为10μmol/L,上下游引物各取4μl,1μl 10×T4 ligation buffer,1μl T4 PNK混合,放置于PCR仪上,设定37℃ 30min,75℃ 10min,然后取出使其自然冷却至室温,再加入1μl T4 ligase连接酶和1μl第一步已酶切好的载体,室温下放置30min。
1.2.4 转化 将冻存的TOP10感受态细胞从 -80℃ 冰箱中取出,放置于冰浴中直至融化,然后向上步的每个转化管中加入50μl感受态细胞,混匀,冰浴30min,42℃水浴中热击45s,迅速将管子重新冰浴2min。加入室温下的1ml不含氨苄青霉素的LB培养基,在37℃摇床上摇45min。离心半径8.5cm,室温6000r/min,离心3min,去上清,留约100μl重新吹打混匀,用玻璃棒涂抹于含氨苄青霉素的LB培养基上,标记,37℃细菌培养箱中过夜。
1.2.5 阳性克隆鉴定 取新管,每管加入400μl含氨苄青霉素的LB培养液,枪头挑菌后放入管中,标记,37℃摇床摇4~6h。观察菌液是否浑浊,若浑浊则可作为模板使用并鉴定。
向灭菌的0.5ml微量PCR管中加入下列试剂建立15μl反应体系: 10μmol/L上、下游引物各0.5μl,模板1μl,2×PCR Mix 7.5μl,无RNA酶水 5.5μl。PCR反应条件如下: 95℃预变性 10min,95℃变性15s,55℃退火20s,72℃延伸 30s,共进行35个循环,72℃延伸10min。
PCR产物以1%琼脂糖凝胶进行电泳,电压180V,15min。紫外灯下观察,凝胶图像分析系统扫描图像并进行分析结果,选出阳性结果。
1.2.6 质粒提取纯化与测序 观察菌液是否浑浊,若浑浊则使用TIANGEN质粒提取试剂盒[天根生化科技(北京)有限公司]提取质粒,送于北京擎科公司生物技术有限公司测序。
1.2.7 病毒包装盒转染 转染前24h取对数生长期的293T细胞,调整密度为6×105/ml,接种于 15cm 细胞培养皿,37℃、5% CO2培养箱内培养。24h后待细胞密度达70%~80%时开始转染。在灭菌离心管中制备DNA 与Lipofectamine2000转染复合物,转染后的293T细胞继续培养。48h后收集上清,用45μm滤器过滤,吸取2ml加入到目的细胞A549中。再加入0.6μl的1∶5000比例的polybrane于六孔板中,摇晃混匀。离心半径13.9cm,室温 2500r/min,离心90min,后放置于培养箱中,8h后换液。显微镜下观察细胞荧光亮度,待生长状态良好后用流式细胞仪进行GFP阳性筛选。
1.2.8 qRT-PCR检测转染效率 待细胞长至状态良好,收集各组重组慢病毒感染和对照未感染的A549,提取RNA,逆转录得到cDNA,采用嵌合荧光检测法,根据Real time PCR试剂盒(天根公司)与PCR仪(Bio-Rad)说明,配制荧光定量PCR反应体系,以β-arrestin 2全基因引物进行PCR扩增。GAPDH为内参。
2 结 果
2.1 阳性克隆提示慢病毒载体pSicoR-GFP成功线性化
挑取可见的菌落作为模板进行琼脂糖凝胶电泳,观察有无阳性克隆结果。发现4组中均有数目不等的明亮条带,即为阳性结果,见图1。说明目的基因已经插入到酶切载体中,仍需将阳性结果进行测序来验证。
2.2 DNAman比对测序结果与原始设计序列
将上述显示阳性的克隆结果送于擎科公司测序后,使用DNAman来与最初设计的原始序列比对,发现各组均一致,见图2。这表明β-arrestin 2的cDNA编码区成功插入了酶切后的pSicoR-GFP质粒。
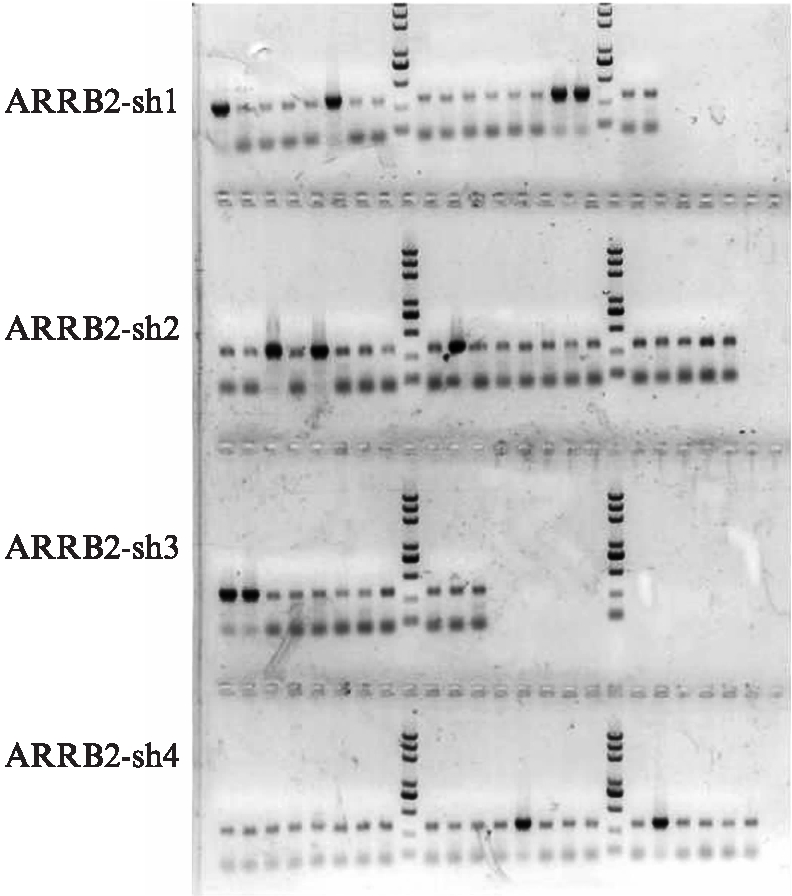
图1 PCR阳性克隆鉴定电泳图
Fig.1 Agarose gel electrophoresis analyses of PCR amplification for positive clones
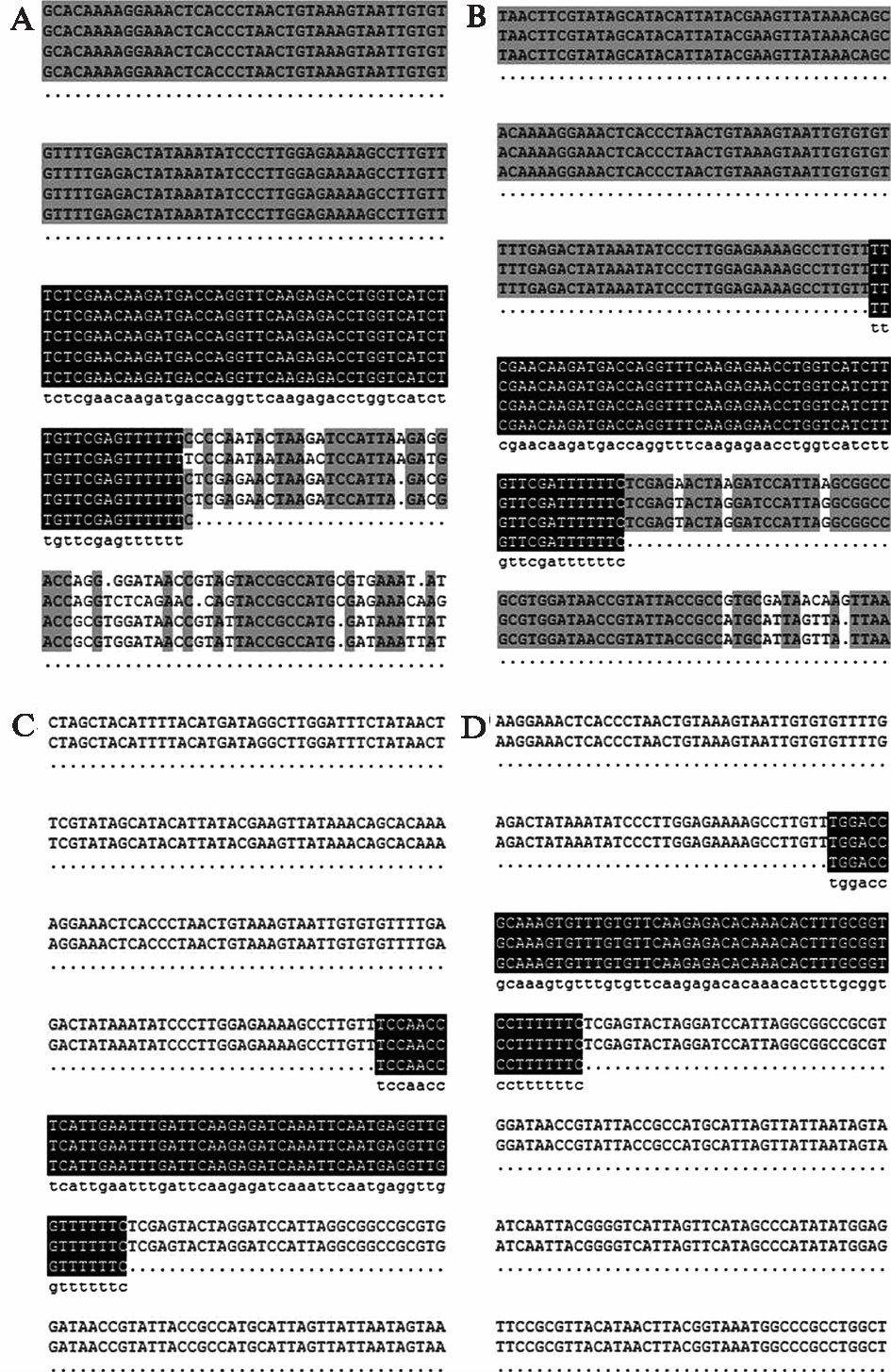
图2 DNAman比对阳性克隆测序结果
Fig.2 Comparison of sequencing analyses for positive clones by DNAman
A: ARRB2-sh1;B: ARRB2-sh2;C: ARRB2-sh3;D: ARRB2-sh4
2.3 qRT-PCR检测转染效率
通过实时荧光定量PCR检测β-arrestin 2 mRNA在4组实验组、阴性对照组、空白对照组细胞中的表达,每一个样本设置3个复孔,取其平均值为检测结果,以GAPDH作为内参。根据公式ΔCt=[ct(目的基因)]-[Ct(内参基因)]和ΔΔCt=[ΔCt(实验组)]-[ΔCt(对照组)],计算出2-ΔΔCt,以反映出目的基因在研究组中表达水平。4组中ARRB2-sh3的敲低效果最好,敲低后表达量降低最为明显(P<0.05),而阴性对照组和空白对照组的mRNA表达无明显差异(P>0.05),见表2。
表2 qRT-PCR检测转染后β-arrestin 2敲低效果
Tab.2 Screening of the most effective clone by quantitative real-time PCR

项目空白对照阴性对照ARRB2-Sh1ARRB2-Sh2ARRB2-Sh3ARRB2-Sh4GAPDH12.27±0.1310.59±0.5111.06±0.4512.41±0.1812.46±0.1312.77±0.37β-arrestin221.91±0.0120.38±0.0221.29±0.0121.88±0.0423.10±0.0222.92±0.092-ΔΔCt1.1110.741.250.560.78
空白对照组为未转染质粒的细胞组,阴性对照组为转染pSicoR-GFP质粒的细胞组
3 讨 论
β-arrestins不仅可以作为一种负调控因子和支架蛋白调控GPCR信号通路[5],还能够独立调控NF-κB[6]、Wnt/β-catenin[7]等肿瘤侵袭转移相关信号通路。β-arrestin 2可以通过与IκBα结合[8]和抑制肿瘤坏死因子受体相关蛋白(TNF receptor associated factor, TRAF)6的自动泛素化来抑制NF-κB活化,从而参与免疫调节。当β-arrestins过表达时可以通过抑制TNF-α信号来激活NF-κB,而通过RNAi下调时可以增强TNF-α信号来导致NF-κB激活。另外有研究发现β-arrestin 2与IκB相互作用可阻止IκB的磷酸化和降解,从而减少紫外线照射引发的NF-κB信号活化[6],说明β-arrestin 2可作为负调控蛋白来抑制NF-κB的信号转导,进而抑制TNF、IL- 6等众多细胞因子的表达。
基因治疗肿瘤是目前研究的热点,而RNA干扰(RNAi)是基因治疗中可能更安全、更高效的方法。RNAi是由RNA介导、在转录后mRNA水平关闭相应基因的表达,介导其互补同源mRNA序列的特异性降解,沉默目的基因的表达[9]。因RNAi具有高度特异性,治疗针对性强,同时它还具有高效性和稳定性。本研究选用慢病毒载体系统用于进一步的实验研究,对提高体外细胞转染效率以及最终实现体内基因治疗目标都具有重要意义[10]。
本实验构建了β-arrestin 2的shRNA慢病毒载体,测序比对成功,通过293T细胞将其成功转染到目的细胞人非小细胞肺癌A549细胞中,检测细胞中β-arrestin 2的mRNA水平确实有着显著下降,证实了β-arrestin 2敲低成功。这为下一步研究β-arrestin 2对相应癌细胞的作用机制奠定了基础。
【参考文献】
[1] FAN H, BITTO A, ZINGARELLI B, et al. Beta-arrestin 2 negatively regulates sepsis-induced inflammation[J]. J Immunol, 2010,130(3): 344-351.
[2] MA L, PEI G. Beta-arrestin signaling and regulation of transcription[J]. J Cell Sci, 2007,120(Pt 2): 213-218.
[3] RANJAN R, GUPTA P, SHUKLA A K. GPCR signaling: β-arrestins kiss and remember[J]. Curr Biol, 2016,26(7): 285-288.
[4] EICHEL K, JULLIE D, VON ZASTROW M. β-Arrestin drives MAP kinase signalling from clathrin-coated structures after GPCR dissociation[J]. Nat Cell Biol, 2016,18(3): 303-310.
[5] ARMANDO S, QUOYER J, LUKASHOVA V, et al. The chemokine CXC4 and CC2 receptors form homo-and heterooligomers that can engage their signaling G-protein effectors and β-arrestin[J]. FASEB J, 2014,28: 459- 4523.
[6] CIANFROCCA R, TOCCI P, SEMPRUCCI E, et al. β-arrestin 1 is required for endothelin-1-induced NF-κB activation in ovarian cancer cells[J]. Life Sci, 2014,118(2): 179-184.
[7] ROSAN L, CIANFROCCA R, MASI S, et al. Beta-arrestin links endothelin A receptor to beta-catenin signaling to induce ovarian cancer cell invasion and metastasis[J]. Proc Natl Acad Sci USA, 2009,106(8): 2806-2811.
L, CIANFROCCA R, MASI S, et al. Beta-arrestin links endothelin A receptor to beta-catenin signaling to induce ovarian cancer cell invasion and metastasis[J]. Proc Natl Acad Sci USA, 2009,106(8): 2806-2811.
[8] MA L, PEI G. β-arrestin signaling and regulation of transcription[J]. J Cell Sci, 2007,120(Pt 2): 213-218.
[9] WANG H, LIU K, FANG B, et al. Identification of acetyltransferase genes (HAT1 and KAT8) regulating HBV replication by RNAi screening[J]. Cell Biosci, 2015,5(2): 66- 67.
[10] 邱雯莉,周红光.hsa-miR-346过表达慢病毒载体的构建、转染和表达[J].兰州大学学报(医学版),2016,42(3): 6-11.