脓毒症(sepsis)是指由感染引起的全身炎症反应综合征[1-3]。其发生率依旧居高不下,目前依然是ICU患者的主要死亡原因。研究显示,每年有数以百万的患者受脓毒症困扰,严重影响着人类的健康。随着病情的演化进展,脓毒症常导致多器官功能障碍(multiple organ disfunction syndrome, MODS)。其中,肺脏由于其解剖学及生理学特点成为了最早且最易受损伤的器官[4-5]。急性肺损伤(acute lung injury, ALI)及其严重形式急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是脓毒症最常见的并发症之一,其发生率在危重病人群中高达7%,死亡率高达40%,已成为脓毒症患者死亡的首位原因[6]。
内皮细胞微粒(endothelial-derived microparticles, EMPs)系内皮细胞在激活或凋亡状态下释放的微小囊泡状物质,是一种表达CD31、CD105、CD144等标志且直径<1μm的微粒[7]。研究发现,EMPs可作为炎症介质和黏附分子的效应载体,参与细胞信号的转导,加重内皮功能的损害,并在炎症反应、心血管疾病、糖尿病、自身免疫病及肿瘤等多种疾病中发挥重要作用[8-11]。
本研究通过动物实验,构建脓毒症肺损伤模型,观察EMPs在急性肺损伤时浓度的变化,探讨脓毒症相关性肺损伤与EMPs的关系。
1 材料与方法
1.1 实验动物
SPF级雄性野生C578L/6J小鼠30只,10~12周龄,体质量20~25g,由复旦大学医学院动物实验中心提供,于控制的条件下饲养,12h光暗周期,给予无菌水和标准小鼠饲料。采用随机数字表法,实验方案经同济大学附属第十人民医院实验动物伦理委员会审核通过并实施。动物使用和处理遵照美国国立卫生署颁布的“实验动物关护和使用指南”进行。
1.2 手术方法
将小鼠分为2组: 结扎盲肠头尾端穿孔术(cecal ligation puncture procedure,CLP)组(n=18)和假手术(Sham)组(n=12)。小鼠均术前禁食 12h。CLP组小鼠均腹腔注射4mg/kg水合氯醛(10mg/ml)进行麻醉。仰卧位固定小鼠,常规腹部碘伏消毒、备皮和铺无菌纱布洞巾。沿腹中线切开皮肤、腹壁约1cm,用无菌镊探查到盲肠后用4号手术缝线在回盲瓣下方结扎盲肠,用18G无菌针头分别于被结扎盲肠头尾端穿孔,然后挤压盲肠,使其内容物沿穿孔部位挤出1.0~1.5ml。将盲肠及挤出内容物一起送回腹腔。腹部切口用碘伏再次消毒后,用2号手术缝线缝合腹壁及切口。碘伏再次消毒缝合口后将小鼠放回笼中观察。假手术组仅开腹手术后再关腹,两组术后均腹腔注射生理盐水1ml。整个实验过程维持室温25~28℃。手术后每6h观察一次小鼠情况。
术后24h CLP组18只小鼠存活14只,假手术组12只小鼠全部存活。
1.3 标本的采集和测定
1.3.1 血清IL-1β,IL- 6,TNF-α测定 各组取6只小鼠,心尖取血500μl,静置15min,离心半径 10cm,3000r/min,离心15min,收集上清液,-80℃保存。酶联免疫吸附(ELISA)试剂盒(杭州联科生物技术股份有限公司)检测血清IL-1β、IL- 6、TNF-α浓度,所有操作按说明书进行。
1.3.2 血清EMPs的测定 各组另取6只小鼠,心尖取血500μl。于离心半径10cm,1200r/min离心10min,获得富血小板血浆,再行离心半径 10cm,3000r/min离心6min,获得贫血小板血浆。取 50μl 贫血小板血浆,和 10μl 藻红蛋白荧光(p-phycoerythrin, PE)标记的抗CD144抗体充分混匀(购自BD Pharmingen公司)。在室温下避光孵育25min,加入50μl已知浓度的绝对计数微球(low-count,购自美国Beckman Coulter公司),再加入 1000ml 磷酸盐缓冲液(PBS),混匀后上流式细胞仪(BD FACS Calibur)检测。样本检测前首先以直径1.1μm的标准微球(购自Sigma公司)设定一个门槛,搜寻符合EMP大小的所有颗粒(EMP直径<1μm),然后将门内收集到的微颗粒进一步在 575nm 的光电倍增管中进行PE强度分析。即将EMPs定义为直径<1nm,且CD144+阳性。读取10000个绝对计数微球后停止计数,计数符合条件的颗粒个数。依据绝对计数微球的浓度换算得出循环EMPs浓度。换算方法: 已知浓度的绝对计数微球浓度为1×106/ml,读取10000个绝对计数微球时读取的符合条件的颗粒个数为n,换算出来的EMPs浓度X=n×102/ml=n×10-1/μl。
1.3.3 肺湿干比的测定 各组取6只小鼠左肺组织,吸水纸吸干表面水分和血液,采用电子天平称湿重,置于80℃烘箱内烘干24h至恒重,称干重,计算肺湿干比: 湿重/干重(W/D)。
1.3.4 肺组织病理学检查 取小鼠左肺下叶组织,大小0.5cm×0.5cm×0.5cm,置入4%多聚甲醛中固定。常规脱水石蜡包埋,组织切片,做H-E染色,光学显微镜下观察肺组织形态学变化。取小鼠左肺下叶组织,切成1mm×1mm×1mm大小,置入2.5%戊二醛固定液中,0~4℃保存。经漂洗、固定、乙醇梯度脱水、丙酮浸泡、Epon 812包埋聚合,醋酸油和柠檬酸铅复染,进行超薄切片,透射电镜下观察。
1.4 统计学处理
应用SPSS 19.0统计学软件。符合正态分布的计量资料以![]() 表示,组间比较采用t检验。P<0.05为差异有统计学意义。
表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 血清IL-1β、IL- 6、TNF-α浓度检测
血清IL-1β浓度CLP组为(548.80±134.10)pg/ml,Sham组为(8.73±1.34)pg/ml,CLP组明显升高,差异有统计学意义(P<0.01);血清IL- 6浓度CLP组为(13440.01±901.40)pg/ml,Sham组为(24.04±1.68)pg/ml,CLP组明显升高,差异有统计学意义(P<0.01);血清TNF-α浓度CLP组为(2776.01±639.90)pg/ml,Sham组为(41.33±7.57)pg/ml,CLP组血清TNF-α浓度明显升高,差异有统计学意义(P<0.01),见表1。
表1 CLP组和Sham组血清IL-1β、IL-6、TNF-α浓度比较
Tab.1 Conparison of IL-1β、IL-6、TNF-α concentration between CLP group and sham group![]()
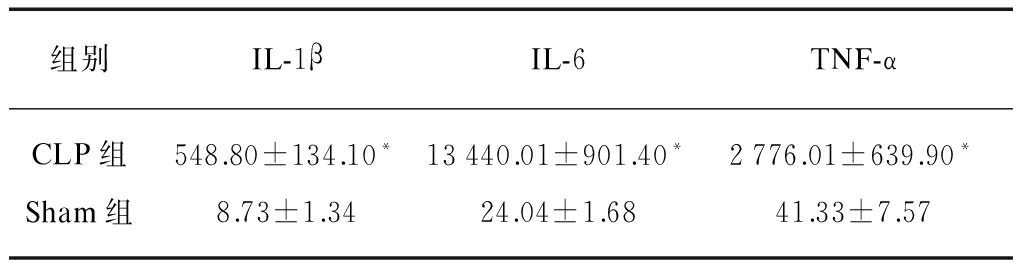
组别IL-1βIL-6TNF-αCLP组548.80±134.10*13440.01±901.40*2776.01±639.90*Sham组8.73±1.3424.04±1.6841.33±7.57
与Sham组相比,*P<0.01
2.2 血清EMPs浓度
CLP组血清EMPs浓度(25.32±1.27)个/μl,Sham组血清EMPs浓度(5.87±0.7)个/μl,与Sham组比较,CLP组血清EMPs浓度明显升高,差异有统计学意义(P<0.01),见图1。
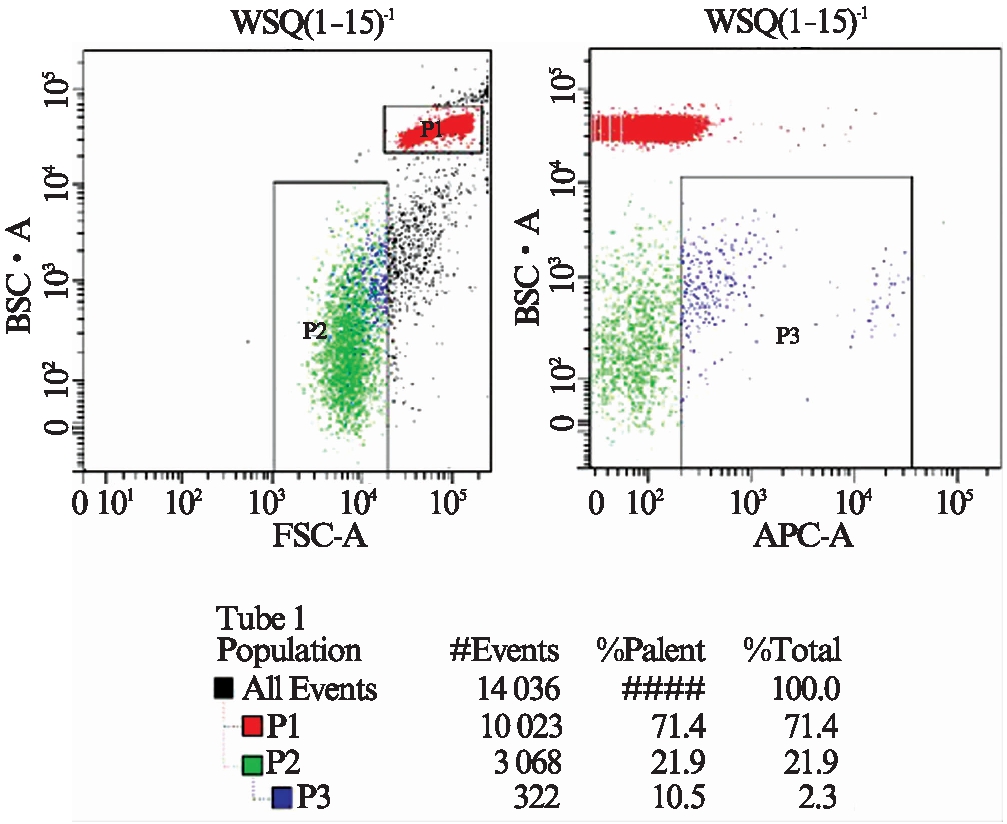
图1 流式细胞术检测血清EMPs浓度
Fig.1 EMPs concentration detected by flow cytometry
P3中检测的个数为读取10000个绝对计数微球时符合条件的颗粒个数,后根据绝对计数颗粒的浓度换算出EMPs的浓度
2.3 肺组织湿重/干重比值
CLP组肺组织W/D比值为5.47±0.03,Sham组为4.39±0.03,CLP组肺组织W/D比值明显升高,差异有统计学意义(P<0.01)。
2.4 肺组织病理学观察
光学显微镜检查显示,Sham组肺组织肺泡结构清晰,无明显炎症细胞浸润和渗出(图2A)。CLP组肺组织部分肺泡萎缩或消失,肺实质化(图2B红色箭头);肺组织内可见炎症细胞灶性浸润,炎症细胞为淋巴细胞和粒细胞(图2B黑色箭头)。
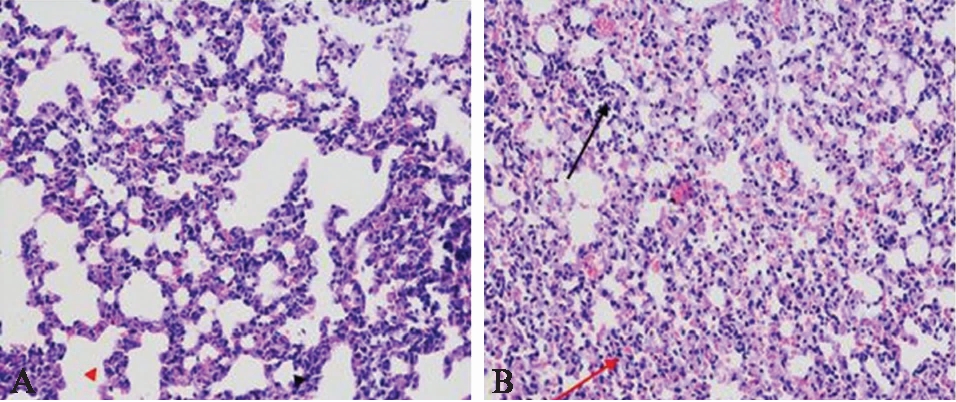
图2 肺组织光学显微镜观察结果
Fig.2 The morphological observation of lung tissue by optical microscope(H-E, ×200)
A: Sham组;B: CLP组
电子显微镜检查结果显示,Sham组肺泡清亮,血管通畅,毛细血管内皮细胞正常;CLP组肺泡内见大量细胞碎片(图3B白箭头);肺毛细血管内皮肿胀增厚(图3B黑箭头)。
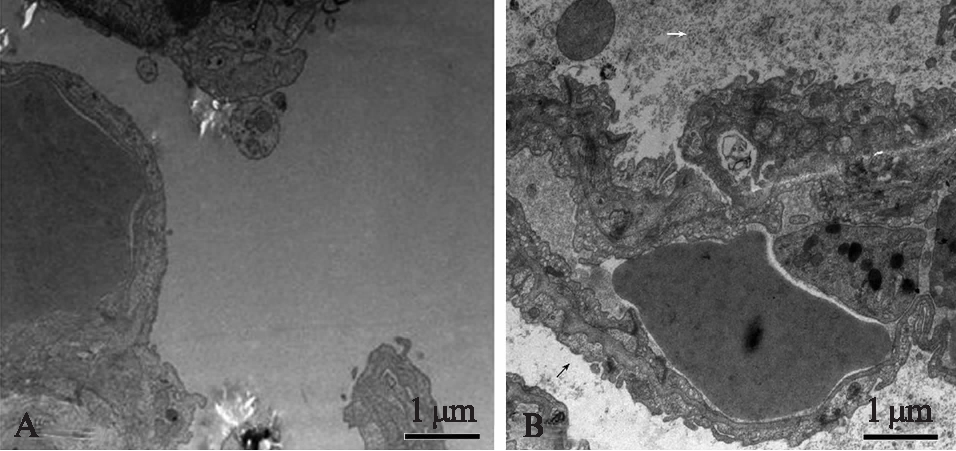
图3 肺组织电子显微镜检查结果
Fig.3 The morphological observation of lung tissue by electron microscope(×20000)
A: Sham组肺组织;B: CLP组肺组织,白箭头示大量细胞碎片;黑箭头示肺毛细血管内皮肿胀增厚
3 讨 论
脓毒症发生时,机体释放大量促炎介质和抗炎介质,多种炎症介质之间相互作用,形成瀑式连锁反应[12],过量炎症介质的作用常导致远隔器官功能发生障碍。脓毒症时肺损伤往往是最早出现的脏器功能损伤。在大量TNF-α、IL-1β等的刺激下,中性粒细胞聚集于肺内微血管并持续活化,释放一系列损伤介质,引起弥漫性肺泡损害,最终导致急性肺损伤[13]。
ALI/ARDS是严重感染创伤休克等导致的以肺泡毛细血管膜损伤为基础,渗透性肺水肿和微肺不张为特征的综合征[14]。ALI的典型病理生理特征是富含蛋白质及中性粒细胞的肺水肿,弥漫性肺泡损伤,肺透明膜形成,肺顺应性下降,并出现严重的低氧血症和呼吸衰竭。其病理生理机制的关键环节是肺血屏障(即肺泡-毛细血管膜)损伤,肺血管通透性增加,进一步导致肺水肿的发生,影响肺部正常的气体交换功能[15]。肺血屏障主要由肺内皮屏障及肺上皮屏障两部分构成,该屏障对于维持正常的肺生理功能至关重要。而脓毒症导致ALI时肺内皮细胞是首要受损的靶器官[16]。
EMPs是内皮细胞激活或凋亡时从其表面释放的直径<1μm的微囊泡,具有内皮细胞的某些抗原特性,可有效反映内皮细胞的结构和功能状态。研究表明,EMPs不仅是内皮功能紊乱的新的标志物,在炎症、血管损伤、内皮功能障碍和血栓形成中也发挥着重要的生物学作用。EMPs可以引起内皮细胞功能障碍和急性肺损伤。Pescatore等[17]发现EMPs可以引发细胞炎症介质瀑布样释放,引起中性粒细胞集聚和MPO释放导致肺损伤,EMPs和LPS同时注射的小鼠肺损伤要比分别单一注射EMPs和LPS的小鼠肺损伤严重得多,提示EMPs还通过其他途径引起肺损伤。
本实验采用的小鼠盲肠结扎穿孔术为经典的脓毒症肺损伤造模的方法[18]。本实验中,CLP组小鼠在24h后死亡4只,死亡率为22.2%,Sham组小鼠无死亡,死亡率为0。CLP组小鼠W/D比值和血清IL-1β、IL- 6、TNF-α含量较假手术组均显著升高。光学显微镜观察结果和电子显微镜观察结果均说明小鼠肺泡组织和肺内皮细胞存在急性严重损伤。说明本实验中采用盲肠结扎穿孔的方法成功制作了急性肺损伤模型。
本实验中CLP组小鼠血清EMPs浓度较假手术组显著升高,显示EMPs和脓毒症相关性ALI存在密切的相关性,EMPs参与了ALI的进程,EMPs的大量释放可能是ALI发生的重要环节之一。继续深入研究EMPs和ALI的关系以及EMPs在ALI中所起的作用对深入探索ALI/ARDS的病理生理机制有着极其重要的作用。
本研究样本量较小,存在一定的局限性。后续的研究中需要进一步增加ALI不同时相、不同严重程度EMPs的变化特点的研究,以更多阐明EMPs参与肺损伤发生的具体机制。
【参考文献】
[1] BONE R C. The pathogenesis of sepsis[J]. Ann Intern Med, 1991,15(6): 457- 469.
[2] RRSSELL J A. Management of sepsis[J]. N Engl J Med, 2006,355(16): 1699-1713.
[3] HOTCHKISS R S, Karl I E. The pathophysiology and treatment of sepsis[J]. N Engl J Med, 2003,348(2): 138-150.
[4] CAWCUTT K A, PETERS S G. Severe sepsis and septic shock: clinical overview and update on management[J]. Mayo Clin Proc, 2014,89(11): 1572-1578.
[5] ISKANDER K N, OSUCHOWSKI M F, STEAMS-KUROSAWA D J, et al. Sepsis: multiple abnormalities, heterogeneous responses, and evolving understanding[J]. Physiol Rev, 2013,93(3): 1247-1288.
[6] RUSSELL J A, WALLEY K R. Update in sepsis 2012[J]. Am J Respir Criti Care Med, 2013,187(12): 1303-1307.
[7] JEANNETEAU J, HIBERT P, MARTINEZ M C, et al. Microparticle release in remote ischemic conditioning mechanism[J]. Am J Physiol Heart Circ Physiol, 2012,303(7): H871-H877.
[8] BITZER M, BEN-DOV I Z, THUM T. Microparticles and microRNAs of endothelial progenitor cells ameliorate acute kidney injury[J]. Kidney Int, 2012,82(4): 375-377.
[9] BIBLE E, QUTACHI O, Chau D Y, et al. Neovascularization of the stroke cavity by implantation of human neural stem cells on VEGF-releasing PLGA microparticles[J]. Biomaterials, 2012,33(30): 7435-7446.
[10] DASGUPTA S K, LE A, CHAVAKIS T, et al. Developmental endothelial locus-1 (Del-1) mediates clearance of platelet microparticles by the endothelium[J]. Circulation, 2012,125(13): 1664-1672.
[11] VAN IERSSEL S H, HOYMANS V Y, VAN CRAENENBROECK E M, et al. Endothelial microparticles (EMP) for the assessment of endothelial function: an in vitro and in vivo study on possible interference of plasma lipids[J]. PLoS One, 2012,7(2): e31496.
[12] PAYEN D, MONNERET G, HOTCHKISS R. Immunotherapy — a potential new way forward in the treatment of sepsis[J]. Crit Care, 2013,17(1): 118.
[13] DOWNEY G P, DONG Q, KRUGER J, et al. Regulation of neutronphil activation in acute lung injury[J]. Chest, 1999,116(Suppl 1): 46s-54s.
[14] WARE L B, MATTHAY M A. The acute respiratory distress syndrome[J]. N Engled, 2000,342(18): 1334-1349.
[15] HEROLD S, GGBRIELLI N M, VAD SZ I. Novel concepts of acute lung injury and alveolar-capillary barrier dysfunction[J]. Am J Physiol Lung Cell Mol Physiol, 2013,305(10): L665-L681.
SZ I. Novel concepts of acute lung injury and alveolar-capillary barrier dysfunction[J]. Am J Physiol Lung Cell Mol Physiol, 2013,305(10): L665-L681.
[16] GILL S E, TANEJA R, ROHAN M, et al. Pulmonary microvascular albumin leak is associated with endothelial cell death in murine sepsis-induced lung injury in vivo[J].PLoS One, 2014,9(2): e88501.
[17] PESCATORE L A, BONATTO D, FORTI F L, et al. Protein disulfide isomerase is required for platelet-derived growth factor-induced vascular smooth muscle cell migration, Nox1 NADPH oxidase expression, and RhoGTPase activation[J]. J Biol Chem, 2012,287(35): 29290-29300.
[18] MATUTE-BEFO G, FREVERT C W, MARTIN T R. Animal models of acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2008,295(3): L379-L399.