胶质瘢痕是脊髓损伤后的普遍结果,由占据了神经损伤坏死区域的星形胶质细胞构成。将胶质瘢痕中的星形胶质细胞转分化为神经元,可以促进神经系统的功能重建,有望治疗脊髓损伤。微RNA(miRNA)指细胞中不编码蛋白质的一类长度约为22nt的RNA小分子,一般认为它可以结合到目标转录产物3′-UTR区域以抑制靶基因的表达。在星形胶质细胞转分化为神经元的研究中,人们主要着眼于转录因子,关于miRNA的报道很少。因此,本研究通过查询星形胶质细胞高表达基因,用生物信息学方法预测调控这些基因的miRNA,并在体内和体外过表达这些miRNA以期探索其对脊髓损伤修复的作用。
1 材料与方法
1.1 材料
X-tremeGENE 9 DNA Transfection Reagent购自Roche公司;反转录试剂盒购自TaKaRa公司;核酸浓度测定仪NanoDrop2000购自Thermo Scientific公司;倒置荧光显微镜购自Nikon公司;实时荧光定量PCR仪购自ABI公司;BBB行为学实验软件购自美国Noduls公司。
1.2 实验方法
1.2.1 TargetScan数据库预测 Darmanis等[1]在单细胞水平上对人脑的转录组进行了测序,发现了人脑星形胶质细胞高表达的24个基因。将这些靶基因输入TargetScan数据库中预测能调控它们的miRNA,并结合Nguyen[2]等对神经组织工程中miRNA所扮演角色及其潜在治疗作用的相关总结,初步得到miRNA与星形胶质细胞高表达靶基因的调控关系预测。
1.2.2 miRNA克隆 抽提293T细胞基因组,以其为模板PCR扩增出预测所得的7种miRNA(miR-9、miR-21、miR-124、miR-125、miR-128、miR-145、miR-375)前体。MiRNA在NCBI中查询得到,用DNAMAN软件进行引物设计,由Invitrogen公司合成引物。PCR反应体系为20μl,DNA模板100ng,上下游引物各 0.5μl,2×Taq PCR Master Mix 10μl,最后用无核酸酶水补足到20μl。反应过程为95℃预变性2min;95℃变性20s,58℃退火20s,72℃延伸 20s,共35个循环;最后 72℃ 延伸 10min,12℃保温 1min。扩增产物和pLVX-shRNA2载体用BamHI和EcoRI双酶切,再将二者连接,转化到DH5α感受态细胞中,涂板并挑选阳性克隆,通过菌落PCR和测序确定克隆的正确性。最后大提质粒,用于直接转染和慢病毒包装。
1.2.3 实时荧光定量PCR 实验用293T细胞由本实验室保存。将预测得到的7种miRNAs(miR-9、miR-21、miR-124、miR-125、miR-128、miR-145、miR-375)和对照组空载体pLVX-shRNA2分别转染到293T细胞中。由于pLVX-shRNA2载体带有GFP序列,转染后48h在荧光显微镜下观察GFP的表达情况。抽提转染后的细胞总RNA并反转录成cDNA,以其为模板进行实时荧光定量PCR(qPCR)检测,确定过表达miRNA后miRNA及预测靶基因的表达量。qPCR的反应体系为20μl,cDNA模板 1μg,上下游引物各0.5μl,2×iTaq Universal SYBR Green Supermix 10μl,最后用无核酸酶水补足到 20μl。反应过程为95℃预变性30s,95℃变性 15s,60℃延伸1min;后两步设置40个循环,延伸时收集荧光。
1.2.4 脊髓损伤模型的构建及形态学观察
(1) 小鼠脊髓损伤模型的构建 小鼠背部去毛,固定于手术台上,连接气体麻醉装置;触及小鼠背部最突出点,以此为中点沿背正中线做1.5cm纵向切口;逐层分离背部筋膜、肌肉,充分暴露T8~T10节段,观察棘突形态,确定T9椎板位置;移除T9椎板,暴露脊髓,使用悬吊钳夹装置dumont 5号镊子夹闭损伤3s;止血、生理盐水冲洗,逐层缝合肌肉、皮肤;将术后小鼠妥善安置于体温维持垫上复苏;术后每天为小鼠排尿1~2次,每次排尿后使用碘伏消毒尿道外口。
(2) 形态学观察 脊髓损伤小鼠于损伤后24h和36h分两次尾静脉注射miRNA慢病毒液,每只每次注射量为 100μl。损伤后 4d 和 23d 处死小鼠,灌注并固定脊髓组织,肉眼观察脊髓形态。
1.2.5 BBB行为学评分实验 将小鼠轻轻放在旷场的中心位置,计时3min,观察小鼠的身体形态和运动轨迹,根据BBB行为学评分标准进行评分。
1.2.6 小鼠脊髓的实时荧光定量PCR 将脊髓损伤后的小鼠处死,提取小鼠脊髓组织总RNA并反转录成cDNA,以其为模板进行实时荧光定量PCR实验,检测小鼠miRNA、靶基因和星形胶质细胞/神经元特异性标记基因(GFAP、MAP2、NeuN、Tuj1)的表达。具体实验步骤见1.2.3。
1.3 统计学处理
统计分析使用GraphPad Prism软件,所有实验数据均使用t检验分析差异。P<0.05认为差异有统计学意义。
2 结 果
2.1 miRNA的预测结果
查询得到的星形胶质细胞高表达基因和TargetScan预测得到的miRNA及其调控关系见表1。miR-9可能参与了多达9个靶基因的表达调控,其次是miR-124和miR-125,两者都分别参与了4个靶基因的表达调控。同时,大多数高表达基因受到1至2个miRNA调控,而SLC4A4可能同时受到miR-9、miR-125、miR-145和miR-375等4种miRNA的调控,这些miRNA和靶基因是接下来研究的重点。
表1 预测miRNA的靶基因
Tab.1 Prediction of miRNA target genes
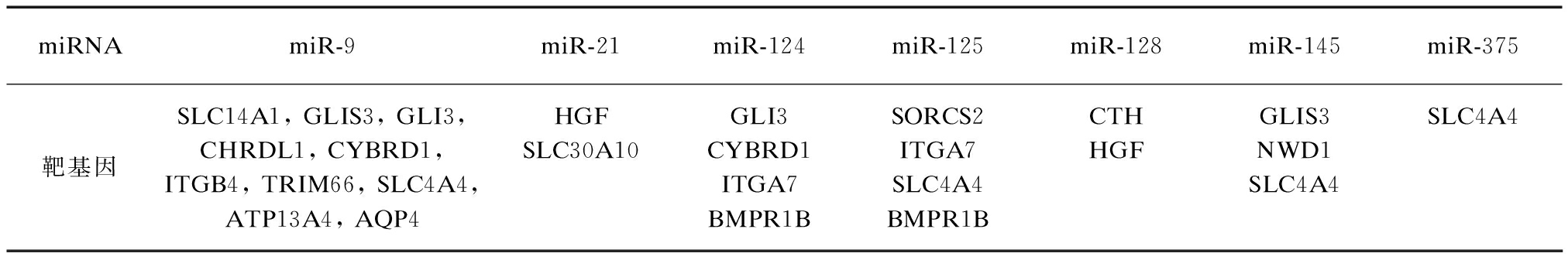
miRNAmiR-9miR-21miR-124miR-125miR-128miR-145miR-375靶基因SLC14A1,GLIS3,GLI3,CHRDL1,CYBRD1,ITGB4,TRIM66,SLC4A4,ATP13A4,AQP4HGFSLC30A10GLI3CYBRD1ITGA7BMPR1BSORCS2ITGA7SLC4A4BMPR1BCTHHGFGLIS3NWD1SLC4A4SLC4A4
2.2 293T细胞靶基因表达量检测
转染pLVX-shRNA2-miRNA后,与对照组相比,7个miRNA实验组的对应miRNA表达量均大幅提升,差异都具有统计学意义(P<0.05)。
分别过表达7种miRNA的293T细胞中,有miR-9、miR-124和miR-125等3组表达量下调的靶基因数量为3或3以上,见图1。miR-128和miR-145各有1个靶基因下调,分别为CTH和GLIS3。miR-21无靶基因下调,miR-375的靶基因SLC4A4表达量虽有降低,但差异无统计学意义(P>0.05)。
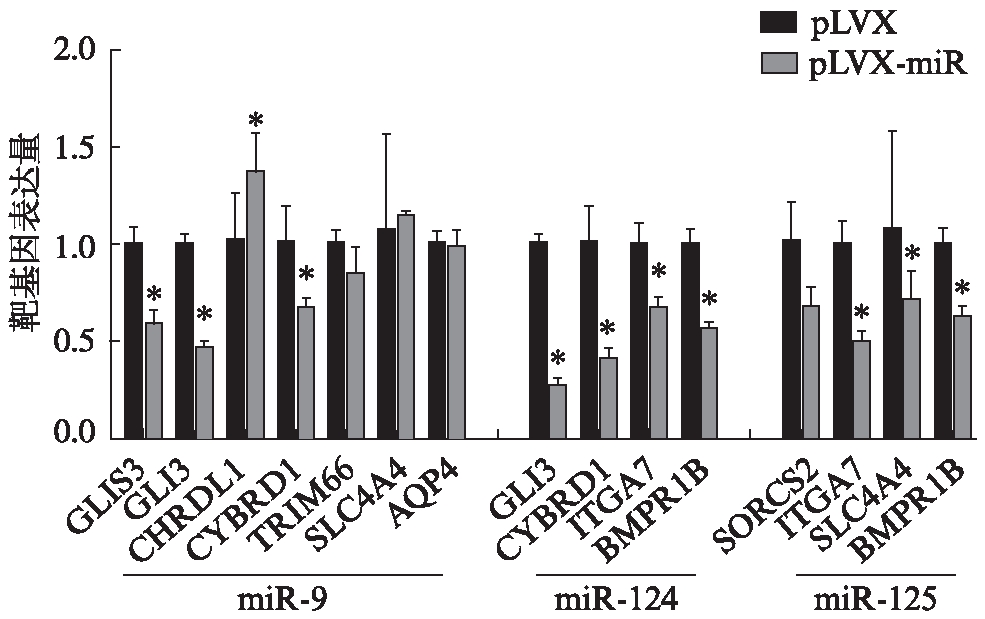
图1 293T细胞中miR-9,miR-124和miR-125组靶基因表达量
Fig.1 The expressions of target genes of miR-9,miR-124 and miR-125 in 293T cells
2.3 脊髓形态学观察
小鼠损伤后23d取脊髓组织进行形态学观察。对照组(pLVX)可看到明显的红色钳夹痕迹,而miR-9组和miR-124组肉眼无法观察到钳夹痕迹,见图2。
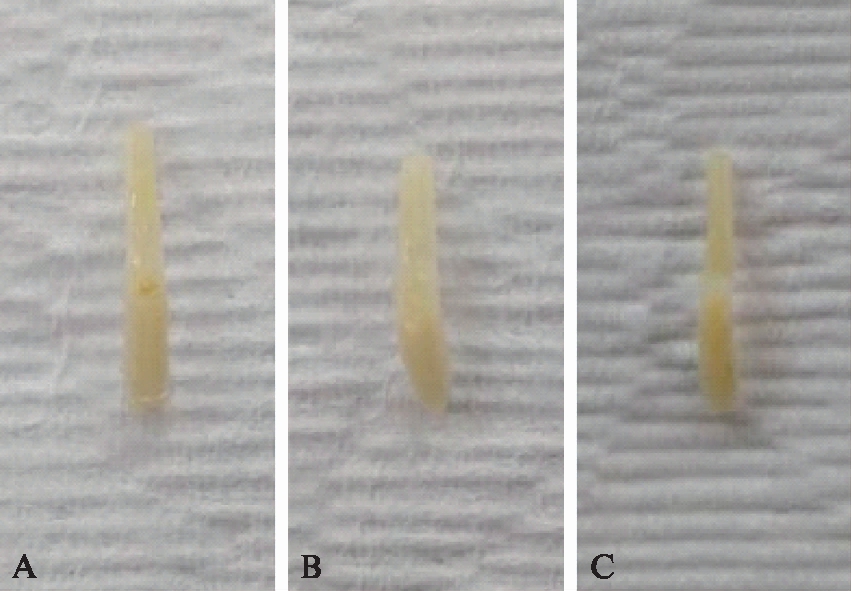
图2 小鼠脊髓形态学观察
Fig.2 The morphological observation of spinal cord
A: pLVX组;B: miR-9;C: miR-124
2.4 BBB行为学评分
对脊髓损伤的小鼠进行BBB行为学评分,损伤后4d开始,每3d评估1次,22d 终止。与对照组(pLVX)相比,miR-9组在16d及之前的评分较低,但差异无统计学意义(P>0.05),19d和22d,miR-9组的评分大于pLVX组,且22d二者的差异具有统计学意义(P<0.05)。miR-124的评分在每一个时间点都低于pLVX组,其中13d和19d二者的差异具有统计学意义(P<0.05)。BBB行为学评分结果见图3。
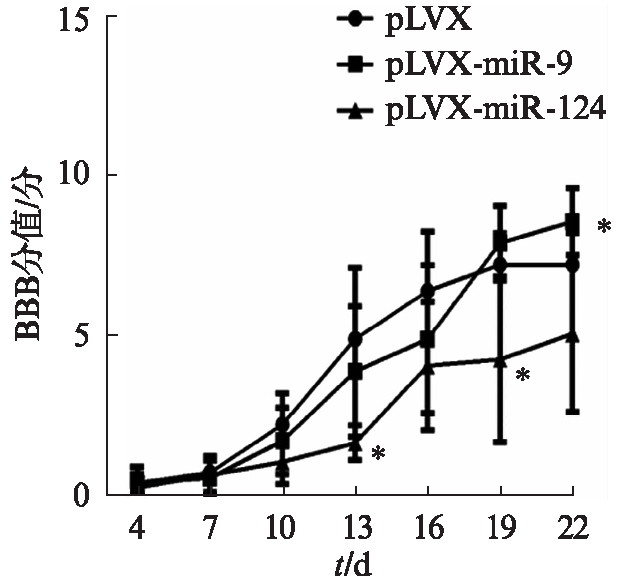
图3 BBB行为学评分
Fig.3 BBB behavioral score
2.5 脊髓神经组织标记基因检测
脊髓损伤后5d,取脊髓组织检测尾静脉注射miRNA的小鼠与对照组(pLVX)小鼠miRNA表达量情况。与pLVX组相比,尾静脉注射pLVX-miR-9慢病毒的小鼠miR-9表达量显著上升(P<0.05),miR-124组与pLVX组相比miR-124的表达量差异无统计学意义(P>0.05)。
脊髓损伤后23d,取脊髓组织检测星形胶质细胞标记基因GFAP和神经元标记基因MAP2、NeuN、Tuj1。与pLVX组相比,miR-9组GFAP表达量下降,MAP2和NeuN表达量上升,且差异有统计学意义(P<0.05)。miR-124组则与pLVX组在4种标记基因上均差异无统计学意义(P>0.05)。检测结果见图4。
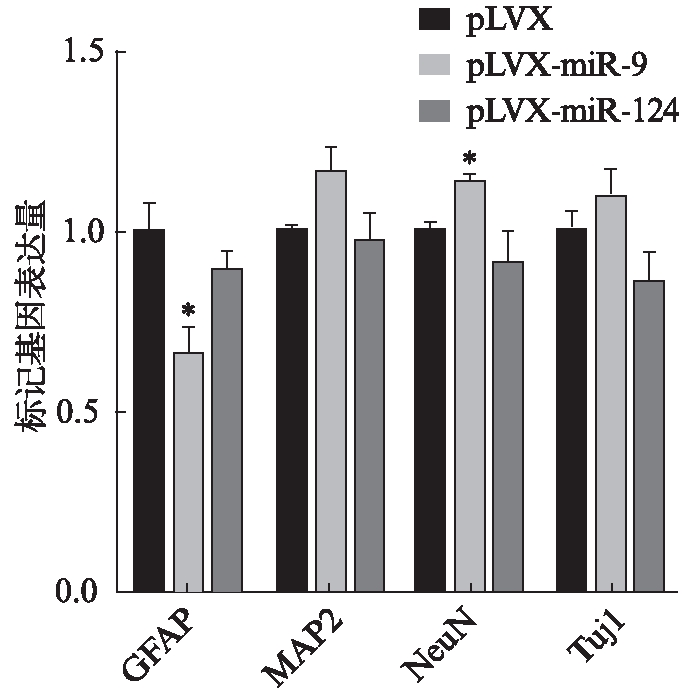
图4 脊髓神经组织标记基因表达量检测
Fig.4 The detection of nerve tissue marker genes expression levels of spinal cord tissues
2.6 脊髓组织靶基因表达量检测
损伤后23d,检测miR-9组和pLVX组小鼠脊髓组织三个靶基因的表达量,GLIS3和CYBRD1在miR-9组中显著下调(P<0.05),GLI3有下调的趋势,但差异无统计学意义(P>0.05),见图5。
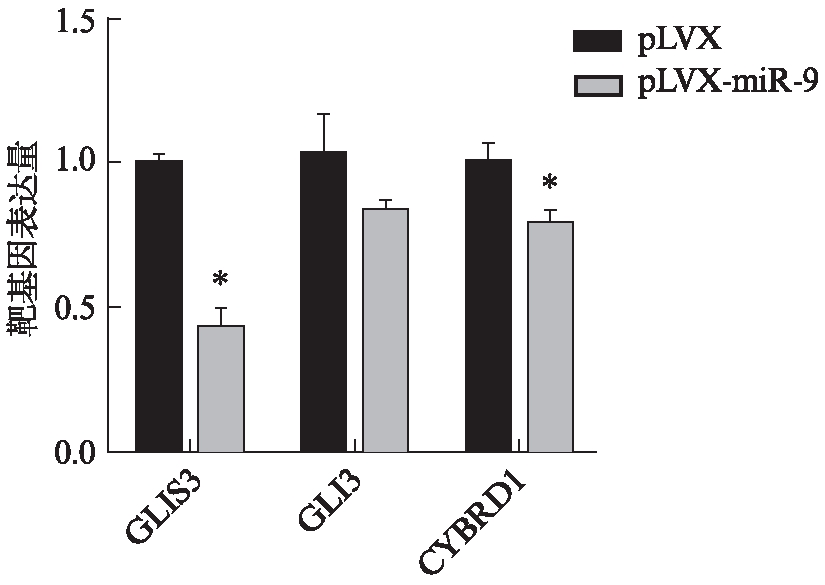
图5 脊髓组织靶基因表达量检测
Fig.5 The detection of target genes expression levels of spinal cord tissues
3 讨 论
脊髓损伤发生后,神经系统损伤区的坏死产物被吞噬细胞清除,坏死区域边缘被大量星形胶质细胞占据,最终导致胶质瘢痕的产生[3]。瘢痕中反应性星形胶质细胞的长期存在会阻碍神经元轴突再生,造成神经突触错误连接,引起癫痫等不良反应[4]。将胶质瘢痕中的星形胶质细胞转分化为神经元可以排除神经胶质的阻碍,有效促进神经系统功能的重建。目前这方面的转分化研究还限于转录因子,人们对于miRNA在这一过程中的作用知之甚少。与转录因子相比,miRNA在自然状态下可稳定存在于细胞内并可在细胞间转移,且用miRNA作为转分化的诱导物不仅可以规避DNA整合到细胞基因组的风险,同时也可以避免引发天然免疫反应[5]。本研究通过在脊髓损伤小鼠体内过表达miRNA,探究miRNA在星形胶质细胞转分化为神经元和脊髓损伤修复中的作用。
比对预测结果与荧光定量PCR的实验结果,本研究发现,虽然前者预测的20个miRNA-靶基因组合中有12个组合与实验结果一致,即荧光定量PCR证明靶基因确实在miRNA过表达的情况下下调了,但还有8个组合的预测结果与实验结果不一致,有的没有显著性差异(如miR-375与SLC4A4),有的甚至出现了靶基因表达量的上调(如miR-9与CHRDL1),因此预测的结果必须得到实验结果的检验与证实。方法上,除荧光定量PCR这种在mRNA水平上的验证外,还有蛋白质水平上的Western印迹法以及常用的荧光素酶报告基因检测。后者采用了源于萤火虫的荧光作为对照,减小了实验误差,提升了实验结果的准确度和可信度。可以采用荧光素酶报告基因检测、荧光定量PCR、Western印迹法等多种方法共同验证。靶基因荧光定量PCR的结果显示,miR-124、miR-9和miR-125是调控靶基因相对较多的miRNA,分别导致了4、3、3个靶基因的下调;从靶基因的角度看,GLIS3、GLI3、ITGA7、BMPR1B和CYBRD1都受到不止一个miRNA的调控,上述miRNA和星形胶质细胞高表达基因可能在这一转分化过程中发挥重要的作用。
脊髓的形态学观察可以给评估小鼠脊髓损伤的恢复情况提供一定的参考。这种方法直观、简单、方便,在各组差异明显的情况下具有一定的参考价值。但是由于动物个体差异较大,并不能将之作为严格的判断标准。从钳夹痕迹推测,miR-9和miR-124对于脊髓损伤修复都具有一定作用。
在脊髓损伤动物模型中,需要对动物后肢的运动功能恢复进行评价,最常用的是BBB行为学评分[6]。这种方法可以通过动物外在功能的恢复情况,反映研究者感兴趣的内在调控机制。miR-9组动物的表现与设想一致,虽然在16d及以前评分低于对照组,但是在16d至19d实现了反超,到达最后一个时间点 22d 时评分显著高于对照组(P<0.05)。这提示miR-9有助于脊髓损伤小鼠运动功能的恢复,且它的作用体现在恢复中后期(16d后)。出乎意料的是,可以同时调控4个靶基因,且形态学方面表现较好的miR-124组小鼠运动功能恢复得最差,低于miR-9组和对照组,在13d和19d两个时间点差异有统计学意义。对miR-124组的miRNA及标记基因表达量的检测显示,miR-124在脊髓组织中并未过表达,且GFAP并未下调,MAP2/NeuN/Tuj1并未上调。可能由于慢病毒载体未定位于脊髓组织,或病毒量太少。虽然在小鼠脊髓中过表达miR-124失败,但证明了它可以在体外靶向下调星形胶质细胞高表达基因GLI3、CYBRD1、ITGA7和BMPR1B。且Nguyen等[2]的综述也提到miR-124可以靶向作用于细胞骨架,增加拥有神经突起的神经元的数量。有理由相信,miR-124依然是脊髓损伤修复研究的候选者。
作为星形胶质细胞和神经元的特异性标记基因,组织定量GFAP和MAP2/NeuN/Tuj1可以从一定程度上反映星形胶质细胞和神经元的数量多寡,从而间接反映前者向后者的转分化情况。miR-9显著降低了脊髓组织GFAP的表达(P<0.05),显著提升了MAP2和NeuN的表达(P<0.05)。可以推测,miR-9促进了星形胶质细胞向神经元的转分化,因此星形胶质细胞标记基因的表达量下降,神经元标记基因的表达量上升。当然,仅仅荧光定量的结果并不能充分证明,还需通过流式细胞术、免疫荧光染色等做进一步研究。
脊髓组织靶基因的荧光定量PCR结果与293T细胞基本一致,即对于脊髓损伤小鼠,miR-9在体过表达可以降低GLIS3和CYBRD1的表达(P<0.05)。GLIS3(GLI-similar 3)是GLI-similar锌指蛋白家族的一员,它可以编码拥有C2H2类型锌指结构域的核蛋白,这个蛋白在早期胚胎发生过程中起着重要作用,可以激活或抑制有关mRNA的转录[6]。CYBRD1(DCYTB)是一种在十二指肠表皮细胞中高表达的基因,它编码的蛋白质是一种铁离子调节的三价铁还原酶,它的组织特异性高表达和铁离子调节的特性显示出它在机体铁元素吸收过程中扮演着重要角色[7]。miR-9促进了星形胶质细胞转分化为神经元,是否通过抑制GLIS3进一步调控其他mRNA的转录,或者是否通过抑制CYBRD1调节铁元素的吸收,接下来的研究需要进一步建立这两个基因与细胞转分化的联系。
综上所述,在脊髓损伤小鼠模型中,miR-9可能通过靶向下调星形胶质细胞高表达基因GLIS3和CYBRD1,促进星形胶质细胞向神经元转分化和脊髓损伤的修复。
【参考文献】
[1] DARMANIS S, SLOAN S A, ZHANG Y, et al. A survey of human brain transcriptome diversity at the single cell level[J]. Proc Natl Acad Sci USA, 2015, 112(23): 7285-7290.
[2] NGUYEN L H, DIAO H J, CHEW S Y. MicroRNAs and their potential therapeutic applications in neural tissue engineering[J]. Adv Drug Deliv Rev, 2015, 88: 53- 66.
[3] LEAL-FILHO M B. Spinal cord injury: from inflammation to glial scar[J]. Surg Neurol Int, 2011, 2: 112.
[4] LEFRANÇOIS T, FAGES C, TARDY M. Neuritic Outgrowth Associated With Astroglial Phenotypic Changes Induced By Antisense Gfap-mrna In Injured Neuron-astrocyte Coculture[J]. J Neurochemistry, 1997, 69: S243.
[5] SHENOY A, BLELLOCH R. MicroRNA induced transdifferentiation[J]. F1000 Biol Rep, 2012, 4(3).
[6] DIMITRI P, HABEB A M, GARBUZ F, et al. Expanding the clinical spectrum associated with GLIS3 mutations[J]. J Clin Endocrinol Metab, 2015, 100(10): E1362-E1369.
[7] MCKIE A T. The role of Dcytb in iron metabolism: an update[J]. Biochem Soc Trans, 2008,36(6): 1239-1241.