·临床研究·
【摘要】 目的 探讨表观扩散系数(apparent diffusion coefficient, ADC)值与孤立性肺病灶(solitary pulmonary lesions, SPLs)病理参数的相关性及其对SPLs的定性诊断价值。方法 该研究应用3.0T磁共振扩散加权成像(diffusion weighted imaging, DWI),以手术切除65例SPLs(恶性52例,良性13例)为研究对象,定量SPLs的多种病理参数(细胞密度,核质比,坏死分数,黏液和病理分级),用多元线性回归分别分析良、恶性SPLs的ADC与多种病理参数的相关性。通过受试者工作曲线(receiver operating characteristic curve, ROC)评估ADC对SPLs的定性诊断效能。结果 恶性SPLs的ADC与细胞密度(β=-0.40, P<0.001)和黏液(β=0.77, P<0.001)独立相关,良性SPLs的ADC与病理参数无相关性。恶性和良性SPLs的ADC分别为(1.10±0.24)×10-3、(1.53±0.47)×10-3 mm2/s,差异有统计学意义(P<0.001)。鳞癌、不含黏液腺癌和含黏液肺癌ADC分别为(0.98±0.11)×10-3、(1.08±0.13)×10-3、(1.69±0.18)×10-3 mm2/s,两两差异均有统计学意义(P<0.05)。当ADC阈值为1.21×10-3 mm2/s时,对SPLs的定性诊断价值最高,灵敏度为80.8%,特异度为77.0%,且对鳞癌、不含黏液腺癌和含黏液肺癌定性诊断准确率分别为100%(9/9)、82%(22/27)、0%(0/5)。鳞癌、不含黏液腺癌和含黏液肺癌的细胞密度分别为373±109、287±51、275±87(每×400高倍视野),其中仅鳞癌与不含黏液腺癌的细胞密度差异有统计学意义(P<0.001)。结论 肺癌的ADC与细胞密度和黏液独立相关。ADC有助于SPLs的定性诊断,对肺鳞癌的定性诊断准确性较高,对低细胞密度腺癌及含黏液肺癌的定性诊断准确性不足。
【关键词】 孤立性肺病灶; 磁共振扩散加权成像; 表观扩散系数; 病理参数; 相关性分析; 定性诊断
肺癌是导致全球癌症相关死亡的主要恶性肿瘤,已成为全球性的健康负担问题。早期发现恶性肺病灶并进行手术治疗,避免不必要的有创性活检、手术或延误治疗对临床实际工作至关重要。CT和PET是孤立性肺病灶(solitary pulmonary lesions, SPLs)的两种常见影像学检查方法。CT增强检查从形态学[1]和强化方式[2]方面评估SPLs的良恶性,但对部分小病灶、活性肉芽肿或良性富血供肺肿瘤[3]的定性诊断较困难。PET有助于鉴别诊断SPLs[4],但由于其对高分化肺腺癌易产生假阴性诊断结果[5]、对炎性结节易产生假阳性诊断结果[6]及价格高昂而未能在临床中被广泛应用。磁共振扩散加权成像(diffusionweighted imaging, DWI)是用表观扩散系数(apparent diffusion coefficient, ADC)值反映组织中水分子扩散运动程度的无创性功能成像技术[7]。已有文献[8-9]探究ADC与肺癌组织病理参数的相关性,包括细胞密度、核质比(nuclear-to-cytoplasm ratio, NCR)、坏死分数或病理分级方面,认为ADC与肺癌的某些病理参数存在相关性。目前尚无研究阐明这些病理参数对ADC的共同影响作用。随着MRI成像技术的发展,DWI对SPLs的定性诊断价值[10]已受到很多学者的关注,由于ADC鉴别诊断阈值、灵敏度和特异度的差异性[11]较大,目前尚无统一的ADC阈值标准。本研究旨在通过影像与病理对照研究探讨ADC与SPLs病理参数的相关性及ADC对SPLs的定性诊断价值。
患者入组标准: (1) 胸部CT检查发现SPLs,大小≥1cm,不含气体及钙化成分;(2) 经抗炎治疗2周后无吸收;(3) 检查前无经皮穿刺活检、支气管镜活检及癌症相关放化疗等治疗史;(4) 无MRI禁忌证,如心脏起搏器置入、身体金属物置入、幽闭恐惧症等。经患者本人知情同意,自愿接受MRI检查。2014年9月至2016年10月在上海交通大学医学院附属仁济医院胸外科拟行外科手术且符合上述标准的65例患者,共计65例病灶纳入研究,男性28例,女性37例。恶性病灶52例,平均年龄(60±13)岁,平均大小(26±11) mm;良性病灶13例,平均年龄(56±13)岁,平均大小(29±18) mm。
采用Philips Ingenia3.0TMRI扫描仪和32通道的体相控阵dStream Torso线圈。检查前嘱患者均匀呼吸并进行呼吸训练。扫描序列包括: (1) 冠状位T2WI-TSE: TR/TE 1250/80ms,FOV 380mm2×380mm2,矩阵272×237,层厚/层间距4/0.5mm,NEX 1,扫描时间72s,呼吸门控;(2) 轴位T2WI-TSE: TR/TE 1098/90ms,FOV 250mm2×250mm2,矩阵280×245,层厚/层间距3/0.5mm,NEX 2,扫描时间252s,呼吸门控;(3) 轴位T2WI-TSE-SPIR: TR/TE 974/65ms,FOV 250×250mm2,矩阵252×210,层厚/层间距3/0.5mm,NEX 2,扫描时间252s,呼吸门控;(4) 轴位mDixon TSE: TR/TE 3.5/1.2ms,FOV 400×349mm2,矩阵272×236,层厚/层间距1.75/0mm,NEX 1,扫描时间19s,屏气扫描。(5) DWI: 采用EPI和SPIR脂肪抑制技术以减少化学位移伪影,b值取0、250、600、800和1000s/mm2,TR/TE 1044/69ms,FOV 400×352mm2,矩阵132×114,层厚/层间距3/0.3mm,EPI 57,NEX 1(b=0和250s/mm2),NEX 2(b=600和800s/mm2),NEX 3(b=1000s/mm2),扫描时间306s,呼吸门控。总扫描时间约15min。
使用Philips Intellispace Portal v6.0后处理工作站,对多b值(0、250、600、800和1000s/mm2)DWI图进行单指数模型拟合,公式如下: Sb/S0=exp(-b×ADC)(b为扩散敏感因子,Sb代表扩散敏感因子为非零b时的信号强度,S0代表未施加扩散梯度时的信号强度,ADC为表观扩散系数)。在ADC图上,参照T2WI和mDixon图,选取病灶最大层面,距病灶边缘适当距离勾勒ROI(避免病灶边缘部分容积效应),记录平均ADC。为了验证ADC测量的可靠性,另一名放射科医师,用相同的方法测量ADC。
参考既往研究方法[12],定义细胞密度为5个高倍视野下的平均细胞数,NCR为细胞核面积/细胞质面积。分析H-E染色病理切片,于最大面积层面随机选取5个视野(×400),在光学显微镜(DM5000,德国徕卡公司)下观察;使用数码相机(DFC295,德国徕卡公司)拍摄照片(2048×1536像素)。使用Image J软件定量细胞密度,计算平均细胞密度和NCR。观察每个病灶所有病理切片后,评估坏死分数,是否出现黏液与病理分级。坏死分数为坏死区占整个病灶的百分比[13],将其分为四度,Ⅰ度: <25%,Ⅱ度: 25%~50%,Ⅲ度: 51%~75%,Ⅳ度: >75%。参照既往研究[8],将恶性SPLs分为低级别(高或中等分化程度)和高级别(低分化程度)。
采用SPSS 22.0与MedCalc 11.4统计软件进行分析,定量资料采用![]() 或范围表示。使用单向随机组内相关系数(intra-class correlation coefficient, ICC)分析观察者间ADC的可靠性。使用多元线性回归与Spearman相关分析ADC与SPLs病理参数的相关性。用受试者工作曲线(receiver operating characteristic, ROC)评估ADC对SPLs的定性诊断价值。采用χ2检验与t检验比较ADC对不同组肺癌的定性诊断价值。P<0.05为差异有统计学意义。
或范围表示。使用单向随机组内相关系数(intra-class correlation coefficient, ICC)分析观察者间ADC的可靠性。使用多元线性回归与Spearman相关分析ADC与SPLs病理参数的相关性。用受试者工作曲线(receiver operating characteristic, ROC)评估ADC对SPLs的定性诊断价值。采用χ2检验与t检验比较ADC对不同组肺癌的定性诊断价值。P<0.05为差异有统计学意义。
恶性SPLs共52例,其中腺癌30例,腺鳞癌3例,鳞癌9例,小细胞癌1例,转移瘤3例(结肠癌转移1例,肝癌转移2例),类癌2例,肉瘤样癌2例,黏液腺癌1例,黏液表皮样癌1例。良性SPLs共13例,其中慢性炎2例,肉芽肿性炎2例,机化性肺炎3例,肺隔离症1例,错构瘤2例,硬化性肺细胞瘤1例,淋巴组织样增生1例,肺良性平滑肌病变1例。
ADC的ICC为0.928(95% CI: 0.893~0.952)。恶性SPLs的ADC与细胞密度(β=-0.40, P<0.001)和黏液(β=0.77, P<0.001)独立相关,与NCR、坏死分数和病理分级无相关性(P>0.05)。良性SPLs的ADC与任一病理参数均无相关性(P>0.05),见表1。根据独立相关病理参数将本组肺癌分为鳞癌(共9例)、不含黏液腺癌(共27例)和含黏液肺癌(共5例,包括3例含黏液分泌的腺癌,1例黏液腺癌,1例黏液表皮样癌)3组,因其余类型肺癌样本数相对偏少未纳入进一步分析。ADC与不同组肺癌单个病理参数的相关性分析见表2。鳞癌(r=-0.85,P<0.01)和不含黏液腺癌(r=-0.85,P<0.01)的ADC与细胞密度呈负相关。9例鳞癌中,Ⅰ度坏死有4例,Ⅱ度坏死有3例,Ⅲ度坏死有1例,Ⅳ度坏死有1例,鳞癌的ADC与坏死分数无相关性(P>0.05);不含黏液腺癌和含黏液肺癌的坏死均为Ⅰ度。含黏液肺癌的ADC与任一病理参数均无相关性(P>0.05)。
表1 ADC与恶性及良性SPLs多种病理参数的相关性
Tab.1 Correlation between ADC and multiple histopathological parameters in malignant and benign SPLs
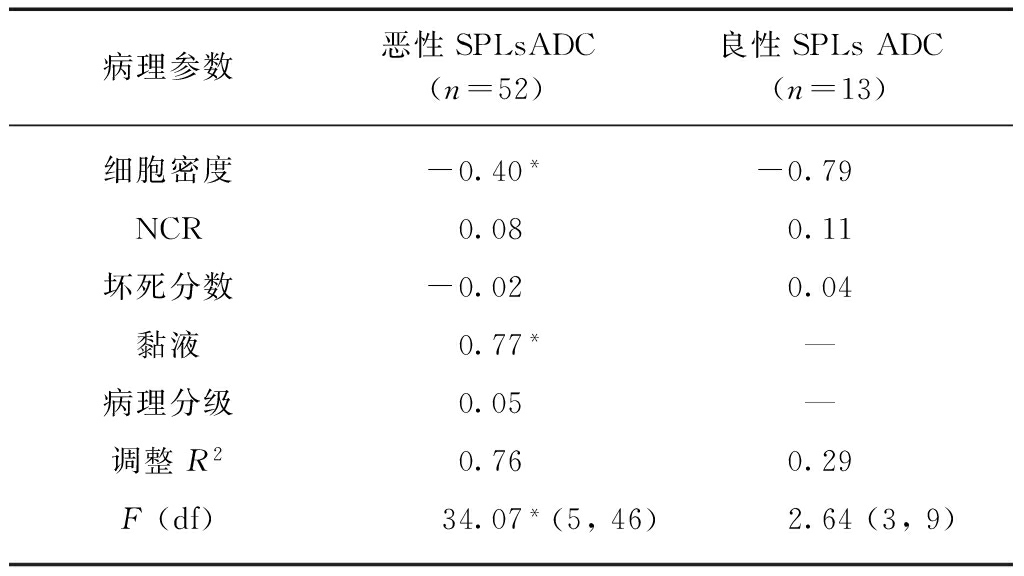
病理参数恶性SPLsADC(n=52)良性SPLsADC(n=13)细胞密度-0.40*-0.79NCR0.08 0.11坏死分数-0.02 0.04黏液0.77* —病理分级0.05 —调整R20.76 0.29F(df)34.07*(5,46) 2.64(3,9)
表中为标准系数β;*P<0.001
表2 ADC与不同组肺癌单个病理参数的相关性
Tab.2 Correlation between ADC and single histopathological parameters in different groups of malignant SPLs
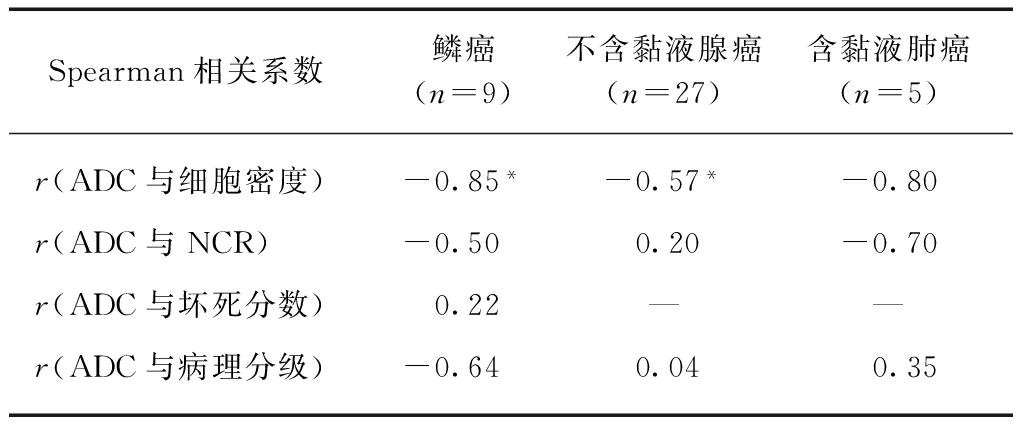
Spearman相关系数鳞癌(n=9)不含黏液腺癌(n=27)含黏液肺癌(n=5)r(ADC与细胞密度)-0.85*-0.57*-0.80r(ADC与NCR)-0.500.20-0.70r(ADC与坏死分数)0.22——r(ADC与病理分级)-0.640.040.35
*P<0.01
恶性和良性SPLs的ADC分别为(1.10±0.24)×10-3、(1.53±0.47)×10-3 mm2/s,差异有统计学意义(P<0.001)。鳞癌、不含黏液腺癌和含黏液肺癌的ADC分别为(0.98±0.11)×10-3、(1.08±0.13)×10-3、(1.69±0.18×10-3) mm2/s,两两间差异均有统计学意义(P<0.05)。当ADC阈值为1.21×10-3 mm2/s时,对SPLs的定性诊断价值最高,ROC曲线下面积(the area under the ROC curve, AUC)为0.817,灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为80.8%、77.0%、80.0%(52/65)、93.3%、50.0%;且对鳞癌、不含黏液腺癌和含黏液肺癌定性诊断准确率分别为100%(9/9)、82%(22/27)、0%(0/5)。鳞癌、不含黏液腺癌和含黏液肺癌的细胞密度分别为373±109、287±51、275±87(每×400高倍视野),其中仅鳞癌与不含黏液腺癌的细胞密度差异有统计学意义(P<0.001),见表3。代表病例见图1~3。
表3 ADC对不同组肺癌的定性诊断价值
Tab.3 Qualitative diagnosis value of ADC in different groups of malignant SPLs
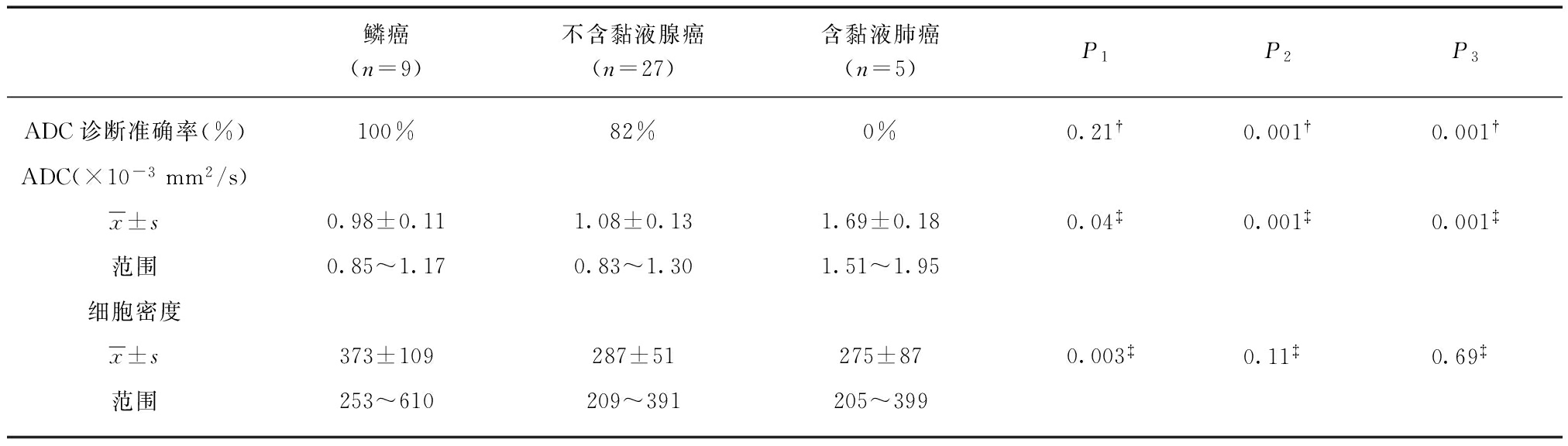
鳞癌(n=9)不含黏液腺癌(n=27)含黏液肺癌(n=5)P1P2P3ADC诊断准确率(%)100%82%0%0.21†0.001†0.001†ADC(×10-3mm2/s)x±s0.98±0.111.08±0.131.69±0.180.04‡0.001‡0.001‡范围0.85~1.170.83~1.301.51~1.95细胞密度x±s373±109287±51275±870.003‡0.11‡0.69‡范围253~610209~391205~399
†: χ2检验, : t检验;P1: 鳞癌与不含黏液腺癌比较;P2: 鳞癌与含黏液腺癌比较;P3: 不含黏液腺癌与含黏液腺癌比较
: t检验;P1: 鳞癌与不含黏液腺癌比较;P2: 鳞癌与含黏液腺癌比较;P3: 不含黏液腺癌与含黏液腺癌比较
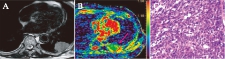
图1 左肺下叶鳞癌Ⅲ级
Fig.1 Squamous cell carcinoma in the left lower lobe, grade Ⅲ
患者,男,80岁;A: T2WI图;B: ADC彩图,病灶(箭头示)平均ADC为0.96×10-3 mm2/s,将其诊断为恶性;C: 病理图(H-E染色,×400倍),细胞密度为401,不含黏液成分
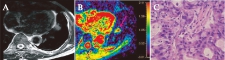
图2 左肺下叶黏液腺癌
Fig.2 Mucoepidermoid carcinoma in the left lower lobe
患者,男,55岁;A: T2WI图;B: ADC彩图,病灶(箭头示)平均ADC为1.95×10-3 mm2/s,将其误判为良性;C: 病理图(H-E染色,×400倍),细胞密度为205,含黏液成分
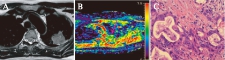
图3 左肺上叶腺癌Ⅱ级
Fig.3 Adenocarcinoma in the left upper lobe, grade Ⅲ
患者,女,33岁;A: T2WI图;B: ADC彩图,病灶(箭头示)平均ADC为1.05×10-3 mm2/s,将其诊断为恶性;C: 病理图(H-E染色,×400倍),细胞密度为290,不含黏液成分
肺癌在恶性肿瘤中发病率及致死率较高,早期准确定性诊断SPLs是影像学检查的重要目的。近年来,高场强MRI、呼吸门控的应用及快速成像技术的发展,进一步提高了肺病灶的DWI成像质量。本研究组内ICC较大,所以ADC测量具有较高的可靠性。本研究从组织病理方面探讨了SPLs ADC的相关影响因素,分析了ADC对SPLs的定性诊断价值,并从肺癌组织病理特征方面加以解释其定性诊断价值。
本研究结果表明,肺癌的ADC与细胞密度独立负相关,而与NCR无相关性。Matoba等[8]和Liu[9]等的研究认为肺癌的ADC与细胞密度呈负相关性,这与本研究结果基本一致。除了肺癌,关于其他肿瘤[13-14]和体外培养细胞[15]的研究也发现ADC与细胞密度负相关。生物组织水分子扩散运动的影响因素复杂,主要取决于细胞外和细胞内间隙比,这可通过细胞密度和NCR值大小来反映。细胞密度增加导致细胞外间隙变小,细胞外水分子扩散运动受限,ADC减小。因为细胞核内水分子扩散系数高于细胞质,故NCR增高会导致细胞内水分子扩散运动增加[16],ADC增大。而往往病理上高NCR的肿瘤细胞外间隙较小,总体表现为水分子扩散运动受限,ADC减小。本研究同时分析了ADC与细胞密度和NCR的相关性,结果显示细胞密度独立影响ADC,原因主要为细胞外间隙所占比例对ADC的影响作用大于细胞内间隙所占比例。
本研究发现肺癌内出现黏液成分是ADC的另一独立相关病理参数,ADC对含黏液肺癌的定性诊断准确性不足。研究[17]发现,6例黏液腺癌的ADC[(1.95±0.30)×10-3 mm2/s]明显高于137例其他类型肺癌的ADC[(1.24±0.31)×10-3 mm2/s](P<0.05),以1.44×10-3 mm2/s作为鉴别诊断阈值时,ADC对黏液腺癌的诊断准确率为0%。上述样本量相对较多的研究与本研究结果相符,本研究发现5例含黏液肺癌的ADC[(1.69±0.18)×10-3 mm2/s]明显高于9例鳞癌[(0.98±0.11)×10-3 mm2/s](P<0.05)和27例不含黏液腺癌的ADC[(1.08±0.13)×10-3 mm2/s](P<0.05)。当以1.21×10-3 mm2/s作为鉴别诊断阈值时,ADC对含黏液肺癌的诊断准确率为0%。这可能因为肿瘤内出现黏液成分导致水分子增多、扩散运动增加,进而ADC明显增大。
本研究表明,肺癌的ADC与小灶性分布坏死无相关性。黑素瘤动物研究[13]通过构建两种坏死模型探究ADC与坏死的相关性,一种模型为坏死呈小灶性(约1mm×1mm)散在分布于活性肿瘤组织内,其在ADC图上难以体现且与ADC无相关性,这与本研究结果一致。在本研究中,9例鳞癌的平均ADC明显低于不含黏液腺癌和黏液肺癌,其中8例鳞癌的坏死呈小灶性分布,这可能因为小灶性坏死小于DWI分辨率而易受部分容积效应影响。另一种模型为坏死呈小片性分布,其在ADC图上可以体现且与ADC呈正相关,这与既往关于前列腺癌与鳞癌的动物研究[18-19]结果相符,可能因为小片性坏死导致肿瘤细胞密度减少,水分子扩散运动增加。本研究表明肺癌的ADC与病理分级无相关性,这与既往研究[8-9]结果不符。Liu等[9]研究显示肺癌的病理分级与细胞密度存在相关性,这说明病理分级可能是影响ADC的一项间接因素。
本研究认为ADC有助于SPLs的定性诊断,对肺鳞癌的定性诊断准确性较高,对低细胞密度腺癌的定性诊断准确性不足。有研究[10]表明ADC对SPLs具有定性诊断价值,这与本研究结果相符。大部分肺鳞癌呈实体状、片状紧密排列,细胞密度较高,ADC较小,故对SPLs定性诊断准确性较高。肺腺癌病理结构多样[20],部分肺腺癌呈腺泡状、管状或者微乳头状排列,细胞相对实性结构腺癌稀疏,ADC较大,故对SPLs定性诊断准确性不足。
本研究存在一些局限性。首先良性SPLs和部分类型恶性SPLs(鳞癌和小细胞癌)的样本总数相对较少,可能对结果造成一定程度的影响;其次,难以保证ADC图的ROI位置与病理切片观察位置一一对应。今后还需扩大样本量,探讨多种MRI功能成像联合应用对SPLs的诊断价值。总之,肺癌的ADC与细胞密度和黏液独立相关。ADC有助于SPLs的定性诊断,对肺鳞癌的定性诊断准确性较高,对低细胞密度腺癌及含黏液肺癌的定性诊断准确性不足。
【参考文献】
[1] ERASMUS J J, CONNOLLY J E, MCADAMS H P, et al.Solitary pulmonary nodules: PartⅠ. Morphologic evaluation for differentiation of benign and malignant lesions[J]. Radiographics, 2000,20(1): 43-58.
[2] KIM J H, KIM H J, LEE K H, et al. Solitary pulmonarynodules: a comparative study evaluated with contrast-enhanced dynamic MR imaging and CT[J]. J Comput Assist Tomogr, 2004,28(6): 766-775.
[3] JEONG Y J, Lee K S, JEONG S Y, et al.Solitary pulmonary nodule: characterization with combined wash-in and washout features at dynamic multi-detector row CT[J]. Radiology, 2005,237(2): 675-683.
[4] GOULD M K, MACLEAN C C, KUSCHNER W G, et al. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions[J]. JAMA, 2001,285(7): 914-924.
[5] CHERAN S K, NIELSEN N D, PATZ E F JR. False-negative findings for primary lung tumors on FDG positron emission tomography: staging and prognostic implications[J]. AJR Am J Roentgenol, 2004,182(5): 1129-1132.
[6] SHIM S S, LEE K S, KIM B T, et al. Focal parenchymal lung lesions showing a potential of false-positive and false-negative interpretations on integrated PET/CT[J]. AJR Am J Roentgenol, 2006,186(3): 639-648.
[7] LE BIHAN D, BRETON E, LALLEMAND D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology, 1988,168(2): 497-505.
[8] MATOBA M, TONAMI H, KONDOU T, et al. Lung carcinoma: diffusion-weighted mr imaging-preliminary evaluation with apparent diffusion coefficient[J]. Radiology, 2007,243(2): 570-577.
[9] LIU H, LIU Y, YU T, et al. Evaluation of apparent diffusion coefficient associated with pathological grade of lung carcinoma, before therapy[J]. J Magn Reson Imaging, 2015,42(3): 595-601.
[10] HENZ CONCATTO N, WATTE G, MARCHIORI E, et al. Magnetic resonance imaging of pulmonary nodules: accuracy in a granulomatous disease-endemic region[J]. Eur Radiol, 2016,26(9): 2915-2920.
[11] SHEN G, JIA Z, DENG H. Apparent diffusion coefficient values of diffusion-weighted imaging for distinguishing focal pulmonary lesions and characterizing the subtype of lung cancer: a meta-analysis[J]. Eur Radiol, 2016,26(2): 556-566.
[12] GUO A C, CUMMINGS T J, DASH R C, et al. Lymphomas and high-grade astrocytomas: comparison of water diffusibility and histologic characteristics[J]. Radiology, 2002,224(1): 177-183.
[13] LYNG H, HARALDSETH O, ROFSTAD E K. Measurement of cell density and necrotic fraction in human melanoma xenografts by diffusion weighted magnetic resonance imaging[J]. Magn Reson Med, 2000,43(6): 828-836.
[14] SUROV A, GOTTSCHLING S, MAWRIN C, et al. Diffusion-weighted imaging in meningioma: prediction of tumor grade and association with histopathological parameters[J]. Transl Oncol, 2015,8(6): 517-523.
[15] MATSUMOTO Y, KURODA M, MATSUYA R, et al. In vitro experimental study of the relationship between the apparent diffusion coefficient and changes in cellularity and cell morphology[J]. Oncol Rep, 2009,22(3): 641-648.
[16] HSU E W, AIKEN N R, BLACKBAND S J. Nuclear magnetic resonance microscopy of single neurons under hypotonic perturbation[J]. Am J Physiol, 1996,271(6 Pt 1): C1895-C1900.
[17] USUDA K, SAGAWA M, MOTONO N, et al. Diagnostic performance of diffusion weighted imaging of malignant and benign pulmonary nodules and masses: comparison with positron emission tomography[J]. Asian Pac J Cancer Prev, 2014,15(11): 4629-4635.
[18] HERNETH A M, GUCCIONE S, BEDNARSKI M. Apparent diffusion coefficient: a quantitative parameter for in vivo tumor characterization[J]. Eur J Radiol, 2003,45(3): 208-213.
[19] JUNG D C, LEE H J, SEO J W, et al. Diffusion-weighted imaging of a prostate cancer xenograft model seen on a 7 Tesla animal MR scanner: comparison of ADC values and pathologic findings[J]. Korean J Radiol, 2012,13(1): 82-89.
[20] ÇAKIR, Ç, GENÇHELLAÇ H, TEMIZÖZ O, et al. Diffusion weighted magnetic resonance imaging for the characterization of solitary pulmonary lesions[J].Balkan Med J, 2015,32(4): 403-409.
【Abstract】 Objective To investigate the correlation of apparent diffusion coefficient (ADC) value with histopathological parameters in solitary pulmonary lesions (SPLs) and its diagnostic value. Methods Sixty-five patients with SPLs undergoing MR diffusion weighted imaging (DWI) examination and receiving surgical treatment were enrolled in the study. Multiple histopathological parameters including cell density, nuclear-to-cytoplasm ratio, necrotic fraction, presence of mucus and grade of differentiation were quantified. The correlation of ADC values with histopathological parameters was analyzed by multiple linear regression in malignant and benign SPLs, The qualitative diagnosis value of ADC in SPLs was evaluated by receiver operating characteristic curve (ROC). Results Cell density (β=-0.40, P<0.001) and presence of mucus (β=0.77, P<0.001) were independently correlated with ADC value in malignant SPLs. There was no significant correlation between histopathological parameters and ADC values in benign SPLs. ADC value of malignant and benign SPLs was(1.10±0.24)×10-3 and(1.53±0.47)×10-3 mm2/s,respectively (P<0.001). ADC value of squamous carcinomas, adenocarcinomas without mucus and malignant tumors with mucus were (0.98±0.11)×10-3, (1.08±0.13)×10-3and (1.69±0.18)×10-3 mm2/s, respectively (P<0.05). At optimal cut-off value of 1.21×10-3 mm2/s, ADC value could best distinguish malignant and benign SPLs with sensitivity of 80.8% and specificity of 77%; and the accurate diagnosis rate of squamous carcinomas, adenocarcinomas without mucus and malignant tumors with mucus were 100.0% (9/9), 82.0% (22/27) and 0% (0/5), respectively. The cell density of squamous carcinomas, adenocarcinomas without mucus and malignant tumors with mucus were 373±109, 287±51 and 275±87 (×400 high power field of vision), respectively; the significant difference was found between squamous cell carcinoma and adenocarcinomas without mucus (P<0.001). Conclusion ADC value is independently correlated with cell density and presence of mucus in malignant SPLs. Squamous carcinoma may be more accurately diagnosed as malignancy by ADC value than adenocarcinomas with low cell density and malignant tumors with mucus.
【Key words】 solitary pulmonary lesion; diffusion weighted imaging; apparent diffusion coefficient; histopathology parameters; correlation analysis; qualitative diagnosis
doi: 10.16118/j.1008-0392.2017.05.010
收稿日期: 2017-05-19
基金项目: 国家自然科学基金(81571670);上海市科委项目(14411968100)
【中图分类号】 R 445
【文献标志码】 A
【文章编号】 1008-0392(2017)05-0046-06