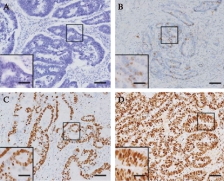
图1 结肠癌组织标本HMGA2免疫组织化学染色
Fig.1 HMGA2 expression in colon cancer tissues(immunohistochemistry)
A.阴性;B.弱阳性;C.阳性;D.强阳性;图中标尺为200μm;小方框内标尺为100μm
·基础研究·
【摘要】 目的 探讨高迁移率族蛋白A2(high mobility group AT-hook 2, HMGA2)在结肠癌组织的表达及意义。方法 选取2011年5月至2012年12月接受手术治疗的114例结肠癌患者,采用免疫组化法检测114例结肠癌组织及45例癌旁组织中HMGA2的表达,分析其与临床病理参数及患者生存预后的关系。结果 在114例结肠癌组织中,HMGA2阳性表达率(89.5%,102/114)明显高于癌旁组织(6.7%,3/45)(P<0.001);HMGA2表达与结肠癌患者年龄、性别、肿瘤大小、肿瘤浸润深度无相关性(P>0.05),与组织学分级(P<0.001)、淋巴结转移(P<0.001)、远处转移(P<0.001)和TNM分期(P=0.014)相关。HMGA2低表达组总体生存率(75.0%)高于HMGA2高表达组(44.6%)(χ2=5.736,P=0.017)。结论 HMGA2可能在结肠癌发生发展过程中起到重要作用,它与结肠癌的侵袭、转移和预后相关,HMGA2的表达检测可作为判断结肠癌患者预后的一种方法。
【关键词】 结肠癌; 转移; 高迁移率族蛋白A2
结肠癌是人类较为常见的恶性肿瘤之一。在中国,其发病率在各种恶性肿瘤疾病中占第3位,其死亡率占第5位,且发病人数及死亡人数有逐年上升的趋势。进一步探索研究新的基因功能与结肠癌发生、发展及其转移的关系,对揭示其发生、发展的具体分子机制、设计合理的治疗药物及判断预后具有重要意义。
高迁移率族蛋白A2(high mobility group AT-hook 2, HMGA2)是高迁移率蛋白家族的一员,在多种恶性肿瘤中表达上调,并可作为多种恶性肿瘤预后指标之一。在肺癌、卵巢癌、口腔鳞状上皮癌和乳腺癌中,HMGA2表达常常与肿瘤的高级别组织学分级相关,并与肿瘤早期复发和较低的总体生存率相关[1-2];在一项横向调查研究[3]中,HMGA2表达与结肠癌Dukes分期和转移相关。对于结肠癌,有文献报道HMGA1蛋白表达与肿瘤进展早期具有相关性,但对于HMGA2蛋白表达与结肠癌临床病理和预后方面的研究不是很多。本研究检测结肠癌患者临床标本中HMGA2的表达水平,分析HMGA2表达与结肠癌患者年龄、性别、肿瘤大小、组织学分级、肿瘤浸润深度、淋巴结转移、远处转移和TNM分期等临床病理参数的关系,并探讨HMGA2表达水平对结肠癌手术患者预后的影响。
经医院伦理委员会的批准,选取2011年5月至2012年10月同济大学附属东方院胃肠外科住院接受手术治疗的114例结肠癌患者,所有纳入研究的患者临床病理资料完整,术前未行放射治疗、化学药物治疗及免疫治疗,全部标本均经本院病理科确诊为结肠腺癌,其中男性65例,女性49例;年龄27~85岁,中位年龄63岁;高分化24例,中分化31例,低分化59例;肿瘤<5cm 者72例,≥5cm 者42例;T1~T2期76例,T3~T4期38例;有淋巴结转移39例,无淋巴结转移75例;远处转移者31例,无远处转移者83例;TNM分期Ⅰ~Ⅱ期者69例,Ⅲ~Ⅳ期者45例。
兔抗人HMGA2多克隆抗体购自美国Abcam公司;取材: 选取癌旁正常结肠组织(距结肠癌肿瘤组织5cm以上)45例作为对照组,标本经10%福尔马林溶液固定、石蜡包埋、4μm连续切片,每例病理切片均由2位高年资病理诊断医师确诊。结肠癌临床标本HMGA2蛋白表达结果判定采用染色阳性细胞比例和染色强度双重评分标准[4]。
结果判断: 细胞核染色呈棕黄色为阳性细胞,染色阳性细胞比例等级评分标准为: 每5个高倍镜视野,≤5%(0分);6%~25%(1分);26%~50%(2分);51%~75%(3分);>75%(4分);染色强度等级评分标准为: 无色(0分);黄色(1分);棕黄色(2分);棕褐色(3分)。将染色比例和染色强度评分相加,分为4组: 阴性(0分)、弱阳性(1~2分)、阳性(3~4分)、强阳性(5~7分),其中阴性和弱阳性为低表达,阳性和强阳性为高表达。每个组织切片均经过两名高年资病理诊断医师在双盲情况下独立进行评分,如出现评分分歧,则经过讨论后重新进行评分。
以患者接受结肠癌手术时间作为术后生存起始时间进行随访,大部分术后患者采用电话随访方式,少数患者通过门诊方式进行随访,随访内容主要包括术后肿瘤是否复发、复发时间、部位、肿瘤标志物和影像学检查、带瘤存活时间、复发后是否接受治疗和相关治疗措施,若患者死亡,则记录死亡时间、原因和患者总体生存时间。随访时间为5~69个月,中位随访时间为51个月,随访截止日期为2017年1月31日。随访率为100%,其中死亡51例。
所有数据均应用SPSS 17.0统计软件进行分析,采用χ2检验或Fisher确切概率法检验HMGA2蛋白表达水平高低与结肠癌患者各项临床病理参数之间的关系;采用单因素回归分析和Cox风险比例模型多因素回归分析评价结肠癌患者的预后;应用Kaplan-Meier方法计算结肠癌患者总体生存率,不同总体生存率之间的比较采用log-rank假设检验。P<0.05为差异具有统计学意义。
HMGA2在结肠癌旁组织细胞中未见明显阳性染色,几乎不表达HMGA2,HMGA2阳性表达率为6.7%(3/45);而在结肠癌组织细胞核中可见HMGA2表达,呈棕黄色或棕褐色,HMGA2蛋白在结肠癌组织中的阳性表达率为89.5%(102/114),见图1;结肠癌组织细胞核中HMGA2表达高于癌旁组织(P<0.001)。

图1 结肠癌组织标本HMGA2免疫组织化学染色
Fig.1 HMGA2 expression in colon cancer tissues(immunohistochemistry)
A.阴性;B.弱阳性;C.阳性;D.强阳性;图中标尺为200μm;小方框内标尺为100μm
114例结肠癌组织标本中,74例呈高表达(64.9%,74/114),40例为低表达(35.1%,40/114)。对2组结肠癌患者的多项临床病理参数进行比较,发现HMGA2高表达与组织学分级、淋巴结转移、远处转移和TNM分期相关,见表1。HMGA2在高中分化的结肠癌组织中高表达阳性率(40.0%)低于低分化结肠癌组织(88.1%)(P<0.001);在淋巴结转移阴性的结肠癌组织中高表达阳性率为(52.0%)低于淋巴结转移阳性的结肠癌组织(89.7%)(P<0.001);在未发生远处转移的结肠癌组织中高表达阳性率为(27.7%)低于远处转移阳性的结肠癌组织(71.0%),两者间差异有统计学意义(P<0.001);在TNM分期Ⅰ期和Ⅱ期结肠癌组织HMGA2过表达阳性率(55.4%)低于Ⅲ期和Ⅳ期(77.6%)。HMGA2表达与结肠癌患者年龄、性别、肿瘤大小、肿瘤浸润深度无相关性(P>0.05)。
表1 HMGA2表达与结肠癌各项临床病理参数之间的关系
Tab.1 Correlations of HMGA2 expression with clinicopathological characteristics of colon cancer patients
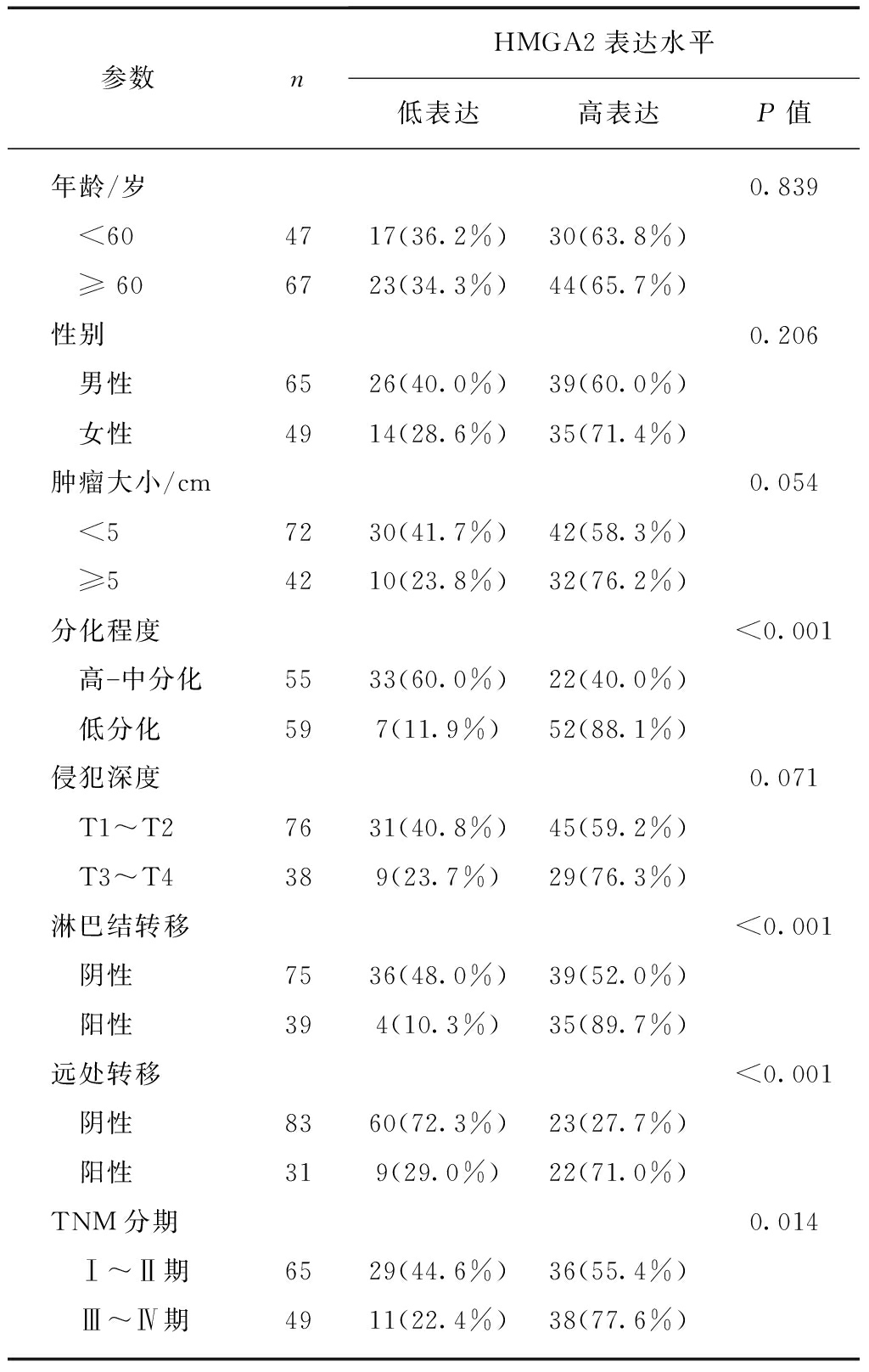
参数nHMGA2表达水平低表达高表达P值年龄/岁0.839 <604717(36.2%)30(63.8%) ≥606723(34.3%)44(65.7%)性别0.206 男性6526(40.0%)39(60.0%) 女性4914(28.6%)35(71.4%)肿瘤大小/cm0.054 <57230(41.7%)42(58.3%) ≥54210(23.8%)32(76.2%)分化程度<0.001 高中分化5533(60.0%)22(40.0%) 低分化597(11.9%)52(88.1%)侵犯深度0.071 T1~T27631(40.8%)45(59.2%) T3~T4389(23.7%)29(76.3%)淋巴结转移<0.001 阴性7536(48.0%)39(52.0%) 阳性394(10.3%)35(89.7%)远处转移<0.001 阴性8360(72.3%)23(27.7%) 阳性319(29.0%)22(71.0%)TNM分期0.014 Ⅰ~Ⅱ期6529(44.6%)36(55.4%) Ⅲ~Ⅳ期4911(22.4%)38(77.6%)
HMGA2低表达组平均生存时间为(58.49±3.87)个月,总体生存率为75.0%,HMGA2高表达组平均生存时间为(37.82±5.22)个月,总体生存率为44.6%。与HMGA2低表达组相比,HMGA2高表达组生存时间明显缩短(χ2=5.736,P=0.017),见图2。
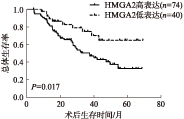
图2 HMGA2高表达组和低表达组结肠癌患者术后生存曲线比较
Fig.2 Survival curves of colon cancer patients with low and high HMGA2 expression
单因素回归分析结果表明,组织学分级(P=0.038)、淋巴结转移(P=0.011)、远处转移(P=0.042)、TNM分期(P=0.015)和HMGA2表达水平(P=0.017)与结肠癌患者总体生存时间相关,见表2。将上述各因素列入多因素回归模型进行分析,HMGA2过表达患者生存时间缩短的风险较低表达组患者生存时间缩短的风险增加近3倍,两者差异有统计学意义(HR: 2.855, 95%CI: 1.390~5.864,P=0.004)。此结果表明: HMGA2表达水平是影响结肠癌患者术后总体生存的独立预后因子;此外,淋巴结转移情况也是影响结肠癌患者术后总体生存的独立预后因子(HR: 2.129, 95%CI: 1.136~3.988, P=0.018)。
表2 结肠癌患者单因素和多因素回归分析结果
Tab.2 Univairate and multivariate regression analyses of factors related to survival time of patients with colon cancer
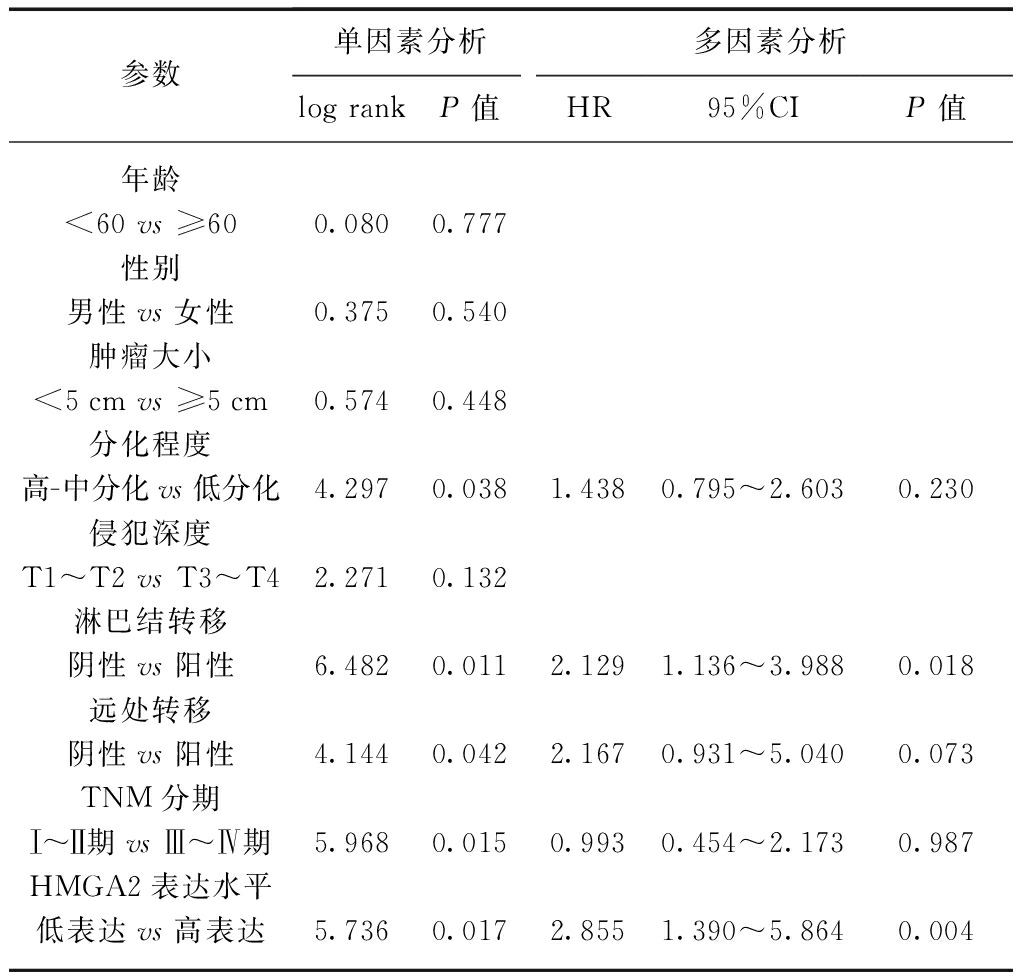
参数单因素分析多因素分析logrankP值HR95%CIP值年龄<60vs≥600.0800.777性别男性vs女性0.3750.540肿瘤大小<5cmvs≥5cm0.5740.448分化程度高-中分化vs低分化4.2970.0381.4380.795~2.6030.230侵犯深度T1~T2vsT3~T42.2710.132淋巴结转移阴性vs阳性6.4820.0112.1291.136~3.9880.018远处转移阴性vs阳性4.1440.0422.1670.931~5.0400.073TNM分期Ⅰ~Ⅱ期vsⅢ~Ⅳ期5.9680.0150.9930.454~2.1730.987HMGA2表达水平低表达vs高表达5.7360.0172.8551.390~5.8640.004
结肠癌是消化系统常见的恶性肿瘤之一,早期结肠癌的5年生存率高达90%;如果有局部淋巴结转移,5年生存率为65%;若发生肺、骨、肝等远处转移时,5年生存率将低于10%[5]。目前,随着分子生物学技术的发展,新的肿瘤分子治疗靶点和肿瘤标志物不断涌现,结肠癌患者的5年生存率以较前大大改观,但每年仍有一部分患者死于肿瘤复发和转移。因此,寻找与结肠癌复发与转移相关的肿瘤分子标志物并研究其在结肠癌发生发展过程中的具体分子机制,对探明结肠癌侵袭转移机制、改进基因靶向治疗和改善结肠癌患者预后具有重要的意义。
HMGA2在多种恶性肿瘤中表达上调[6]。在本研究中,结肠癌旁组织中HMGA2阳性表达率为6.7%(3/45),而结肠癌组织细胞中的HMGA2阳性表达率明显升高,为89.5%(102/114),两者间的差异有统计学意义(P<0.001),这一研究结论与前述所提的研究结果一致。
在肿瘤组织中,HMGA2表达与肿瘤组织学分级具有明显相关性,在一项乳腺癌临床研究中,HMGA2表达与乳腺癌高级别组织学分级相关。在口腔鳞状上皮癌中,HMGA2表达上调与肿瘤淋巴结转移和远处转移具有相关性。Berlingieri等[7]发现,在大鼠甲状腺转化癌细胞中,HMGA2表达水平与恶性程度较高的肿瘤表型相关。Motoyama等[8]发现,在胃癌中,HMGA2表达与胃癌浆膜侵犯具有相关性。在本研究中,HMGA2表达上调与组织学分级、淋巴结转移、远处转移和TNM分期具有相关性。此结果表明,HMGA2可能与结肠癌术后复发、侵袭和远处转移等恶性病理学特征相关,因此,进一步研究HMGA2分子表达在结肠癌细胞中的具体生物学作用和分子机制显得尤为重要。
HMGA2过表达可作为多种恶性肿瘤的预后指标之一。本研究将组织学分级、淋巴结转移、远处转移、TNM分期和HMGA2表达等与结肠癌患者总体生存时间相隔的因素列入多因素回归模型进行分析,HMGA2过表达患者生存时间缩短的风险较低表达组患者生存时间缩短的风险增加近3倍,此结果表明HMGA2表达水平是影响结肠癌患者术后总体生存的独立预后因子,结合HMGA2过表达与结肠癌侵袭、转移等恶性特征具有相关性,推测HMGA2过表达可能导致结肠癌患者预后较差,术后生存时间较短。Sarhadi等[9]分析了49例肺腺癌患者的预后情况,结果表明,与HMGA2阴性表达患者相比,HMGA2中度表达与过表达组患者预后较差,总体生存时间短。Shell等[10]对100例卵巢癌患者的HMGA2表达水平进行研究,并分析HMGA2高表达组和低表达组卵巢癌患者的预后情况,结果表明,HMGA2高表达组患者的无病生存期和总体生存期均较HMGA2低表达组缩短,HMGA2高表达组卵巢癌患者预后较差,可作为卵巢癌患者的独立预后因子,其预后价值大于传统肿瘤标志物E-cadherin、vimentin和Snail。Motoyama等[8]利用RT-PCR技术对110例胃癌组织的HMGA2 mRNA水平进行检测,并通过Cox风险比例回归模型对胃癌患者预后进行分析,结果表明HMGA2过表达、淋巴结转移和腹膜侵袭是胃癌患者的独立预后因子,HMGA2过表达胃癌患者的总体生存期较短。上述研究结果与本研究结论基本一致。
综上所述,HMGA2在结肠癌组织中表达上调,HMGA2表达水平与结肠癌肿瘤组织学分级、淋巴结转移、远处转移和TNM分期具有相关性,且HMGA2水平可作为评估结肠癌手术患者的独立预后因子,提示HMGA2可能在结肠癌发生发展过程中起到重要作用,进一步研究HMGA2在结肠癌细胞增殖、迁移侵袭和转移等恶性生物学特征中的作用和分子机制,对丰富结肠癌发病机制和寻找潜在基因治疗靶点具有重要意义。
【参考文献】
[1] MIYAZAWA J, MITORO A, KAWASHIRI S, et al. Expression of mesenchyme-specific gene HMGA2 in squamous cell carcinomas of the oral cavity[J]. Cancer Res, 2004,64(6): 2024-2029.
[2] 杨垒,杨永志,秦环龙.大肠癌和癌旁组织中具核梭杆菌丰度差异的研究[J].同济大学学报(医学版),2015,36(5): 34-38.
[3] HUANG M L, CHEN C C, CHANG L C. Gene expressions of HMGI-C and HMGI(Y) are associated with stage and metastasis in colorectal cancer[J]. Int J Colorectal Dis, 2009,24(11): 1281-1286.
[4] TSAI H L, YEH Y S, CHANG Y T, et al. Co-existence of cyclin D1 and vascular endothelial growth factor protein expression is a poor prognostic factor for UICC stage Ⅰ-Ⅲ colorectal cancer patients after curative resection[J]. J Surg Oncol, 2013,107(2): 148-154.
[5] MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016,66(4): 271-289.
[6] FUSCO A, FEDELE M. Roles of HMGA proteins in cancer[J]. Nat Rev Cancer, 2007,7(12): 899-910.
[7] BERLINGIERI M T, MANFIOLETTI G, SANTORO M, et al. Inhibition of HMGI-C protein synthesis suppresses retrovirally induced neoplastic transformation of rat thyroid cells[J]. Mol Cell Biol, 1995,15(3): 1545-1553.
[8] MOTOYAMA K, INOUE H, NAKAMURA Y, et al. Clinical significance of high mobility group A2 in human gastric cancer and its relationship to let-7 microRNA family[J]. Clin Cancer Res, 2008,14(8): 2334-2340.
[9] SARHADI V K, WIKMAN H, SALMENKIVI K, et al. Increased expression of high mobility group A proteins in lung cancer[J]. J Pathol, 2006,209(2): 206-212.
[10] SHELL S, PARK S M, RADJABI A R, et al. Let-7 expression defines two differentiation stages of cancer[J]. Proc Natl Acad Sci USA, 2007,104(27): 11400-11405.
【Abstract】 Objective To investigate the expression of HMGA2 protein in colon cancer and its clinical significance. Methods HMGA2 expression was detected by immunohistochemistry in 114 samples of cancer tissues and 45 samples of pericancerous colon tissues from patients with colon cancer treated from May 2011 to December 2012. The correlation of HMGA2 expression with clinicopathological features of patients was analyzed. Results The expression rate of HMGA2 in tumor tissues (89.5%,102/114) was significant higher than that in pericancerous tissues (6.7%,3/45) (P<0.001). There was no correlation of HMGA2 expression with age, sex, tumor size, and tumor invasion depth in colon cancer. HMGA2 expression was significantly correlated with histologic grade(P<0.001), lymph node metastasis (P<0.001), distant metastasis (P<0.001)and TNM stage (P<0.014). Kaplan-Meier analysis showed significant difference in survival rates between groups with high and low HMGA2 expression (44.6% vs.75.0%, χ2=5.736, P=0.017). Conclusion Expression of HMGA2 may be involved in the invasiveness of colon cancer playing an important role in tumor development and progression. HMGA2 expression might be a useful marker of poor prognosis in colon cancer.
【Key words】 colon cancer; metastasis; high mobility group AT-hook 2
doi: 10.16118/j.1008-0392.2017.05.006
收稿日期: 2017-04-20
基金项目: 上海市浦东新区卫计委青年科技项目(PW2014B-8)
【中图分类号】 R 735.3
【文献标志码】 A
【文章编号】 1008-0392(2017)05-0028-05