表1 研究中所用样品相关信息表
Tab.1 the information of samplesin the research

样品代数来源者年龄/岁ASCsP823BMSCsP736DPSCsP921UCDSCsP830
·基础研究·
【摘要】 目的 培养脂肪、骨髓、牙髓及脐带4种不同来源的间充质干细胞,并鉴定其线粒体结构和活性。方法 通过流式细胞术、透射电子显微镜及细胞代谢分析仪等技术分别检测各种间充质干细胞的纯度、内部线粒体的超微结构及呼吸耗氧量。结果 脂肪、骨髓、牙髓及脐带4种间充质细胞均成纤维状贴壁生长,同时表达CD73、CD90及CD105,不表达CD34、CD11b、CD19、CD45及HLA-DR;ASC与BMSC较DPSC与UCDSC线粒体结构成熟,代谢水平高。结论 脂肪、骨髓、牙髓及脐带来源的细胞均具有间充质干细胞的特点,但其线粒体结构和活性等方面存在差异。
【关键词】 间充质干细胞; 细胞培养; 结构; 活性
间充质干细胞(mesenchymal stem cells, MSCs)是一类中胚层来源的、具有自我更新和分化能力的多能干细胞,已广泛用于临床治疗[1]。研究[2]表明: MSCs可以作为载体工具转移自身功能性线粒体进入损伤细胞,进而修复其能量代谢缺陷,为线粒体异常引起的相关疾病提供新方向。MSCs广泛存在于全身多种组织中,且不同来源的MSCs的生物学特性存在差异[3],其线粒体特性亦可能存在不同。因而有必要进一步比较不同来源的MSCs线粒体生物学特性的差异,为补偿缺陷细胞线粒体的供体细胞的选取提供依据。
本研究选取4种不同组织来源的MSCs: 牙髓间充质干细胞(dental pulp stem cells, DPSCs)、骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)、脂肪间充质干细胞(adipose tissue derived stem cells, ASCs)及脐带间充质干细胞(umbilical cord derived mesenchymal stem cells, UCDSCs),从超微结构与代谢活性等方面分析线粒体生物特性的差异,结合细胞来源及功能作用讨论线粒体不同的原因,为MSCs的临床应用提供更多依据。
1.1.1 标本来源 DPSCs、BMSCs、ASCs及UCDSCs由同济大学医学院干细胞转化研究中心惠赠。样品信息见表1。
表1 研究中所用样品相关信息表
Tab.1 the information of samplesin the research

样品代数来源者年龄/岁ASCsP823BMSCsP736DPSCsP921UCDSCsP830
1.1.2 主要试剂 DMEM/F12培养基、胎牛血清、0.25%胰蛋白酶、细胞冻存液及青链霉素为Gibco公司产品;PBS购自HyClone公司;人MSCs鉴定试剂盒购自BD公司;细胞线粒体压力测定试剂盒及细胞糖酵解测定试剂盒购自Seahorse生物公司。
从液氮中取出细胞放入37℃的恒温水浴箱,1min 内解冻完毕后用完全培养基稀释,经离心洗涤后进行细胞活率检测,其余细胞加入相应培养基,置于37℃、5%CO2条件下培养。细胞静置培养1~2d 后进行换液,待细胞长成单层并且局部汇合度达到80%~90%时,0.25%胰蛋白酶消化并收获细胞,以5×104/cm2的密度接种于10cm培养皿中,培养细胞备用。
取传至第7~9代MSCs,待其生长至80%融合时进行细胞表型鉴定。除去培养液和悬浮细胞,冷PBS连续漂洗3次,弃洗液。0.25%胰蛋白酶消化后制成密度为l×107/ml(若细胞量较少也可为5×106/ml)的单细胞悬液。分成9份,分别孵育抗体: CD90、CD44、CD105、CD73、CD34、CD11b、CD19、CD45及HLA-DRD。用PBS冲洗细胞两次,制备细胞悬液用FACSCalibur流式细胞仪(BD Biosciences)检测,每管样本至少检测10000个细胞。
收集细胞沉淀并将其浸泡在2.5%戊二醛中,固定24h后,用2%锇酸固定2h,分别用50%、70%、90%和100%的丙酮脱水,每级10min,每次3次。用浸泡液(环氧树脂混合液∶纯丙酮=1∶1)于37℃中浸泡 24h。环氧树脂包埋成块24h。半薄切片后,甲苯胺蓝染色观察,超薄切片机切片后,用醋酸铀、硝酸铅双重电子染色。采用日立H-600型透射电子显微镜观察、照相。
将细胞置于Seahorse生物能量代谢监测仪的96孔板内。测量基础条件下(未加入解耦联剂)的耗氧率。然后将1.0μmol/L的线粒体抑制剂寡霉素、2.0μmol/L的线粒体解耦联剂及完全关闭线粒体呼吸链的鱼藤酮及抗霉素分别加入孔板内,进一步测量最大氧耗率。校正最终的耗氧率(OCR)和产酸率(ECAR)数值,比较ECAR与OCR,分析细胞代谢情况。
使用SPSS 18.0软件,组间比较采用t检验。P<0.05为差异有统计学意义。
相同培养条件下,4种MSCs形态均与成纤维细胞生长状态类似,呈梭形或不规则三角形贴壁生长,胞质向外伸出长短不同的突起,成螺旋状生长,见图1。相对于其余3种细胞而言,BMSCs细胞突起较多;ASCs与UCDSCs形态较其余两种形态细胞规则,突起较少。
对扩大培养的细胞使用标志性抗体鉴定。用FACS检测细胞表面标志,发现4种MSCs均表现CD90、CD105及CD73阳性表达及CD34、CD11b、CD19、CD45及HLA-DR阴性表达,见图2。所有样品均可达到较高纯度。

图1 MSCs扩大培养结果
Fig.1 The culture and proliferation of MSCs
A、B、C、D: ×40;E、F、G、H: ×100
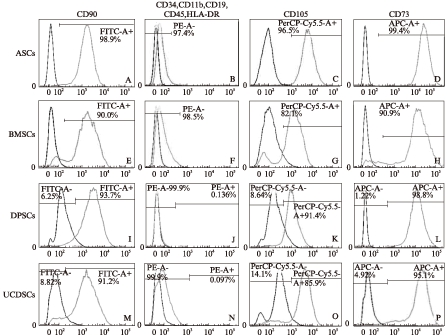
图2 MSCs流式鉴定分析结果
Fig.2 MSCs Analysis on flow cytometer
所有的MSCs都表现出相似的形态: 核呈不规则形且含有明显核仁和大量常染色质;胞质丰富,含丰富的线粒体等细胞器及大小不等的空泡;细胞表面具有很多细的伪足,见图3。与其余3种细胞相比,骨髓MSCs线粒体成嵴较多且粘连在一起;其余3种MSCs,线粒体形态相似,椭圆形结构居多,嵴长度数量适中,见表2。
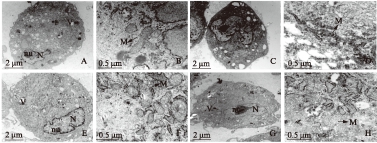
图3 MSCs线粒体超微结构观察
Fig.3 Theanalysis of mitochondrial ultrastructure from different MSCs
A: ASCs, C: BMSCs, E: DPSCs,G: UCDSCs;B、D、F、H分别来自ASCs、BMSCs、DPSCs、UCDSCs的线粒体微观结构
表2 MSCs线粒体结构观察统计结果
Tab.2 The statistics of mitochondrial morphologyin the MSCs

样品细胞数量线粒体数量主要形态结构ASCs421圆形及哑铃形结构居多,嵴数量长度适中BMSCs319基本上均表现长条状,高电子密度,嵴黏连在一起DPSCs740呈圆形或椭圆形,嵴数量少而清晰UCDSCs222同DPSCs相似,大多数为圆形或椭圆形,嵴较少
利用细胞能量代谢分析测定相同培养条件下的不同MSCs单位时间内的耗氧率与产酸率,发现ASC与BMSC表现出高耗氧状态,而DPSC中的线粒体有氧呼吸代谢率最低(P<0.01),见图4。
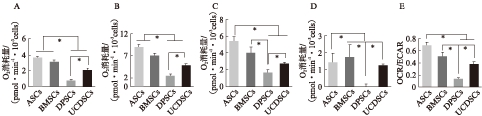
图4 不同种MSCs内线粒体呼吸耗氧率的比较
Fig.4 The comparison of mitochondrial respiratory function in different MSCs
A: 基础呼吸耗氧率;B: 最大呼吸耗氧率;C: 有氧呼吸储备;D: ATP转换;E: 不同种类MSCs代谢率比较;*P<0.01
线粒体功能缺陷造成的神经肌肉疾病、心血管病及糖尿病等多种线粒体疾病,具有易发生、难治愈和可遗传的特点,已成为当前生物医学研究领域的热点[4]。MSCs具有体外多能性和低免疫排斥及肿瘤形成率,是细胞替代治疗和组织工程的首选种子细胞[5]。MSCs的治疗潜能不仅体现在细胞替代和因子效应,也可以作为供体细胞通过隧道纳米管状结构或微泡分泌等方式转移自身线粒体至受损组织或细胞,原位调控细胞代谢功能,这为治疗线粒体疾病提供新的研究思路[6]。
由于细胞来源不同,MSCs除具有共同的鉴定标准外,其表面标记、增殖分化及免疫调节等生物学特性表现出较大差异[3,7],因此MSCs线粒体的功能和活性也可能有所不同。为了适应细胞活动的能量需求,线粒体结构在不同的生理条件下发生改变,所以线粒体的超微结构可以在一定程度上反映线粒体的功能和活性的状态。而且线粒体是细胞有氧代谢场所,细胞耗氧量及胞外产酸率可以直接代表其代谢活性。因此,本研究从线粒体的超微结构与代谢活性两个方面,比较分析不同来源的MSCs线粒体结构及活性的差异,从而揭示其与细胞功能相关性。
首先,本研究选取了供体条件与细胞代数接近且易分离得到的4种MSCs。在相同培养条件下传代培养,从而排除了不同培养条件对线粒体代谢活性的影响。通过观察细胞形态并鉴定细胞纯度发现四种细胞均符合MSCs的鉴定标准[8],可以用于线粒体的差异比较。其次,本研究利用透射电子显微镜对细胞内部的超微结构进行观察。与其余3种细胞相比,BMSCs的线粒体数量更多且结构相对成熟。BMSCs是最早被发现的一类MSCs,主要存在与骨髓基质中,通过分泌可溶性细胞因子与造血干细胞相互作用,维持体内造血功能[9]。BMSCs较成熟的线粒体结构可能与其功能相关,但具体机制尚需进一步验证。最后,本研究利用海马细胞能量代谢测定仪相对精确地测定了各种MSCs的线粒体呼吸量。相对于氧电极,细胞能量代谢测定仪可以在微环境中利用光学传感器同步地实时探测OCR和ECAR变化,从而快速检测细胞内两大能量转换途径(线粒体的有氧代谢和糖酵解)的能量代谢状态[9]。本研究发现ASCs与BMSC具有较高的有氧呼吸量,与超微结构结果相一致,这可能与其较强的细胞迁移能力相关[10]。
本研究初步探讨了相同培养条件下的4种MSCs内线粒体结构、功能和活性的差异。本研究提示,根据受体细胞线粒体状态选取合适的MSCs供体,有可能更好的修复细胞的代谢功能,这将为线粒体移植疗法的应用提供新的理论依据。
【参考文献】
[1] HSU Y C, WU Y T, Y U TH, et al. Mitochondria in mesenchymal stem cell biology and cell therapy: from cellular differentiation to mitochondrial transfer[J]. Semin Cell Dev Biol, 2016,52: 119-131.
[2] JIANG D, GAO F, ZHANG Y, et al. Mitochondrial transfer of mesenchymal stem cells effectively protects corneal epithelial cells from mitochondrial damage[J]. Cell Death Dis, 2016,7(11): e2467.
[3] LI C Y, WU X Y, TONG J B, et al. Comparative analysis of human mesenchymal stem cells from bone marrow and adipose tissue under xeno-free conditions for cell therapy[J]. Stem Cell Res Ther, 2015,6: 55.
[4] NUNNARI J, SUOMALAINEN A. Mitochondria: in sickness and in health[J]. Cell, 2012,148(6): 1145-1159.
[5] KASSEM M, ABDALLAH B M. Human bone-marrow-derived mesenchymal stem cells: biological characteristics and potential role in therapy of degenerative diseases[J]. Cell Tissue Res, 2008,331(1): 157-163.
[6] JACKSON M V, MORRISON T J, DOHERTY D F, et al. Mitochondrial transfer via tunneling nanotubes is an important mechanism by which mesenchymal stem cells enhance macrophage phagocytosis in the in vitro and in vivo models of ARDS[J]. Stem Cells, 2016,34(8): 2210-2223.
[7] 魏飞宇,成燕,李进,等.含Ⅲ型纤连蛋白域蛋白5真核表达载体的构建及初步功能研究[J]. 同济大学学报(医学版),2015,36(4): 19-24.
[8] DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006,8(4): 315-317.
[9] DIVAKARUNI A S, ROGERS G W, MURPHY A N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode[J]. Curr Protoc Toxicol, 2014,60: 25.2.1-16.
[10] ROCHE S, DELORME B, OOSTENDORP R A, et al. Comparative proteomic analysis of human mesenchymal and embryonic stem cells: towards the definition of a mesenchymal stem cell proteomic signature[J]. Proteomics, 2009,9(2): 223-232.
【Abstract】 Objective To compare the mitochondrial structure and activities of mesenchymal stem cells (MSCs) derived from different human tissues. Methods Mesenchymal stem cells were isolated from human adipose tissue, bone marrow, dental pulp and umbilical cord. The isolated MSCs were cultured and proliferated in vitro, and the purity was assayed by Flow Cytometry. The ultrastructure and metabolic activity of MSCs were detected by transmission electron microscopy and XFeExtracellular Flux Analyzers, respectively. Results MSCs derived from 4 tissues presented in culture as adherent growth and a spindle cell morphology, the cells positively expressed CD73, CD90 and CD105, and negatively expressed CD34, CD11b, CD19, CD45 and HLA-DR. Compared with MSCs from dental pulp and umbilical cord, the mitochondria of MSCs from adipose tissue and bone marrow had more mature morphology and higher metabolic activity. Conclusion Pluripotent stem cells derived from different tissues show similar characteristics, however, may have different ultrastructure and metabolic activity of mitochondria in MSCs of different origin.
【Key words】 mesenchymal stem cells; cell culture; structure; activity
doi: 10.16118/j.1008-0392.2017.05.003
收稿日期: 2017-03-30
基金项目: 国家自然科学基金重点项目(81430026);上海市科委基础研究项目(16JC1404700)
【中图分类号】 Q 244
【文献标志码】 A
【文章编号】 1008-0392(2017)05-0013-05