·临床研究·
【摘要】 目的 探讨重度慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者营养风险与运动耐量的关系。方法 根据营养风险筛查2002标准(NRS-2002)对58例重度COPD患者进行营养风险评估,分为无营养风险组(A组,n=33)及有营养风险组(B组,n=25)。两组分别进行血气分析(arterial blood gas, ABG)、常规肺功能(pulmonary function test, PFT)及心肺运动试验(cardiopulmonary exercise test, CPET)。结果 两组间的年龄和身高差异无统计学意义(P>0.05)。B组体质量及BMI低于A组(P<0.01)。血气分析中两组间的paO2和paCO2差异无统计学意义(P>0.05)。肺功能检测B组DLCO显著低于A组(P<0.05)。而两组间其他指标(FEV1、FEV1%pred、FVC、FEV1/FVC、RV及RV/TLC)差异无统计学意义(P均>0.05)。心肺运动试验检查B组![]() 及Peak O2 pulse显著低于A组(P<0.05, P<0.01)。两组间
及Peak O2 pulse显著低于A组(P<0.05, P<0.01)。两组间![]() 及Peak Load差异无统计学意义(P>0.05)。58例重度COPD患者的NRS评分与
及Peak Load差异无统计学意义(P>0.05)。58例重度COPD患者的NRS评分与![]() 呈显著负相关(r=-0.353,P<0.01)。58例重度COPD患者的NRS评分与Peak O2 pulse、Peak Load呈负相关(r=-0.322、-0.272,P均<0.05)。结论 有营养风险的重度COPD患者的肺换气功能减低更显著,运动耐量下降更明显。重度COPD患者的NRS评分可预测其运动耐量。
呈显著负相关(r=-0.353,P<0.01)。58例重度COPD患者的NRS评分与Peak O2 pulse、Peak Load呈负相关(r=-0.322、-0.272,P均<0.05)。结论 有营养风险的重度COPD患者的肺换气功能减低更显著,运动耐量下降更明显。重度COPD患者的NRS评分可预测其运动耐量。
【关键词】 营养风险筛查; 慢性阻塞性肺疾病; 静态常规肺功能检测; 心肺运动试验
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种以持续气流受限为特征的可以预防和治疗的疾病,其主要累及肺脏,但也可引起全身(或称肺外)的不良效应[1]。近期研究表明,营养不良是COPD全身效应的常见表现之一[2]。营养状态是COPD预后不良的独立危险因素[3]。COPD患者较常出现的营养不良类型为蛋白质-能量营养不良[4],常表现为患者的体质量等人体测量值低于正常值,但内脏蛋白指标仍处于正常范围。欧洲肠内肠外营养学会于2002年首先提出了“营养风险”的概念,推荐使用营养风险筛查2002(Nutritional Risk Screening 2002, NRS 2002)对住院患者进行营养风险筛查,预测患者的临床结局和预后,为患者的营养支持治疗提供依据[5]。该筛查工具与其他目前常用的几个营养评估工具相比,有着更高的灵敏度和特异度。在欧洲医院中该筛查工具已得到了广泛应用。然而目前国内外尚未见COPD患者营养风险与运动耐量相关性的研究报道,本研究对重度COPD患者的营养风险和肺通气、换气功能及运动耐量的相关性进行研究,现报道如下。
1.1 一般资料
选择2011年1月至2012年12月在同济大学附属肺科医院呼吸科住院的重度COPD男性患者共58例,年龄47~78岁,所有患者均符合慢阻肺的诊断标准,气流受限程度分级符合GOLD 3~ 4级(诊断和病情分级均依据2012版GOLD指南)。排除心血管、肾脏、内分泌、消化及神经系统等其他系统严重疾病。
根据NRS2002的评分标准将此58例重度COPD患者分为两组: 无营养风险组(NRS评分<3分,n=33,组1)及有营养风险组(NRS评分≥3分,n=25,组2)。所有患者均在住院病情稳定期行静态常规肺功能检测(pulmonary function test, PFT)及心肺运动试验(cardiopulmonary exercise test, CPET)测定并收集数据。
1.2 方法
1.2.1 体质量及身高 使用经过校正的体质量计,测量时患者免鞋、着病房衣服。身高精确至0.5cm,体质量精确到0.5kg,计算体质量指数(body mass index, BMI)。BMI=体质量(kg)÷身高2(m)。
1.2.2 营养风险评估 采用定点连续抽样,根据NRS2002标准对研究对象进行营养风险筛查。按照患者入院病历描述的诊断进行疾病严重程度的评分。询问患者近期(1~3个月内)体质量变化、近1周内进食量变化,结合患者BMI,取各项最高分作为营养状态评分。如果患者的年龄>70岁,则营养风险得分上再加1分,作为年龄调整得分。NRS 2002评分为营养状况评分、疾病严重程度评分及年龄调整评分的总和,评分范围为0~7分。总评分≥3分表明患者有营养不良或有营养风险。
1.2.3 血气分析测定 每位患者均右前臂桡动脉处抽取动脉血,血样采用丹麦Radiometer ABL800全自动血气分析仪,并记录动脉氧分压(PaO2)、动脉二氧化碳分压(PaCO2)。标本于行PFT、CPET测定前当天留取。
1.2.4 PFT测定 所有患者均使用德国Jaeger公司MasterScreen Diffusion高级组合式肺功能仪测定肺功能。测定前肺功能仪均经过严格定标,所采用的PFT预计值公式参照1988年建立的中国成人肺功能正常预计值公式。受试者需至少完成3次可接受的肺功能检查,每次检查间隔 1min,误差<5%,取其最佳值,并记录各项测定指标。记录的参数包括第1s用力呼气容积(FEV1)、第1s用力呼气容积占预计值百分比(FEV1%pred)、第 1s 用力呼气容积与用力肺活量比(FEV1/FVC)、深吸气量(IC)、残气量(RV)、肺总量(TLC)、残总百分比(RV/TLC)、肺一氧化碳弥散量(DLCO)。
1.2.5 CPET测定 所有患者均采用德国Jaeger公司Mastercreen-CPX测试系统进行测定。测定前流量传感器及气体分析器均行严格定标。根据受试者的情况,选择不同的负荷(10~25W/min)进行斜坡式功率递增症状限制性CPET试验。开始3min受试者保持静息至各项数据稳定,然后进行3min无负荷热身运动,接着负荷连续递增直至受试者出现不适症状(常见症状主要有自觉腿部酸痛、力竭或呼吸困难等),卸载负荷逐步停止运动。试验过程中动态监测12导联心电图、血压、脉搏血氧饱和度、肺通气,运用实时呼吸(breath-by-breath)法记录O2及CO2的气体交换数据,利用V-slope法确定无氧阈(AT),并使用每10s平均数据进行各种图示和后续计算[6]。试验过程中如发生以下情况即中止试验: (1) 心电图提示ST段压低2mm伴有胸痛或ST段压低3mm不伴有胸痛;(2) 频发的室性期前收缩;(3) 二度、三度的房室传导阻滞;(4) 收缩压≥250mmHg(1mmHg=0.133kPa)和/或舒张压≥120mmHg;(5) 血压较基础血压下降≥30mmHg;(6) 脉搏血氧饱和度≤80%。本研究所采用的CPET预计值公式参照2003年ATS/ACCP发布的CPET指南[7]。试验结束后记录各项参数,包括峰值功率(Peak Load)、峰值摄氧量(Peak ![]() O2)、峰值摄氧量占预计值百分比(Peak
O2)、峰值摄氧量占预计值百分比(Peak ![]() O2%pred)、峰值公斤摄氧量(Peak
O2%pred)、峰值公斤摄氧量(Peak ![]() O2/kg)、峰值氧脉搏(Peak O2 pulse)。
O2/kg)、峰值氧脉搏(Peak O2 pulse)。
1.3 统计学处理
用SPSS 21.0统计软件包进行分析,所有数据用![]() 表示,两组间各项参数比较采用独立样本t检验,NRS评分与Peak
表示,两组间各项参数比较采用独立样本t检验,NRS评分与Peak ![]() O2、Peak O2 pulse及Peak Load之间的相关性均用Pearson相关分析,并进行显著性检验。P<0.05为差异有统计学意义。
O2、Peak O2 pulse及Peak Load之间的相关性均用Pearson相关分析,并进行显著性检验。P<0.05为差异有统计学意义。
2.1 一般资料
本研究共收入58例重度COPD男性患者,其中无营养风险组共有33例,有营养风险组25例。有营养风险组的年龄和身高与无营养风险组相比,差异无统计学意义(P>0.05);有营养风险组体质量及BMI低于无营养风险组,差异有统计学意义(P<0.01),见表1。
表1 COPD无营养风险组及有营养风险组的一般资料比较
Tab.1 Characteristics of COPD patients in each group![]()
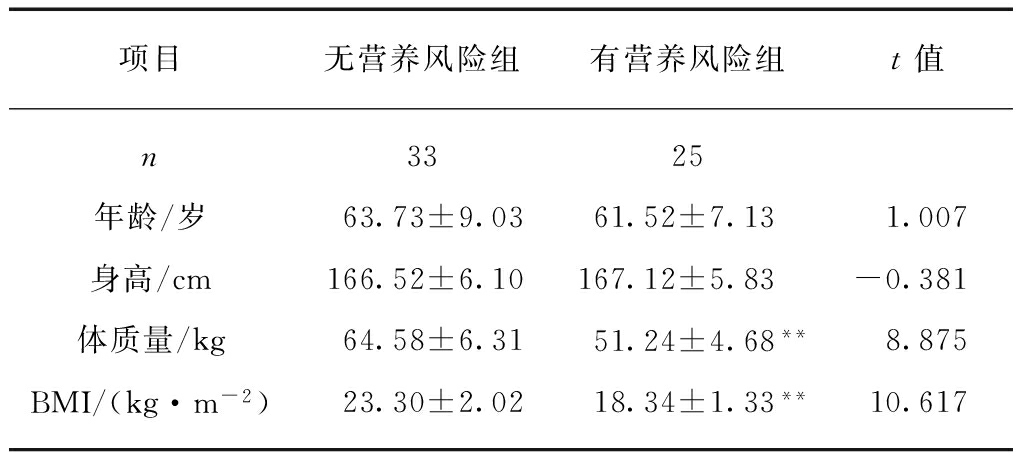
项目无营养风险组有营养风险组t值n3325年龄/岁63.73±9.0361.52±7.131.007身高/cm166.52±6.10167.12±5.83-0.381体质量/kg64.58±6.3151.24±4.68**8.875BMI/(kg·m-2)23.30±2.0218.34±1.33**10.617
与无营养风险组相比,**P<0.01
2.2 血气分析、PFT、CPET、测定结果比较
血气分析有营养风险组的PaO2和PaCO2与无营养风险组相比,差异无统计学意义(P>0.05),见表2。
PFT检测有营养风险组DLCO低于无营养风险组,两组间差异存在统计学意义(P<0.05),表明COPD有营养风险组肺弥散功能显著下降。而有营养风险组其他PFT指标FEV1、FEV1%pred、FVC、FEV1/FVC、RV与无营养风险组比较,差异无统计学意义(P>0.05),见表2。
表2 COPD无营养风险组及有营养风险组的血气分析测定结果
Tab.2 Results of blood gas analysis, PFT and CPET in each group
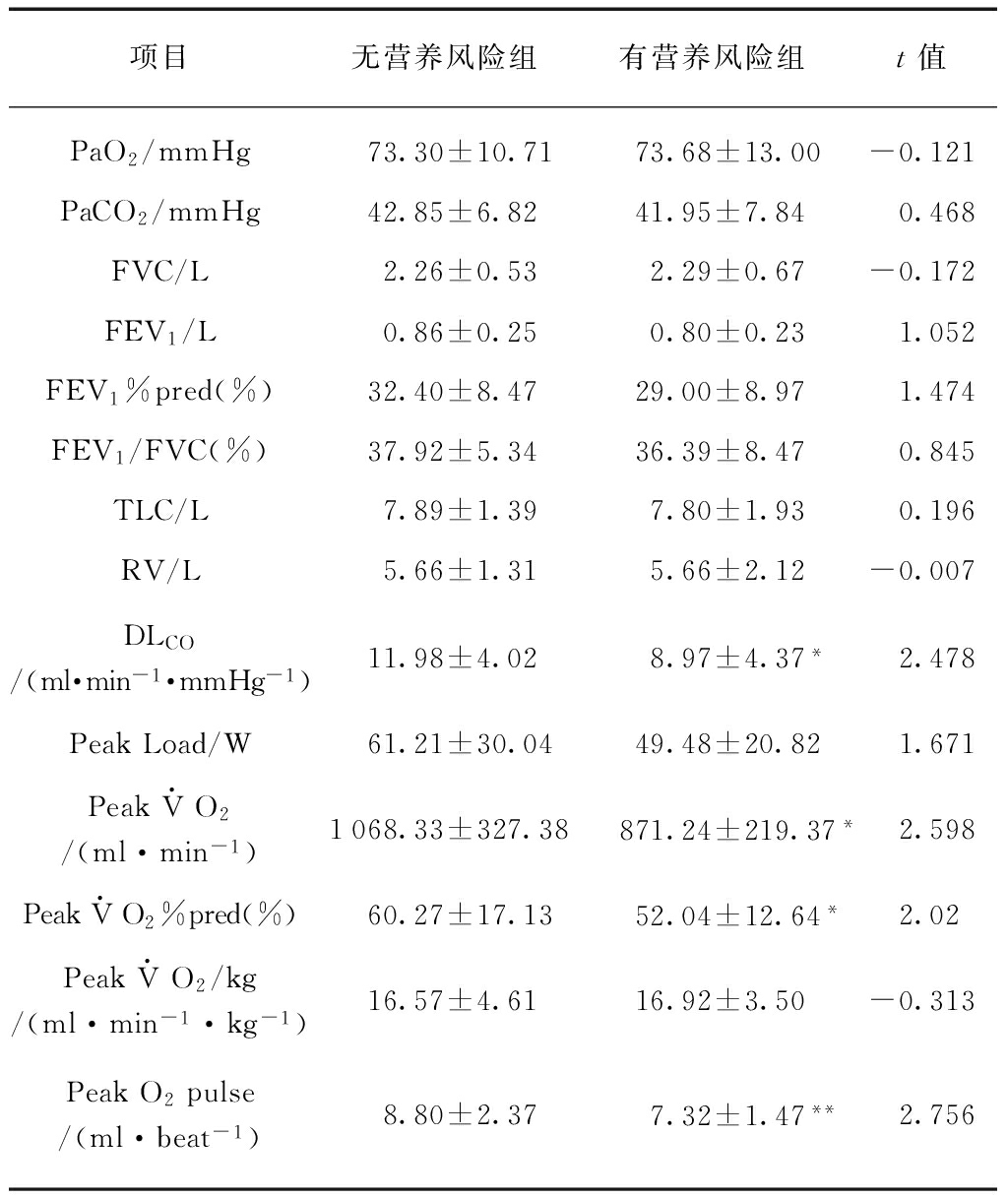
项目无营养风险组有营养风险组t值PaO2/mmHg 73.30±10.71 73.68±13.00-0.121PaCO2/mmHg42.85±6.8241.95±7.840.468FVC/L2.26±0.532.29±0.67-0.172FEV1/L0.86±0.250.80±0.231.052FEV1%pred(%)32.40±8.4729.00±8.971.474FEV1/FVC(%)37.92±5.3436.39±8.470.845TLC/L7.89±1.397.80±1.930.196RV/L5.66±1.315.66±2.12-0.007DLCO/(ml·min-1·mmHg-1)11.98±4.028.97±4.37*2.478PeakLoad/W61.21±30.0449.48±20.821.671PeakV·O2/(ml·min-1)1068.33±327.38871.24±219.37*2.598PeakV·O2%pred(%)60.27±17.1352.04±12.64*2.02PeakV·O2/kg/(ml·min-1·kg-1)16.57±4.6116.92±3.50-0.313PeakO2pulse/(ml·beat-1)8.80±2.377.32±1.47**2.756
与无营养风险组相比,*P<0.05,**P<0.01;1mmHg=0.133kPa
CPET测定有营养风险组Peak ![]() O2及Peak
O2及Peak ![]() O2%pred低于无营养风险组,两组间存在统计学差异(P均<0.05),表明COPD有营养风险组的运动耐量降低;有营养风险组Peak O2 pulse低于无营养风险组,P<0.01,表明COPD有营养风险组的心功能降低;而有营养风险组Peak
O2%pred低于无营养风险组,两组间存在统计学差异(P均<0.05),表明COPD有营养风险组的运动耐量降低;有营养风险组Peak O2 pulse低于无营养风险组,P<0.01,表明COPD有营养风险组的心功能降低;而有营养风险组Peak ![]() O2/kg及Peak Load与无营养风险组比较差异无统计学意义(P>0.05),见表2。
O2/kg及Peak Load与无营养风险组比较差异无统计学意义(P>0.05),见表2。
2.3 NRS评分与Peak ![]() O2、Peak O2 pulse及Peak Load相关性分析
O2、Peak O2 pulse及Peak Load相关性分析
58例重度COPD患者的NRS评分与Peak ![]() O2呈显著负相关(r=-0.353,P<0.01),见图1;与Peak O2 pulse、Peak Load呈负相关(r=-0.322,r=-0.272,P<0.05),见图2、图3。
O2呈显著负相关(r=-0.353,P<0.01),见图1;与Peak O2 pulse、Peak Load呈负相关(r=-0.322,r=-0.272,P<0.05),见图2、图3。
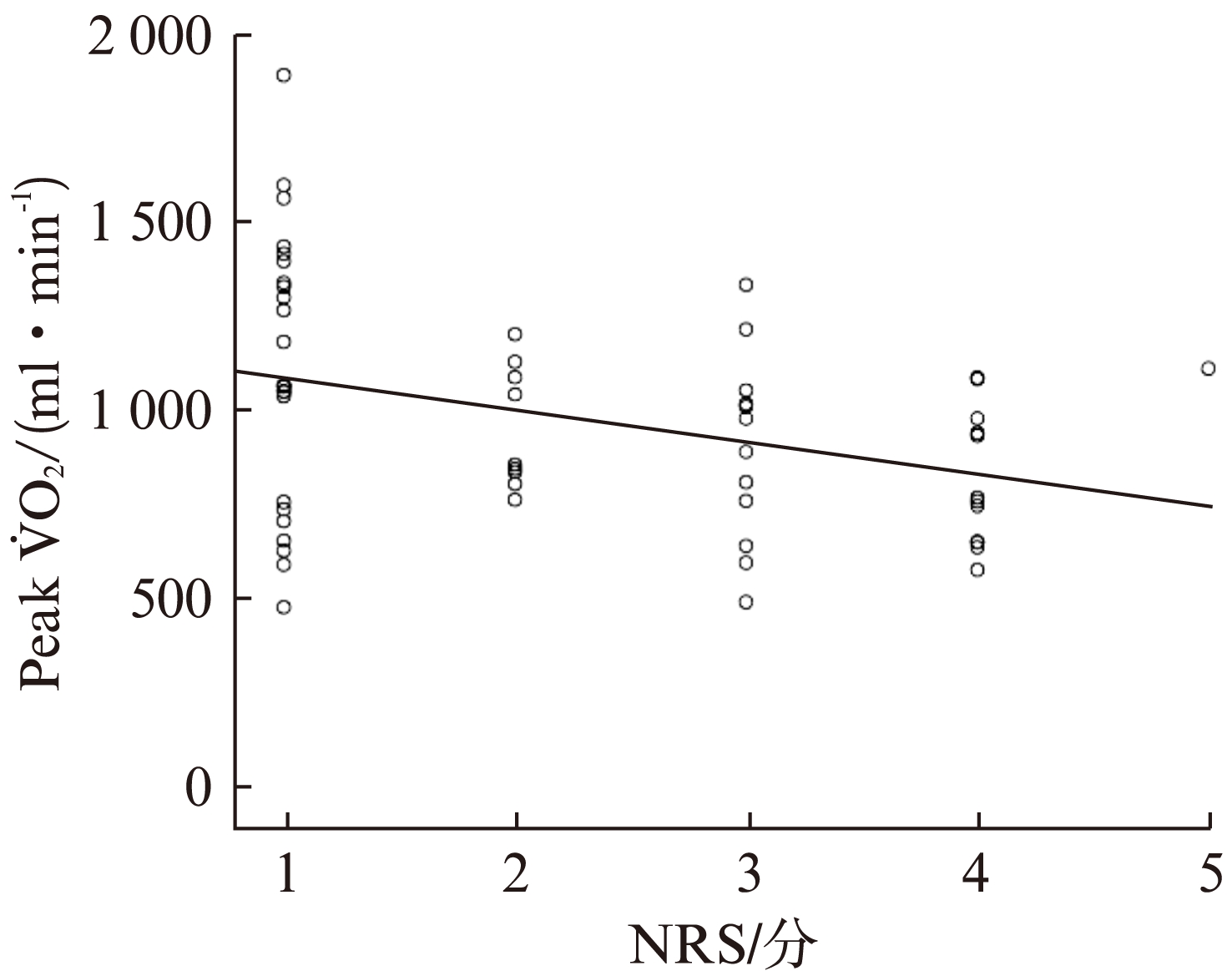
图1 重度COPD患者的NRS评分与Peak ![]() O2相关性
O2相关性
Fig.1 Correlation between nrs score and peak ![]() O2
O2
r=-0.353,P<0.01
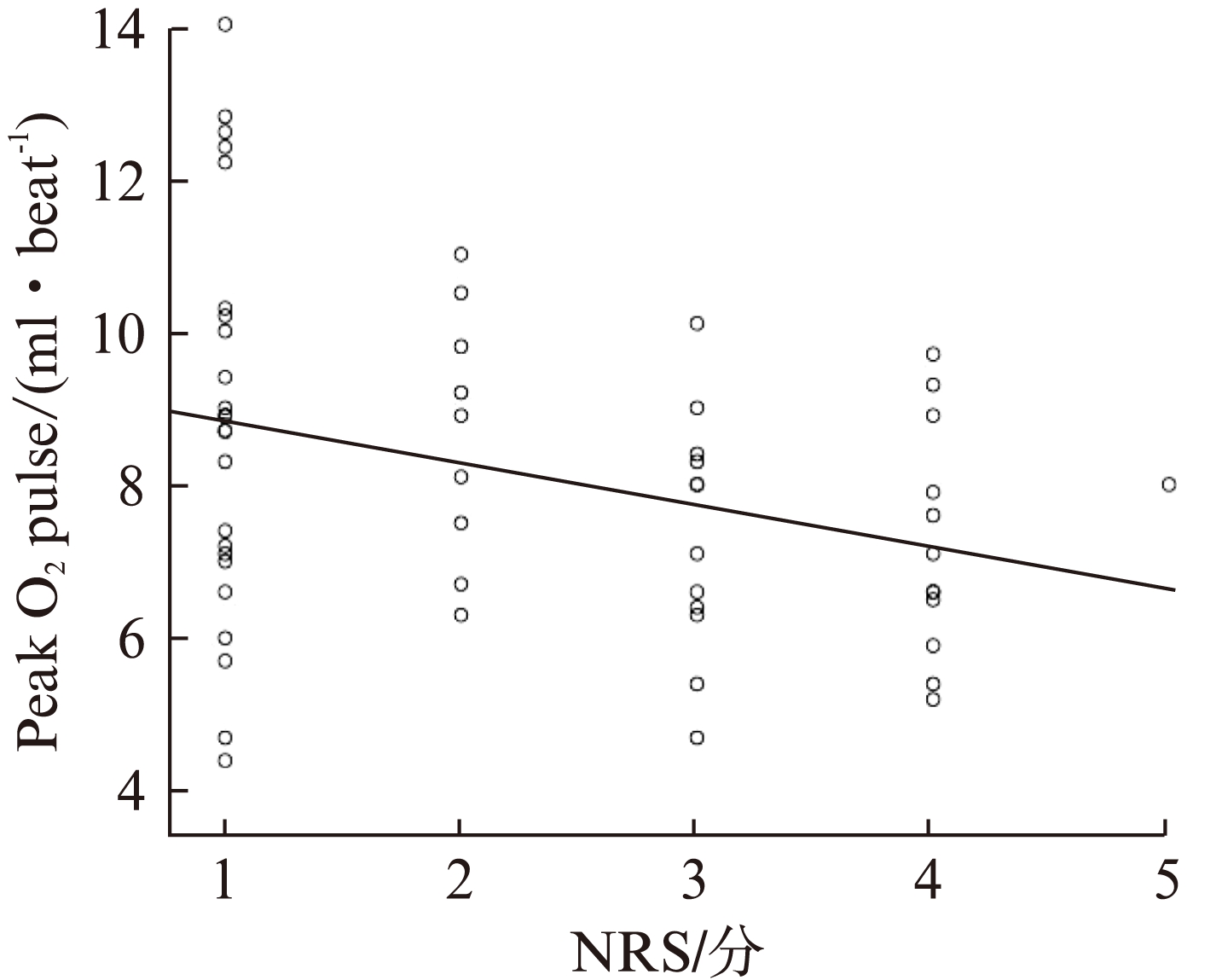
图2 重度COPD患者的NRS评分与Peak O2 pulse相关性分析
Fig.2 Correlation between NRS score and peak O2 pulse
r=-0.322,P<0.05
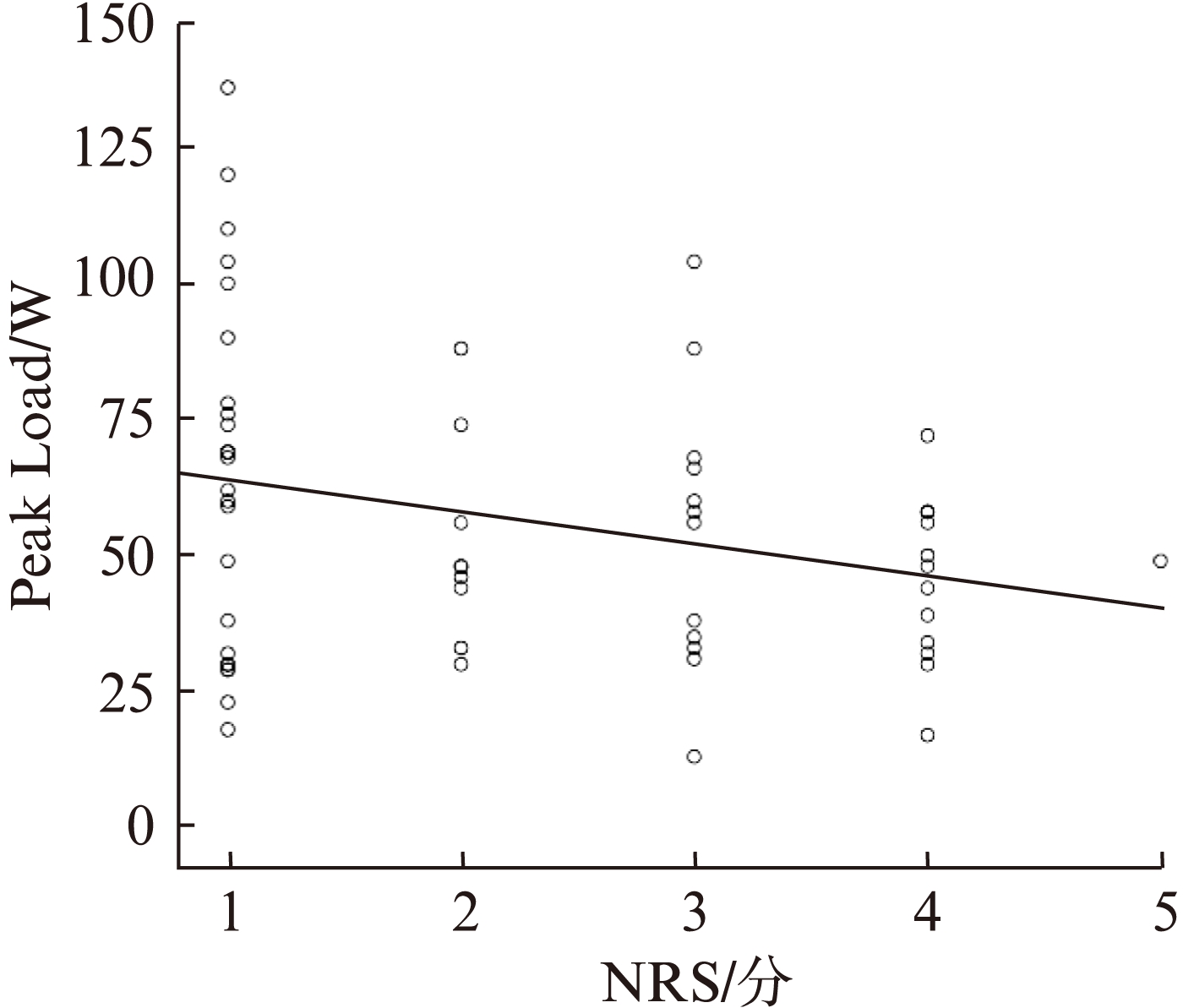
图3 重度COPD患者的NRS评分与Peak Load相关性
Fig.3 Correlation between NRS score and Peak Load
r=-0.272,P<0.05
营养不良是COPD患者比较常见的并发症。造成COPD患者发生营养不良的机制是多方面的,主要原因是COPD患者机体能量需求与营养摄入的严重不平衡。一方面COPD患者因为气道阻力增高,肺顺应性减低,导致呼吸肌负荷增加,通气效率低下,耗氧量增加,使基础代谢率明显提高。另一方面COPD患者因气促、长期服药、精神焦虑等情况导致食欲下肢,从而出现营养摄入的严重不足。同时营养不良会引起呼吸肌的肌力和耐力下降,呼吸肌容易出现疲劳,导致通气驱动不足,使呼吸功能进一步受损。Gray-Donald等[8]发现营养不良的COPD患者活动时呼吸肌比正常对照者运动过程中更早进入无氧代谢状态,而无氧代谢状态下,呼吸肌的工作效率明显减低,表明营养状况可明显影响呼吸肌肌力和膈肌收缩功能,从而导致运动耐量下降。
FEV1与气流受限有着很好的相关性,是反映气流受限严重程度的良好指标。而FEV1/FVC则是早期气流受限的指标,但却无法准确反映气流阻塞的严重程度。Vibhuti等[9]报道COPD患者FEV1和体质量指数呈正相关,可以预示疾病的严重程度。但周锋等[10]研究显示,COPD患者的体质量指数与FEV1、FEV1%pred及FEV1/FVC等指标相关性并不好。本研究结果发现,COPD有营养风险组FEV1、FEV1%pred及FEV1/FVC等通气指标两组间差异无统计学意义,与周锋等的研究结果相同。而有营养风险组DLCO较无营养风险组则明显减低,这可能与营养不良的重度COPD患者肺小动脉内膜增厚更明显造成气体弥散距离加大有关,也可能是COPD患者运动耐量降低的潜在原因[11]。
近期研究显示,FEV1仅仅反映COPD患者静息状态下的通气状况,并不是反映COPD运动耐力水平的一个良好指标。而CPET能有效地判断COPD患者运动受限的原因并能评估其最大运动耐力,是评价患者运动能力及判断受限原因的金标准[12]。CPET目前已被用于COPD患者功能评价及预后评估[13]。
研究发现COPD患者外周骨骼肌有氧代谢能力明显减低,运动的早期即可出现外周肌肉的疲劳,营养不良的患者则尤为明显。营养不良可以造成外周骨骼肌结构和生化的改变,如线粒体数目减少、体积减小及功能下降,糖原利用和乳酸形成加快等,这些都可导致骨骼肌对氧的利用能力下降,更早发生代谢性酸中毒,外周骨骼肌内乳酸堆积,更易发生疲劳,而腿部肌肉疲劳是除呼吸困难外造成COPD患者运动受限的另一重要原因。目前临床上因受试者往往在最大运动平台出现前就会终止运动,因此常用Peak ![]() O2来代替
O2来代替![]() O2max。研究显示Peak
O2max。研究显示Peak ![]() O2能够反映人体最大有氧代谢能力和心肺储备功能,同样被认为是评价运动耐量的金标准,也是预测COPD患者早期死亡的重要指标。相关研究[14]显示,COPD患者Peak
O2能够反映人体最大有氧代谢能力和心肺储备功能,同样被认为是评价运动耐量的金标准,也是预测COPD患者早期死亡的重要指标。相关研究[14]显示,COPD患者Peak ![]() O2较正常组有显著下降。国外研究[15]也证明营养缺乏的COPD患者 12min 行走距离明显减小,提示营养不良与运动耐量下降有关。同时也有研究[16]提示营养不良可以导致COPD患者肌肉有氧代谢能力和运动耐量降低。在本研究中,COPD有营养风险组Peak
O2较正常组有显著下降。国外研究[15]也证明营养缺乏的COPD患者 12min 行走距离明显减小,提示营养不良与运动耐量下降有关。同时也有研究[16]提示营养不良可以导致COPD患者肌肉有氧代谢能力和运动耐量降低。在本研究中,COPD有营养风险组Peak ![]() O2 及Peak
O2 及Peak ![]() O2%pred均明显低于无营养风险组,进一步提示有营养风险的COPD患者运动耐量更低、有氧代谢能力更差;重度COPD患者的NRS评分与Peak
O2%pred均明显低于无营养风险组,进一步提示有营养风险的COPD患者运动耐量更低、有氧代谢能力更差;重度COPD患者的NRS评分与Peak ![]() O2呈显著负相关的结果,则进一步提示营养状态可影响COPD患者运动耐量,营养风险筛查可以预测COPD患者有氧代谢能力和运动耐量。
O2呈显著负相关的结果,则进一步提示营养状态可影响COPD患者运动耐量,营养风险筛查可以预测COPD患者有氧代谢能力和运动耐量。
在CPET中Peak Load也是反映运动耐量的重要参数。本研究中有营养风险组Peak Load虽低于无营养风险组,但两组比较差异无统计学意义,可能与样本量偏小有关。Peak O2 pulse是CPET测定中反映心功能、循环功能及心肌氧供需平衡的重要指标。营养不良COPD患者以气肿型多见,肺血管床破坏较严重,左心室充盈不足、心输出量减低,在运动中心输出量不能随运动功率的增加而相应的增加,使组织氧供减少,从而使Peak O2 pulse下降。本研究发现有营养风险组Peak O2 pulse明显低于无营养风险组,同时NRS评分与Peak O2 pulse、 Peak Load也存在相关性,也进一步验证了上述机制,提示COPD有营养风险组心功能较无营养风险组显著减低,心肌氧供需不平衡更严重。
综上所述,存在营养风险的重度COPD患者肺弥散功能减低更显著,运动耐量下降更明显,有氧代谢能力更低,心血管功能更差,心肌氧供需不平衡更严重。COPD患者的营养风险筛查评分与运动耐量及有氧代谢能力存在良好的相关性。对重度COPD患者进行营养风险筛查可预测患者的运动耐量及心肌氧供需平衡状况,可能更有助于评估COPD患者的病情严重程度,预测临床事件风险。
虽然本研究得到了一些初步的结果,但仍存在一些不足。本研究样本量偏少,尚不能非常充分说明营养风险与重度COPD患者运动耐力的相关性。同时本研究中对于COPD患者的吸烟以及用药情况没有比较,需要在以后的研究过程中进行补充。且需要更多的前瞻性研究,引入其他营养评估方法,通过比较以明确营养风险筛查是否能更好的预测重度COPD患者的临床转归。
【参考文献】
[1] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36: 1-10.
[2] ROIG M, ENG J J, ROAD J D, et al. Falls in patients with chronic obstructive pulmonary disease: a call for further research[J]. Respir Med, 2009,103: 1257-1269.
[3] BRUG J, SCHOLS A, MESTERS I. Dietary change, nutrition education and chronic obstructive pulmonary disease[J]. Patient Educ Couns, 2004,52(3): 249-257.
[4] AKNER G, CEDERHOLM T. Treatment of protein-energy malnutrition in chronic nonmalignant disorders[J]. Am J Clin Nutr, 2001,74: 6-24.
[5] KLYE U G, KOSSOVSKY M P, KARSEGARD V L, et al. Comparison of tools for nutritional assessment and screening at hospital admission: a population study[J]. Clin Nutr, 2006,25(3): 409-417.
[6] SUN X G, HANSEN J E, BESHAI J, et al. Oscillatory breathing and exercise gas exchange abnormalities prognosticate early mortality and morbidity in heart failure[J]. J Am Coll Cardiol, 2010,55: 1814-1823.
[7] AMERICAN THORACIC SOCIETY, AMERICAN COLLEGE OF CHEST PHYSICIANS. ATS/ACCP Statement on cardiopulmonary exercise testing[J]. Am J Respir Crit Care Med, 2003,167(2): 211-277.
[8] GRAY-DONALD K, GIBBONS L, SHAPIRO S H, et al. Nutritional status and mortality in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 1996,153: 961-966.
[9] VIBHUTI A, ARIF E, DEEPAK D, et al. Correlation of oxidative status with BMI and lung function in COPD[J]. Clin Biochem, 2007,140(13-14): 958-963.
[10] 周锋,刘锦铭,孙兴国.体重指数对慢性阻塞性肺疾病患者心肺运动耐量的影响[J].中华结核和呼吸杂志,2012,35: 453-454.
[11] 吴常伟,刘锦铭,杨文兰,等.运动试验中摄氧效率与慢性阻塞性肺疾病稳定期患者运动耐量的相关性研究[J].中华结核和呼吸杂志,2013,36: 1-6.
[12] FERRAZZA A M, MARTOLINI D, VALLI G, et al. Cardiopulmonary exercise testing in the functional and prognostic evaluation of patients with pulmonary diseases[J]. Respiration, 2009,77(1): 3-17.
[13] 刘锦铭,刘海舰.心肺运动试验的基本概念及其临床意义[J].中华结核和呼吸杂志,2012,35: 954-956.
[14] 刘海舰,刘锦铭,杨文兰,等.运动试验后心率恢复与稳定期慢性阻塞性肺疾病患者运动耐量的相关性研究[J].中华全科医师杂志,2013,12: 34-39.
[15] KONDRUP J, RASMUSSEN H H, HAMBERG O, et al. Nutritional Risk Screening(NRS 2002): a new method based on an analysis of controlled clinical trials[J]. Clin Nutr, 2003,22(4): 321-336.
[16] KONDRUP J, ALLISON S P, ELIA M, et al. ESPEN Guidelines for Nutritional Screening 2002[J]. Clin Nutr, 2003,22(4): 415-421.
Correlation between nutritional risk and exercise tolerance in patients with severe chronic obstructive pulmonary disease
【Abstract】 Objective To investigate the relationship between nutritional risk and exercise tolerance in patients with severe chronic obstructive pulmonary disease (COPD). Methods The nutritional risk of 58 severe COPD patients was assessmented according to the nutritional risk screening 2002 (NRS-2002). There were 33 patients without nutritional risk (NRS<3, group A) and 25 patients with nutritional risk (NRS≥3, group B). Arterial blood gas (ABG) analysis, pulmonary function test (PFT) and cardiopulmonary exercise test (CPET) were performed in all patients. Results There were no significant differences in age and height between two groups (P>0.05). The weight [(51.24±4.68) kg], BMI (18.34±1.33) in group B were lower than those in group A (P<0.01). There no significant differences in blood gas parameters PaO2 and PaCO2 between two groups (P>0.05). Pulmonary function tests showed that the DLCO of group B was significantly lower than that of group A (P<0.01); while there were no significant differences in other indicators (FEV1, FEV1%pred, FVC, FEV1/FVC, RV, RV/TLC) between two groups (P>0.05). In cardiopulmonary exercise test, Peak ![]() O2, Peak
O2, Peak ![]() O2%pred and Peak O2 pulse in group B were singificantly lower than those in group A (P<0.05 or P<0.01). There were no significant differences in Peak
O2%pred and Peak O2 pulse in group B were singificantly lower than those in group A (P<0.05 or P<0.01). There were no significant differences in Peak ![]() O2/kg and Peak Load between the two groups (P>0.05). NRS score and Peak VO2 of 58 cases of patients with COPD showed a significant negative correlation (r=-0.353, P<0.01). The NRS score of 58 patients with severe COPD was negatively correlated with Peak O2 pulse, Peak Load (r=-0.322、0.272, P<0.05). Conclusion The nutritional risk of patients with severe COPD can worsen pulmonary ventilation function and decrease exercise tolerance significantly. Nutritional risk assessment may help to understand the severity of patients with severe COPD and to predict clinical risk.
O2/kg and Peak Load between the two groups (P>0.05). NRS score and Peak VO2 of 58 cases of patients with COPD showed a significant negative correlation (r=-0.353, P<0.01). The NRS score of 58 patients with severe COPD was negatively correlated with Peak O2 pulse, Peak Load (r=-0.322、0.272, P<0.05). Conclusion The nutritional risk of patients with severe COPD can worsen pulmonary ventilation function and decrease exercise tolerance significantly. Nutritional risk assessment may help to understand the severity of patients with severe COPD and to predict clinical risk.
【Key words】 nutritional risk screening; chronic obstructive pulmonary disease; static routine pulmonary functiontest; cardiopulmonary exercise test
doi: 10.16118/j.1008-0392.2017.04.013
收稿日期: 2006-11-25
基金项目: 中华医学会临床医学慢性呼吸道疾病科研专项基金(08020420120);上海市科学技术委员会科研计划(114119a3000,11411951302)
【中图分类号】 R563
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0060-06