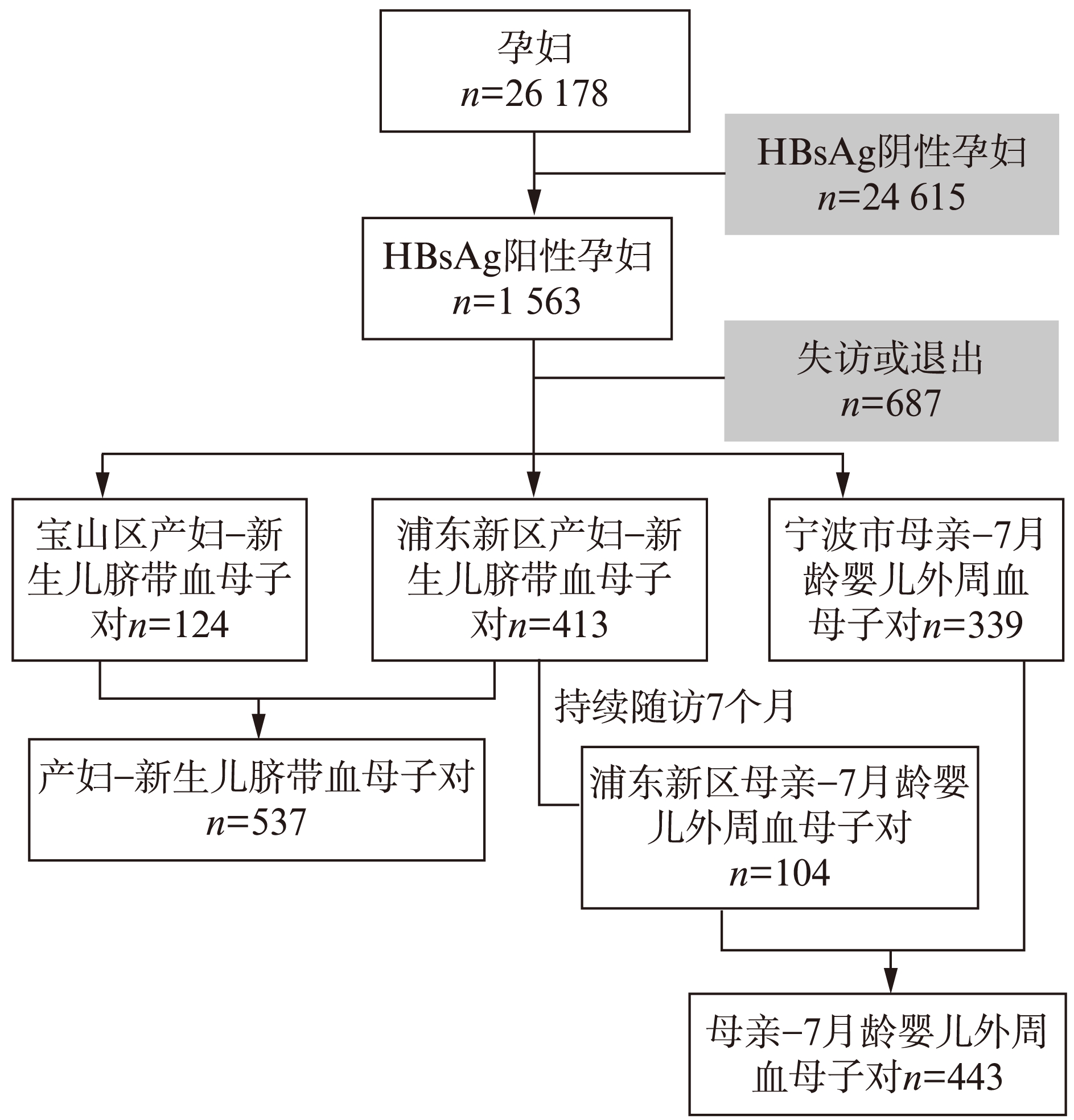
图1 参与者样本收集流程图
Fig.1 Flow diagram of participants
·临床研究·
【摘要】 目的 研究乙型肝炎病毒基因(HBV DNA)preS区内与慢性乙型重型肝炎(chronic severe hepatitis B, CSHB)相关变异在母婴传播过程中的进化趋势。方法 收集879例HBsAg阳性孕妇外周血,孕妇分娩后将其新生儿脐带血、完成乙肝疫苗注射后的7月龄婴儿外周血亦纳入队列。通过基因分型和系统发育分析鉴定HBV的母婴传播情况,运用单克隆测序方式检测母子体内HBV preS区中CSHB相关突变情况。结果 HBV B/C基因型中CSHB相关变异C2875T、C2980T、G2988A、C3067T、C3097A、T25G、A76C、A79G、T100C、C102T、C106A、T109G、C135T、T147C、A148G,可通过宫内感染途径传播给新生儿;C2基因型中变异A3097C/G、G132C在HBV宫内感染中存在明显优势(P<0.05;P<0.05)。B2基因型中,变异C3057G、T3060C、C3097A、T3169A、A20G、A76C、C129T,能够通过MCTC途径由母亲传播给7月龄婴儿;C2基因型中以上变异突变率低。结论 在母婴传播过程中,HBV B2基因型中CSHB相关变异较多;婴儿完成接种免疫后,野生型HBV在母婴传播中具有感染优势,进化具有保守性。
【关键词】 乙型肝炎病毒; 慢性乙型重型肝炎; 变异; 宫内感染; 母婴传播
人体外周血中乙型肝炎病毒表面抗原(HBsAg)持续阳性6个月以上称为慢性HBV感染,全球约有3.5亿人为慢性HBV感染者[1-2]。目前采用乙型肝炎疫苗(HBVac)和乙型肝炎免疫球蛋白(HBIG)联合免疫预防措施阻断HBV的母婴传播(mother-to-child transmission, MTCT),但仍有约15%的新生儿通过宫内感染途径感染HBV;而幼年期感染HBV的儿童中,90%以上会发展成慢性HBV感染者[3]。我国慢性重型肝炎以慢性乙型重型肝炎(chronic severe hepatitis B, CSHB)为主,病死率超过50%,约1%的慢性HBV感染者会发展为CSHB[4-5]。
HBV DNA preS区携带有效的T细胞和B细胞抗原表位,具有强免疫原性。研究证实,乙肝病毒preS区突变会引起HBV复制、致癌、宫内感染能力的改变,存在使慢性HBV感染病情加重导致CSHB发生的突变。目前已发现CSHB患者体内HBV DNA preS区点突变率高于慢性HBV感染者的有nt.2875、nt.2901、nt.2910、nt.2928、nt.2951、nt.2962、nt.2988、nt.3057、nt.3067、nt.3178、nt.3191、nt.20、nt.25、nt.27、nt.40、nt.76、nt.99、nt.127、nt.132等[6-9]。本研究调查了CSHB相关变异在HBV母婴传播中的进化趋势,重点阐述从围产期到7月龄婴儿(持续感染HBV 6个月以上,确定已发生慢性HBV感染)期间的变化情况及规律。
1.1 一般资料
HBV的宫内感染是指新生儿出生24h内,其静脉血和/或脐带血呈现HBsAg和/或HBV DNA阳性(HBV DNA>1.0×103copies/ml)[10]。HBsAg阳性产妇分娩的新生儿,在接种过全程乙肝疫苗免疫(0、1、6月龄接种3针)后,7月龄时外周血仍呈现HBsAg阳性,即认为发生了婴儿的慢性HBV感染。
本研究对中国上海市、浙江省宁波市共计 26178 名孕妇进行检测,将外周血HBsAg阳性的 1563 例孕妇纳入调查范围。至纳入队列的孕妇分娩时,抽取产妇外周静脉血5ml、新生儿脐静脉血 3ml。上海队列中,新生儿出后立即用生理盐水清洗脐带以避免母亲血液污染脐带血;宁波队列未采取防污染措施,因此未收集脐带血。最终,上海市收集HBsAg阳性产妇外周血及其分娩时新生儿脐带血共537对;随访7个月后,完成HBsAg阳性产妇外周血、接种全程(0、1、6月龄注射)乙肝疫苗的7月龄婴儿外周静脉血104对;浙江省宁波市完成采集HBsAg阳性产妇外周血、7月龄婴儿外周静脉血339对[11](图1)。所有入选母亲均对本课题知情同意并自愿参加该队列研究[12]。

图1 参与者样本收集流程图
Fig.1 Flow diagram of participants
1.2 诊断标准
感染HBV母亲的入选标准: (1) 确定孕妇妊娠期间外周血HBsAg阳性;(2) 对本课题研究知情同意并自愿参与队列研究。发生HBV宫内感染的诊断标准: 脐带血中HBV DNA滴度≥1×103 copies/ml (real-time PCR)。新生儿、婴儿感染慢性HBV的诊断标准: 脐带血HBsAg阳性新生儿;完成全程乙肝疫苗接种后,7月龄时外周静脉血仍呈现HBsAg阳性。
1.3 血清学标志物和HBV定量
使用ELISA试剂盒(Kehua, Shanghai, China)分析所收集样本(母亲、脐带血、7月龄婴儿)外周血中的HBsAg、抗HBs、HBeAg、抗HBe和抗HBc进行检测。使用聚合酶链式反应(PCR)试剂盒(上海复兴实业股份有限公司)测定血清中HBV DNA载量,病毒载量≥103 copies/ml为HBV DNA阳性。所用仪器为LightCyclerTM480(Roche,德国)。
1.4 HBV基因组DNA提取与克隆、测序
使用QIAGEN公司QIAamp DNA Blood Mini Kit提取、收集HBV基因组DNA,-40℃保存待用。运用PCR对HBV DNA阳性母亲和孩子体内HBV DNA preS(nt.2848-nt.154)区进行扩增。第一轮上游引物: 5′-AAAATTAATT-ATCCTGCTAGG-3′(nt.2627-nt.2647),下游引物: 5′-CTGAGCACCACCTGAAGAG-3′(nt.251-nt.269);第二轮上游引物: 5′-TTTACAACTCTGTGGAAGGC-3′(nt.2747-nt.2766),下游引物: 5′-GGTTATGGTGT-CTCAGATCTGAG-3′(nt. 233-nt. 255)。使用0.8%琼脂糖凝胶电泳对PCR产物鉴定后,采用pMD18-T Vector构建pMD18-T-DNA载体。在Amp+LB固态培养基上,涂板X-gal、IPIG混合液(X-gal: 40μl、IPIG: 5μl),置于37℃恒温箱备用。将全量10μl的连接体系加入到70μl大肠杆菌感受态细胞菌液中,冰中放置30min,42℃水浴90s,取出后冰浴120s。随后,每管加入450μl Amp-LB培养液,摇菌箱中37℃震荡 45min。离心半径9.5cm,12000r/min,离心1min,弃部分上清,剩余约80μl培养液。将细菌沉淀与培养液吹打混匀,涂板于前期准备的培养皿上,恒温箱中37℃培养过夜。随机挑选10个白色重组单克隆菌落、提取重组质粒后,送检测序。最终,完成母亲-脐带血测序464条、母亲-7月龄儿童血测序142条。测序序列已上传NCBI GenBank,登录号为KF811606-KF812519、KF840099-KF840131。通过MEGA 7.0软件对测序DNA序列进行序列比对和核苷酸突变分析。
1.5 统计学处理
使用SPSS 18.0进行双向统计学检验,计量资料使用![]() 表示,计量资料比较采用独立样本t检验,计数资料比较采用
表示,计量资料比较采用独立样本t检验,计数资料比较采用 2检验,P值均为双尾。P<0.05为差异有统计学意义。
2检验,P值均为双尾。P<0.05为差异有统计学意义。
2.1 影响HBV跨胎盘传播的临床、病毒学因素
本研究共包括413例HBsAg阳性孕妇,通过抽取分娩后新生儿脐带血、检测HBV病毒相关标记物,确定其中41例发生HBV宫内感染,即新生儿宫内感染率为9.93%(41/413)。发生宫内感染组母亲在γ-GT(U/l)水平、HBeAg阳性率、HBV DNA载量等方面,均显著高于未发生宫内感染组内母亲,而平均年龄较低,见表1。
表1 与HBV跨胎盘传播相关临床、病毒学危险因素的分析
Tab.1 Analysis of the clinical and virological characteristics associated with the risk of HBV trans-placental transmission
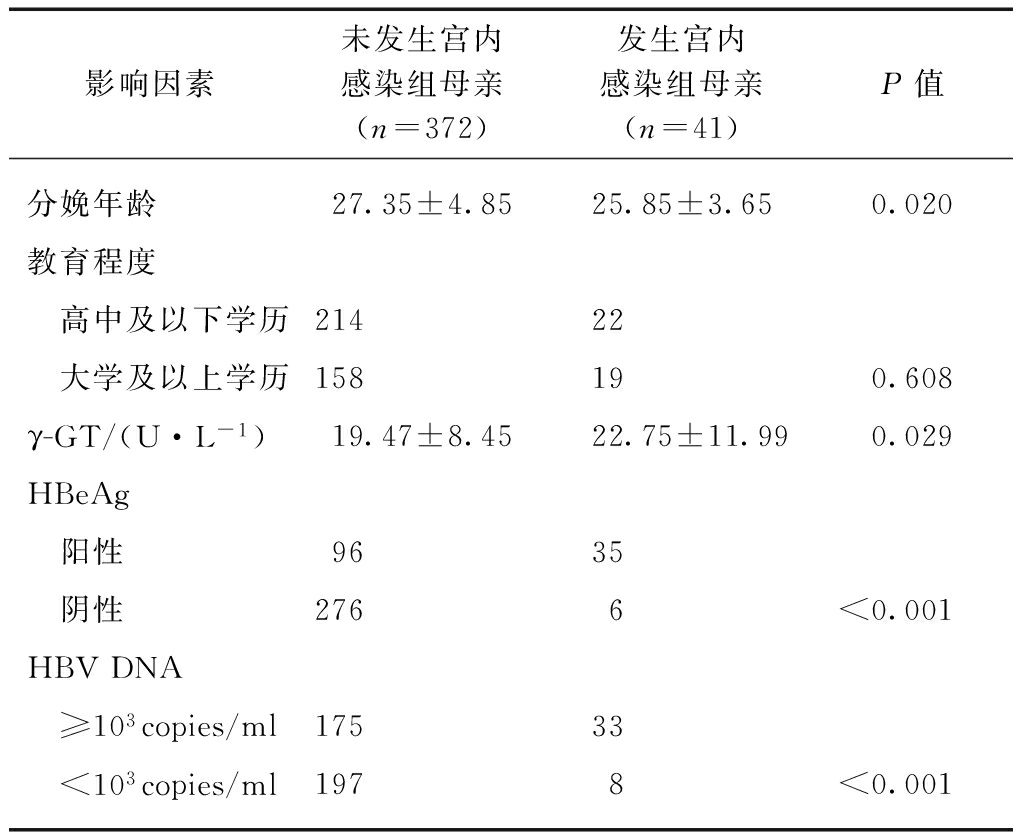
影响因素未发生宫内感染组母亲(n=372)发生宫内感染组母亲(n=41)P值分娩年龄27.35±4.8525.85±3.650.020教育程度 高中及以下学历21422 大学及以上学历158190.608γ-GT/(U·L-1)19.47±8.4522.75±11.990.029HBeAg 阳性9635 阴性2766<0.001HBVDNA ≥103copies/ml17533 <103copies/ml1978<0.001
γ-GT: γ谷氨酰转肽酶
2.2 HBV宫内感染过程中CSHB相关变异的传递
CSHB相关变异位点,如B基因型中C2980T、G2988A、C3067T、C3097A、T25G、A76C、C106A、T109G、C135T、T147C、A148G,以及C基因型中C2875T、A79G、T100C、C102T,均可通过宫内感染途径感染新生儿。与野生型HBV相比,C基因型中A3097C/G、G132C在母亲外周血中突变率低,而在脐带血中突变率呈现上升趋势(1% vs 11.5%,P<0.05;1% vs 8%,P<0.05);C基因型中变异G3102A在母亲外周血中突变率明显高于脐带血(9.9% vs 0,P<0.05),见表2。
2.3 CSHB相关变异在HBV母婴传播中的传递
B2基因型中CSHB相关变异位点C3057G、T3060C、C3097A、T3169A、A20G、A76C,C2基因型中C3057A、C129T,均能够通过MCTC途径感染7月龄婴儿。而在变异位点nt.3060、nt.3097、nt.3169、nt.20、nt.76处,B2基因型母亲、7月龄婴儿体内均表现出高突变率,C2基因型母亲、7月龄婴儿外周血中未检出。C2基因型CSHB相关变异中,A121G在母亲、7月龄婴儿外周血中存在明显差异(33.3% vs 4.2%,P<0.05),C129T呈现高突变率;而在B2基因型中C129T检出率低,见表3。
表2 宫内感染中HBV preS区CSHB相关变异的传递
Tab.2 CSHB-related mutations in the preS region of HBV [n(%)]
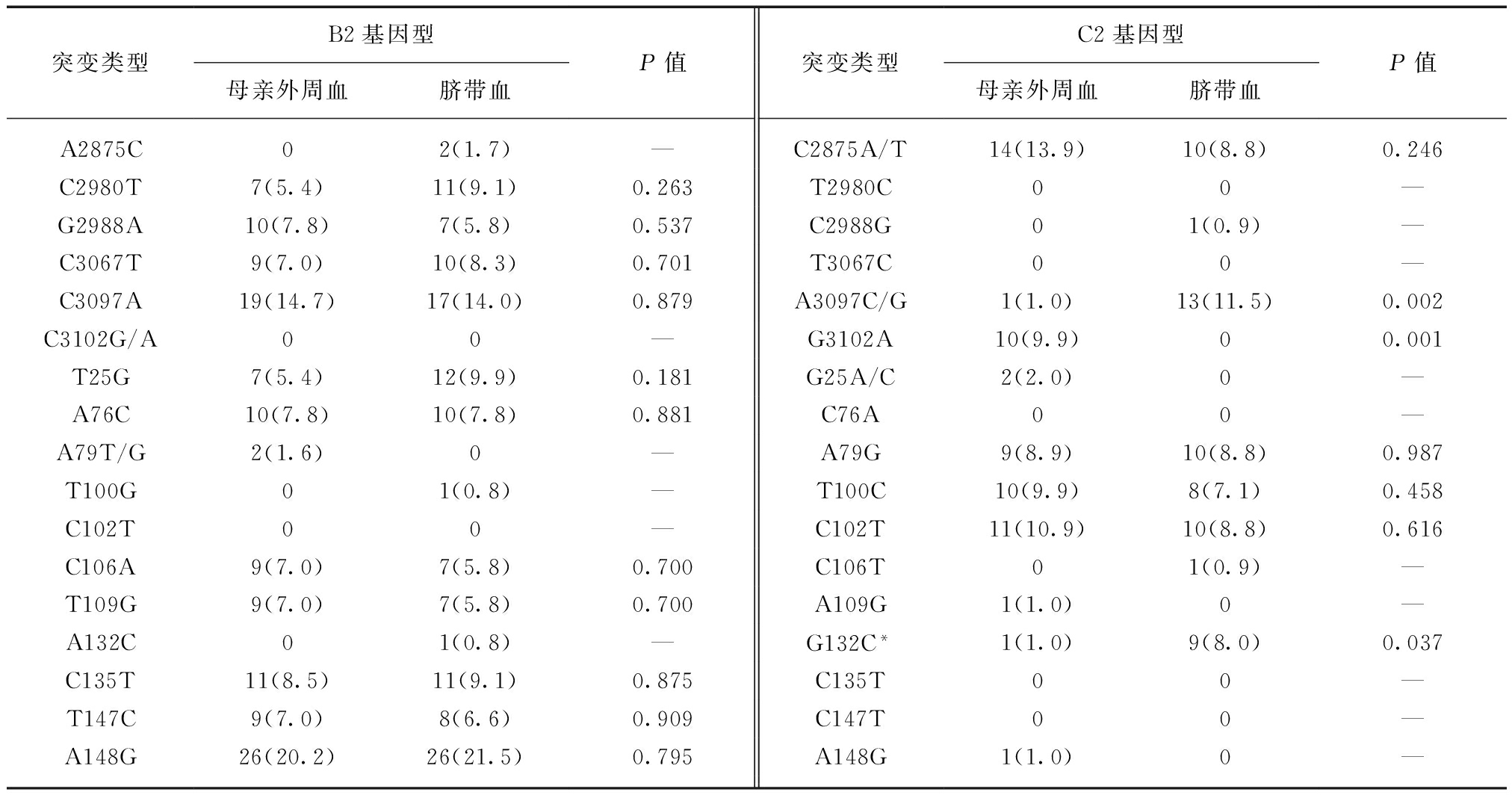
突变类型B2基因型母亲外周血脐带血P值突变类型C2基因型母亲外周血脐带血P值A2875C02(1.7)—C2875A/T14(13.9)10(8.8)0.246C2980T7(5.4)11(9.1)0.263T2980C00—G2988A10(7.8)7(5.8)0.537C2988G01(0.9)—C3067T9(7.0)10(8.3)0.701T3067C00—C3097A19(14.7)17(14.0)0.879A3097C/G1(1.0)13(11.5)0.002C3102G/A00—G3102A10(9.9)00.001T25G7(5.4)12(9.9)0.181G25A/C2(2.0)0—A76C10(7.8)10(7.8)0.881C76A00—A79T/G2(1.6)0—A79G9(8.9)10(8.8)0.987T100G01(0.8)—T100C10(9.9)8(7.1)0.458C102T00—C102T11(10.9)10(8.8)0.616C106A9(7.0)7(5.8)0.700C106T01(0.9)—T109G9(7.0)7(5.8)0.700A109G1(1.0)0—A132C01(0.8)—G132C*1(1.0)9(8.0)0.037C135T11(8.5)11(9.1)0.875C135T00—T147C9(7.0)8(6.6)0.909C147T00—A148G26(20.2)26(21.5)0.795A148G1(1.0)0—
*: 连续矫正
表3 母婴传播中HBV preS区CSHB相关变异的传递
Tab.3 CSHB-related mutations in the preS region of HBV [n(%)]
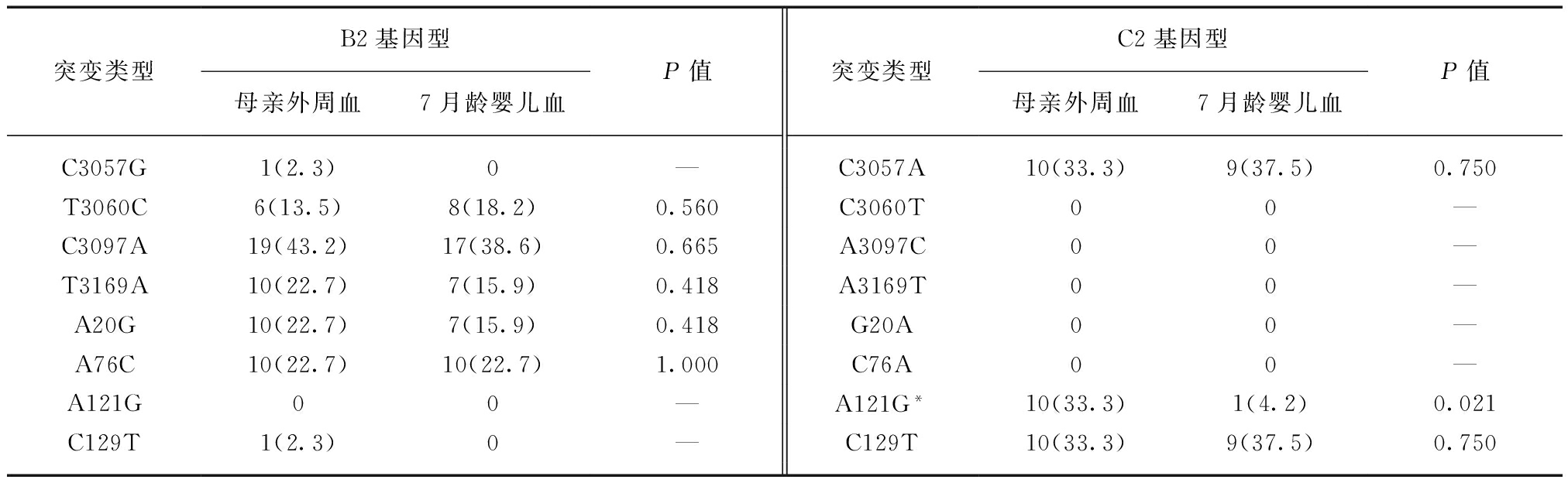
突变类型B2基因型母亲外周血7月龄婴儿血P值突变类型C2基因型母亲外周血7月龄婴儿血P值C3057G1(2.3)0—C3057A10(33.3)9(37.5)0.750T3060C6(13.5)8(18.2)0.560C3060T00—C3097A19(43.2)17(38.6)0.665A3097C00—T3169A10(22.7)7(15.9)0.418A3169T00—A20G10(22.7)7(15.9)0.418G20A00—A76C10(22.7)10(22.7)1.000C76A00—A121G00—A121G*10(33.3)1(4.2)0.021C129T1(2.3)0—C129T10(33.3)9(37.5)0.750
*: 连续矫正
2.4 CSHB相关变异对宫内感染导致婴儿慢性HBV感染过程的影响
上海浦东新区413例母亲-脐带血对中,有104例完成连续7个月的随访,其中4例呈现配对母亲外周血-脐带血-7月龄婴儿外周血HBsAg阳性。4例HBV DNA阳性的7月龄婴儿外周血中,3例由宫内感染途径引起。完成对3例配对母亲外周血-脐带血-7月龄婴儿外周血中HBV基因进化树的构建后,preS区母亲外周血、脐带血的同源性为97.85%~100%,脐带血、7月龄婴儿外周血的同源性为97.64%~100%,母亲外周血、7月龄婴儿外周血的同源性为97.01%~100%,见图2。即宫内感染可造成2.8%(3/104)的婴儿感染慢性HBV。
针对3例由宫内感染造成的慢性HBV母婴传播的配对母亲外周血-脐带血-7月龄婴儿外周血分析后发现,变异位点A76C、C135T在母亲外周血、脐带血、7月龄婴儿血中的突变率均很高。C2基因型中变异位点A109T(87.5% vs 0,P<0.001)不易发生宫内感染;C135T在母亲、新生儿和7月龄婴儿体内均不具有生存优势,见表4。

图2 HBV母婴传播系统发育树
Fig.2 Phylogenetic tree of HBV MTCT
M: 母亲外周血;U: 配对脐带血;C: 随访7个月后,配对7月龄婴儿外周血
表4 母亲外周血、脐带血、7月龄婴儿静脉血中CSHB相关变异位点
Tab.4 Nucleotides exchanges between mothers, umbilical cord and infants[n(%)]

突变类型B2基因型C2基因型母亲外周血配对脐带血7月龄婴儿外周血母亲外周血配对脐带血7月龄婴儿外周血母亲外周血配对脐带血7月龄婴儿外周血总克隆数10910889111111A76C10(100)9(100)10(100)——————A109T———7(87.5)—8(88.9)1(9.1)——C135T———1(12.5)——10(90.9)11(100)11(100)
目前,对CSHB的研究多集中在患者体内免疫系统Th17/Treg比值失衡、IL-21表达上调、CD8+TCR上调等方面,未针对CSHB相关病毒变异在HBV慢性感染早期、母婴传播中进化规律进行详细研究[13-14]。研究证实,妊娠期妇女体内高病毒载量(HBV DNA)、高HBeAg阳性率与妇女妊娠年龄成负相关[11],这与本研究中发生宫内感染组母亲体内γ-GT水平、HBV DNA载量、HBeAg阳性率高于未发生宫内感染母亲,而平均年龄低于未发生宫内感染母亲的结果一致。此外,虽然妊娠期妇女通常处于免疫耐受期,但HBV突变率通常不高[15],本研究中HBsAg阳性母亲外周血、新生儿脐带血中HBV CSHB相关变异的突变率差异不明显,这可能与妊娠期妇女多处于免疫耐受期(高水平HBeAg)有关,即高水平HBeAg对胎盘屏障的免疫抑制作用较明显。表明在HBV的宫内感染阶段,野生型HBV在宫内感染过程中具有生存优势。
在对母亲、7月龄婴儿母子对的分析中,本研究发现了与HBsAg阳性母亲外周血、新生儿脐带血组不同的现象: 母亲、7月龄婴儿母子对中皆出现的CSHB相关变异数目明显减少,只检出8类,而在HBsAg阳性母亲外周血、新生儿脐带血组中检出17类。在我们发现的野生型HBV具有生存优势的基础上,进一步证实了HBV在进化过程中表现出的保守性。不仅如此,本研究还发现在两种基因型HBV中,相较于C2基因型中的低突变率,B2型中CSHB相关变异T3060C、C3097A、T3169A、A20G、A76C具有明显的易感、易传播优势,表明在人体免疫系统的识别下,这些突变具有一定感染优势。
在preS区中,A3097C/G、G132C在母亲、新生儿脐带血中存在明显差异,即含有A3097C/G、G132C的HBV突变株在跨胎盘传播过程中具有较强的生存优势;A121G则增加了HBV母婴传播导致7月龄婴儿感染慢性HBV的危险性。虽然母婴传播仍是导致HBV突破性感染的主要原因,但完整的新生儿免疫接种计划已经使婴儿慢性HBV感染率减少了72%~92%[16-17],本研究亦证实: 母婴传播宫内感染途径只导致了2.8%的免疫后7月龄婴儿感染慢性HBV。
尽管只有一部分HBsAg阳性母亲体内存在与CSHB相关变异,但已发现部分CSHB相关变异可通过MTCT途径传播。因此,选择更好的阻断HBV母婴传播中CSHB相关变异传递的方法,是一个值得深入研究的减少HBV母婴传播、减少慢性乙型重型肝炎发病率的方向。
【参考文献】
[1] 胡世兵,顾建平,吴四明,等.原发性肝癌肝外供血动脉TACE治疗的可行性评估[J].同济大学学报(医学版),2016,37(1): 89-92.
[2] CAO G W. Clinical relevance and public health significance of hepatitis B virus genomic variations[J]. World J Gastroenterol, 2009,15(46): 5761-5769.
[3] DENG M, ZHOU X, GAO S, et al. The effects of telbivudine in late pregnancy to prevent intrauterine transmission of the hepatitis B virus: a systematic review and meta-analysis[J]. Virol J, 2012,9: 185.
[4] XIONG Y, TAN Y, SONG Y G. Analysis of T cell receptor Vβ diversity in peripheral CD4+ and CD8+ T lymphocytes obtained from patients with chronic severe hepatitis B[J]. Hepat Mon, 2014,14(2): e15900.
[5] 刘扬,王跃如,姚乐,等.肝细胞癌胆管转移致阻塞性黄疸的外科治疗[J].同济大学学报(医学版),2016,37(2): 49-51.
[6] SALPINI R, SVICHER V, CENTO V, et al. Characterization of drug-resistance mutations in HBV D-genotype chronically infected patients, naïve to antiviral drugs[J]. Antiviral Res, 2011,92(2): 382-385.
[7] LIU S J, XIE J X, YIN J H, et al. A matched case-control study of hepatitis B virus mutations in the preS and core promoter regions associated independently with hepatocellular carcinoma[J]. J Med Virol, 2011,83(1): 45-53.
[8] WU W, CHEN Y, RUAN B, et al. Gene heterogeneity of hepatitis B virus isolates from patients with severe hepatitis B[J]. Hepatobiliary Pancreat Dis Int, 2005,4(4): 530-534.
[9] 艾香英.重型肝炎与HBV PreS区基因突变的关系研究及中医干预的疗效观察[D].广州: 广州中医药大学,2013.
[10] ELEFSINIOTIS I S, PAPADAKIS M, VLACHOS G, et al. Presence of HBV-DNA in cord blood is associated with spontaneous preterm birth in pregnant women with HBeAg-negative chronic hepatitis B virus infection[J]. Intervirology, 2011,54(5): 300-304.
[11] LI Z X, XIE Z Y, NI H X, et al. Mother-to-child transmission of hepatitis B virus: evolution of hepatocellular carcinoma-related viral mutations in the post-immunization era[J]. J Clin Virol, 2014,61(1): 47-54.
[12] LI Z X, HOU X M, CAO G W. Is mother-to-infant transmission the most important factor for persistent HBV infection[J]. Emerg Microbes Infect, 2015,4(5): e30.
[13] LIU B, GAO W, ZHANG L. Th17/Treg imbalance and increased interleukin-21 are associated with liver injury in patients with chronic severe hepatitis B[J]. Int Immunopharmacol, 2017,46: 48-55.
[14] YUAN L Y, KE Z Q, WANG M, et al. Procalcitonin and C-reactive protein in the diagnosis and prediction of spontaneous bacterial peritonitis associated with chronic severe hepatitis B[J]. Ann Lab Med, 2013,33(6): 449-454.
[15] 刘敏,李自雄,路卫,等.乙型肝炎病毒垂直传播的危险因素和预防策略[J].上海预防医学,2016,28(7): 464-468.
[16] WEN W H, CHEN H L, NI Y H, et al. Secular trend of the viral genotype distribution in children with chronic hepatitis B virus infection after universal infant immunization[J]. Hepatology, 2011,53(2): 429-436.
[17] HANN H W, HANN R S, MADDREY W C. Hepatitis B virus infection in 6,130 unvaccinated Korean-Americans surveyed between 1988 and 1990[J]. Am J Gastroenterol, 2007,102(4): 767-772.
Evolutionary tendency of chronic severe hepatitis B-related mutations in mother-to-child transmission of hepatitis B virus
【Abstract】 Objective To study the evolutionary tendency of chronic severe hepatitis B (CSHB)-related mutations in the preS region of hepatitis B virus (HBV) during mother-to-child transmission. MethodsPeripheral blood from HBsAg-positive mothers, umbilical cord blood from newborns, and peripheral blood from 7-month old infants who
received:intact vaccination were collected. Cloning sequencing was conducted to detect the viral mutations. Genotyping and phylogenetics analysis were conducted to determine the mother-to-child transmission of HBV. The Pearson Chi-square test and continuity correction were applied to evaluate the categorical variables.Results HBV strains with CSHB-related mutations C2875T, C2980T, G2988A, C3067T, C3097A, T25G, A76C, A79G, T100C, C102T, C106A, T109G, C135T, T147C and A148G could be transmitted to newborns through intrauterine pathway. HBV mutations includingA3097C/G and G132C had survival advantages in intrauterine transmission and chronicity (P<0.05; P<0.05). Genotype B2 HBV strains with mutations C3057G, T3060C, C3097A, T3169A, A20G, A76C, and C129T could be transmitted to 7-month old infants through mother to child transmission, while the similar phenomenon was not observed in genotype C2 HBV strains. Conclusion More CSHB-related mutations could be detected in genotype B2 HBV during mother-to-child transmission. After the immunization, HBV without the CSHB-related mutations has advantage of infecting infants and reflects the conservative nature on evolution perspectives of HBV.
【Key words】 hepatitis B virus; chronic severe hepatitis B; mutations; trans-placental HBV transmission; mother-to-child transmission
doi: 10.16118/j.1008-0392.2017.04.011
收稿日期: 2017-02-09
基金项目: 国家自然科学基金重点国际合作项目(81520108021)
【中图分类号】 R373.2
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0049-06