·基础研究·
【摘要】 目的 观察TBB作用下乳腺癌细胞中miR- 411的表达,研究过表达miR- 411对乳腺癌细胞凋亡和细胞周期改变的影响。方法 Real-time PCR验证生物芯片检测的差异miRNAs,流式细胞术分析转染前后细胞周期及细胞凋亡情况,针对miR- 411进行下游靶基因预测,以real-time PCR验证预测结果。结果 TBB作用下MCF-7细胞株中miR- 411显著升高;与对照组相比,转染组早期凋亡细胞比例升高;FoxO1 mRNA表达含量显著增高。结论 TBB能够改变乳腺癌MCF-7细胞株中miR- 411的表达,过表达miR- 411能够抑制乳腺癌细胞株的凋亡,其机制可能与通过影响FoxO1表达有关。
【关键词】 乳腺肿瘤; 蛋白激酶CK2的抑制剂; miR- 411; 细胞凋亡
四溴苯三唑(4,5,6,7-tetra-bromo-benzotriazole, TBB)是一种蛋白激酶CK2的抑制剂,是一种存在于细胞质和核质中多功能的信使非依赖性丝/苏氨酸蛋白激酶,通过对底物的磷酸化在细胞的增殖分化、信号转导加工及细胞凋亡等众多方面有着重要作用[1]。
微小RNA(microRNA, miRNA)作为非编码性小分子RNA通过mRNA降解和翻译抑制在肿瘤形成和发展中发挥着重要的作用,扮演着肿瘤侵袭、凋亡、耐药调节者的关键角色。人乳腺癌中同样存在各种异常表达的miRNA。miR- 411在一些肿瘤组织和细胞中也存在表达异常。Skalsky等[2]指出miR- 411在胶质母细胞瘤中相对于与周围组织表达过量;有学者指出在子痫前期患者胎盘组织中发现miR- 411表达降低,并阐明其发病可能受到miRNA的调控[3]。本文研究分析TBB影响下人类乳腺癌MCF-7细胞中差异表达的miRNA,进一步研究差异表达的miR- 411对乳腺癌细胞凋亡产生的影响,针对miR- 411进行下游靶基因预测,探讨其与蛋白激酶CK2信号转导通路之间的关系及在乳腺癌发生发展中的作用。
1.1 实验材料
人类乳腺癌MCF-7细胞株,购自中国科学院细胞所;TBB购自Calbiochem;DMEM、胎牛血清购自Gibco;TRIzol和脂质体Lipofectamine 2000购自Invitrogen公司;hsa-miR- 411 mimic购自上海吉玛制药技术有限公司;real-time PCR试剂购自TaKaRa公司;miRcute miRNA提取分离试剂购自天根生化科技(北京)有限公司;miRNAs及靶基因引物购自上海捷瑞生物工程有限公司。
1.2 方法
1.2.1 细胞培养、分组与转染 用DMEM培养液培养人类乳腺癌MCF-7细胞株,细胞培养箱(5% CO2,37℃,饱和湿度)孵育细胞,至细胞融合约 70%~80%进行传代。将细胞随机分为3组: 正常对照组(负对照组)、空白载体组(空对照组)、和转染hsa-miR- 411-mimic组(实验组)。取对数生长期的细胞,以1×106的密度接种至96孔板内,用Lipofectamine2000脂质体转染,操作按照Lipofectamine2000说明书进行,混匀后置于细胞培养箱中4~6h,细胞换液,每孔加入2ml培养基;置于细胞培养箱中18~48h后,收集细胞,检测表达。
1.2.2 生物芯片技术检测miRNAs表达 既往实验[4]通过从TBB处理48h后的实验组及对照组MCF-7细胞株提取并分离出RNA,并利用MiRCURYTMHy3TM/Hy5TM Power labeling kit (Exiqon, Vedbaek, Denmark)标记miRNAs,在miRCURYTM LNA Array (v.16.0) (Exiqon)上进行Hy3TM标记样品的杂交反应。使用Axon GenePix 4000B生物芯片扫描仪(Axon Instruments, Foster City, CA)对所有样品进行扫描。将扫描图像输入GenePix Pro 6.0软件(Axon),以调整栅极和提取信息,标准化数据后筛选所有差异表达miRNAs。
1.2.3 real-time PCR检测 检测miR- 411表达水平: 按照miRcute miRNA提取分离试剂盒说明书进行miRNAs的抽提,根据各miRNAs的序列设计出对应的茎环引物和上游引物,选用8.6μl体系,进行cDNA的合成,逆转录反应条件为: 16℃ 30min,42℃ 30min,85℃ 8min,4℃ 10min,反应结束后置于冰上操作,采用real-time PCR,反应选用20μl体系,扩增条件: 95℃ 2min,95℃ 30s,60℃ 45s,共40个循环,72℃ 5min。实验结果在荧光定量操作系统中进行分析对比,采用2-ΔΔCt对目标基因miR- 411的mRNA表达进行相对定量。引物序列如下。miR- 411 上游引物: CGC AGGGGGAAAGTTCTAT;下游引物: GTCGTATCCAGTGCAGGGTCCGAGGTATT CGCACTGGATACGAC GGACTA。
检测靶基因mRNA表达水平: 按照TRIozl试剂说明书进行总RNA的抽提,cDNA的合成根据TaKaRa公司PrimeScriptTM real-time PCR kit说明书进行。选用20μl体系,扩增条件均同上。实验结果在荧光定量操作系统中进行分析对比,采用2-ΔΔCt对相关靶基因的mRNA表达进行相对定量。
1.2.4 流式细胞术 检测细胞周期has-miR- 411-mimic转染后36h,离心半径17.8cm,1500r/min,离心5min收集细胞,加入预冷的70%乙醇,4℃固定过夜,RNase(终浓度为0.1g/L)消化30min,细胞染色: 加入0.05g/L碘化丙啶250μl,室温避光反应30min后上机检测。根据公式计算细胞增殖指数(proliferation index, PI)以衡量细胞的分裂活动PI=(S+G2M)/(G0G1+S+G2M)。
检测细胞凋亡hsa-miR- 411-mimic转染后36h,离心半径17.8cm,1500r/min,离心5min收集细胞;按ApoScreenTM Annexin Ⅴ Apoptosis Kit试剂盒说明配制标记液,标记每105细胞加入 52.5μl Annexin Ⅴ液,混匀后避光反应20min后,加入 255μl 碘化丙啶,避光反应3~5min,混匀后在通过Annexin V-FITC/PI双染流式细胞计数定量分析,检测miR- 411作用于乳腺癌MCF-7细胞株后对细胞凋亡的影响。
1.2.5 miR- 411靶基因预测 miRNA与其潜在的靶基因的结合具有一定规律性,可以通过生物信息学技术进行编程从而预测miRNA的潜在靶基因。检索hsa-miR- 411,通过PicTar、miRDB、MicroCosm、TargetScan等4个数据库,收集、归纳、整理,利用Cytoscape软件计算出共同的预测靶基因。并利用基因功能在线分析网站对其发挥的主要生物学功能、分子生物学功能进行分类。
1.3 统计学处理
SPSS 15.0软件分析各组数据均以![]() 表达,Real-time PCR检测结果经过内参基因均一化处理,通过2-ΔΔCt方式计算,目标基因表达差异以倍数来表示;采用两独立样本的秩和检验(Mann-Whitney U)分析不同组的细胞周期、凋亡数据。P<0.05为差异有统计学意义。
表达,Real-time PCR检测结果经过内参基因均一化处理,通过2-ΔΔCt方式计算,目标基因表达差异以倍数来表示;采用两独立样本的秩和检验(Mann-Whitney U)分析不同组的细胞周期、凋亡数据。P<0.05为差异有统计学意义。
2.1 miRNAs生物芯片检测结果
既往实验中,将校正后的微阵列芯片数据导入Cluster 3.0,采用Median center、Hierarchical及Average linkage进行聚类分析。结果显示,TBB处理后的实验组相比较于对照组miR-331-3p、miR-24、miR-181、miR-101、miR-3607-3p、miR-320a、miR-15a、miR-300、miR-141、miR- 429、miR-34a、miR- 411、miR-93、miR-652、miR-191、miR-23b,16个miRNAs表达上调(P<0.05);而miR-634、miR-3178、miR- 4317、miR-593、miR-302c、miR-625、miR-3676、miR-1469、miR-H14-3p、miR-BART8、miR-3195,11个miRNAs则表达下调(P<0.05)。
2.2 PCR验证芯片结果
通过real-time PCR验证TBB处理前后的乳腺癌MCF-7细胞相关miRNAs的表达变化。结果显示miR-181表达具有显著升高,miR-181在实验组中ΔCt为-(1.484±0.273),而对照组中ΔCt为 -(0.435±0.270),两者差异有统计学意义(P<0.01);另外miR- 411、miR-331-3p、miR-93、miR- 625的表达在TBB处理前后也具有差异,其在实验组中ΔCt分别为4.962±0.462、8.648±4.994、10.157±0.656、7.811±0.657,而对照组中ΔCt分别为6.565±1.145、11.002±6.267、12.319±1.421、6.353±0.866,前后两组差异有统计学意义(P<0.05),其中miR-625的表达较对照组有所降低;而本次试验中其余miR-3607、miR-593、miR101、miR-652等7个miRNAs较对照组相比,差异无统计学意义(P>0.05),见表1。
表1 Real-time PCR验证芯片结果数据
Tab.1 The results of microRNAs expression in different treatment by RT-PCR

待验证miRNA实验组ΔCt值对照组ΔCt值P值miR-3607-3p0.882±0.7811.060±0.2700.642miR-181-1.485±0.273b-0.435±0.3590.001miR-5930.010±0.2970.818±0.8050.068miR-4114.962±0.462a6.565±1.1440.020miR-331-3p8.648±4.995a11.002±6.2670.026miR-9310.157±0.656a12.319±1.4210.015miR-6257.811±0.657a6.353±0.8670.017miR-10110.602±0.86710.729±1.6780.068miR-1418.028±0.6507.957±0.9660.289miR-6343.242±0.5673.289±0.6620.264miR-6528.958±1.0478.083±1.9110.090miR-3005.833±2.0935.079±3.1770.154
与对照组相比,aP<0.05,bP<0.01
2.3 流式细胞技术检测细胞周期结果
用100nmol/L miR- 411转染的MCF-7细胞36h后,流式细胞仪分析显示,可见G0/G1期细胞数量百分比为(58.94±1.70)%,相比较空对照组及负对照组的G0/G1期细胞数量百分比(39.12±3.82)%及(40.81±1.94)%明显增多,差异具有统计学意义(P<0.01),三组间G2/M期细胞数量百分比无明显变化,而miR- 411转染的MCF-7细胞株S期细胞数量明显减少,其细胞数量百分比为(17.50±3.82)%,细胞增殖指数明显降低,差异具有统计学意义(P<0.01)。根据上述结果,考虑miR- 411是作用于G0/G1期,使细胞停滞在该期,当上调了miR- 411的表达后,使得S期细胞明显减少,见表2,图1、图2。
表2 miR- 411作用后36h对乳腺癌MCF-7细胞周期的影响
Tab.2 The results of the flow cytometry in three groups

组别细胞周期G0/G1期S期G2/M期PI值实验组58.94±1.70*17.50±3.82a23.55±2.2341.06±1.70*负对照组39.12±3.8237.64±3.1523.24±2.7660.88±3.82空对照组40.81±1.9434.14±1.2425.04±2.5159.19±1.94
与负对照组及空对照组比较,*P<0.01
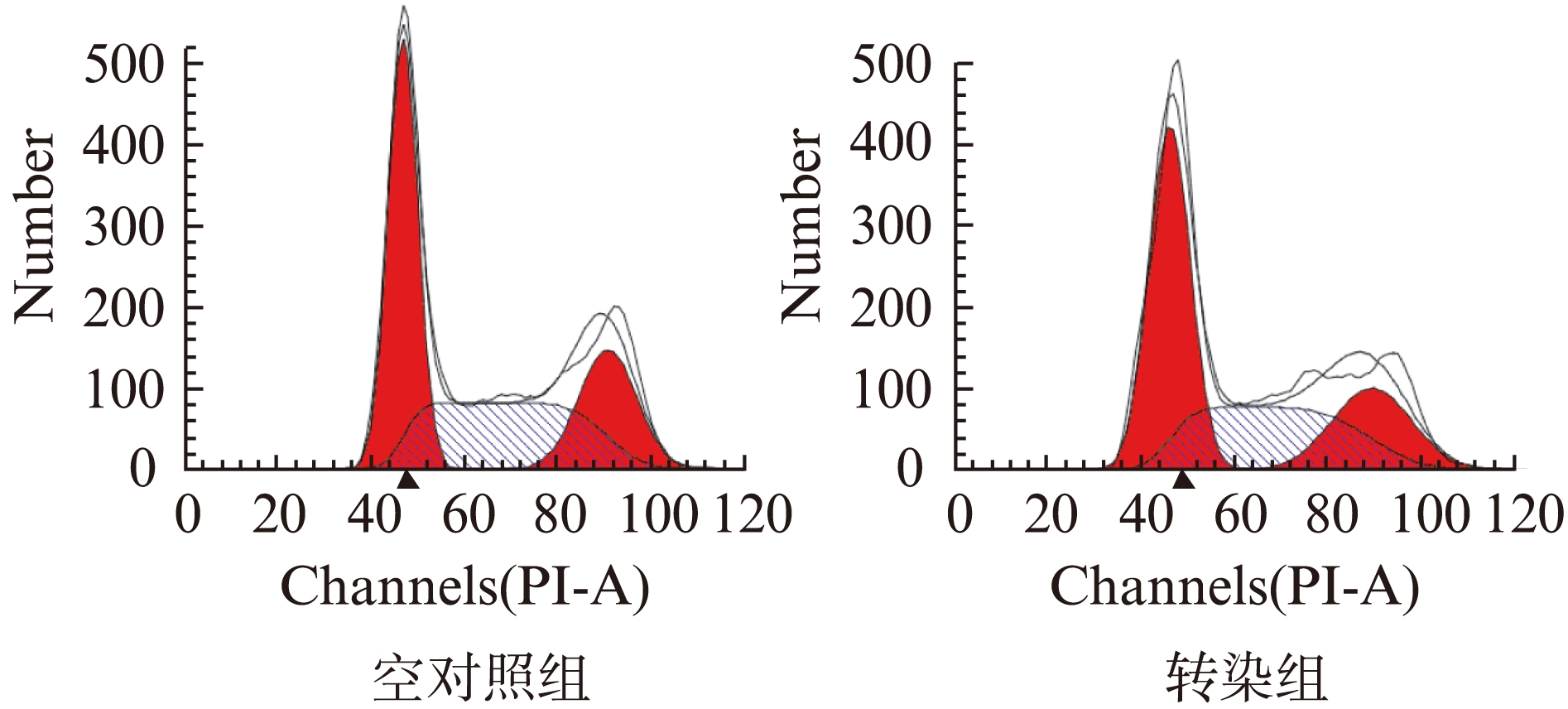
图1 对照组与转染组细胞周期检测图
Fig.1 Changes of the cell cycle in flow cytometry

图2 miR- 411作用后36h对细胞周期的影响
Fig.2 Changes of cell cycle in MCF-7 transfected with miR- 411 mimic
与S期相比,*P<0.01,与实验组、对照组细胞数目相比,#P<0.01
2.4 流式细胞仪检测细胞凋亡结果
结果显示,在乳腺癌MCF-7细胞中过表达miR- 411可诱导细胞发生早期凋亡反应(26.83±1.48)%,与空对照组(12.63±1.02)%、负对照组(11.78±1.58)%相比,差异具有显著统计学意义(P<0.01),见图3。
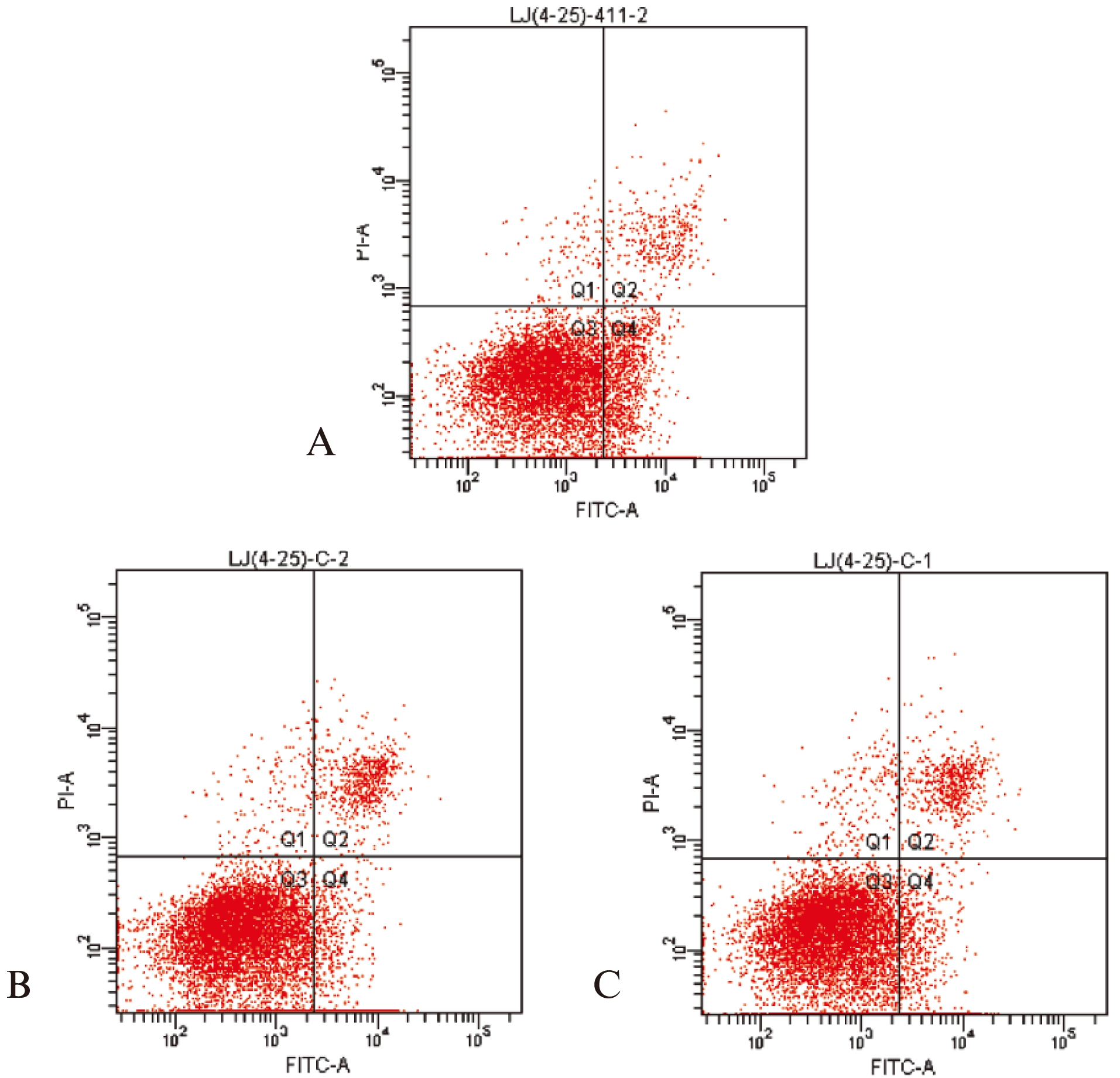
图3 各组流式细胞术分析细胞凋亡图
Fig.3 The results of the tumor cell apoptosis in three groups
A: 实验组,凋亡细胞比例25.2%;B: 负对照组,凋亡细胞比例10.8%;C: 空对照组,凋亡细胞比例13.2%
2.5 miR- 411的基因信息及靶基因预测结果
MiRBase数据库显示: 成熟的hsa-miR- 411全长22nt,序列为UAUGUAACACGG UCCACUAACC。Pubmed数据库显示: 编码miR- 411的基因定位在14q32.31的101489662-101489757bp区域。利用PicTar、TargetScan,MicroCosm、miRDB四个靶基因在线预测软件对miR- 411进行靶基因预测,结果显示4个数据库同时预测出的靶基因为: RYBP、ErbB4、TNRC6b、UBE2R2、AKAP5、ZNF518A、GTF2B、FoxO1、FBXO34、CAMSAP1,同10种同预测靶基因。将筛选出的靶基因于在线Gene Ontology进行GO分类后发现,他们的主要生物学功能包括: 细胞周期调控、细胞凋亡调控、蛋白激酶调控、转录因子、细胞或基质间黏附等功能。
2.6 PCR验证预测结果
对预测靶基因进行分析,按照PubMed上提供的基因序列及基因ID设计出上游及下游引物。通过荧光定量Real-time PCR检测在转染组与对照组中的mRNA含量的表达变化。结果显示FoxO1 mRNA表达升高,其余靶基因mRNA表达并未见明显差异(P>0.05)。FoxO1在转染组中ΔCt为2.680±1.860,而对照组中ΔCt为6.836±1.290,两者差异有统计学意义(P<0.05),见表3。
表3 Real-time PCR验证预测基因mRNA表达结果
Tab.3 The results of the mRNAs expression in target genes by RT-PCR
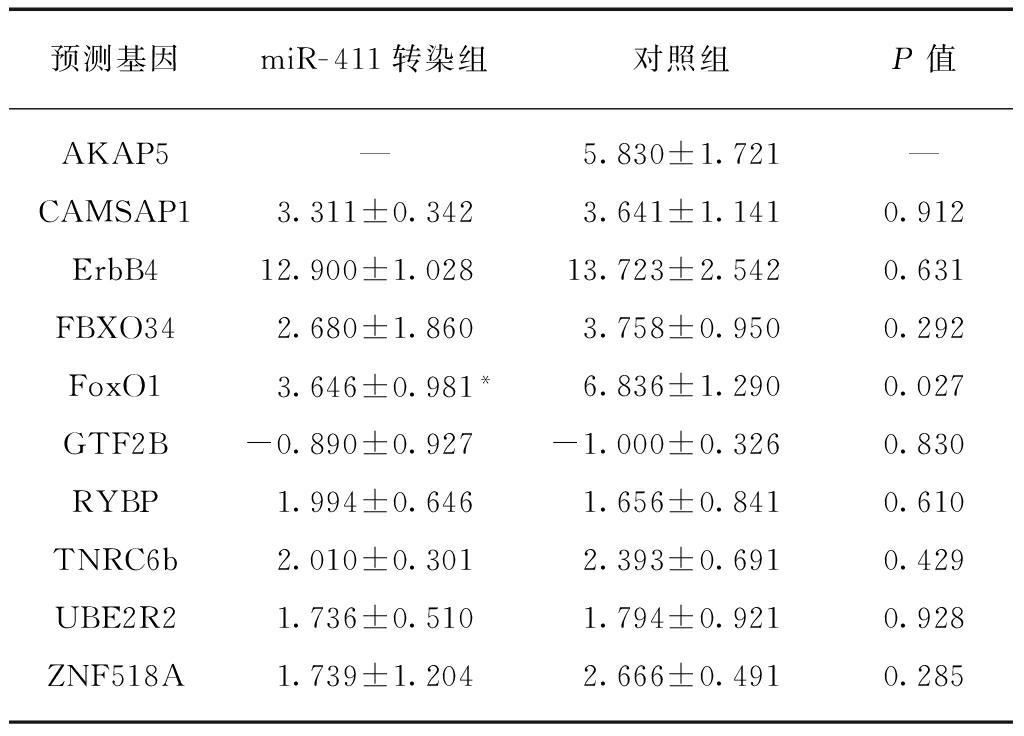
预测基因miR-411转染组对照组P值AKAP5—5.830±1.721—CAMSAP13.311±0.3423.641±1.1410.912ErbB412.900±1.02813.723±2.5420.631FBXO342.680±1.8603.758±0.9500.292FoxO13.646±0.981*6.836±1.2900.027GTF2B-0.890±0.927-1.000±0.3260.830RYBP1.994±0.6461.656±0.8410.610TNRC6b2.010±0.3012.393±0.6910.429UBE2R21.736±0.5101.794±0.9210.928ZNF518A1.739±1.2042.666±0.4910.285
对照组相比,*P<0.05
CK2作为重要的生物蛋白激酶,除调节已知的下游基因外,对miRNA也可能有非常重要的调节作用。在实验中,鉴于生物芯片和real-time PCR验证的结果,证明miR- 411在TBB作用下乳腺癌MCF-7细胞株中表达升高,进一步通过Lipofectamine2000脂质体转染hsa-miR- 411 mimics从而提升乳腺癌MCF-7细胞中miR- 411的表达活性后发现,miR- 411对乳腺癌MCF-7细胞凋亡产生影响,明确了miR- 411作为潜在的TBB作用底物从而探讨TBB除了目前已明确的磷酸化HS1蛋白通路外,存在其他作用底物及下游传导通路。实验最后对预测的miR- 411下游靶基因进行了验证,发现miR- 411可能通过某通路影响FoxO1 mRNA的表达,进而参与细胞周期的调控、细胞凋亡的调节等环节。因此通过生物信息学分析将蛋白激酶CK2、miR- 411与FoxO1联系在一起,为进一步深入研究其如何对肿瘤发生发展产生影响提供了方向。
3.1 miR- 411在TBB作用下乳腺癌细胞株中表达
研究发现CK2与细胞凋亡也存在密切的联系。其对凋亡的控制主要通过细胞核中的信号来实现,尤其是核质和染色体是蛋白激酶CK2优先作用的靶点,在增殖细胞和实体肿瘤细胞中可以检测到CK2在核中的含量及活性的明显高于正常细胞。而CK2抑制剂抑制细胞凋亡也是对与细胞相关的一系列凋亡因子磷酸化,其中较常见的是Max(为c-Myc原癌基因的转录产物),当其受到凋亡信号的刺激时,Max蛋白免受Caspase介导的降解,出现对凋亡反应的一系列改变[5]。其作用于细胞对其进行凋亡、增殖调控的同时,对miRNAs也可能有非常重要的调节作用。本次实验中根据生物芯片及real-time PCR也筛选出许多未被人们发现、具有差异的miRNAs。而这些miRNAs可能作为生物蛋白激酶CK2未知的下游基因外,对乳腺癌细胞的功能进行调节。
3.2 上调乳腺癌细胞株miR- 411表达后的相关研究
利用脂质体介导技术将生物合成的hsa-miR- 411 mimics转染至人乳腺癌MCF-7细胞株中,提升乳腺癌MCF-7细胞中miR- 411的表达活性。miRNAs mimics相当于靶miRNA的前体分子,进入细胞后参与形成RISC复合体,从而增强内源性靶miRNA的翻译作用。在流式细胞术对细胞周期及细胞凋亡数据的分析中显示,miR- 411转染组中G0/G1期细胞数量明显增多,S期细胞数量减少,细胞增殖指数PI下降。且miR- 411在人乳腺癌MCF-7细胞株中的表达升高可诱导其发生早期凋亡反应。
目前预测miRNAs的靶基因成为当前筛选miRNAs靶基因较为理想的方法。从已知的miRNAs与靶基因之间的相互作用中,研究者可以得出miRNA5′端2~8个核苷酸(称为种子序列)可以与靶mRNA3′端的UTR区完全互补[6]。利用这一特性,许多靶基因预测软件诞生并被广泛采用。通过miRNAs与其靶基因自然配对的基本原理,不同研究小组在各种不同计算机预测,开发出多个miRNAs靶基因预测软件,主要的有: miRanda、TargetScan、PicTar、miRDB等。其各具特点,通过热力学特征原理进行多物种保守或非保守、单位点或共位点的预测,此外,还有许多在线预测网站可供学者们查询相关数据,例如: miTarget、microTar、miRacle等[7]。
利用real-time PCR对预测的下游靶基因进行了验证,发现FoxO1 mRNA在hsa-miR- 411 mimics脂质体转然后出现表达上升,与对照组相比差异具有统计学意义(P<0.05)。根据现有人们的发现,miRNAs仅能通过对mRNA降解和对蛋白翻译来发挥其功能,故FoxO1可能并非为miR- 411的下游直接作用的位点,而其差异的存在提示了可能存在其他作用途径影响了FoxO1 mRNA的表达上调。
FoxO1(Forkhead box O1)家族是PI3k/Akt信号转导通路的下游靶点,由功能相关的FoxO1、FoxO3a、FoxO4、FoxO6等4个成员组成,是一种保守的基因转录激活因子。FoxO家族蛋白参与着细胞凋亡、细胞自我吞噬、DNA损伤修复、细胞周期、细胞分化相关的下游基因的调节,其中FoxO对Bim、Trail及Fas L等基因的调控,可影响肿瘤细胞的凋亡,对p21、p27及cyclin D1的调控可影响细胞的生长周期,另外,FoxO家族蛋白可GADD45a对于DNA损伤修复以及Atg7基因对于细胞自我吞噬功能产生调节作用。同时FoxO家族蛋白在TGF-β介导的p21CIP1上调中起作用,而该过程又可被PI3k所负调控,胰岛素等诱导的增殖信号也会导致FoxO蛋白通过Akt介导的Thr24、Ser256和Ser319位点的磷酸化,导致FoxO从细胞核中转运到细胞浆中,从而抑制其转录活性[8]。
FoxO1作为某些肿瘤的抑癌基因,参与细胞周期的抑制、细胞凋亡调控及抗氧化应激、DNA修复等多个环节,其表达的FoxO1蛋白更被认为是一种细胞增殖的负性调节因子,同时也是一种细胞凋亡促进因子。有研究报道在喉鳞癌中,miR-132能够通过PI3K/AKT通路使得细胞中FoxO1基因表达降低,从而促进了肿瘤细胞生长[9]。在Samuels等[13]在研究中使用了PI3激酶抑制剂LY294002,其仅能稍微抑制FoxO1和FoxO3的磷酸化,却发现很有效地抑制了结肠癌HCT116、DLD1细胞株的细胞增殖。国外学者也发现,在FoxO1低表达的乳腺癌细胞MCF-7中,利用miR-27a、miR-96、miR-182可显著提升FoxO1蛋白的表达,从而降低细胞增殖、使细胞G1期停滞,并诱导细胞死亡。最近,Lou等[14]研究中发现,在上调肝癌HepG2 and SMMC-7721细胞株中miR-142-5p的表达活性后,细胞中FoxO1、FoxO3 mRNA及蛋白表达均上升,且细胞增殖受到明显抑制。
本研究发现hsa-miR- 411可能通过调控FoxO1基因的上游通路,从而影响FoxO1 mRNA的表达,进而参与细胞周期的调控、细胞凋亡的调节等。因此通过生物信息学分析将蛋白激酶CK2、miR- 411与FoxO1通路联系在一起,其可能通过互相调控作用对肿瘤发生发展产生影响,这些研究为我们进一步深入研究miR- 411如何具体调控FoxO1的表达进而参与调控乳腺癌增殖及凋亡提供了方向。
【参考文献】
[1] BREHME H, KIRSCHSTEIN T, SCHULZ R, et al. In vivo treatment with the casein kinase 2 inhibitor 4,5,6,7-tetrabromotriazole augments the slow afterhyperpolarizing potential and prevents acute epileptiform activity[J]. Epilepsia,2014,55(1): 175-183.
[2] SKALSKY R L, CULLEN B R. Reduced expression of brain-enriched microRNAs in glioblastomas permits targeted regulation of a cell death gene[J]. PLoS One, 2011,6(9): e24248.
[3] 俞凌,朱晓明,王珺,等.子痫前期患者胎盘组织中miR- 411表达的研究[J].科学技术与工程,2009,9(10): 2583-2586.
[4] LI D, CHEN L, FANG L, et al. Alterations of microRNAs are associated with impaired growth of MCF-7 breast cancer cells induced by inhibition of casein kinase 2[J]. Int J Clin Exp Pathol, 2014,7(7): 4008-4015.
[5] KRAMEROV A A, GOLUB A G, BDZHOLA V G, et al. Treatment of cultured human astrocytes and vascular endothelial cells with protein kinase CK2 inhibitors induces early changes in cell shape and cytoskeleton[J]. Mol Cell Biochem, 349(1-2): 125-137.
[6] KREK A, GRUN D, POY M N, et al. Combinatorial microRNA target predictions[J]. Nat Genet, 2005,37(5): 495-500.
[7] GENDRON C, SCHWENTKER A, VAN AALST J A. Genetic Advances in the Understanding of Microtia[J]. J Pediatr Genet, 2016,5(4): 189-197.
[8] SAMUELS Y, DIAZ LA J R, SCHMIDT-KITTLER O, et al. Mutant PIK3CA promotes cell growth and invasion of human cancer cells[J]. Cancer Cell, 2005,7(6): 561-573.
[9] LOU K, CHEN N, LI Z, et al. MicroRNA-142-5p overexpression inhibits cell growth and induces apoptosis by regulating FOXO in hepatocellular carcinoma cells[J]. Oncol Res, 2017,25(1): 65-73.
Expression of miR- 411 in breast cancer cells with TBB treatment and its relation to cell apoptosis
【Abstract】 Objective To investigate the expression of miR- 411 in breast cancer cells after treated with TBB and its relations to cell cycle and apoptosis. Methods Breast cancer MCF-7 cells were transfected with hsa-miR- 411-mimic and treated by 4,5,6,7-tetra-bromo-benzotriazole (TBB). The expression of microRNAs in MCF-7 cells were detected by microRNAs array, and real-time PCR. The cell cycle and apoptosis of MCF-7 cells were analyzed by flow cytometry after hsa-miR- 411 mimics transfection. The possible target of miR- 411 was forecasted by bioinformatics tools and the expression of the possible target gene was detected by real-time PCR. Results Real-time PCR showed that the expression of miR- 411 was changed after TBB treatment in MCF-7 cells. Flow cytometry showed that early apoptotic cells in transfected groups dramatically increased compared to control groups. Real-time PCR showed that the expression of FoxO1 mRNA was significantly upregulated. Conclusion The expression of miR- 411 is altered after the introduction of CK2 inhibitor TBB. Transfection with miR- 411 mimics can increase phase G0/G1 cells, inhibiting cell proliferation and promoting apoptosis. FoxO1 gene may be involved in the pathway of tumor cell proliferation and apoptosis.
【Key words】 breast cancer; TBB; miR- 411; cells apoptosis
doi: 10.16118/j.1008-0392.2017.04.007
收稿日期: 2017-04-18
【中图分类号】 R 655.8
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0031-06