·基础研究·
【摘要】 目的 观察Runx2在人退变腰椎间盘软骨终板中的表达情况并探讨其与软骨终板退变的关系。方法 收集人腰椎间盘软骨终板组织42例,其中,椎体骨折患者的手术标本20例为对照组,椎间盘退变患者的手术标本22例为实验组。H-E染色、免疫组织化学法、及PCR法检测Runx2的表达量;Western印迹法检测两组之间Runx2、aggrecan及collagen I的表达量。结果 对照组终板软骨结构清晰完整,而退变组的软骨终板结构破坏严重。正常终板软骨中几乎没有Runx2的表达,退变的软骨终板可见明显的Runx2阳性细胞。轻度退变组、中度退变组和重度退变组Runx2 mRNA的表达量分别为对照组的(4.74±0.78)、(7.74±0.97)、(16.97±1.89)倍。Runx2 mRNA的表达量与腰椎间盘软骨终板退变的程度呈明显的正相关。Western印迹法显示,轻度退变组Runx2、aggrecan及collagen I蛋白表达量分别为对照组的(2.79±0.52)倍、(0.48±0.12)、(0.67±0.17)差异有统计学意义(均P<0.05);中度退变组Runx2、aggrecan及collagen I蛋白表达量分别为对照组的(4.40±1.78)倍、(0.23±0.14)、(0.36±0.12)差异有统计学意义(均P<0.01);重度退变组Runx2、aggrecan及collagen I蛋白表达量分别为对照组的(8.75±1.88)倍、(0.13±0.09)、(0.08±0.03)差异有统计学意义(均P<0.01)。结论 Runx2可以作为预测腰椎间盘退变和软骨终板退变严重程度的指标,并可作为治疗腰椎间盘退变性疾病的潜在靶点。
【关键词】 椎间盘退变; 腰椎; 软骨终板退变; Runt相关转录因子2
由腰椎间盘退变相关疾病引起的腰腿痛是导致劳动能力丧失和生活质量下降的常见原因。同时,相关疾病的诊断及治疗也给家庭和社会造成了极大的经济负担。目前国内外大部分学者认为椎间盘的营养供应障碍是导致椎间盘退变的重要原因之一[1]。椎间盘的营养主要由纤维环外周的小血管、软骨终板中央微孔弥散供应,其中通过软骨终板微孔的弥散作用是椎间盘营养供应的主要通路。随着人的衰老和外界各种因素刺激,软骨终板逐渐出现钙化,终板微孔数也逐渐减少或消失。上述改变不仅妨碍了椎间盘营养物质供应,还阻碍了代谢废物的排出。Runt相关转录因子2(Runt-related transcription factor 2, Runx2)在各种组织钙化、骨化的生理病理过程中均发挥着重要作用[2]。有研究[3]表明,Runx2亦在软骨细胞肥大、成熟及骨基质产生的过程中发挥重要调节作用。也有学者[1]提出,Runx2与小鼠的椎间盘退变密切相关,但是目前在人的椎间盘表达水平尚无研究。因此本研究通过检测人不同退变程度的椎间盘软骨终板组织中Runx2、及细胞外基质aggrecan、collagen I的表达水平,探讨Runx2与软骨终板退变的关系。
1.1 一般资料
共收集42例软骨终板标本,其中20例爆裂性骨折做融合手术的患者,作为对照组;22例患有不同退变程度的椎间盘突出患者,作为实验组。参照Tompson等[4]提出的分级标准,再将实验组中退变的软骨终板组织分为轻度退变组(Tompson Ⅰ、Ⅱ级)4例、中度退变组(Tompson Ⅲ级)4例和重度退变组(Tompson Ⅳ、Ⅴ级)4例。所有手术标本的获取均得到患者或其家属的知情同意。
1.2 主要材料及试剂
TRIzol Reagent购自Invitrogen公司;反转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)购自美国Thermo公司,TransStart Top Green qPCR SuperMix购自北京全式金生物技术有限公司,ABI Prism 7500 real-time PCR仪购自Applied Biosystems公司;免疫组化试剂盒购自武汉博士德生物工程有限公司;蛋白裂解液购自上海碧云天生物技术有限公司;BCA试剂盒购自上海威奥生物科技有限公司;一抗Runx2、β-actin、辣根过氧化酶(HRP)标记的羊抗兔二抗购自CST公司;aggrecan,collagen I购自Abcam公司。
1.3 方法
1.3.1 H-E染色 标本处理及观察环锯减压取下的标本包括上、下椎体缘和中间的椎间盘。标本经10%的中性甲醛固定,脱钙液脱钙,再经乙醇逐级脱水,石蜡包埋切片,H-E染色,在显微镜下观察。
1.3.2 免疫组织化学法检测 标本做好切片后,加入过氧化氢,修复抗原,封闭后,加入一抗Runx2(1∶500),封闭过夜,在常温下孵育二抗,染色后在显微镜下观察。
1.3.3 组织总RNA的提取和real-time PCR的检测 将收集的软骨终板组织匀浆后,各加入1ml TRIzol Reagent提取总RNA。震荡混匀后室温静置5min,吹打分别装入EP管中;加入200μl的氯仿,上下混匀并置于室温 15min,吸取上层水相,加入 0.5ml 异丙醇混匀,室温放置 10min,离心半径 10cm,12000r/min,离心10min,去除上清液体,用 1ml 75%的乙醇洗涤沉淀,悬浮后离心半径 10cm,12000r/min,离心5min,弃上清,将沉淀物室温干燥10min,溶于DEPC水中。按照反转录试剂盒说明书将mRNA反转录得到cDNA,取3μl为模板进行PCR反应,引物序列由生工生物工程(上海)股份有限公司定制。Runx2上游引物: 5′-TGCCTGCCT GGGGTCTGT A-3′;下游引物: 5′-CGGGCC CTCCCTGAACTCT-3′。GAPDH上游引物: 5′-GAAGGTGAAGGTCGGAGTG-3′;下游引物: 5′-GAAGATGGTGATGGGATTTC-3′。按照试剂盒说明书上样,在PCR仪器上进行基因扩增。采用2-ΔΔCt的算法分析各组样本中Runx2的相对表达量。
1.3.4 蛋白提取及Western印迹法检测 分离软骨终板,尽量剪碎,用组织研磨机充分研磨。加蛋白提取裂解液RIPA和蛋白酶抑制剂,提取蛋白。BCA法测定蛋白浓度,取定量后的蛋白样品上样。以10%的SDS-PAGE电泳(恒压80V,30min;110V,1h)。以湿转法将胶转膜至PVDF膜上(恒压110V,1.5h),常温封闭1.5h。兔抗人β-actin单克隆一抗1∶500、Runx2单克隆一抗、aggrecan及collagen I单克隆一抗4 ℃孵育过夜。以辣根过氧化酶(HRP)标记的羊抗兔二抗室温孵育1h,用ECL发光试剂显影成像。
1.4 统计学处理
用SPSS20.0软件进行统计学处理。所有实验都重复3次,所有实验数据都以![]() 表示,用t检验分析组间差异。P<0.05为差异有统计学意义。
表示,用t检验分析组间差异。P<0.05为差异有统计学意义。
2.1 H-E染色观察
对照组正常的椎间盘软骨终板组织的结构完整、排列清晰,软骨细胞核和细胞质清晰可见,见图1A;而重度退变组软骨终板组织结构破坏严重,细胞呈空泡样,细胞密度稀疏,见图1B。
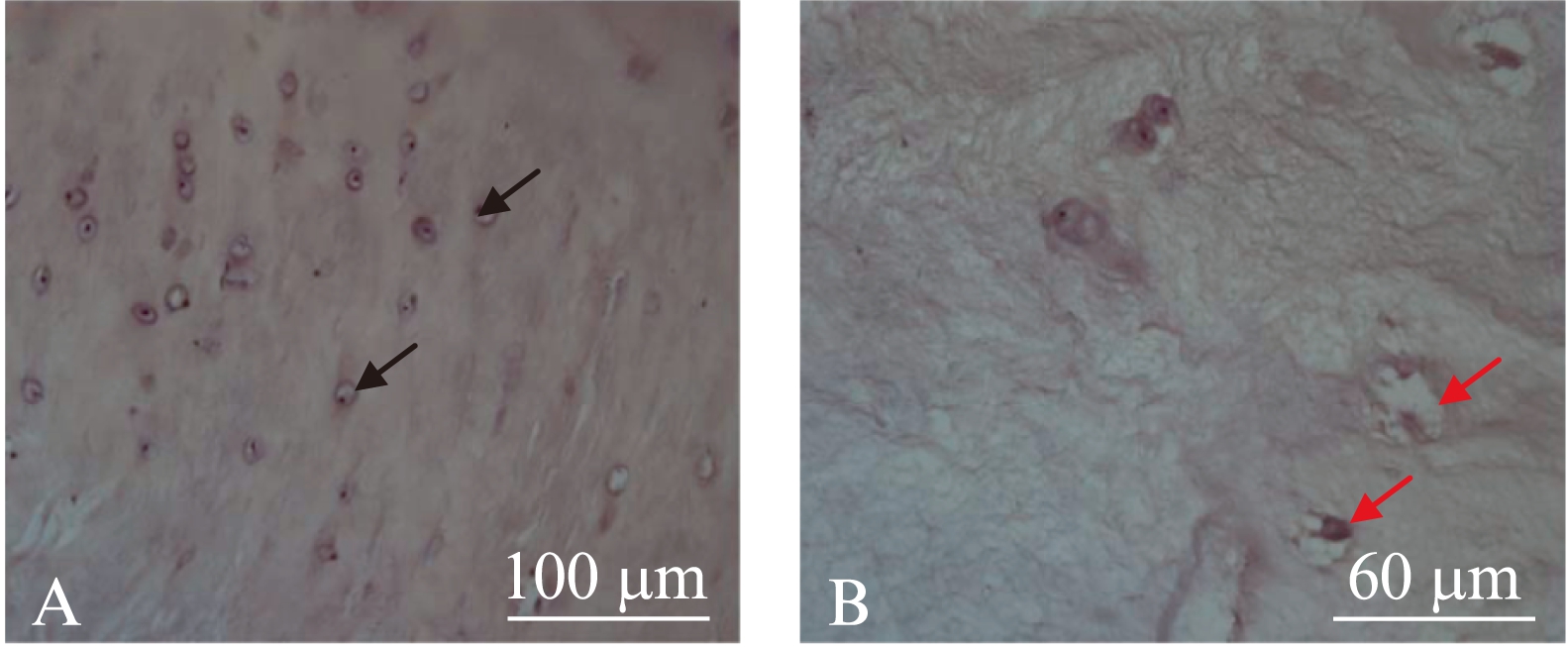
图1 腰椎骨折患者和椎间盘退变者软骨终板的H-E染色结果
Fig.1 The endplate structure of normal and degenerated lumbar disc demostrated by H-E staining
A: 对照组, 黑色箭头示软骨终板细胞;B: 重度退变组, 红色箭头示软骨终板细胞
2.2 免疫组织化学法观察Runx2的表达
免疫组织化学法观察对照组和重度退变组中Runx2的表达情况。对照组中的软骨终板细胞几乎没有Runx2的表达,见图2A、B;而重度退变组中的软骨终板细胞中Runx2阳性细胞数量明显多于正常组,见图2C、D。

图2 实验组与对照组终板软骨组织的免疫组化切片结果
Fig.2 Theimmunohistochemical analysis of endplate cartilages in two groups
A: 正常软骨终板;B: A图方框区域放大;C: 退变的软骨终板,Runx2表达情况明显多于正常组;D: B图方框区域放大,黑箭头示Runx2阳性细胞
2.3 PCR法观察Runx2 mRNA的表达
进一步明确Runx2与软骨终板退变分级的关系,用PCR对不同退变程度的软骨终板进行检测;结果显示,随着软骨终板退变越严重,Runx2 mRNA的表达越高。轻度退变组Runx2表达量为对照组的(4.74±0.78)倍(P<0.05),中度退变组Runx2表达量为对照组的(7.74±0.97)倍(P<0.01),重度退变组Runx2表达量为对照组的(16.97±1.89)倍(P<0.01),差异均具有统计学意义,见图3。
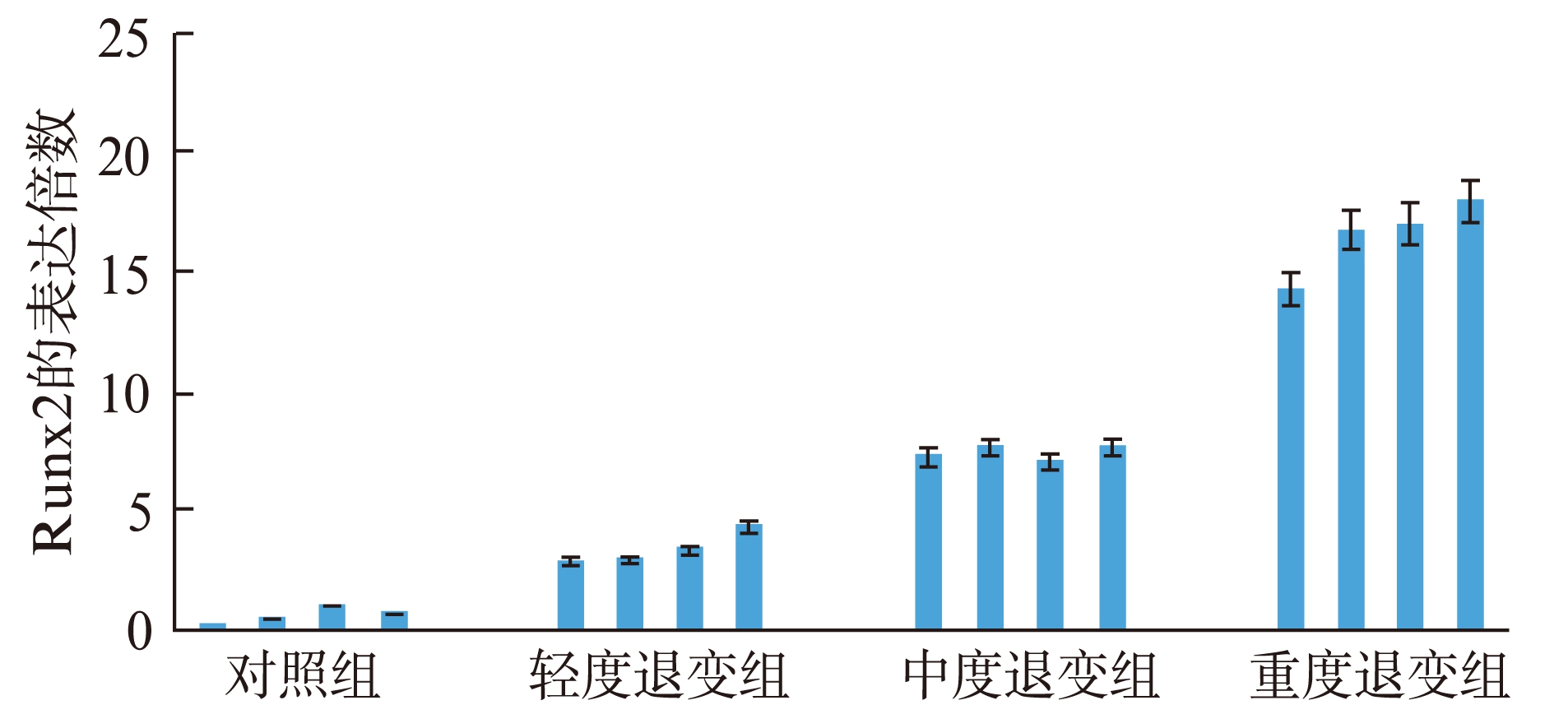
图3 Runx2的mRNA水平与椎间盘软骨终板退变程度的关系
Fig.3 The relationship between Runx2 mRNA expression and the degenerative degree of endplate cartilage
2.4 Western印迹法检测相关蛋白表达
Western印迹法检测对照组和实验组软骨终板中Runx2、aggrecan和collagen I蛋白表达,结果显示,随着软骨终板退变越严重,Runx2蛋白的表达越高;aggrecan和collagen I蛋白的表达量越低,见图4。轻度退变组Runx2表达量为对照组的(2.79±0.52)倍(P<0.05),aggrecan的表达量为对照组的0.48±0.12(P<0.05),collagen I的表达量为对照组的0.67±0.17(P<0.05);中度退变组Runx2表达量为对照组的(4.40±1.78)倍(P<0.01),aggrecan的表达量为对照组的0.23±0.14(P<0.01),collagen I的表达量为对照组的0.36±0.12(P<0.01);重度退变组Runx2表达量为对照组的(8.75±1.88)倍(P<0.01),aggrecan的表达量为对照组的0.13±0.09(P<0.01),collagen I的表达量为对照组的0.08±0.03(P<0.01),差异均具有统计学意义。
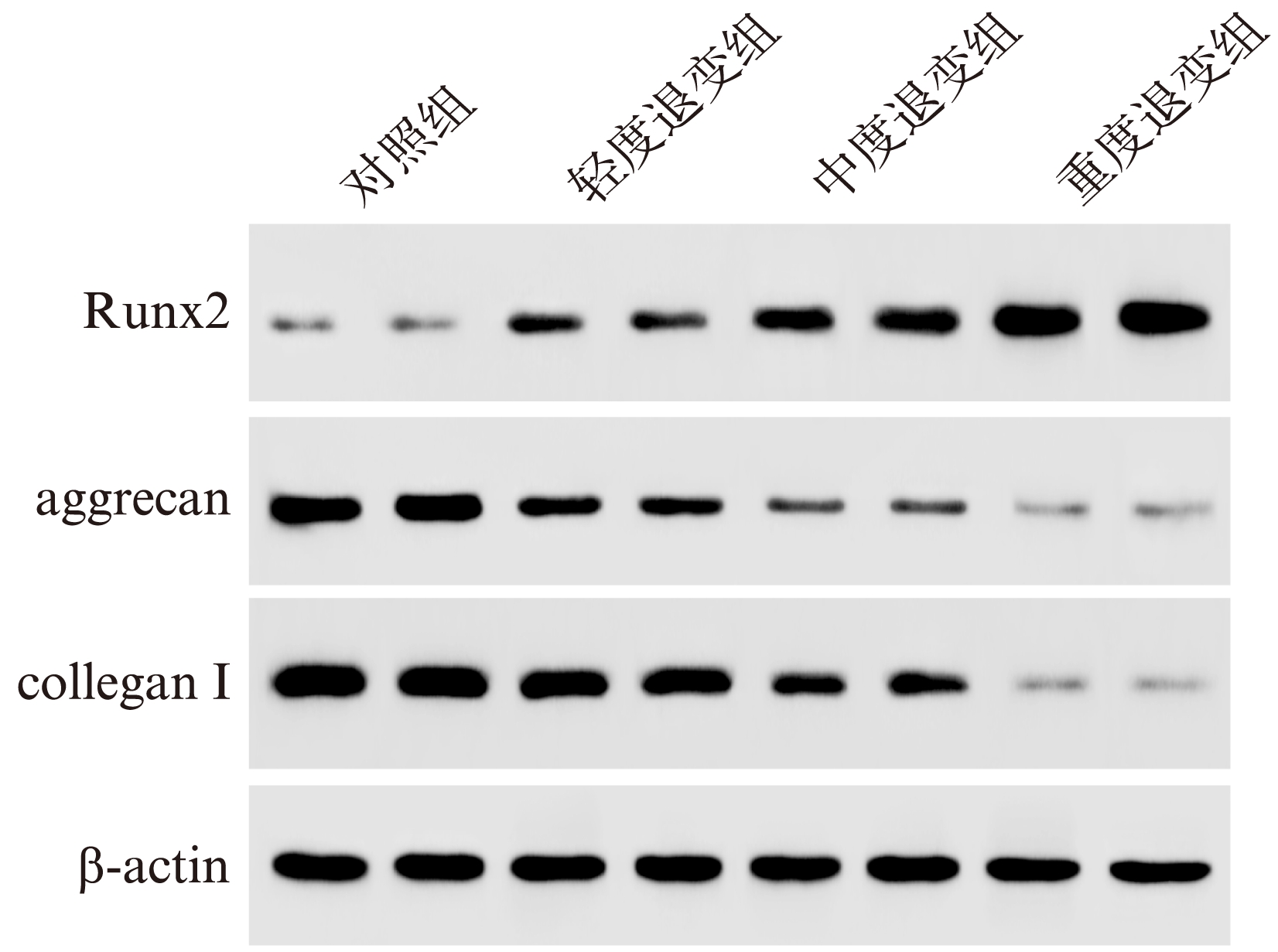
图4 Western印迹法检测Runx2、aggrecan和collagen I的表达
Fig.4 Expressions of Runx2, aggrecan and collagen I by Western blotting
腰椎间盘退变相关疾病是导致患者劳动能力丧失和生活质量下降最常见的原因。目前国内外大部分学者认为软骨终板退变引起的椎间盘营养供应障碍是导致椎间盘退变的最重要的原因之一。
本研究表明,aggrecan和collagen I的表达量随着终板退变程度的加重而降低。作为终板细胞外最重要的细胞外基质,aggrecan和collagen I在连接软骨组织结构、调节抗压及维持软骨细胞的正常生理活动中发挥重要作用。Antoniou等[5]研究证实,终板中aggrecan与collagen I在2~5岁时含量最高,但随着年龄增长含量逐步下降。Higuchi等[6]发现,在不同年龄的小鼠,终板外区深层的钙化发生于出生后1周,可导致营养物质和水分进入髓核变得困难;髓核的退变常常发生于出生后8周,明显迟于终板的退变。最近,软骨终板作为椎间盘退变的始动因素在人体体内研究中同样得到证实。Nerlich等[7]研究发现,人类在2岁时椎间盘软骨终板就已经开始退变,而髓核的退变一般发生在10岁以后。髓核细胞内粗面内质网和高尔基复合体的含量较少。组织化学研究也证实,髓核基质包含的细胞外基质与终板相似。髓核与终板交界处的细胞活力最强,进而推测髓核细胞起源于终板软骨细胞表层。彭宝淦等[8]发现,只要软骨终板保持良好状态,髓核就可再生,终板的退变最终导致髓核的退变,而终板退变的标志是软骨内钙化的出现;软骨终板钙化程度与椎间盘退变程度呈高度一致性,即软骨终板钙化层越厚,椎间盘退变越严重。
本研究表明,退变椎间盘软骨终板中Runx2的表达量明显高于正常椎间盘中的水平。有体外研究发现,Runx2是细胞内骨化的关键调节基因,向成纤维细胞内导入Runx2基因也可以促使其向成骨细胞的方向转化。小鼠体内实验研究[9]发现,Runx2基因敲除的小鼠表现为细胞的成骨能力明显减弱。Runx2基因敲除小鼠表达细胞外胶原的肥大软骨细胞明显减少,而软骨细胞肥大是软骨内成熟、骨化所必须的一步。在导入Runx2基因后,小鼠软骨骨化的抑制效应可获得部分缓解。由此可见,Runx2能促进软骨细胞的分化与成熟。在小鼠软骨细胞内过量表达的显性负突变Runx2会使软骨细胞成熟受到抑制,使软骨表现永久软骨特性[7]。有研究发现Runx2与后纵韧带骨化(ossification of posterior longitudinal ligament, OPLL)、异位钙化、动脉粥样硬化等发生密切相关。刘洋等[10]发现中国汉族人OPLL的发生与Runx2的基因多态性密切相关。在椎间盘退变中,Runx2亦发挥重要作用。Yao等[11]研究发现,终板软骨组织处于特殊的无氧环境中,低氧可促进软骨形成,但抑制其骨化。低氧诱导因子-1/巨噬细胞游走抑制因子(HIF1A/MIF)通路在调节终板软骨干细胞的软骨-成骨分化中发挥重要作用。MIF可通过调节Runx2的转录相关活动,下调Runx2的表达,从而发挥抑制终板软骨细胞骨化、退变的作用。正常小鼠在生长1年后,小鼠的软骨终板不断出现钙化,软骨终板的Runx2表达也明显增多。而在应力介导退变的模型小鼠的软骨终板中,Runx2表达量明显增多,且Runx2的过量表达区域与细胞外基质(aggrecan等)的降解区域重合。
综上所述,随着椎间盘软骨终板退变的不断加重,Runx2的表达量呈逐步增高的趋势。可以推测,软骨终板过表达Runx2与其退变严重程度密切相关。Runx2作为预测腰椎间盘软骨终板退变严重程度的指标。但是,何种因素导致Runx2表达量的变化,调控其表达的关键上、下游信号通路有哪些,还有待于进一步的研究。
【参考文献】
[1] VERGROESEN P P, KINGMA I, EMANUEL K S, et al. Mechanics and biology in intervertebral disc degeneration: a vicious circle[J]. Osteoarthritis Cartilage, 2015,23(7): 1057-1070.
[2] WEI J, SHIMAZU J, MAKINISTOGLU M P, et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation[J]. Cell, 2015,161(7): 1576-1591.
[3] LIN L, CHEN L, WANG H, et al. Adenovirus-mediated transfer of siRNA against Runx2/Cbfa1 inhibits the formation of heterotopic ossification in animal model[J]. Biochem Biophys Res Commun, 2006,349(2): 564-572.
[4] THOMPSON J P, PEARCE R H, SCHECHTER M T, et al. Preliminary evaluation of a scheme for grading the gross morphology of the human intervertebral disc[J]. Spine (Phila Pa 1976), 1990,15(5): 411-415.
[5] ANTONIOU J, GOUDSOUZIAN N M, HEATHFIELD T F, et al. The human lumbar endplate. Evidence of changes in biosynthesis and denaturation of the extracellular matrix with growth, maturation, aging, and degeneration[J]. Spine (Phila Pa 1976),1996,21(10): 1153-1161.
[6] HIGUCHI M, KANEDA K, ABE K. Postnatal histogenesis of the cartilage plate of the spinal column: Electron microscopic observations[J]. Spine(Phila Pa 1976),1982,7(2): 89-96.
[7] VO N V, HARTMAN R A, PATIL P R, et al. Molecular mechanisms of biological aging in intervertebral discs[J]. J Orthop Res, 2016,34(8): 1289-1306.
[8] 彭宝淦,贾连顺,施杞,等.软骨终板钙化在椎间盘退变过程中的作用机理[J]. 中国矫形外科杂志,2000,7(2): 40-43.
[9] TAKARADA T, HINOI E, NAKAZATO R, et al. An analysis of skeletal development in osteoblast-specific and chondrocyte-specific runt-related transcription factor-2 (Runx2) knockout mice[J]. J Bone Miner Res, 2013,28(10): 2064-2069.
[10] 刘洋,石长贵,袁文,等.汉族人群后纵韧带骨化症的单核苷酸多态性分析[J]. 第二军医大学学报,2015,36(1): 6-13.
[11] YAO Y, DENG Q, SONG W, et al. MIF plays a key role in regulating tissue-specific chondro-osteogenic differentiation fate of human cartilage endplate stem cells under hypoxia[J]. Stem Cell Reports, 2016,7(2): 249-262.
Expression of Runx2 in degenerated lumbar endplate cartilage and its clinical significance
【Abstract】 Objective To investigate the expression of Runx2 in degenerated lumbar endplate cartilage and its clinical significance. Methods Twenty two specimens of degenerated human lumbar cartilage endplates (study group) and 20 specimens of non-degenerated lumbar cartilage endplate (control group) were collected. H-E staining was used to examine the morphological changes of lumbar cartilage endplate. The expression of Runx2 protein and mRNA was detected with immunohistochemistry, RT-PCR and Western blotting, respectively; the expression of aggrecan and collagen I was also detected with Western blotting in two groups. Results The structure of cartilage endplate was complete and compactly arranged in control group, while in the degenerated group the structure of endplate was seriously destructed. Immunohistochemistry analysis showed that the Runx2-positive cells were scarcely distributed in normal endplates, while significantly widely distributed in the degenerated endplates. In the mild, moderate and severe degenerative groups, RT-PCR analysis showed that the mRNA expression of Runx2 was positively correlated with the degenerative degree of endplate cartilage, which was (4.74±0.78), (7.74±0.97) and (16.97±1.89) fold higher than that of control group, respectively. Western-blotting showed that the expressions of Runx2, aggrecan and collagen I protein in mild, moderate and severe degenerative group were (2.79±0.52), (0.48±0.12), (0.67±0.17) fold (P<0.05); (0.36±0.12), (0.23±0.14), (4.40±1.78) fold (P<0.01); and (8.75±1.88), (0.13±0.09), (0.08±0.03) fold (P<0.01) higher than those in control group. Conclusion Runx2 can be an ideal indicator to predict the degeneration degree of lumbar endplate cartilage and may serve as a potential treatment target for lumbar disc degenerative diseases.
【Key words】 intervertebral disc degeneration; lumbar vertebra; endplate cartilage degeneration; Runx2
doi: 10.16118/j.1008-0392.2017.04.005
收稿日期: 2017-03-11
基金项目: 上海市卫生与计划委员会科研项目 (201640063) ; 江西省自然科学基金项目(20171BAB205034)
【中图分类号】 R681.5+3
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0021-05