·基础研究·
【摘要】 目的 检测碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)和成纤维细胞生长因子受体2(basic fibroblast growth factor receptor-2, FGFR-2)在胃癌组织中的表达,并探讨其对淋巴管生成和肿瘤生物学行为的影响。方法 采用免疫组化学方法检测59例胃癌及癌旁组织bFGF、FGFR-2及D2- 40表达。结果 59例胃癌组织bFGF和FGFR-2表达分别达69.5%(41/59)、64.4%(39/59),明显高于癌旁组织35.6%、33.9%(P<0.05);二者在淋巴结转移组表达高于无转移组,浸润程度越深表达越高。胃癌癌周微淋巴管密度高于正常胃组织(10.89±3.67 vs 3.58±0.96),且与淋巴结转移(P<0.05)、bFGF和FGFR-2阳性表达(P<0.05)正相关。结论 bFGF和FGFR-2可能通过促进淋巴管生成参与胃癌浸润转移。
【关键词】 胃肿瘤; 碱性成纤维细胞生长因子; 成纤维细胞生长因子受体-2; 微淋巴管密度
碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)是一种多肽生长因子,在多种肿瘤中过表达,与肿瘤的发生发展、转移及血管生成密切相关。成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)是一类FGF受体,参与细胞分裂、迁徙和分化,对肿瘤生长和癌症患者生存起着至关重要的作用。近期研究发现,阻断FGF/FGFR信号可对肿瘤生长、转移及淋巴血管生成产生影响,因此成为肿瘤的研究和靶向治疗的新热点[1]。淋巴道转移是实体肿瘤转移的最早通路之一[2],与肿瘤的预后密切相关。但目前淋巴道转移及其调节机制尚不清楚。研究证明[3],淋巴管生成与淋巴道转移密切相关。本研究采用免疫组织化学法检测胃癌组织中bFGF及FGFR-2表达及微淋巴管密度,分析bFGF、FGFR-2表达在胃癌中的意义及与淋巴管生成的关系。
1.1 一般资料
收集哈尔滨医科大学第四临床医院原发性胃腺癌根治手术标本59例,所有病例均行淋巴结剥离,术前未经任何抗癌治疗。其中,男42例,女17例;年龄33~78岁,平均(58.03±7.23)岁;按照WHO胃腺癌分级标准,高分化13例,中分化27例,低分化19例。根据TNM分期标准,T1期17例,T2期42例;淋巴结转移34例,无淋巴结转移25例。另取27例胃远切端(距肿瘤边缘>8cm)组织作为正常胃组织。
1.2 方法
1.2.1 免疫组织化学法检测 标本4%中性甲醛固定、石蜡包埋后行H-E及免疫组织化学染色(SP法)。bFGF兔抗人多克隆抗体、D2- 40(克隆号D2- 40)及免疫组化SP试剂盒购于福州迈新公司,FGFR2抗人多克隆抗体购于武汉博士德公司。按试剂说明书进行免疫组化染色,每批染色均设置阳性、阴性对照。
1.2.2 结果判断 bFGF、FGFR-2以肿瘤细胞质呈棕黄色颗粒为阳性。根据Eastham等[4]的方法,无着色为(-);切片中癌组织阳性弱,阳性范围<癌组织面积50%者为(+);染色弱,阳性范围≥50%为(++);染色强,阳性范围<50%为(+++);染色强,阳性范围≥50%为(++++)。(-)~(++)划为低表达,(+++)~(++++)划为高表达。D2- 40标记以淋巴管内皮细胞质呈棕黄色颗粒为阳性,微淋巴管密度(lymphatic microvessel density, LMVD)计数采用Weidner等[5]报道方法,先在低倍镜下(×40)观察肿瘤周边区及正常组织,选择其中淋巴管高密度区在高倍镜(×100)下计数被染色淋巴管的数目,计数5个高倍镜视野下的淋巴管数目。
1.3 统计学处理
计数资料用![]() 表示,计量资料采用t检验,计数资料采用χ2检验,相关分析采用Spearman等级相关分析。以P<0.05为差异有统计学意义。
表示,计量资料采用t检验,计数资料采用χ2检验,相关分析采用Spearman等级相关分析。以P<0.05为差异有统计学意义。
2.1 bFGF、FGFR-2表达及与临床病理特征关系
bFGF和FGFR-2阳性细胞包括正常胃黏膜上皮细胞、癌旁肠上皮化生、轻-中度不典型增生细胞和胃癌细胞,间质中血管内皮细胞、成纤维细胞、平滑肌细胞及炎细胞。其中,bFGF和FGFR-2在正常胃黏膜组织(33.3%和29.6%)及癌旁组织(35.6%和33.9%)中主要呈低表达,二者比较差异无统计学意义;但在胃癌组织(69.5%,41/59和64.4%,38/59)中表达均明显高于正常胃黏膜组织及癌旁组织(P<0.05),见图1、表1。bFGF和FGFR-2表达与年龄、性别、分化程度无关,与浸润深度、淋巴结转移相关,见表2。
2.2 LMVD与临床病理特征的关系
D2- 40阳性的微淋巴管在正常胃组织各层均可见到,以黏膜下层数目最多,LMVD为3.58±0.96。在胃癌组织周边,微淋巴管多扩张,呈不规则形,且数量增多,LMVD为10.89±3.67,与正常胃组织比较,差异有统计学意义(P<0.05),见图2。LMVD与年龄、性别、分化程度、浸润深度无关,与淋巴结转移密切相关,见表2。
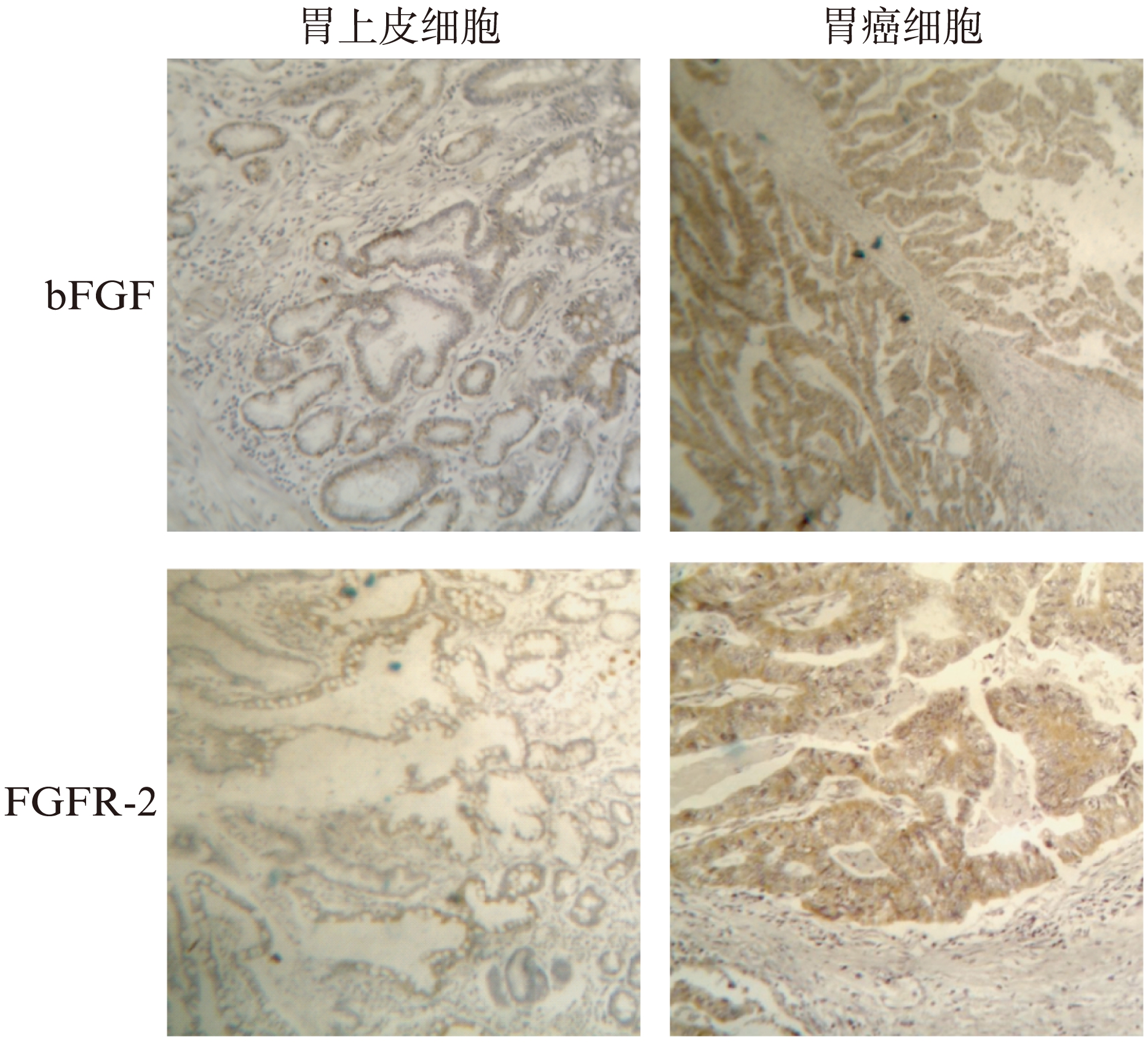
图1 bFGF、FGFR-2在胃上皮细胞和胃癌细胞胞浆中的表达(SP,×100)
Fig.1 Positive expression of bFGF and FGFR-2 in the cytoplasm of normal gastric epithelial cells and gastric cancer cells(SP,×100)
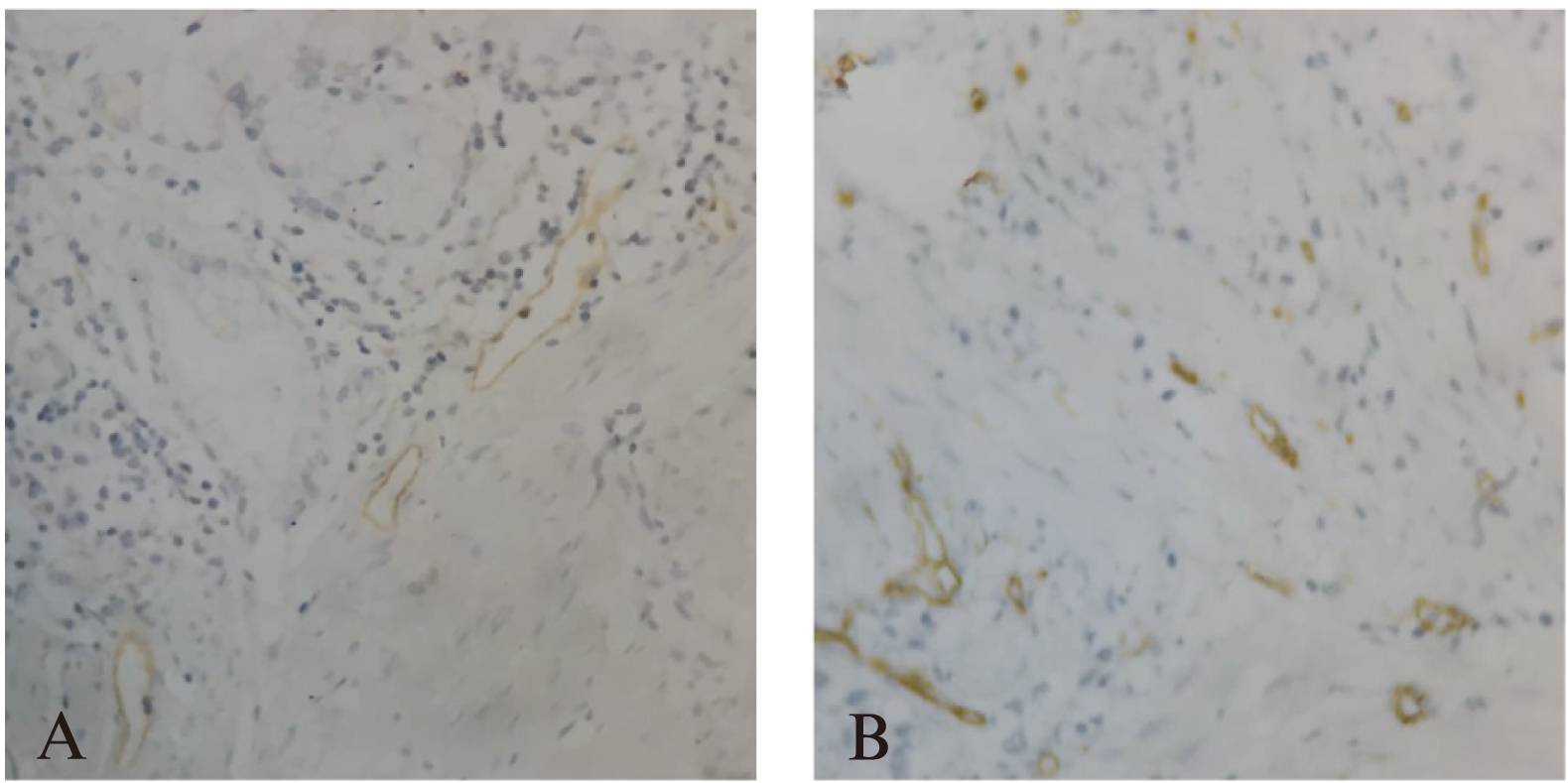
图2 胃正常组织和胃癌组织中D2- 40标记阳性LMVD(免疫组化染色,×400)
Fig.2 D2- 40 marked LMVD in normal gastric tissues and gastric cancers (immunohistochemical straining,×400)
A: 胃正常组织;B: 胃癌组织
表1 bFGF与FGFR在各组中的阳性表达情况
Tab.1 The expression of bFGF and FGFR in gastric cancers and adjacent gastric tissues and normal gastric tissues
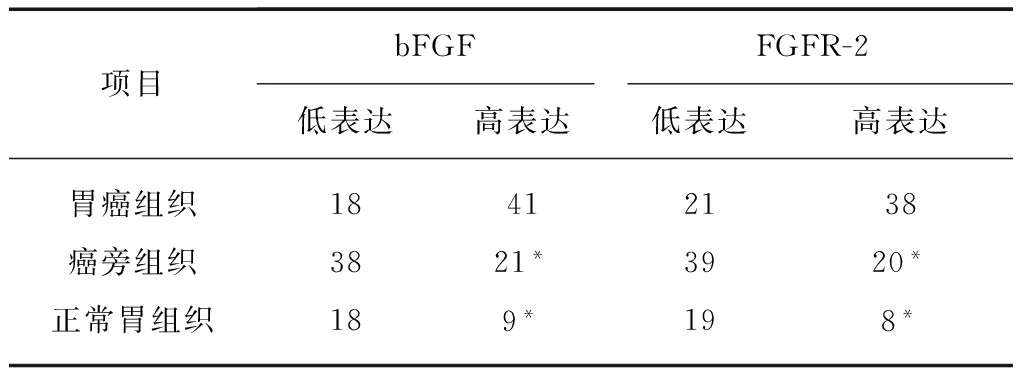
项目bFGFFGFR-2低表达高表达低表达高表达胃癌组织18412138癌旁组织3821*3920*正常胃组织189*198*
与胃癌组织比较,*P<0.05
表2 bFGF、FGFR及LMVD与临床病理参数之间的关系
Tab.2 Relationshipamong bFGF, FGFR, LMVD and clinicopathological characteristics
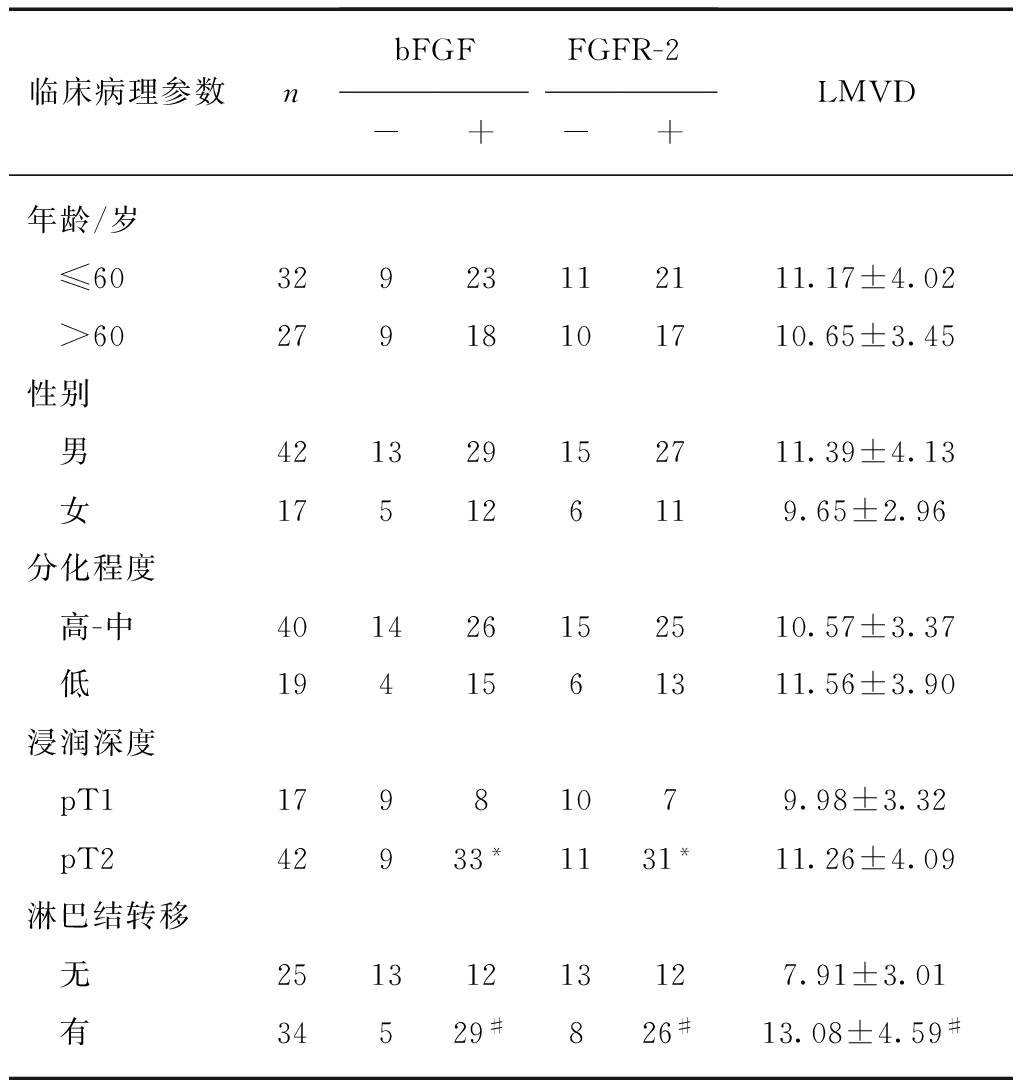
临床病理参数nbFGFFGFR-2-+-+LMVD年龄/岁 ≤6032923112111.17±4.02 >6027918101710.65±3.45性别 男421329152711.39±4.13 女175126119.65±2.96分化程度 高-中401426152510.57±3.37 低1941561311.56±3.90浸润深度 pT117981079.98±3.32 pT242933*1131*11.26±4.09淋巴结转移 无25131213127.91±3.01 有34529#826#13.08±4.59#
与pT1比较,*P<0.05;与无淋巴结转移组比较,#P<0.05
2.3 bFGF、FGFR-2与LMVD的相关性
Spearman等级相关分析显示,bFGF与LMVD成正相关(r=0.517,P<0.05),FGFR-2与LMVD成正相关(r=0.423,P<0.05)。
bFGF广泛、微量存在于人体多种组织中,具有调节多种细胞的生长、分化,诱导新生血管形成及促进创伤组织修复等功能。人体bFGF基因位于染色体4q26-27[6],因mRNA翻译起始点和剪接点的不同,产生不同相对分子质量bFGF异构体。其中,以AUG起始点密码子编码的小分子量型bFGF,主要表达于细胞浆和细胞膜,是强有力的血管生成促进剂,能促进成纤维细胞等多种细胞增殖和分化;而以CUG起始点编码的高分子量型bFGF则是一种转录调节因子,主要存在于细胞核中,直接进行调节转录,可能与细胞增殖生长有关。bFGF在乳腺癌、肺癌、黑素瘤、肝癌等多种肿瘤组织中高表达[7]。本研究结果表明,bFGF在胃癌组织胞质中高表达,且与浸润深度、淋巴结转移密切相关,与分化程度无关。
FGFR是一类受体型酪氨酸激酶家族,对细胞生长增殖和分化等起重要的调节作用。FGF与FGFR结合形成二聚体,导致FGFR的胞内域发生自身磷酸化[8],激活Ras-依赖丝裂原活化蛋白激酶(MAPK)和Ras非依赖磷酸肌醇3-激酶(PI3K)-AKT信号通路,从而促进细胞的增殖、生长,上皮-间质细胞转化。FGFR-2是bFGF的主要受体,在血管内皮细胞及多种肿瘤细胞过表达。本研究结果表明,胃癌组织中FGFR-2表达明显高于癌旁组织及正常组织,且与胃癌浸润深度、淋巴结转移相关。Coldren等[9]从非小细胞肺癌细胞株的基因表达数据中发现bFGF和FGFRs有明显的上升,提示bFGF/FGFRs自分泌信号通路在非小细胞肺癌中起着重要的作用。Hideaki等[10]检测胃癌组织中FGFR表达发现,FGFR-1、FGFR-2、FGFR- 4均过表达,且与胃癌的浸润深度、淋巴结转移、病理分期、远处转移及复发密切相关。说明FGFR2在胃癌发生发展中表达上调,可能参与胃癌细胞淋巴迁移;且过表达的bFGF可能通过自分泌方式与过表达FGFR-2结合,进一步促进胃癌细胞增殖、浸润、转移。这有待于作进一步研究。
淋巴系统转移是胃癌的主要且较早的转移途径,是影响患者生存的重要因素[11]。近年研究表明,淋巴系统转移与淋巴管生成相关。本研究用D2- 40标记淋巴管发现,胃癌周围微淋巴管密度增高,且与淋巴结转移密切相关,说明癌组织周围存在新生淋巴管。由于新生淋巴管管壁薄,缺乏连续基底膜,使肿瘤细胞易于进入淋巴管道,从而发生转移。目前,有关bFGF/FGFR与淋巴管生成关系的研究甚少。本研究认为bFGF和FGFR-2与淋巴管生成相关。有体内外实验证实[12-13],bFGF能促进VEGF等多种生长因子分泌,且有协同作用,可间接促进淋巴管内皮增生。bFGF是否通过与胃癌细胞FGFR-2结合实现这一作用,仍有待于作深入探讨。
【参考文献】
[1] KATOH M. FGFR inhibitors: Effects on cancer cells, tumor microenvironment and whole-body homeostasis[J]. Int J Mol Med, 2016,38(1): 3-15.
[2] 王晓蕾,陈锡美.肿瘤淋巴管生成的信号转导途径与肿瘤淋巴转移[J].同济大学学报(医学版),2003,24(4): 275-278.
[3] 项锋钢,徐静,于文娟.胃癌组织中微淋巴管的生成特点及临床病理意义[J].世界华人消化杂志,2007,15(23): 2491-2495.
[4] EASTHAM J A, TRUONG L D, ROGERS E, et al. Transforming growth factor-beta 1: comparative immunohistochemical localization in human primary and metastatic prostate cancer[J]. Lab Invest, 1995,73: 628-635.
[5] WEIDNER N, FOLKMAN J, POZZA F, et al. Tumor angiogenesis: a new significant and independent prognostic indicator in earlystage breast carcinoma[J]. J Natl Cancer Inst, 1992,84(24): 1875-1887.
[6] OKADA B M, THIERY J P, JOUANNEAU J. Fibroblast growth factor2[J]. Int Biochem, 2000,32(3): 263-267.
[7] VILLEGAS S N, CANHAM M, BRICKMAN J M. FGF signaling as a mediator of lineage transitions-evidence from embryonic stem cell differentiation[J]. J Cell Biochem, 2010,110(1): 10-20.
[8] ESWARAKUMAR V P, LAX I, SCHLESSINGER J. Cellular signaling by fibroblast growth factor receptors[J]. Cytokine Growth Factor Rev, 2005,16(2): 139-149.
[9] COLDREN C D, HELFICH B A, WITTA S E, et al. Baseline gene expression predicts sensitivity to gefitinib in non-small cell lung cancer cell lines[J]. Mol Cancer Res, 2006,4(8): 521-528.
[10] HIDEAKI M, MIKITO I, YOKO T, et al. Prognostic significance of the co-overexpression of fibroblast growth factor receptors 1, 2 and 4 in gastric cancer[J]. Mol Clin Oncol, 2014,2(4): 509-517.
[11] 王晓蕾,方建萍,汤如勇,等.VEGFR-3在胃癌细胞、血管及淋巴管内皮的表达及与转移的关系[J].同济大学学报(医学版),2007,28(1): 28-33.
[12] 张志华,刘鹏,王丽红,等.bFGF表达对裸鼠白血病移植瘤血管新生影响的研究[J].中国肿瘤临床,2013,40(14): 821-823.
[13] TURNER N, GROSE R. Fibroblast growth factor signalling: from development to cancer[J]. Nat Rev Cancer, 2010,10(2): 116-129.
Expression of bFGF and FGFR-2 in gastric cancer and its clinicopathological significance
【Abstract】 Objective To investigate the expression of basic fibroblast growth factor (bFGF) and basic fibroblast growth factor receptor-2 (FGFR-2) in gastric cancer and their clinicopathological significance. Methods Immunohistochemical technique were used to detect the expressions of bFGF, FGFR-2 and D2- 40 in 59 samples of gastric cancers and adjacent gastric tissues. Results The expressions of bFGF (69.5%, 41/59) and FGFR-2 (64.4%, 39/59) in gastric cancers were significantly higher than those in adjacent gastric tissue (P<0.05). The expressions of bFGF and FGFR-2 were positively correlated with lymph node metastasis and tumor infiltration depth. The lymphatic microvessel density (LMVD) in gastric cancer was significantly higher than that in normal gastric tissue (10.89±3.67 vs 3.58±0.96, P<0.05), which was correlated with lymph nodes metastasis and the expressions of bFGF and FGFR-2 (P<0.05). Conclusion The expression of bFGF and FGFR-2 is higher in gastric cancer, which might be associated with lymphangiogenesis and contribute to invasion and metastasis in gastric cancer.
【Key words】 gastric neoplasm; basic fibroblast growth factor; basic fibroblast growth factor receptor-2; lymphatic microvessel density
doi: 10.16118/j.1008-0392.2017.04.004
收稿日期: 2017-04-05
基金项目: 黑龙江省教育厅科学技术研究项目(11541142)
【中图分类号】 R735.2
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0017-04